Viabilidad
de esporas y funcionamiento de un inoculante líquido a base de Glomus
cubense en Sorghum bicolor L. cv. Moench
Spore viability
and liquid inoculant performance based on Glomus cubense in Sorghum
bicolor L. cv. Moench
Ms.C. Aracely
Mena Echevarría, Ms.C. Yonaisy Mujica Pérez, Dra.C. Kalyanne Fernández
Suárez, Dr.C. José Dell` Amico Rodríguez
Instituto Nacional
de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las
Lajas, Mayabeque, Cuba, CP 32700.
RESUMEN
El trabajo tuvo
como objetivo evaluar la viabilidad funcional y capacidad de colonización
del hongo micorrízico arbuscular Glomus cubense, en medio líquido.
Se realizaron dos experimentos, en uno se estudió la viabilidad fúngica
de las esporas en un medio líquido y como control agua destilada estéril
durante seis meses. Se utilizaron 100 esporas como promedio. En el segundo se
estudió la capacidad de colonización de las esporas almacenadas
durante seis meses inoculadas en plantas de sorgo (Sorghum vulgare
Perz.). Se determinaron indicadores de funcionamiento micorrízico (frecuencia
e intensidad de la colonización, contenido de proteínas fácilmente
extraibles, producidas por los HMA) e indicadores de crecimiento y desarrollo
de las plantas (masa seca de raíz y aérea). Los datos fueron analizados
mediante el programa STATGRAPHICS Centurion para Windows y se utilizó
la prueba de Duncan con una significación de un 5 % en los casos en que
el ANOVA resultó significativo. Los resultados demostraron la viabilidad
de las esporas de Glomus cubense durante seis meses, con marcadas pérdidas
de viabilidad en la variante conservada en agua destilada estéril. Los
estudios de colonización en plantas de sorgo demostraron la estabilidad
funcional de las esporas, debido a que se alcanzaron niveles de colonización
superiores en las plantas inoculadas en relación con las no inoculadas.
Estos resultados demuestran la viabilidad y estabilidad funcional del inoculante
líquido hasta seis meses de conservado.
Palabras
clave: esporas, conservación, estabilidad, gramíneas.
ABSTRACT
This study aimed
to evaluate arbuscular mycorrhizal fungi (Glomus cubense) functional
viability and colonization ability in liquid medium. Two experiments were conducted,
one studied spores fungal viability in liquid medium and sterile water was used
in control around six months. Average 100 spores were used. In second text,
we studied spores ability colonizing stored by six months in sorghum (Sorghum
vulgare Perz.) plants. Mycorrhizal performance indicators were determined
(colonization frequency and intensity and protein total) and plants growth and
development indicators (dry mass root of air). Data were analyzed using Statgraphics
Centurion for Windows and used the Duncan test with a significance
of 5% in the cases where the ANOVA was significant. Results showed Glomus
cubense spores viability after six months, with marked loss of viability
in the variant preserved in sterile distilled water. Colonization studies demonstrated
spores functional stability on sorghum plants, due to were achieved superior
colonization levels in plants inoculated with respect to non-inoculated. Results
demonstrated viability and functional stability of liquid inoculant retained
up to six months.
Key words:
spores, conservation,
stability, grasses.
INTRODUCCIÓN
En el contexto
agrícola mundial están bien argumentados los múltiples
y extraordinarios beneficios que la simbiosis micorrízica confiere a
las plantas.
Los hongos micorrízicos del tipo arbuscular (HMA) constituyen los más
comunes y ampliamente distribuidos en los ecosistemas terrestres (1). Estas
evidencias, unidas a la antigüedad de los HMA, sugieren la importante contribución
de estos a la exitosa colonización de la tierra por las plantas y el
papel crucial que han desempeñado en su evolución y diversificación
(2).
Los hongos micorrízicos arbusculares (HMA) se consideran biótrofos
obligados porque dependen de la planta huésped para completar su ciclo
de vida y uno de los principales factores que explica esta condición
es el metabolismo o la absorción de carbono en el estadio presimbiótico,
debido al hecho de que las hifas extrarradicales de estos hongos son incapaces
de absorber carbohidratos (3). Dentro de las principales funciones que realizan
estos hongos en la interfase suelo-planta se destaca su papel en la absorción
de nutrientes, específicamente fósforo y otros macro
y micronutrientes (4), debido al aumento del volumen de suelo a explorar (5);
su rol en el restablecimiento de la diversidad de las comunidades biológicas
contribuyendo a la sostenibilidad de los agro y ecosistemas (1, 6); su efecto
positivo ante estreses bióticos (patógenos) y abióticos
(salinidad y sequía) debido a que actúan en varios procesos fisiológicos
de las plantas (7, 8) y la tolerancia de las mismas a los metales pesados (9).
Atendiendo a los criterios anteriormente expuestos, en Cuba desde la década
de los 90, el Instituto Nacional de Ciencias Agrícolas (INCA) inició
un amplio programa de investigaciones básicas con estos simbiontes y
como resultado se obtuvo un biofertilizante de formulación sólida
registrado como EcoMic®, con alto grado de pureza y estabilidad
biológica, con el cual se ejecutaron estudios que mostraron resultados
satisfactorios en cultivos como la soya (10), en el desarrollo de portainjertos
en viveros de aguacate (11) y en yuca (12).
Teniendo en cuenta la efectividad mostrada por este inoculante sólido,
a partir del año 2000 se inician nuevos estudios, pero esta vez con el
propósito de formular un nuevo producto a partir de hongos micorrízicos
arbusculares (HMA) en soporte líquido, con la finalidad de diversificar
las vías de inoculación de estos simbiontes, garantizando futuras
aplicaciones por la vía del fertirriego. Recientemente se han encontrado
resultados promisorios con la utilización de los HMA en formulación
líquida en cereales como el arroz bajo condiciones de estrés salino
(13).
Un elemento crucial que limita el uso de inoculantes microbianos es la estabilidad
funcional del producto una vez que se formula, por lo tanto, el objetivo fundamental
de este estudio fue evaluar la viabilidad de las esporas de Glomus cubense,
conservadas durante seis meses en medio líquido y su funcionamiento como
inoculante en plantas de Sorghum bicolor L. Moench.
MATERIALES
Y MÉTODOS
Experimento
1
Obtención del material fúngico para el inoculante líquido
Para la realización de esta investigación se utilizó la
cepa INCAM-4 de Glomus cubense (14), procedente de la colección
de cepas del Instituto Nacional de Ciencias Agrícolas (INCA) de Cuba.
El inóculo certificado de Glomus cubense (100 g), que contiene
una mezcla de arcilla caolinítica y propágulos fúngicos
(esporas, hifas, micelio), se usó para la siembra de plantas de sorgo
en potes de cultivo de seis litros con un sustrato mineral estéril. A
los 90 días de crecimiento, se eliminó la parte aérea de
las plantas, y el sustrato con las raíces micorrizadas se utilizó
como fuente de esporas. El material fue homogenizado manualmente, secado a temperatura
ambiente y almacenado durante 15 semanas a 4 oC.
Para el aislamiento de las esporas se tomaron 50 g del material homogenizado
y se realizó un tamizado húmedo (15), de una pasta obtenida por
mezcla del sólido con agua, entre dos tamices (40 y 400 µm de luz)
con la adición de agua para facilitar el proceso. El residuo remanente
se recogió en el tamiz de 40 μm, con una espátula se pasó
a un tubo de centrífuga en el cual se mezcló con solución
de sacarosa (720 g de sacarosa y 20 g de Tween 80 L-1) y se centrifugó
a 2000 rpm durante cinco minutos. Posteriormente se decantó la fracción
líquida con los propágulos fúngicos los que fueron depositados
en tubos eppendorf de 1,5 mL, con 300 µL de solución Ringer para
conservarlos hasta el momento de la desinfección. Un litro de la solución
Ringer contenía NaCl 7,5 g, KCl 0,75 g, CaCl2 0,1 g y NaHCO3
0,1 g.
Estabilidad del inoculante líquido
Con el objetivo de evaluar la viabilidad del germoplasma fúngico contenido
en la solución osmoprotectora, se realizó un experimento de almacenamiento
colocando 400 esporas viables en 300 mL de solución en frascos de color
ámbar y conservados en refrigeración. Este ensayo se extendió
por seis meses, se realizaron cinco observaciones por cada tratamiento y dos
repeticiones en el tiempo. Los tratamientos estudiados siguieron un diseño
completamente aleatorizado y como control se utilizó la misma cantidad
de propágulos pero conservados en agua destilada estéril.
Determinaciones realizadas
Con carácter mensual durante los seis meses se evaluaron indicadores
morfológicos de las esporas de HMA como coloración y forma de
las esporas con la ayuda del microscopio óptico. También se cuantificó
la producción de nuevas esporas, utilizando el estereomicroscopio (MEIJI
TECHNO) y se determinó el incremento porcentual del contenido de proteínas
totales fácilmente extraíbles producidas en el medio líquido
(16).
Experimento 2
Para comprobar la efectividad de este inoculante tras seis meses de conservación,
se prosiguió con un ensayo de inoculación en áreas del
invernadero del departamento de Biofertilizantes y Nutrición de las Plantas
del INCA. Se utilizó sorgo (Sorghum bicolor L. Moench) como cultivo modelo
y las semillas se desinfectaron con una solución de hipoclorito de sodio
al 10 % durante 10 minutosA. Pasado este tiempo se decantó
la solución, se lavaron tres veces con agua destilada y se colocaron
dos semillas por maceta.
Se utilizaron macetas plásticas de 1 kg de capacidad y como sustrato
un suelo Hidromórfico Gley Vértico Carbonatado (17), cuyas características
se muestran en la Tabla
I. La esterilización se efectuó en autoclave a 121 oC
durante dos horas, en ciclos de tres días seguidos.

Descripción del inoculante micorrízico, diseño
experimental y descripción de los tratamientos
Las plantas crecieron a una temperatura promedio de 25±3 oC,
humedad relativa de 75-80 % y fotoperiodo natural. El experimento se extendió
por 60 días y se desarrolló dos veces durante el año 2013
(abril y junio).
El inoculante líquido se formuló teniendo en cuenta los procedimientos
descritos anteriormente y se inoculó 1 mL (40 esporas promedio) por cada
maceta en el momento se la siembra. Se empleó una variante con inoculo
sólido certificado a razón de dos gramos por maceta con igual
contenido de esporas como promedio y como control un tratamiento sin inocular.
Se aplicó riego manual en función de las necesidades de las plantas.
Se siguió un diseño completamente aleatorizado con ocho tratamientos
que se describen en la Tabla
II. Se utilizaron 10 macetas por cada tratamiento.

Determinaciones y Análisis Estadístico
Los muestreos se realizaron a los 30 y 60 días después la de germinación
(ddg) de las semillas, se tomaron cinco macetas por cada tratamiento.
Se realizaron las siguientes evaluaciones:
• Indicadores de funcionamiento micorrízico: para la estimación
de los indicadores fúngicos las raicillas fueron secadas a 70 oC
y teñidas (18). Se determinó la frecuencia e intensidad de la
colonización micorrízica por el método de los interceptosC.
• Indicadores del crecimiento de las plantas: se determinó la masa seca
de la raíz y aérea de las planta colocando las muestras en la
estufa a 70 oC hasta obtener peso constante.
Todos los caracteres cumplían los supuestos de normalidad y homogeneidad
de varianza, por lo cual se procedió a efectuar un análisis de
varianza con arreglo bifactorial en el experimento uno y ANOVA de clasificación
simple en el experimento dos. Los datos fueron analizados mediante el software
STATGRAPHICS Centurion para Windows. Para la discriminación
de medias se utilizó el procedimiento de Duncan con una significación
de un 5 % en los casos en que el ANOVA resultó significativo.
RESULTADOS
Y DISCUCIÓN
Los datos que
se muestran se corresponden con las medias de una repetición ya que el
comportamiento fue similar en la segunda.
Experimento 1
La observación al microscopio óptico de los propágulos
de la especie Glomus cubense conservados en refrigeración durante
seis meses revelaron que las esporas mantuvieron su coloración de hialina
a amarilla, con una tendencia muy pálida. En cuanto
a las formas de las esporas se pudo observar diversidad: ovoide, elipsoide,
piriforme a irregular, raramente globosa. Se observó que las paredes
de las esporas estuvieron conformadas por dos capas y no se observó eclosión
de las mismas.
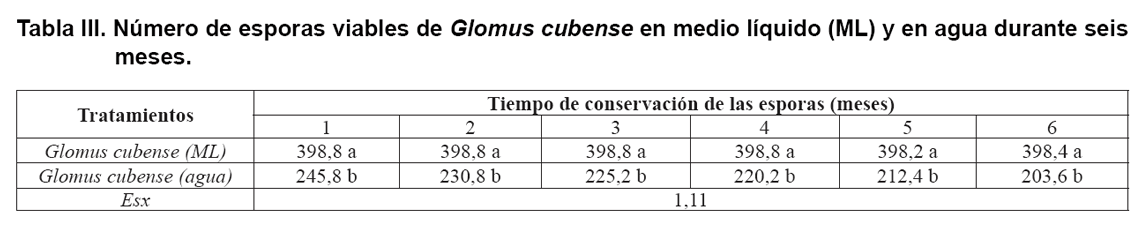
En la Tabla III se muestra
el número de esporas viables en medio líquido y agua destilada
estéril durante los seis meses del ensayo. El análisis bifactorial
arrojó que el número de esporas viables de Glomus cubense
dependió de la interacción entre el tipo de solución utilizada
y el tiempo de conservación.
Se encontró que en el medio líquido el contenido de esporas se
mantuvo estable durante el período de estudio, mientras que el valor
de las esporas conservadas en agua destilada estéril se redujo prácticamente
a la mitad desde el primer mes de la evaluación, tendencia que fue en
descenso en la medida que transcurrió el tiempo del estudio.
Este comportamiento encontrado en las esporas conservadas en agua destilada
estéril pudo estar relacionado con la diferencia de presión osmótica
entre el interior de la espora y el exterior rodeado por agua.
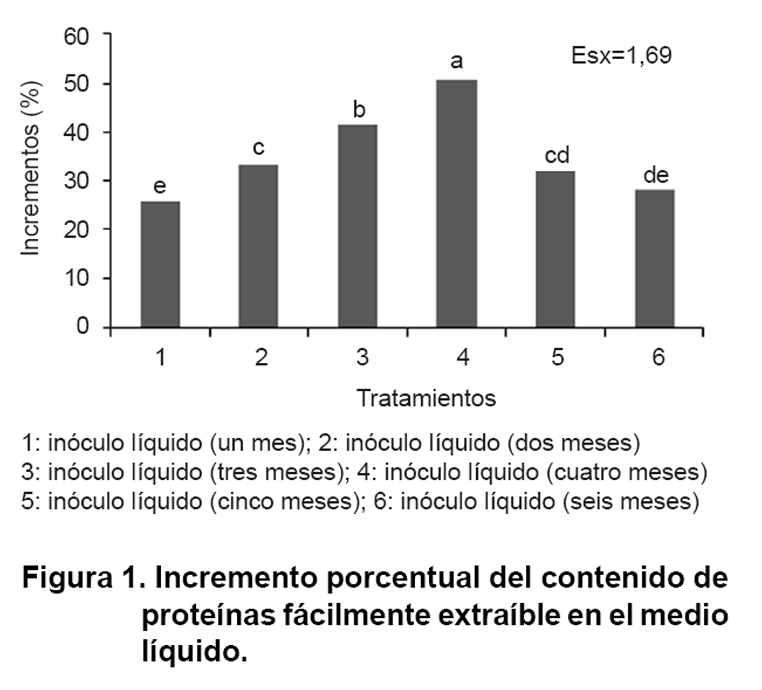
En la Figura 1 se describen
los incrementos porcentuales del contenido de proteínas fácilmente
extraíbles producidas en medio líquido encontrándose una
tendencia al incremento, con porcentajes superiores a los cuatro meses de conservadas
las esporas (50 %) y un descenso marcado a partir de los cinco meses.
No se debe obviar que la desinfección realizada a las esporas utilizadas
en este experimento eliminó parte de la microbiota asociada a la pared
exterior de las mismas y algunos estudios confirman que la presencia de microorganismos
en las paredes de las esporas estimulan la germinación, el desarrollo
del tubo germinativo y la ramificación hifal, procesos propios del metabolismo
del hongo y que estimulan, en su conjunto, la liberación de sustancias
al medio que las rodea (19).
En este estudio
se demostró la habilidad de la esporas de Glomus cubense para
mantenerse viables pasados seis meses de conservación en medio líquido,
situación que pudiera estar relacionada con la estimulación de
mecanismos de germinación a partir de la creación de una condición
de estrés durante un tiempo de almacenamiento.
Experimento 2
Influencia de la inoculación de Glomus cubense en indicadores
del funcionamiento micorrízico
En la Figura
2 se describe el comportamiento de la frecuencia de colonización
micorrízica alcanzada por las plantas de sorgo en los dos muestreos realizados.
Se observó, en el primer muestreo, diferencias entre los tratamientos
estudiados en relación con el control no inoculado. Los tratamientos
inoculados con esporas conservadas por tres, cuatro, cinco y seis meses alcanzaron
los mayores valores (11 %) y a su vez no difirieron del tratamiento con inóculo
sólido. Por otra parte, se encontró que los tratamientos inoculados
con esporas conservadas por uno y dos meses mostraron los valores más
bajos.
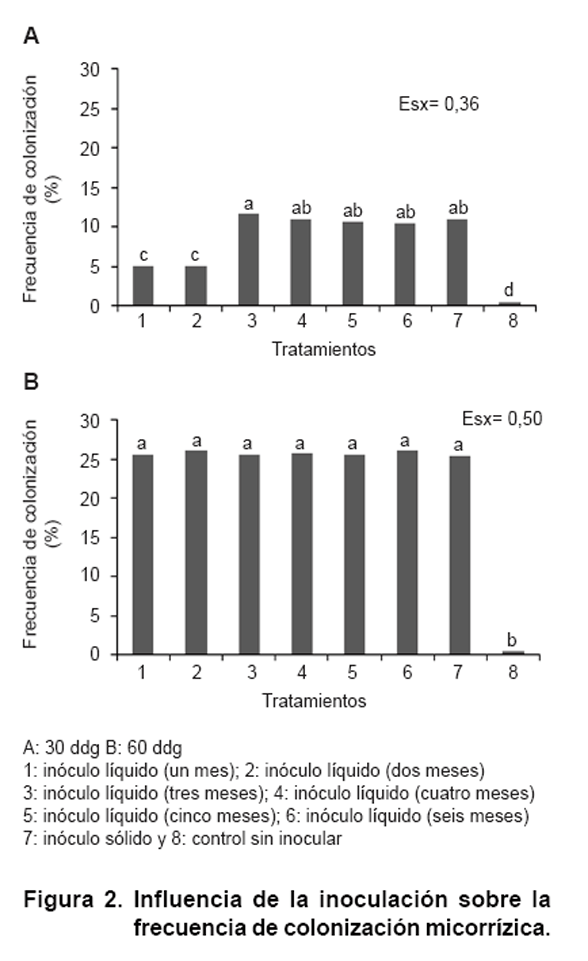
En el segundo muestreo se pudo apreciar diferencias en relación con el
control no inoculado. Los valores máximos alcanzados en los tratamientos
inoculados (25 %) fueron inferiores si se comparan con los reportados en plantas
de arroz bajo condiciones de estrés salino, donde se informaron cifras
cercanas a 38 % a los 60 ddg en tratamientos micorrizados con inóculo
líquido (20).
La respuesta encontrada para este indicador en el tratamiento no inoculado puede
estar relacionada con la presencia de algunas estructuras fúngicas que
persistieron tras el proceso de esterilización del suelo, siendo dicho
propágulo menos infectivo que la especie inoculada en este ensayo.
El comportamiento de la intensidad de la colonización micorrízica
durante el ensayo se muestra en la Figura
3. En el primer muestreo realizado se encontró que los tratamientos
inoculados con esporas almacenadas por tres, cuatro, cinco y seis meses mostraron
un comportamiento similar al tratamiento con inóculo sólido (T7),
alcanzando valores cercanos a 0,13 %. En otro orden, los tratamientos inoculados
con esporas almacenadas por uno y dos meses (T1 y T2) mostraron un comportamiento
similar con valores que oscilaron entre 0,05 % y todos los tratamientos inoculados
difirieron significativamente del control no inoculado.
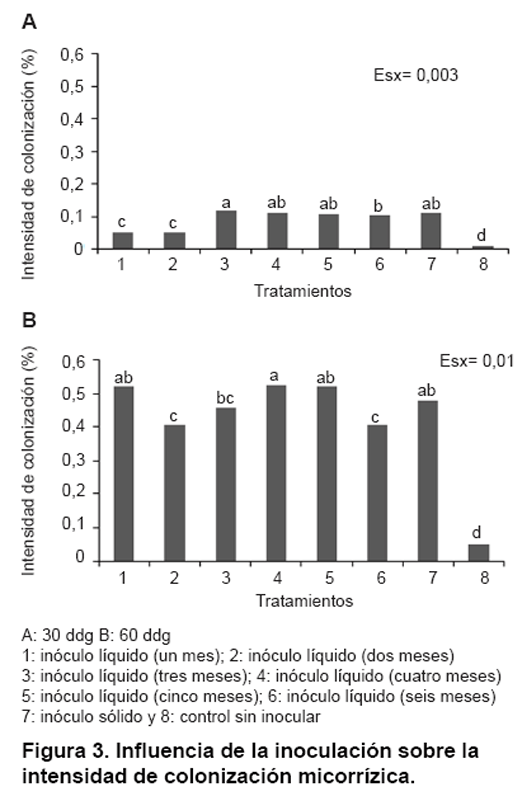
En el segundo muestreo se pudo apreciar que los tratamientos T1, T4, T5 y T7
(inoculados con esporas almacenadas por uno, cuatro, cinco y siete meses respectivamente)
alcanzaron valores superiores (0,53 %) difiriendo significativamente de los
tratamientos T2, T3 y T6 (inoculados con esporas almacenadas por dos, tres y
seis meses respectivamente) con valores que oscilaron entre 0,40-0,45 %. El
tratamiento no inoculado mantuvo el mismo comportamiento que en el muestreo
anterior. Estudios realizados en plantas de trigo arrojaron valores de intensidad
de colonización de 0,49 % cuando se inocularon con HMA en formulación
líquida, el cual fue inferior al encontrado en este estudio (20).
Al realizar un análisis integral de los indicadores de funcionamiento
micorrízico se deduce que ambas formas de inoculación (líquido
o sólido) resultaron promisorias para las plantas de sorgo.
Influencia de la inoculación con Glomus cubense en
indicadores del crecimiento de las plantas
Uno de los beneficios que
se le atribuye a los HMA es su capacidad para promover el crecimiento y desarrollo
vegetal (21), y en las Figuras
4 y 5 se muestra
la influencia de la inoculación sobre la masa seca de la raíz
y la masa seca foliar respectivamente. Se encontró un comportamiento
similar en ambos muestreos en cuanto al comportamiento de los tratamientos inoculados
en relación con el control, lo que permite aseverar la efectividad del
establecimiento micorrízico para ambas formas de inoculación (sólido
y líquido) en los dos indicadores evaluados.
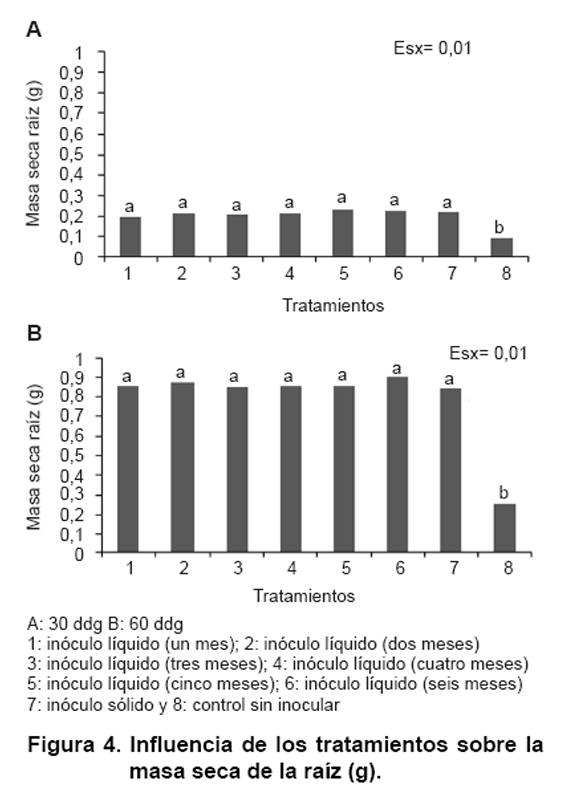
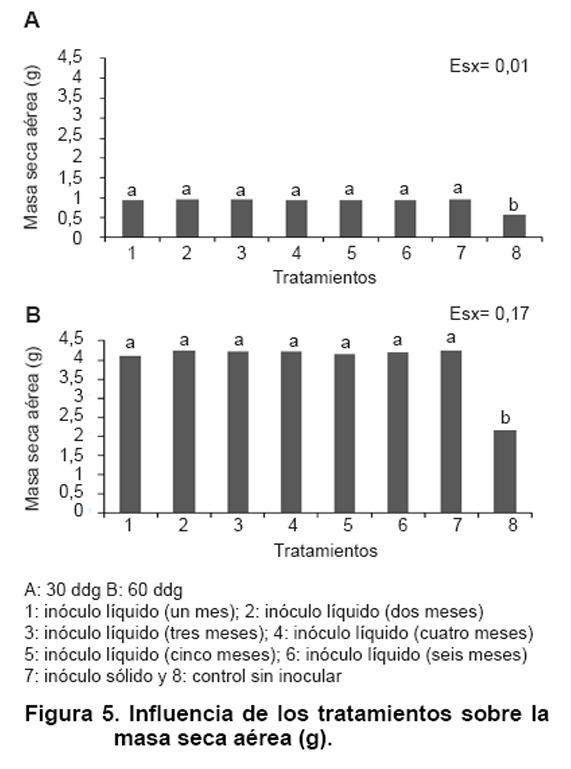
El efecto de la inoculación de HMA sobre indicadores de crecimiento y
desarrollo de las plantas ha sido ampliamente avalado en numerosos estudios,
no sólo por la habilidad de dichos simbiontes para colonizar una raíz,
sino para tomar del suelo y transferir a la planta nutrientes como el fósforo
y el nitrógeno, constituyendo este uno de los aspectos clave que determina
la eficacia de la simbiosis (4, 5).
Los resultados de esta investigación demostraron la efectividad de la
solución osmoprotectora del inoculante líquido al mantener la
viabilidad de las esporas de HMA durante todos los tiempos estudiados. Por otra
parte, se encontraron incrementos de proteínas totales en el inoculante
líquido en todos los tiempos estudiados, siendo superior a los 4 meses.
Se obtuvo un efecto positivo en los indicadores de funcionamiento micorrízico
y del crecimiento de las plantas de sorgo al inocular las esporas de HMA almacenadas
hasta los 6 meses.
BIBLIOGRAFÍA
1. Klabi, R.; Hamel, C.;
Schellenberg, M.P.; Iwaasa, A.; Raies, A. y St-Arnaud, M. ‘‘Interaction between
legume and arbuscular mycorrhizal fungi identity alters the competitive ability
of warm-season grass species in a grassland community’’, Soil Biology and
Biochemistry, vol. 70, marzo de 2014, pp. 176-182, ISSN 0038-0717, DOI
10.1016/j.soilbio.2013.12.019.
2. Miranda, D.; Fischer, G. y Ulrichs, C. ‘‘The influence of arbuscular mycorrhizal
colonization on the growth parameters of cape gooseberry (Physalisperuviana
L.) plants grown in a saline soil’’, Journal of soil science and plant nutrition,
vol. 11, no. 2, enero de 2011, pp. 18-30, ISSN 0718-9516, DOI 10.4067/S0718-95162011000200003.
3. Neumann, E. y George, E. ‘‘Nutrient Uptake: The Arbuscular Mycorrhiza Fungal
Symbiosis as a Plant Nutrient Acquisition Strategy’’ [en línea], eds.
Koltai, H. y Kapulnik, Y., Arbuscular Mycorrhizas: Physiology and Function,
edit. Springer Netherlands, 2010, pp. 137-167, ISBN 978-90-481-9488-9, [Consultado:
5 de mayo de 2015], Disponible en: <http://link.springer.com/chapter/10.1007/978-90-481-9489-6_7>.
4. Abo-Rekab, Z.; Darwesh, R. y Hassan, N. ‘‘Effect of arbuscular mycorrhizal
fungi, NPK complete fertilizers on growth and concentration nutrients of acclimatized
date palm plantlets’’, Mesopotamia Journal of Agriculture, vol. 38,
2010, pp. 9–19, ISSN 1815316X.
5. Mrnka, L.; Kuchár, M.; Cieslarová, Z.; Matejka, P.; Száková,
J.; Tlustoš, P. y Vosátka, M. ‘‘Effects of Endo- and Ectomycorrhizal
Fungi on Physiological Parameters and Heavy Metals Accumulation of Two Species
from the Family Salicaceae’’, Water, Air, & Soil Pollution, vol.
223, no. 1, 6 de julio de 2011, pp. 399-410, ISSN 0049-6979, 1573-2932, DOI
10.1007/s11270-011-0868-8.
6. McCain, K.N.S.; Wilson, G.W.T. y Blair, J.M. ‘‘Mycorrhizal suppression alters
plant productivity and forb establishment in a grass-dominated prairie restoration’’,
Plant Ecology, vol. 212, no. 10, 19 de junio
de 2011, pp. 1675-1685, ISSN 1385-0237, 1573-5052, DOI 10.1007/s11258-011-9940-0.
7. Ruiz-Lozano, J.M.; Porcel, R.; Azcón, C. y Aroca, R. ‘‘Regulation
by arbuscular mycorrhizae of the integrated physiological response to salinity
in plants: new challenges in physiological and molecular studies’’, Journal
of Experimental Botany, vol. 63, no. 11, 6 de enero de 2012, pp. 4033-4044,
ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/ers126, [PMID: 22553287].
8. Banuelos, J.; Alarcón, A.; Larsen, J.; Cruz-Sánchez, S. y Trejo,
D. ‘‘Interactions between arbuscular mycorrhizal fungi and Meloidogyne incognita
in the ornamental plant Impatiens balsamina’’, Journal of soil science and
plant nutrition, vol. 14, no. 1, marzo de 2014, pp. 63-74, ISSN 0718-9516,
DOI 10.4067/S0718-95162014005000005.
9. Cicatelli, A.; Todeschini, V.; Lingua, G.; Biondi, S.; Torrigiani, P. y Castiglione,
S. ‘‘Epigenetic control of heavy metal stress response in mycorrhizal versus
non-mycorrhizal poplar plants’’, Environmental Science and Pollution Research,
vol. 21, no. 3, 24 de agosto de 2013, pp. 1723-1737, ISSN 0944-1344, 1614-7499,
DOI 10.1007/s11356-013-2072-4.
10. Corbera, J. y Nápoles, M.C. ‘‘Evaluación de la inoculación
conjunta bradyrhizobium japonicum - hongos ma y la aplicación de un bioestimulador
del crecimiento vegetal en soya, cultivada en época de primavera’’, Cultivos
Tropicales, vol. 32, no. 4, diciembre de 2011, pp. 13-19, ISSN 0258-5936.
11. Rivera Espinosa, R.A.; Martin Cardenas, J.V.; Calderón Puig, A. y
Torrez Hernández, A. ‘‘Utilizacion de cepas eficientes de hongos micorrizicos
arbusculares en el desarrollo de portainjertos de aguacate en un sustrato suelo-
cachaza’’, Cultivos Tropicales, vol. 32, no. 2, junio de 2011, pp.
172-183, ISSN 0258-5936.
12. Rivera Espinosa, R.; Fundora Sánchez, L.R.; Calderón Puig
Especialista, A.; Martín Cárdenas, J.V.; Marrero Cruz, Y.; Martínez,
L.R.; Simó González, J.; Riera Nelson, M. y Joao, J.P. ‘‘La efectividad
del biofertilizante EcoMic® en el cultivo de la yuca. resultados de las
campañas de extensiones con productores’’, Cultivos Tropicales,
vol. 33, no. 1, marzo de 2012, pp. 5-10, ISSN 0258-5936.
13. Fernández, F.; Dell’Amico, J.M.; Angoa, M.V. y la Providencia, I.E.
de. ‘‘Use of a liquid inoculum of the arbuscular mycorrhizal fungi Glomus
hoi in rice plants cultivated in a saline Gleysol: A new alternative to
inoculate’’, Journal of Plant Breeding and Crop Science, vol. 3, no.
2, 2011, pp. 24–33, ISSN 2006-9758.
14. Rodríguez, Y.; Dalpé, Y.; Séguin, S.; Fernández,
K.; Fernández, F. y Rivera, R.A. ‘‘Glomus cubense sp. nov.,
an arbuscular mycorrhizal fungus from Cuba’’, Mycotaxon, vol. 118,
no. 1, 2012, pp. 337–347, ISSN 2154-8889.
15. Gerdemann, J.W. y Nicolson, T.H. ‘‘Spores of mycorrhizal Endogone species
extracted from soil by wet sieving and decanting’’, Transactions of the
British Mycological Society, vol. 46, no. 2, junio de 1963, pp. 235-244,
ISSN 0007-1536, DOI 10.1016/S0007-1536(63)80079-0.
16. Bradford, M.M. ‘‘A rapid and sensitive method for the quantitation of microgram
quantities of protein utilizing the principle of protein-dye binding’’, Analytical
Biochemistry, vol. 72, no. 1–2, 7 de mayo de 1976, pp. 248-254, ISSN 0003-2697,
DOI 10.1016/0003-2697(76)90527-3.
17. Hernández, A.; Pérez, J.; Bosch, D. y Castro, N. Clasificación
de los suelos de Cuba 2015, edit. Ediciones INCA, Mayabeque, Cuba, 2015,
p. 93, ISBN 978-959-7023-77-7.
18. Phillips, J.M. y Hayman, D.S. ‘‘Improved procedures for clearing roots and
staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment
of infection’’, Transactions of the British Mycological Society, vol.
55, no. 1, agosto de 1970, pp. 158-161, ISSN 0007-1536, DOI 10.1016/S0007-1536(70)80110-3.
19. Cranenbrouck, S.; Voets, L.; Bivort, C.; Renard, L.; Strullu, D.-G. y Declerck,
S. ‘‘Methodologies for in Vitro Cultivation of Arbuscular Mycorrhizal Fungi
with Root Organs’’ [en línea], eds. Declerck, P.D.S., Fortin, P.J.A.,
y Strullu, P.D.D.-G., In Vitro Culture of Mycorrhizas, edit. Springer
Berlin Heidelberg, 2005, (ser. Soil Biology, no. ser. 4), pp. 341-375, ISBN
978-3-540-24027-3, [Consultado: 14 de marzo de 2015], Disponible en: <http://link.springer.com/chapter/10.1007/3-540-27331-X_18>.
20. Plana, R.; González, P.J.; Fernández, F.; Calderón,
A.; Marrero, Y. y DellAmico, J.M. ‘‘Efecto de dos inoculantes micorrízicos
arbusculares (base líquida y sólida) en el cultivo del trigo duro
(Triticum durum)’’, Cultivos Tropicales, vol. 29, no. 4, diciembre
de 2008, pp. 35-40, ISSN 0258-5936.
21. Smith, S.E. y Read, D.J. Mycorrhizal Symbiosis [en línea],
3.a ed., edit. Academic Press, 2008, p. 816, ISBN 978-0-08-055934-6, [Consultado:
14 de marzo de 2015], Disponible en: <http://books.google.com.cu/books?hl=es&lr=&id=qLciOJaG0C4C&oi=fnd&pg=PP2&dq=Mycorrhizal+Symbiosis%2B+3rd+edition&ots=zptWjUVGqH&sig=-kh7kEX_L6EDUheQx0RmFMKIIQ4&redir_esc=y#v=onepage&q=Mycorrhizal%20Symbiosis%2B%203rd%20edition&f=false>.
Recibido: 8 de
enero de 2014
Aceptado: 24 de julio de 2014
Ms.C. Aracely
Mena Echevarría, Instituto Nacional de Ciencias Agrícolas
(INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700.
Email: amena@inca.edu.cu







