Percepción
de señales de los hongos micorrízicos arbusculares por plantas
de tomate (Solanum lycopersicum L.) en las fases iniciales del establecimiento
de la simbiosis
Perception
of arbuscular mycorrhizal fungus’ signals by tomato plants (Solanum lycopersicum
L.) at initial stages of symbiosis establishment
Dr.C. Eduardo
Pérez,I Dra.C. Yakelín Rodríguez,I
Dra.C. Kalyanne Fernández,I Blanca M. de la Noval,I
A. HernándezII
IInstituto
Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José
de las Lajas, Mayabeque, Cuba, CP 32700.
IIFacultad de Biología Universidad de la Habana, Cuba.
RESUMEN
La percepción
de las señales que se establecen entre las plantas y los microorganismos
que cohabitan con ellas inducen diferentes reacciones que pueden ser desde neutras
hasta defensivas. La simbiosis con hongos micorrízicos arbusculares (HMA)
es la más extendida en el planeta y los mecanismos por los cuales colonizan
a la planta, así como la percepción de las señales que
emiten se encuentran en el foco de investigación de la actualidad, dado
que la rapidez con que sean percibidas las señales les permitirá
competir con otros microorganismos presentes en la rizósfera por el nicho
de establecimiento, teniendo en cuenta que no todos colonizan con la misma intensidad
y que esto depende en primer término de la relación especie-fertilidad
del suelo. Por ello se realizó este experimento de comparación
con dos de las cepas más utilizadas del cepario del Instituto Nacional
de Ciencias Agrícolas (INCA) para comprobar la rapidez de la percepción
de las señales de estos HMA por las plantas y se evaluó a través
de dos enzimas relacionadas con la defensa. Se observó una rápida
inducción de las actividades de estas enzimas al inicio de la dinámica,
que disminuyó rápidamente en la medida que se inició el
reconocimiento entre los simbiontes. Las plantas inoculadas con G. cubense
respondieron más rápido, según pudo observarse en la dinámicas
de activación y esto podría relacionarse con el hecho de ser la
cepa recomendada para esta condición de suelo por sus efectos agronómicos
demostrados.
Palabras
clave: Mycorrhizae, enzimas pectinolíticas, mecanismos de defensa.
ABSTRACT
The signal perception
established between plants and microorganisms cohabiting with them induce different
reactions that range from neutral to defensive. The symbiosis with mycorrhizal
arbuscular fungi (AMF) is the most widespread on the planet and the mechanisms
used by these fungus to colonize plants as well as the perception of signals
emitted are in the focus of research today because the speed which those signals
are perceived allow them to compete with other microorganisms present in the
rhizosphere for the establishment’ niche, taking into account that not all mycorrhizal
fungus colonize with the same intensity and that intensity of colonization depends,
primarily, on the species- soil fertility relationship. Therefore, this experiment
was carried out to compare two of the strains most frequently used from INCA
AMF’ strain collection in order to check the speed of plants can perceived the
signals emitted by these AMF, and it was evaluated using defense enzymes. A
swift activation of these enzymes at initial stages of dynamic was observed;
but the activation diminishes as soon as recognition achieved. Inoculated plants
with G. cubense shown faster responses, according the dynamic of activation;
this could be according to the criteria of strain recommendation for this specie
which has been shown the better agronomic effects for this soil condition.
Key words:
Mycorrhizae,
pectinolytic enzymes, defense mechanisms.
INTRODUCCIÓN
Las plantas son
organismos vivos que se comunican con otros organismos en su ambiente. Dado
que las plantas no pueden ver, oír o caminar emiten señales que
les permiten percibir los cambios en el ambiente y sobrevivir. Las plantas producen
y exudan a través de la raíz una gran variedad de químicos
entre los que se encuentran azúcares, aminoácidos, ácidos
grasos, reguladores del crecimiento y metabolitos secundarios, algunos de los
cuales utilizan para la comunicación con su ambiente (1).
Entre las interacciones que se producen en la rizósfera se pueden mencionar
las raíz-raíz, raíz-microorganismos y raíz-insectos.
Muchas de estas interacciones tienen efecto neutro sobre las plantas. Sin embargo,
en la rizósfera se encuentran también las que se establecen con
los mutualistas o los que son beneficiosos (2).
Por su parte, los microorganismos pueden afectar el crecimiento y desarrollo
de las plantas de forma positiva o negativa, así como cambiar la dinámica
de los nutrientes, la susceptibilidad a enfermedades la tolerancia a metales
pesados y pueden además ayudar a las plantas en la degradación
de xenobióticos (3). Como resultado, la interacción planta-microorganismo
presenta un potencial considerable para la explotación biotecnológica.
Un buen ejemplo sería poder manipular las señales que toman lugar
en la rizósfera, en la cual las plantas usan sus raíces para comunicarse
e interactuar con otros microorganismos (1).
Entre las más antiguas asociaciones simbióticas de las plantas
se encuentran las micorrizas arbusculares que se establecen con hongos del phylum
Glomeromycota. Esta simbiosis que la forman más del 80 % de las plantas
terrestres se considera la más extendida en el planeta y su desarrollo
resulta en la formación de estructuras subcelulares dentro de la planta
conocidas como arbúsculos que resultan en el sitio principal de intercambio
de nutrientes entre la planta y su par asociado (4). Los hongos micorrízicos
arbusculares (HMA) se conectan a la planta a través de una red hifal
que puede exceder 100 metros de hifas por centímetro cubico de suelo
y está especializada en la toma de nutrientes y agua (5). A cambio la
planta suplementa al hongo con carbohidratos provenientes de la fotosíntesis.
El 20 % de los productos de la fotosíntesis (cerca de 5 billones de toneladas
de carbono por año) se estiman que son consumidos por el hongo micorrízico,
por lo tanto estos hongos contribuyen significativamente al ciclaje de fosfato
y carbono e influencian la productividad en los ecosistemas terrestres (6).
El control bidireccional ejercido por ambos simbiontes implica importantes cambios
en el metabolismo primario y secundario y la regulación de los mecanismos
defensivos de la planta (7) y tienen un importante impacto en su fisiología,
alterando las capacidades de la planta para enfrentar estrés bióticos
y abióticos (8, 9, 10).
Es conocido que no todos los HMA resultan tener igual eficiencia en diferentes
ambientes edáficos y que hay una relación especifica entre su
eficiencia, en términos agronómicos, y la fertilidad y el pH de
los suelos (11, 12). Debido a estas razones podría pensarse que la percepción
de las señales emitidas por estos hongos determinan, no solo su eficiencia
en términos de competencia por el nicho de colonización, sino
también la rapidez con que estos colonizan las plantas y, por tanto,
comienzan a pasar de la fase de estrés biótico a la fase de simbionteA.
A pesar de ello, los estudios de la percepción de señales que
estos hongos inducen en la planta aún se encuentran en fases iniciales
por el hecho de su biotrofismo obligatorio (1, 13), por lo que este trabajo
tuvo como objetivo evaluar los cambios en las actividades relacionadas con la
defensa inducidos por dos HMA en plantas de tomate en la fase inicial del establecimiento
de la simbiosis.
MATERIALES
Y MÉTODOS
Material
vegetal
Se empleó la variedad de tomate (Solanum lycopersicum L.) Amalia
obtenida por el Departamento de Genética y Mejoramiento Vegetal del Instituto
Nacional de Ciencias Agrícolas (INCA) como modelo de estudio porque se
conoce que induce sistemas defensivos en etapas tardías de la colonización.
Material fúngico
Se utilizaron las cepas de hongos micorrízicos arbusculares (HMA) Glomus
mosseae (Nicolson & Schenck), INCAM-2; G. cubense (Y. Rodr.&
Dalpé), INCAM-4; procedentes del cepario del Laboratorio de Micorrizas
del INCA, San José de las Lajas, Mayabeque. Las especies se conservaron
en un sustrato desarrollado para estos fines (Registro de patente No.2264) a
4ºC. Los inóculos de HMA utilizados en los experimentos poseían
un título promedio de 50 esporas g-1 de sustrato, certificado
en el Laboratorio de Micorrizas del INCA.
Condiciones experimentales
El experimento se desarrolló en cepellones, con un sustrato esterilizado
por calor a 121 oC por 1 h durante tres días alternos conformado por
una mezcla de suelo Ferralítico Rojo lixiviado típico (14) y humus
de lombriz en relación 3:1 (p/p). Las características agroquímicas
del sustrato empleado se muestran en la Tabla
I.

Las plantas se desarrollaron en condiciones controladas de temperatura (23 ±
2 ºC), humedad relativa (80-85 %) y fotoperíodo natural (14 horas
luz -10 horas oscuridad). Los experimentos se ejecutaron en condiciones de casa
de cristal en las áreas del Centro Nacional de Sanidad Agropecuaria (CENSA),
San José de las Lajas, Mayabeque, Cuba.
Dinámica de inducción temporal y local de PR 2 (ß 1,3 glucanasas)
y PR 3 (quitinasas), en plantas micorrizadas con las cepas promisorias
Para evaluar la inducción de PR2 y PR3 en las primeras horas del proceso
de micorrización, se sembraron las semillas en el sustrato presentado
en la Tabla I y se mantuvieron
en las condiciones antes descritas. En el día 21 (después de la
germinación) se inocularon las plantas, por la vía radical, con
los hongos micorrízicos seleccionados, en forma líquida utilizando
una suspensión de esporas (105 esporas mL-1), en una solución
protegida osmóticamente (solicitud de Patente Nacional, OCPI 2004-0272).
Las muestras de raíces se tomaron a las 1, 2, 4, 8, 12, 18, 24 y 48 horas,
después de la aplicación de la suspensión.
Las muestras de raíces se maceraron en nitrógeno líquido
y se homogenizaron en proporción 1:2 (g mL-1), con solución
amortiguadora de extracción (acetato de sodio, 0,1 M, pH 5,2; que contenía
5 g de polivinilpirrolidona y 0,05 g de b- mercaptoetanol, en 100 mL de solución
de extracción). El homogenato se agitó en zaranda durante 45 minutos,
en baño de hielo. Posteriormente se filtró y se centrifugó
a 14 000 x G, a 4 °C durante 25 minutos, en centrífuga refrigerada
(Beckman, modelo J2-21). El sobrenadante se almacenó a -20 °C hasta
su uso, para las determinaciones de la actividad enzimática por las metodologías
presentadas en la Tabla
II. La concentración de proteínas se determinó según
Bradford (1976).

Diseño experimental y análisis estadístico de los
datos
Los experimentos se desarrollaron siguiendo un diseño completamente aleatorizado
con tres repeticiones y se reprodujeron en dos momentos diferentes.
Se calculó el intervalo de confianza de las medias al 95 % de probabilidad,
atendiendo al número de repeticiones y la reproducibilidad de los datos.
RESULTADOS
Y DISCUSIÓN
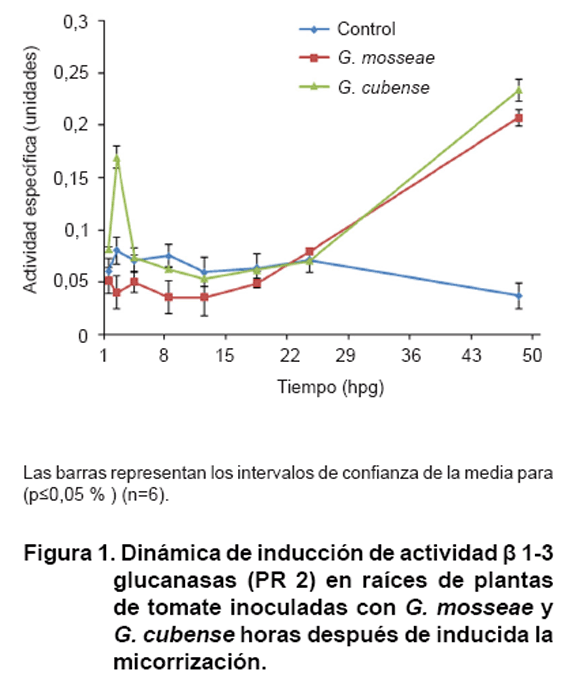
La Figura
1 muestra la dinámica de activación encontrada, a nivel local,
en raíces, para la enzima ß 1, 3 glucanasa horas después
de haber sido inoculadas con los HMA en estudio. Se aprecia que la inducción
es rápida, dado que se detectaron niveles de actividad enzimática
que en el caso G. cubense superaron a las plantas sin inocular desde
la hora uno y hasta la cuatro. Por su parte, la cepa G. mosseae aunque
con valores inferiores al testigo, también presentó niveles de
actividad desde la hora uno. En las horas finales de esta dinámica (48
horas) se observó un incremento significativamente superior en las plantas
tratadas con respecto al testigo sin inocular.
La Figura
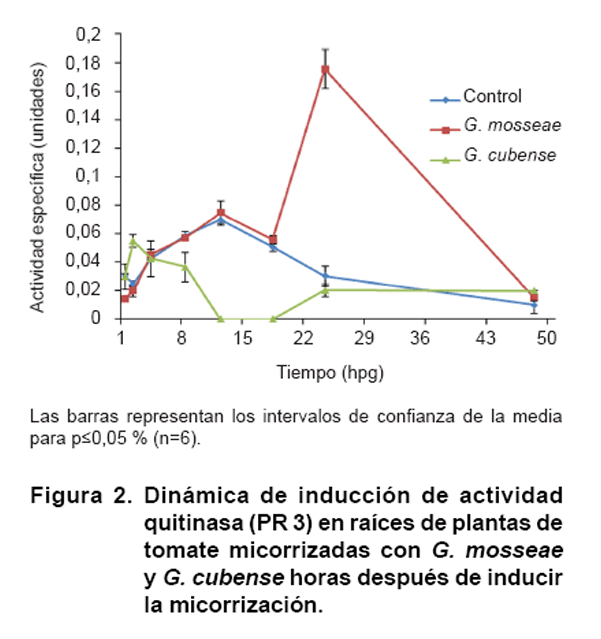
2 muestra la dinámica de activación de la enzima quitinasa
en raíces de plantas inoculadas, horas después de ser inducida
la micorrización. Se observa que las plantas inoculadas con G. cubense
presentan niveles de activación al inicio de la dinámica que disminuye
a las 12 horas, estas plantas presentan una nueva inducción en la hora
17 que se mantiene hasta el final de la dinámica. Las plantas tratadas
con G. mosseae mostraron un comportamiento similar a las plantas testigo,
las que inicialmente presentan una baja actividad y un máximo a las 12
horas. Las plantas testigo a partir de este momento disminuyen la actividad
hasta el final de la dinámica, no ocurriendo así con las plantas
micorrizadas con G. mosseae que presentan un máximo de activación
en la hora 24 y disminuye con el tiempo.
De modo general,
se observa que para ambas cepas fue rápida y elevada la inducción
de PRs a nivel local, lo que indica que la percepción de las señales
que se establecen entre las cepas y las plantas de tomate fue efectiva.
La inducción de mecanismos defensivos por estos hongos formadores de
micorrizas arbusculares que es deprimida como consecuencia del reconocimiento
molecular entre los simbiontes, provoca una supresión de los eventos
moleculares que permiten la acción defensiva por parte de la planta y
está en correspondencia con lo obtenido por otros autores (15). Esta
depresión es debida fundamentalmente al hecho descrito por estos autores
relacionado con la secreción de una proteína efectora por los
HMA que promueve la biotrofía simbiótica, actuando sobre los genes
defensivos de las plantas. Este hecho promueve la colonización de los
HMA en el sistema radical, que a partir de la percepción de señales
de forma rápida provocó niveles de inducción de PR proteínas
que tienden a disminuir después de haber sido enfrentados los simbiontes
y debe ser la causa de la disminución de las actividades detectadas.
Este hecho indica que en la medida que la planta y los HMA comienzan a interactuar
la dinámica en el tiempo de inducción de mecanismos de defensa
debe disminuir, si se considera que pasan de una fase de estrés biótico
a simbiontes, lo que se puede predecir por el rápido establecimiento
de las señales que se establecen entre ambas partes.
Los resultados de inducción temprana de ß 1, 3 glucanasa, así
como la detección de niveles basales en las plantas sin micorrizar coinciden
con los informados al encontrar niveles de activación de la enzima desde
horas tempranas de la colonización. Los niveles basales de actividad
para ambas enzimas podrían estar asociados con procesos de diferenciación
celular. En el caso de las plantas micorrizadas estos niveles, además,
se pueden asociar al crecimiento hifal en las raíces de las plantasA.
La existencia de un máximo de actividad en las plantas inoculadas con
G. cubense en el inicio de la dinámica de actividad de ß
1,3 glucanasa indica que la presencia del HMA en la raíz, induce la activación
de esta enzima, que además de actuar en los procesos de diferenciación
celular antes mencionados, participa en la degradación de las paredes
celulares de los hongos debido a la presencia de ß 1,3 glucanos en las
mismas (16), lo que permite este reconocimiento entre la planta y los hongos
micorrízicos empleados y que es más evidente para la cepa G.
cubense. Además, se ha informdo que la percepción de las
señales por las plantas produce cambios morfológicos en la célula
hospedante que se comienza a preparar para la colonización con la formación
de un aparato de prepenetración que involucra la activación de
enzimas que favorecen el crecimiento hifal del hongo en la raíz (17).
De igual forma, las quitinasas presentes en las plantas, dado su papel en las
respuestas de defensa, generan la producción de elicitores que inducen
respuestas más débiles en plantas micorrizadas que en aquellas
que se enfrentan a microorganismos patógenos (13).
La elevación de las actividades enzimáticas al inicio de las dinámicas
realizadas, seguida por una disminución rápida que llega hasta
los niveles basales de actividad, supone una rápida interacción
y reconocimiento entre las plantas y el HMA. Está demostrado que el reconocimiento
entre la planta y el hongo HMA hace que cese la respuesta defensiva por parte
de la planta (13, 15) y que el rápido reconocimiento de los simbiontes
suprima rápidamente los patrones defensivos de la misma.
El hecho de que la inducción y el reconocimiento, entendido como la activación
y la disminución de las actividades enzimáticas, permita señalar
a la cepa G. cubense como la que más rápido fue percibida
por la planta, podría estar relacionado con el hecho de que esta cepa
es la que se recomienda para esta condición de fertilidad y pH de suelo
por sus efectos agronómicos observados.
BIBLIOGRAFÍA
1. Almuiñas,
R.J.L. y Galarza, L.J. ‘‘El proceso de planificación estratégica
en las universidades: desencuentros y retos para el mejoramiento de su calidad’’,
Revista Gestão Universitária na América Latina-GUAL,
vol. 5, no. 2, 2012, pp. 72–97, ISSN 1983-4535.
2. Idris, K.; Hamzah, A.; Uli, J. y Tiraieyari, N. ‘‘Importance of program development
competencies for agricultural extension agents performance in process of technology
transfer’’, American Journal of Agricultural and Biological Sciences,
vol. 5, no. 3, 2010, pp. 376–379, ISSN 1557-4989.
3. Alfaro, R.J.
Elementos metodológicos para la planificación estratégica
en programas de educación superior. [en línea], 1.a ed.,
edit. IICA, CECAP, San José, Costa Rica, 1997, p. 64, ISBN 0534-539,
[Consultado: 14 de marzo de 2015], Disponible en: <http://www.sidalc.net/cgi-bin/wxis.exe/?IsisScript=BINAI.xis&method=post&formato=2&cantidad=1&expresion=mfn=010521>.
4. Marzin, J.;
López, T. y Cid, G. ‘‘Tendencias actuales en transferencia de tecnología
y extensionismo: lecciones para la situación en Cuba’’, en: Sablón,
M., Salguero, Z., y Vallejo, Y., Extensión Agraria: Selección
de lecturas, edit. Félix Varela, La Habana, Cuba, 2011, pp. 37-46, ISBN
978-959-7023-62-3.
5. Iturbide, F.M.J.
Diagnóstico de Guatemala: Necesidades de capacitación para
enfrentar los desafíos de la negociación internacional de actividades
REDD+ [en línea], [Contrato 83105592], Programa Reducción
de Emisiones de la Deforestación y Degradación de Bosques en Centroamérica
y República Dominicana (REDD – CCAD/GIZ), Guatemala, 2012, p. 46, [Consultado:
2 de septiembre de 2015], Disponible en: <http://www.reddccadgiz.org/documentos/doc_423813522.pdf
>.
6. Valdés,
N. y Vargas, D. ‘‘Gases de efecto invernadero en la agricultura, un llamado
a la acción’’, en: Ríos, H., Vargas, D., y Funes, F., Innovación
agroecológica, adaptación y mitigación del cambio climático,
1.a ed., edit. Ediciones INCA, Mayabeque, Cuba, 2011, pp. 15-23, ISBN 978-959-7023-52-4.
7. Ríos,
H.; Vargas, D. y Funes, F. Innovación agroecológica, adaptación
y mitigación del cambio climático, 1.a ed., edit. Ediciones
INCA, Mayabeque, Cuba, 2011, p. 105, ISBN 978-959-7023-52-4.
8. Expósito,
V.M. y Hidalgo, E.J. Diagnóstico rural participativo: Una guía
práctica [en línea], edit. Centro Cultural Poveda, Proyecto
Comunicación y Didáctica, Santo Domingo, República Dominicana,
2003, p. 116, ISBN 99934-24-10-2, [Consultado: 2 de septiembre de 2015], Disponible
en: <http://www.inducar.pt/cp/ow_userfiles/plugins/forum/attachment_44_507eea1fe8529.pdf
>.
9. Geilfus, F.
80 herramientas para el desarrollo participativo [en línea],
8.a ed., edit. IICA, San José, Costa Rica, 2009, p. 217, ISBN 99923-77-27-5,
[Consultado: 2 de septiembre de 2015], Disponible en: <http://www.google.com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&ved=0CB0QFjAAahUKEwjjnLb059jHAhXFqx4KHVf3B8c&url=http%3A%2F%2Fejoventut.gencat.cat%2Fpermalink%2Faac2bb0c-2a0c-11e4-bcfe-005056924a59&usg=AFQjCNGzfHQYfU6qHPPMijALQMRLukSViw&bvm=bv.101800829,d.dmo&cad=rja>.
10. Serrate-Alfonso,
A.; Portuondo-Velez, A.L.; Sanchez-Puigbert, N. y Suarez-Ojeda, R. ‘‘Evaluacion
de la cultura organizacional y su incidencia en la efectividad grupal’’, Ingeniería
Industrial, vol. 35, no. 1, abril de 2014, pp. 2-12, ISSN 1815-5936.
11. Freedman, M.
‘‘The genius is in the implementation’’, Journal of Business Strategy,
vol. 24, no. 2, 1 de febrero de 2003, pp. 26-31, ISSN 0275-6668.
12. Martínez,
M.F.Z.; Bakker, N. y Gómez, H.L. ‘‘Herramientas para la metodología
campesino a campesino innovación pedagógica para construir saberes
agroecológicos’’, LEISA Revista de Agroecología, vol.
26, no. 4, 2010, pp. 3-10, ISSN 1569-8424.
13. Nieto, M. y
Delgado, R. ‘‘El sector agrario y la seguridad alimentaria’’, en: Funes, F.,
García, L., Bourque, M., Pérez, N., y Rosset, P., Transformando
el campo Cubano: avances de la agricultura sostenible, edit. Asociación
Cubana de Técnicos Agricolas y Forestales, La Habana, Cuba, 2001, pp.
39-56, ISBN 978-959-246-032-4.
14. Pérez,
M.M.E. y Clavijo, P.N. Experiencias y enfoques de procesos participativos
de innovación en agricultura: el caso de la Corporación PBA en
Colombia [en línea], edit. FAO, 2012, p. 55, ISBN 978-92-5-307425-9,
[Consultado: 2 de septiembre de 2015], Disponible en: <http://www.fao.org/3/a-i3136s.pdf>.
15. Poussart, C.
‘‘Equidad de género y su importancia para el desarrollo de las fincas
forestales integrales’’, Agricultura Orgánica, vol. 13, no.
1, 2007, pp. 33-36, ISSN 1028-2130.
16. Lage, A. ‘‘La
empresa de alta tecnología y la gestión de discontinuidades’’,
La economía del conocimiento y el socialismo, 1.a ed., edit. Academia,
La Habana, Cuba, 2013, pp. 243–265, ISBN 978-959-270-286-8.
Recibido: 9 de
enero de 2014
Aceptado: 12 de enero de 2015
Dr.C. Eduardo
Pérez, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta
postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700. Email: eduardo@inca.edu.cu



