COMUNICACIÓN CORTA
La kinetina ribósido como estimulador de la germinación In
Vitro de esporas de Glomus clarum
The
kinetin riboside as In Vitro stimulator of Glomus clarum spores
germination
Dra.C.
Kalyanne Fernández Suárez, Dr.C. Eduardo Pérez Ortega,
Laura R. Medina García
Instituto Nacional
de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las
Lajas, Mayabeque, Cuba, CP 32700.
RESUMEN
La micorrización
de plantas in vitro constituye hoy en día un reto de la biotecnología
agrícola y depende en gran medida del potencial germinativo de los propágulos
de hongos micorrízicos arbusculares (HMA) utilizados, en especial las
esporas, sus habilidades colonizativas y de los sistemas y medios de cultivo.
El objetivo de este trabajo fue evaluar el efecto de dos concentraciones (0,05
mg L-1 y 0,07 mg L-1) de la auxina AIA y la citoquinina
kinetina ribósido en la germinación y el crecimiento del tubo
germinativo in vitro de esporas de G. clarum en medio de cultivo
E (MS modificado). Se utilizó además el medio E y el SRM como
controles. Todos los medios de cultivo influyeron sobre el comportamiento de
ambas variables. La concentración de kinetina ribósido de 0,07
mg L-1 tuvo un efecto positivo sobre el porcentaje de germinación,
alcanzándose valores en este medio cercanos al 100 %, transcurridos 10
días de incubación. Estos valores fueron estadísticamente
similares a los encontrados en el medio SRM. Sin embargo, los mayores valores
de crecimiento del tubo germinativo se obtuvieron en el medio SRM y superaron
en un 45 % aproximadamente a los alcanzados en medio E combinado con la concentración
de kinetina ribósido de 0,07 mg L-1. Las concentraciones de
AIA utilizadas tuvieron un efecto inhibitorio sobre la germinación e
igualmente sobre el crecimiento de los tubos germinativos.
Palabras
clave: mycorrhizae, sustancias de crecimiento vegetal, germinación
de esporas, micelio.
ABSTRACT
Nowadays the in
vitro mycorrhization of plants is a challenge in agricultural biotechnology
and it depends of the germination potential of arbuscular mycorrhizal fungal
(AMF) propagules, specially the spores, their colonization abilities and the
media and systems of culture. The aim of this work was to evaluate the effect
of two concentrations (0,05 mg L-1 y 0,07 mg L-1) of the
auxin AIA and the cytochinin kinetin riboside on in vitro germination
and germinative tube length of G. clarum spores in E medium (modified
MS). E and MSR media were used as controls. All culture media had influence
on both variables performance. The concentration of kinetin riboside of 0,07
mg L-1 had a positive effect on germination percentage, reaching
values of 100 % in that medium after 10 days of incubation. Those values were
statistically similar to those founded in MSR medium. However, the highest values
of germinative tube length were obtained in MSR medium and they were 45 % higher
to those measured in E medium combined with kinetin riboside (0,07 mg L-1).
The AIA concentrations used had an inhibitory effect on spore germination and
also on the germinative tubes growth.
Key words:
mycorrhizae, plant growth substances, spores germination, mycelium.
INTRODUCCIÓN
La capacidad
de los Hongos Micorrízicos Arbusculares (HMA) de aumentar el crecimiento
y la sobrevivencia de las plantas ha despertado el interés de los científicos
en todo el mundo. En la actualidad se ha potenciado el uso de estos microorganismos
como sustitutos de fertilizantes químicos y plaguicidas, en armonía
con el desarrollo de prácticas de producción agrícola sostenibles
(1).
La micorrización de plantas in vitro constituye hoy en día
un reto de la biotecnología agrícola y depende en gran medida
del potencial germinativo de los propágulos de hongos micorrízicos
arbusculares (HMA) utilizados, en especial las esporas, de sus habilidades colonizativas
y de los sistemas y medios de cultivo. El perfeccionamiento metodológico
continuo de los sistemas de cultivo (composición de los medios de cultivo
y las condiciones ambientales de crecimiento) contribuirá al desarrollo
de sistemas que garanticen la producción masiva de plantas micorrizadas
in vitro (2).
El medio de cultivo E (3) fue diseñado para sustituir el medio SRM (Strullu
y Romand modificado), comúnmente utilizado para el cultivo in vitro
de los HMA, ya que este no garantiza los requerimientos nutricionales de las
plantas de papa in vitro. Este medio se obtuvo a partir de modificaciones
realizadas al medio MS (Murashige & Skoog), para garantizar la micorrrización
de plantas de papa (Solanum tuberosum L. cv. Desiré) con el
HMA G. clarum (Nicolson & Schenck), en sistemas de cultivo parcialmente
in vitro (3). Sin embargo, en sistemas totalmente in vitro,
también estudiados por el mismo autor, en los que usualmente se producen
las plantas en estas condiciones, no se logró la germinación de
las esporas en el medio EA, o no ocurrió con la rapidez necesaria. La
causa probable de la ausencia o retardo en la germinación fue la presencia
de etileno en los envases (2), conocido regulador del crecimiento vegetal que
puede influir negativamente en la germinación de esporas de HMA (4, 5)
y es producido por las plantas de papa cuando se cultivan en envases cerrados
(6).
La germinación de esporas es uno de los procesos más importantes
durante el ciclo de vida de estos hongos, de la cual va a depender, en gran
medida, el éxito del establecimiento de la simbiosis (7), tanto en condiciones
naturales como in vitro. Aunque las esporas, por lo general, no necesitan
de factores externos para germinar (8), este es un proceso complejo que está
influido por dormancia y almacenamiento, pH, temperatura, humedad, luz, aireación
(oxígeno, CO2), iones inorgánicos, microorganismos,
agentes oxidantes, antibióticos y pesticidas. Otras investigaciones más
recientes reconocen también a factores radicales liberados por el hospedero
conocidos como proteínas, CO2, flujo de protones extracelulares
y estrigolactonas (9) como estimuladores de la germinación de esporas
(10) y el crecimiento y la ramificación hifal presimbióticos (11,
12).
Otros reguladores del crecimiento como auxinas o citoquininas podrían
tener determinada influencia sobre la germinación de esporas de HMA,
ya que se conoce que las plantas micorrizadas varían los niveles de estas
hormonas en relación con las plantas no micorrizadas (13), modifican
su potencial colonizativo y se discute la posibilidad de que estos hongos produzcan
alguna de ellas (13).
Por todo lo expuesto anteriormente, el propósito de este trabajo fue
evaluar el efecto de la auxina AIA y la citoquinina kinetina ribósido
en la germinación y el crecimiento del tubo germinativo de esporas de
G. clarum en medio de cultivo E.
MATERIALES
Y MÉTODOS
Para dar cumplimiento
al objetivo propuesto se realizó un experimento con dos repeticiones
en el tiempo, en condiciones controladas de laboratorio, en el cual se evaluó
el efecto de dos reguladores del crecimiento sobre la germinación y el
largo del tubo germinativo in vitro de esporas del HMA G. clarum
- MUCL 46238, aislado de un ecosistema cubano.
Las esporas de G. clarum utilizadas, de cuatro meses de cultivo, se
adquirieron en GINCO (Colección in vitro de Glomeromycota, BCCM/MUCL,
Unidad de Microbiología, Universidad católica de Lovaina, Lovaina
la Nueva, Bélgica, http://www.mbla.ucl.ac.be/ginco-bel) y fueron suministradas
en placas Petri de 90 mm de diámetro, en asociación con raíces
transformadas (Ri T-DNA) de zanahoria (Daucus carota L.) en medio SRM (Strullu
y Romand modificado) (14), solidificado con 3 g L-1 de Gel Gro®.
Las esporas se extrajeron del cultivo después de solubilizar el medio
SRM con una solución de ácido cítrico (1,92 g 100 mL-1)
y citrato de sodio (2,94 g 100 m L-1) (15) y mantenidas en agua desionizada
estéril hasta su utilización. Posteriormente, se inocularon en
medio E (MS modificado) (3) sin azúcar y sin vitaminas combinado con
dos concentraciones (0,05 mg L-1 y 0,07 mg L-1) de kinetina
ribósido (Duchefa Biochemie) y ácido indol acético (AIA
- Sigma) y se utilizaron los medios E y SRM como controles.
Se inocularon cinco esporas por placa Petri de 90 mm de diámetro con
ayuda de una micropipeta Eppendorf (20 µL) y se utilizaron 10 placas para
cada medio de cultivo. Posteriormente, se sellaron las placas con Parafilm (Pechiney,
PlasticPackaging, Chicago, IL 60631) y se incubaron a 27 oC hasta finalizar
los estudios.
Evaluaciones
Se determinó el porcentaje de germinación (%) y la longitud del
tubo germinativo (mm) de las esporas. La germinación se monitoreó
cada dos días después de la incubación y hasta los 16 días.
Se consideró una espora germinada cuando se apreció crecimiento
del tubo germinativo a partir del esporóforo o del extremo de la hifa
de sostenimiento, en el caso de que la espora tuviese. La longitud del tubo
germinativo se evaluó al finalizar el experimento (16 días) empleando
un micrómetro. Las evaluaciones se realizaron utilizando un microscopio
de disección (10-40X, Olympus SZ40, Olympus Optical GmbH, Alemania).
Análisis estadístico
Después de comprobada la normalidad y la homogeneidad de varianza (Test
de Brown-Forsythe), utilizando el paquete estadístico Statistica, los
datos fueron sometidos a Análisis de Varianza de clasificación
simple y posterior Test de Tuckey, con el fin de identificar las diferencias
significativas entre los tratamientos a p<0,05. Los valores de porcentaje
de germinación fueron transformados, según la expresión
arcsen√/100 y comprobada su distribución normal. Con los valores de ambas
variables se calcularon los intervalos de confianza de la media al 95 % de probabilidad,
atendiendo al número de repeticiones y la reproducibilidad de los datos.
RESULTADOS
Y DISCUSIÓN
Al evaluar el
efecto de las dos concentraciones de kinetina ribósido y AIA en medio
E sobre el porcentaje de germinación de esporas de G. clarum
(Figura 1), se obtuvo
un efecto diferenciado de los medios de cultivo sobre la variable, apreciable
desde los primeros cuatro días de incubación.
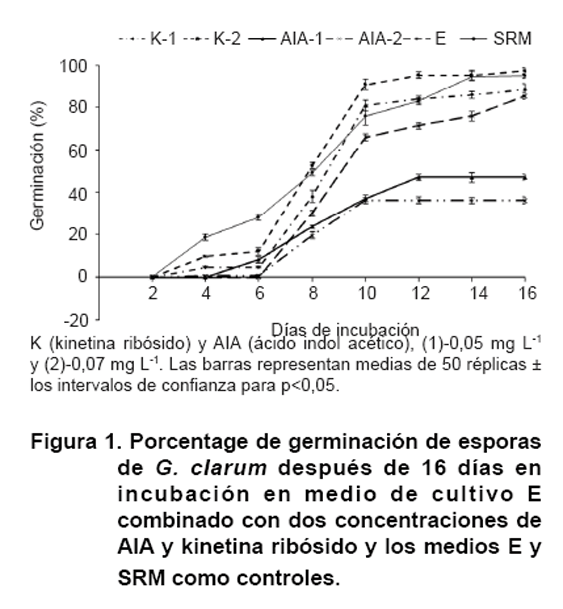
Los porcentajes de germinación de las esporas comenzaron a aumentar gradualmente
a medida que transcurrieron los días, alcanzando un valor máximo
para cada medio de cultivo en el día 10. A partir de este momento los
valores de la variable se mantuvieron constantes hasta el día 16 en que
finalizó el experimento, siendo mayores en las esporas que se encontraban
en los medios E-kinetina 2 (0,07 mg L-1) y el medio SRM, sin diferencias
significativas entre ellos. A los 16 días, prácticamente el 100
% de las esporas se encontraban germinadas en estos dos medios.
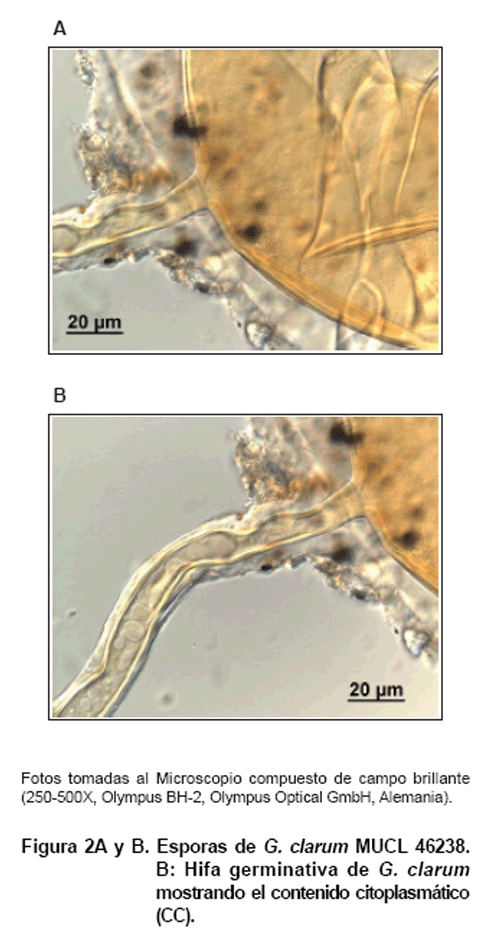
Los tubos germinativos
observados mostraban un crecimiento típico de G. clarum con
gran cantidad de contenido citoplasmático (Figura
2) y se extendían rectos dentro de los medios de cultivo, sin apreciarse
efecto de la composición de los medios sobre su comportamiento, aunque
sí sobre la longitud de los mismos.
En la Figura 3 puede
observarse el efecto de la composición de los medios sobre el crecimiento
de los tubos germinativos de esporas de G. clarum. A diferencia del
porcentaje de germinación, los mayores valores de esta variable se obtuvieron
en el medio SRM, utilizado comúnmente para el cultivo in vitro
de HMA en raíces transformadas, seguido por el medio E combinado con
0,07 mg L-1 de kinetina ribósido, que en este caso mostró
valores 45 % menores que los encontrados en medio SRM.
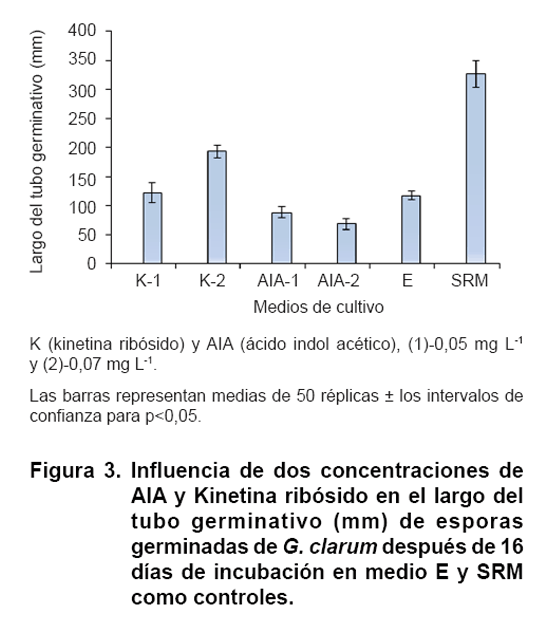
En ambos
medios los valores de crecimiento de los tubos germinativos superaron estadísticamente
a los observados en el resto de los medios de cultivo. Los menores valores de
esta variable se obtuvieron en los medios que contenían AIA.
Las plantas micorrizadas incrementan la acumulación de citoquininas tanto
en raíces como en tallos, por lo que es obvio que existe una estrecha
relación entre el establecimiento micorrízico y la evolución
de esta fitohormona en las diferentes partes del vegetal (12).
Si bien no existen informes en la literatura consultada que destaquen un efecto
directo de las citoquininas sobre los eventos previos al proceso colonizativo
de los hongos micorrízicos, no caben dudas que en el caso de este experimento
existe evidencia directa de que la kinetina ribósido, a la concentración
de 0,07 mg L-1 en el medio E, estimula significativamente la germinación
de esporas de G. clarum y el crecimiento de los tubos germinativos.
No obstante, en el caso de los hongos ectomicorrízicos, sí existen
evidencias de que las citoquininas producidas por las plantas estimulan las
ramificaciones del micelio (13). Si esto se confirmara, sería evidente
que las hifas de los hongos micorrízicos tienen receptores, al menos,
para algunas fitohormonas y estas podrían jugar un rol en la fase asimbiótica
de su ciclo de vida.
Determinados metabolitos secundarios radicales como los flavonoides o terpenoides,
dependiendo de la especie de planta, aunque no son esenciales en la simbiosis
micorrízica arbuscular, pueden afectar la germinación de las esporas,
la producción de ramificaciones hifales y la colonización radical
(10, 11, 12). Los isoflavonoides tienen estructuras similares a estrógenos
y en R. intraradices se ha demostrado que existen sitios de unión
similares a los que utilizan los estrógenos, que al parecer juegan un
papel en la regulación del crecimiento de la hifa (16).
Por otra parte, ha sido clonado un cDNA de R. intraradices (Ginmyc1)
con una secuencia similar a una proteína receptora de hormona esteroide
y los productos del gen han sido detectados solo en las hifas externas, lo cual
sugiere que puedan jugar un papel en el estadio de precolonización (17).
En el medio E combinado con cualquiera de las dos concentraciones de AIA se
obtuvieron valores de germinación menores significativamente que en las
esporas incubadas en los otros medios de cultivo. Estos valores no superaron
el 50 % de germinación, manifestando un efecto inhibitorio de esta hormona,
a la concentración utilizada, sobre el comportamiento de la variable.
Es probable que las concentraciones de AIA empleadas hayan tenido un efecto
negativo sobre la germinación y el crecimiento de los tubos germinativos,
teniendo en cuenta los estudios realizados por Cecep et al. (7), al
inocular, conjuntamente con las esporas, bacterias aisladas del exterior de
esporas de G. sp., en condiciones in vitro. Según estos
autores los efectos encontrados en el comportamiento de ambas variables estuvieron
relacionados con la producción de AIA por parte de las cepas bacterianas
empleadas. Si la concentración de AIA se encontraba en valores nanomolares
pues se estimulaba la germinación de las esporas y por el contrario,
si los valores de AIA producidos eran del orden de los micromolares, como los
empleados en este experimento, pues se inhibía la germinación.
En un estudio similar, se refirió que las fitohormonas como el AIA pueden
estimular la germinación de esporas y el crecimiento hifal de Gigaspora
margarita y G. fistulosum a concentraciones nanomolares e inhibirlos
a altas (micromolares) (17).
CONCLUSIONES
• La aplicación
de kinetina ribósido de 0,07 mg L-1 al medio E estimula la
germinación de esporas de G. clarum, alcanzándose valores
de germinación del 100 %, similares a los obtenidos en medio SRM. Sin
embargo, las concentraciones de AIA utilizadas (0,05 mg L-1 y 0,07
mg L-1) en el mismo medio (E), tuvieron un efecto inhibitorio, tanto
sobre la germinación como sobre el crecimiento de los tubos germinativos
de las esporas. Los mayores valores de longitud de los tubos germinativos se
obtuvieron en el medio SRM, comúnmente utilizado para el cultivo in
vitro de los HMA.
• Aunque en la literatura no abundan trabajos relacionados con el efecto de
las citoquininas sobre la germinación de esporas, es preciso tener en
cuenta los resultados de este estudio, no solo para complementar los avances
alcanzados en la temática de micorrización de plantas in vitro
en nuestro país, sino también porque constituyen resultados valiosos
a considerar en los intentos por cultivar in vitro especies de HMA
consideradas “recalcitrantes” que se resisten al cultivo en estas condiciones.
• La ausencia de descripciones sobre el papel de las fitohormonas en la biología
de los hongos en general, podría simplemente ser el reflejo de que in
vivo la acción de las hormonas está regulada por gradientes de
concentración que son difíciles de reproducir experimentalmente.
BIBLIOGRAFÍA
1. Fernández,
F.; Dell’Amico, J.M.; Angoa, M.V. y la Providencia, I.E. de. ‘‘Use of a liquid
inoculum of the arbuscular mycorrhizal fungi Glomus hoi in rice plants
cultivated in a saline Gleysol: A new alternative to inoculate’’, Journal
of Plant Breeding and Crop Science, vol. 3, no. 2, 2011, pp. 24–33, ISSN
2006-9758.
2. Fernández Suárez, K. ‘‘Los sistemas de cultivo in vitro
aplicados al estudio de los hongos micorrízicos arbusculares (HMA)’’,
Cultivos Tropicales, vol. 33, no. 2, junio de 2012, pp. 33-43, ISSN
0258-5936.
3. Fernández Suárez, K.; Fernández MartínI, F. y
Declerck, S. ‘‘Búsqueda de un medio de cultivo para la micorrización
In Vitro de plántulas de papa (Solanum tuberosum L.)’’,
Cultivos Tropicales, vol. 34, no. 4, diciembre de 2013, pp. 9-19, ISSN
0258-5936.
4. Mukherjee, A. y Ané, J.-M. ‘‘Germinating Spore Exudates from Arbuscular
Mycorrhizal Fungi: Molecular and Developmental Responses in Plants and Their
Regulation by Ethylene’’, Molecular Plant-Microbe Interactions, vol.
24, no. 2, 2 de noviembre de 2010, pp. 260-270, ISSN 0894-0282, DOI 10.1094/MPMI-06-10-0146.
5. Fracetto, G.G.M.; Peres, L.E.P.; Mehdy, M.C. y Lambais, M.R. ‘‘Tomato ethylene
mutants exhibit differences in arbuscular mycorrhiza development and levels
of plant defense-related transcripts’’, Symbiosis, vol. 60, no. 3,
14 de julio de 2013, pp. 155-167, ISSN 0334-5114, 1878-7665, DOI 10.1007/s13199-013-0251-1.
6. Taghizadeh, M. y Ehsanpour, A. ‘‘The in vitro effects of CoCl2 as
ethylene synthesis inhibitor on PI based protein pattern of potato plant (Solanum
tuberosum L.)’’, Journal of Cell and Molecular Research, vol.
5, no. 1, 20 de noviembre de 2013, pp. 42-46, ISSN 2008-2762, DOI 10.14677/jcmr.v5i1.28410.
7. Cecep, H.; Dedeh, H.A.; Nurbaity, A. y Sauman, J. ‘‘Rhizobacteria Selection
to Enhance Spore Germination and Hyphal Length of Arbuscular Mycorrhizal Fungi
in Vitro’’, Asian Journal of Agriculture and Rural Development,
vol. 3, no. 4, 2013, pp. 199 - 204, ISSN 2224-4433.
8. Twanabasu, B.R.; Stevens, K.J. y Venables, B.J. ‘‘The effects of triclosan
on spore germination and hyphal growth of the arbuscular mycorrhizal fungus
Glomus intraradices’’, Science of The Total Environment, vol.
454-455, 1 de junio de 2013, pp. 51-60, ISSN 0048-9697, DOI 10.1016/j.scitotenv.2013.02.036.
9. Kohlen, W.; Charnikhova, T.; Liu, Q.; Bours, R.; Domagalska, M.A.; Beguerie,
S.; Verstappen, F.; Leyser, O.; Bouwmeester, H. y Ruyter-Spira, C. ‘‘Strigolactones
are transported through the xylem and play a key role in shoot architectural
response to phosphate deficiency in nonarbuscular mycorrhizal host Arabidopsis’’,
Plant Physiology, vol. 155, no. 2, 2011, pp. 974–987, ISSN 1532-2548.
10. Cohen, M.; Prandi, C.; Occhiato, E.G.; Tabasso, S.; Wininger, S.; Resnick,
N.; Steinberger, Y.; Koltai, H. y Kapulnik, Y. ‘‘Structure–function relations
of strigolactone analogs: activity as plant hormones and plant interactions’’,
Molecular plant, vol. 6, no. 1, 2013, pp. 141–152, ISSN 1752-9867.
11. Gough, C. y Cullimore, J. ‘‘Lipo-chitooligosaccharide Signaling in Endosymbiotic
Plant-Microbe Interactions’’, Molecular Plant-Microbe Interactions,
vol. 24, no. 8, 6 de abril de 2011, pp. 867-878, ISSN 0894-0282, DOI 10.1094/MPMI-01-11-0019.
12. Bonfante, P. y Genre, A. ‘‘Arbuscular mycorrhizal dialogues: do you speak
‘plantish’ or ‘fungish’?’’, Trends in Plant Science, vol. 20, no. 3,
marzo de 2015, pp. 150-154, ISSN 1360-1385, DOI 10.1016/j.tplants.2014.12.002.
13. Barker, S.J. y Tagu, D. ‘‘The Roles of Auxins and Cytokinins in Mycorrhizal
Symbioses’’, Journal of Plant Growth Regulation, vol. 19, no. 2, 1
de junio de 2000, pp. 144-154, ISSN 0721-7595, 1435-8107, DOI 10.1007/s003440000021.
14. Declerck, S.; Strullu, D.G. y Plenchette, C. ‘‘Monoxenic culture of the
intraradical forms of Glomus sp. isolated from a tropical ecosystem:
a proposed methodology for germplasm collection’’, Mycologia, 1998,
pp. 579–585, ISSN 1557-2536.
15. Doner, L.W.; Becard, G. y card. ‘‘Solubilization of gellan gels by chelation
of cations’’, Biotechnology Techniques, vol. 5, no. 1, 1 de enero de
1991, pp. 25-28, ISSN 0951-208X, 1573-6784, DOI 10.1007/BF00152749.
16. Poulin, M.-J.; Simard, J.; Catford, J.-G.; Librie, F. y Piché, Y.
‘‘Response of Symbiotic Endomycorrhizal Fungi to Estrogens and Antiestrogens’’,
Molecular Plant-Microbe Interactions, vol. 10, no. 4, 1 de mayo de
1997, pp. 481-487, ISSN 0894-0282, DOI 10.1094/MPMI.1997.10.4.481.
17. Delp, G.; Smith, S.E. y Barker, S.J. ‘‘Isolation by differential display
of three partial cDNAs potentially coding for proteins from the VA mycorrhizal
Glomus intraradices’’, Mycological Research, vol. 104, no.
03, marzo de 2000, pp. 293–300, ISSN 1469-8102, DOI null.
18. Kaneko, M. y Tanimoto, E. ‘‘Auxin-regulation of hyphal elongation and spore
germination in arbuscular mycorrhizal fungus, Gigaspora margarita’’,
En: International Symposium «Root Research and Applications»
RootRAP, Boku–Vienna, Austria, 2009, pp. 2–4, [en línea],[Consultado:
14 de marzo de 2015], Disponible en: <http://asrr.boku.ac.at/fileadmin/files/RRcd/session03/poster/146.pdf>.
Recibido: 12 de
septiembre de 2014
Aceptado: 5 de febrero de 2015
Dra.C. Kalyanne
Fernández Suárez, Instituto Nacional de Ciencias Agrícolas
(INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700.
Email: kalyanne@inca.edu.cu


