Micropropagación
masiva de Stevia rebaudiana Bertoni en sistemas de inmersión
temporal
Mass
microprogation of Stevia rebaudiana Bertoni in temporary immersion
systems
Ms.C.
Silvana Alvarenga Venutolo, Tatiana Salazar Aguilar
Centro de Investigación
en Biotecnología. Escuela de Biología. ITCR. Cartago. Costa Rica.
RESUMEN
Stevia rebaudiana
Bertoni, familia Asteraceae, es conocida como “yerba dulce” por poseer un edulcorante
natural. Sus propiedades provienen de la presencia de glicósidos diterpenos
denominados esteviósidos y rebaudiósidos en las hojas. El porcentaje
de germinación de las semillas de S. rebaudiana es muy bajo
y las plantas producidas son heterogéneas, por lo que no es conveniente
para la propagación masiva en campo. El cultivo en sistemas de inmersión
temporal, es una herramienta eficaz para la micropropagación, ya que
incrementa el coeficiente de multiplicación y produce el mejoramiento
en la calidad del material regenerado in vitro. En esta investigación
se determinó el proceso de propagación de inmersión temporal
más eficiente para el escalamiento de la producción masiva de
Stevia rebaudiana, con el empleo de medios líquidos en sistemas
de inmersión temporal automatizado (RITA®) y vasos gemelos
(BIT), en comparación con el cultivo en medio semisólido. La mayoría
de los tratamientos en sistemas de inmersión temporal BIT y RITA®
produjeron plantas verdes y vigorosas, con bajos niveles de hiperhidricidad.
El mayor número promedio de regeneración de hojas y brotes se
obtuvo en RITA® con 10 minutos de inmersión cada ocho
horas. Se determinó que en el tratamiento que consistió en 10
minutos de inmersión cada 12 horas en BIT, produjo plantas muy vigorosas,
con el mayor incremento en longitud, masa fresca y masa seca promedio. El empleo
de cultivo in vitro en biorreactores de inmersión temporal (RITA®
y BIT), ofrece muchas ventajas en el proceso de escalamiento de la producción
de esta especie de interés comercial, respecto a los sistemas de cultivo
convencional, favoreciendo el proceso de aclimatación.
Palabras
clave: edulcorantes, cultivo in vitro, biorreactores, propagación,
Stevia.
ABSTRACT
Stevia rebaudiana
Bertoni, Asteraceae, is a natural sweetener called “Stevia”. Its properties
came from the diterpenoid glycosides presented in the leaves: a stevioside and
rebaudisioside. The percentage of seed germination of S. rebaudiana
is very low and the plants produced are heterogeneous, so it is not suitable
for mass propagation in the field.The tissue culture in temporary immersion
systems, is an effective tool for micropropagation, since it increases the multiplication
coefficient and produces the improvement in the quality of in vitro
regenerated plants. This research determined the efficieness of propagation
process using temporary immersion devices for scaling up the mass production
of Stevia rebaudiana, with the use of liquid media in automated temporary
immersion system (RITA®) and twin flasks system (BIT), compared
with semisolid culture. Most of the treatments involving temporary immersion
systems (BIT y RITA®), produced green plants and vigorous plants,
with low levels of hyperhydricity. The highest average of regenerated leaves
and shoots was obtained in the RITA® system, with 10 minutes
of immersion every 8 hours. It was determined also that 10 minutes on inmersion
each 12 hour with the BIT produced vigorous plants, with an increased length,
fresh and dry weight mass. The use of in vitro culture in temporary
immersion bioreactors (RITA® and BIT), offers many advantages
in the process of scaling the production of this kind of commercial plant, related
to connentional propagation system and encouraging the process of acclimatization.
Key words:
sweetener, in vitro culture, bioreactors, propagation, Stevia.
INTRODUCCIÓN
Stevia rebaudiana
Bertoni, de la familia Asteraceae, es conocida como “yerba dulce” por poseer
un edulcorante natural. Forma parte de la medicina tradicional indígena
del Paraguay, por sus usos como edulcorante y medicinal. Sus propiedades provienen
de la presencia de glicósidos diterpenos denominados esteviósidos
y rebaudiósidos (1, 2).
La Stevia rebaudiana acumula más de treinta esteviol glicósidos
en diferentes concentraciones, dependiendo del genotipo y de las condiciones
de cultivo. Los glicósidos más conocidos son los esteviósidos
y el rebaudósido A (3). Se ha reportado que la producción de esteviósidos
varía en un rango del 5 al 22 % del peso seco de la hoja y del 25 al
54 % de rebaudiósidos y en la variedad mejorada “Morita” la producción
de rebaudiósido puede alcanzar el 61,6 % (3, 4, 5, 6).
Las semillas de esta especie son muy pequeñas, por tanto, la colecta
es muy lenta y se dificulta por la floración poco uniforme del cultivo
en campo, lo que incide en la maduración de las mismas (7). El porcentaje
de germinación de las semillas de S. rebaudiana es muy bajo.
Se reporta que el mayor porcentaje de germinación fue de un 25,5 % a
los nueve días de siembra en suelo, pero posteriormente decreció
al 6,12 % de germinación, lo que se explica por una pérdida de
viabilidad de las semillas si se almacenan por largos periodos, por lo que no
es recomendable para la propagación masiva en campo (8).
Adicionalmente, la reproducción sexual produce poblaciones heterogéneas,
con un gran rango de variabilidad en los niveles de glicósidos producidos.
La propagación vegetativa está limitada, debido al bajo número
de propágulos producidos en comparación con el uso de las técnicas
de cultivo in vitro (9).
Se requiere el desarrollo de técnicas eficientes de propagación
masiva en esta especie, para obtener plantas libres de patógenos y que
conserven la tasa de producción de los metabolitos secundarios de interés,
en este caso los glicósidos.
El empleo del cultivo en biorreactores en medios líquidos y biorreactores
de inmersión temporal de vasos gemelos BIT, se han convertido en una
herramienta eficaz para la micropropagación, ya que incrementa el coeficiente
de multiplicación y produce el mejoramiento en la calidad del material
regenerado in vitro (10, 11). El empleo de estos sistemas incide en
la reducción de los costos de producción en el cultivo a escala,
ampliamente documentado en gran número de especies de valor comercial
(10, 12). Por otra parte, se controlan los tiempos de inmersión y se
reducen los problemas de hiperhidricidad, frecuentes en sistemas de cultivo
en medios líquidos (10, 11, 12).
En esta investigación se determinó el proceso de propagación
de inmersión temporal más eficiente para el escalamiento de la
producción masiva de Stevia rebaudiana, con el empleo de medios
líquidos en sistemas de inmersión temporal automatizado RITA®
y BIT, en comparación con el cultivo en medio semisólido.
MATERIALES
Y MÉTODOS
Introducción
y establecimiento in vitro
La introducción y el establecimiento in vitro se realizó
utilizando micro estacas de plantas cultivadas en el invernadero del Centro
de Investigación en Biotecnología (CIB), del Instituto Tecnológico
de Costa Rica (ITCR), ubicado en la provincia de Cartago en Costa Rica. Se introdujo
y multiplicó el material en medio semi-sólido que contenía
las sales y vitaminas (13), suplementado con 2 mg L-1 de Pantotenato
de Calcio, 0,5 mg L-1 de ácido giberélico (AG3),
30 g L-1 de sacarosa y 3,2 g L-1 de Phytgel®, a pH
de 5,7. Los explantes permanecieron en condiciones de luz difusa a una temperatura
de 25 ± 2 oC, y un fotoperiodo de 16 horas luz y ocho horas
oscuridad.
Las vitroplantas se subcultivaron cada 30 o 45 días, dependiendo del
crecimiento y desarrollo observado, bajo las mismas condiciones de luz
y temperatura ya descritas.
Micropropagación de S. rebaudiana en sistemas de cultivo
de inmersión temporal automatizado RITA® y de inmersión
temporal en vasos gemelos BIT
Las condiciones de cultivo fueron: 25Η2 ºC de temperatura, luz difusa
y fotoperiodo de 16 horas luz y ocho horas de oscuridad. Los explantes consistieron
en micro estacas de 12 mm de longitud, tomadas de vitroplantas vigorosas con
coloración verde oscuro, con tres subcultivos y con un mes desde su última
multiplicación.
Sistema 1. Inmersión temporal en RITA®
Se evaluaron cuatro tratamientos: cinco minutos de inmersión cada ocho
horas (T1) y cada 12 horas (T2); 10 minutos de inmersión cada ocho horas
(T3) y cada 12 horas (T4). Los recipientes de cultivo contenían 250 mL
de medio de multiplicación líquido y 25 explantes, cada uno, por
lo que para cada tratamiento se evaluaron cuatro RITA®, completando
cuatro repeticiones.
Sistema 2. Inmersión temporal en BIT
Se construyeron prototipos de BIT, empleando frascos de vidrio de 1 L de capacidad
con tapas autoclavables, tubos de vidrio para la entrada y salida de aire, empaques,
mangueras y filtros hidrofóbicos de 0,22 µm (Figura
1). El sistema se evaluó mediante cuatro tratamientos: cinco minutos
de inmersión cada ocho horas (T5) y cada 12 horas (T6); 10 minutos de
inmersión cada ocho horas (T7) y cada 12 horas (T8). Cada recipiente
contenía 500 mL de medio líquido y 50 explantes, cada tratamiento
consistió en cuatro repeticiones.

Tratamientos
testigo
El tratamiento testigo T9 consistió en el cultivo de 25 explantes por
frasco de cultivo con 250 mL de medio semi-sólido, en envases del sistema
de inmersión temporal RITA®, con un total de cuatro repeticiones.
El T10 consistió en el cultivo de cuatro repeticiones de 50 explantes
cada una, en frascos de cultivo BIT con 500 mL de medio de cultivo.
En todos los sistemas se utilizó un medio de micropropagación
con sales M&S, suplementado con 2 mg L-1 de Pantotenato de Calcio
y 0,5 mg L-1 de AG3, sin gelificante, excepto en el medio
semisólido (tratamientos testigo).
Transcurrido el periodo de multiplicación de tres semanas, se determinó
el número de brotes, el número de hojas, la longitud, la masa
fresca y la masa seca. Se calcularon promedios de la variable por repetición
en cada tratamiento. Solamente la medición de la masa seca se registró
como un solo dato para cada repetición, se obtuvo colocando los explantes
en la estufa a 70 oC durante 24 horas. Así mismo, se determinó
el contenido de clorofila a y b utilizando 15 mg de tejido, que posteriormente
se congeló con nitrógeno líquido, se maceró en un
mortero y se homogenizó con 1 mL de acetona al 80 %. Los extractos se
centrifugaron a 15000 g (12 500 rpm) por 15 minutos. Por último, se tomó
el sobrenadante y se realizaron las lecturas a 646,8 y 663,2 nm en un espectrofotómetro.
La concentración de clorofilas totales se calculó de acuerdo a
las ecuaciones propuestas por Lichtenthaler (14).
Se evaluaron las características cualitativas de coloración e
hiperhidricidad por tratamiento a través de la observación, y
se documentaron a través de fotografías. El color se evaluó
de acuerdo a una carta de Colores Pantone facilitados por la Escuela de Diseño
Industrial del ITCR.
Análisis estadístico de datos
Para cada una de las variables se calcularon los promedios correspondientes
por repetición. Los resultados se tabularon en cuadros que mostraban
el comportamiento de la variable según el tratamiento. Los datos obtenidos
se analizaron mediante ANOVA. La comparación de medias se hizo a través
de la Prueba de Tukey con una diferencia significativa honesta tanto de 1 como
de 5 %, con el uso del software Minitab®.
RESULTADOS
Y DISCUSIÓN
En gran número
de especies se ha reportado la producción de mayor número de propágulos
con el empleo de medios líquidos, ya que en este sistema los explantes
están en contacto directo con el medio de cultivo, lo que incide en que
la toma de nutrientes sea más efectiva; por otra parte, las sustancias
de desecho se secretan al medio líquido por lo que afectan en menor medida
al explante (11, 12, 15).
En el cultivo in vitro de Stevia en medio líquido en un biorreactor
de columna de burbujeo se determinó un incremento en masa fresca de los
brotes, en comparación con tratamientos utilizando matraces en agitación
(16).
En este trabajo se utilizó la inmersión temporal en sistemas BIT
y RITA®. Se realizó la comparación de medias del
número de brotes, número de hojas, longitud, masa fresca y masa
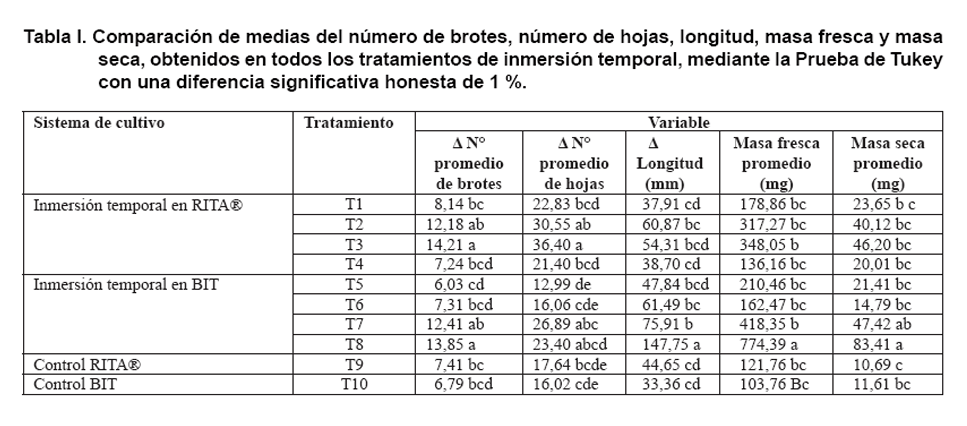
seca, las variables obtenidas en todos los tratamientos se muestran en la Tabla
I.
Número
de brotes
Los tratamientos T2, T3, T7 y T8 produjeron un mayor número promedio
de brotes, entre 12,18 y 14, 21, no evidenciando una diferencia significativa
entre los tratamientos (Tabla
I). El número de brotes promedio es un factor determinante en la
tasa de multiplicación, por lo que es relevante en la estimación
de costos de los procesos de propagación comercial.
En el caso de la micropropagación utilizando biorreactores se informa
de la facilidad en la producción y manejo de un mayor número de
plántulas, la estimulación de la tasa de crecimiento por la aireación
forzada, así como por la supresión de la dominancia apical, que
induce la estimulación de crecimiento de brotes laterales (17), lo que
representa una ganancia en cuanto a cantidad y calidad de material in vitro
disponible, lo que adquiere aún más relevancia cuando se trabaja
con especies de difícil manejo en laboratorio, haciendo indispensable
la implementación de tratamientos eficaces (11, 15, 18, 19, 20).
Número de hojas
En los sistemas BIT y RITA®, la inmersión por un periodo
de 10 minutos cada ocho horas produjo el mayor número promedio de hojas,
siendo mayor en el sistema RITA®. En cuanto al número
de hojas regeneradas en las plántulas, se determinó que el tratamiento
que presentó la mayor media 36,40 fue el T3 (10 minutos de inmersión
cada ocho horas en RITA®); sin embargo, no se presentó
diferencia significativa entre este tratamiento y los tratamientos T2 (10 minutos
de inmersión, cada ocho horas, RITA®), con un promedio
de 30,55 hojas y el T7 (10 minutos de inmersión, cada ocho horas, BIT),
con 26,89 hojas promedio y el T8 (10 minutos cada 12 horas, BIT),
con 23,40 hojas promedio producidas.
El número promedio de hojas es importante en Stevia rebaudiana,
ya que los metabolitos secundarios de esta especie, los diterpenos glicósidos,
que le confieren el sabor edulcorante, conocidos como esteviol glicósidos
(esteviósido y rebaudiósidos) se acumulan en las hojas, en un
rango de 4 a 20 % p/p en cultivos comerciales (15, 21), por lo que es de interés
obtener plántulas con mayor número de hojas y mayor área
foliar.
Longitud de las plántulas
El tratamiento que presentó el mayor promedio de longitud (147,74 mm),
consistió en una inmersión de 10 minutos cada 12 horas en el sistema
BIT. Produjo plantas de longitud casi 2,5 veces mayor al tratamiento en RITA®,
de cinco minutos de inmersión cada 12 horas (T2). Estos dos tratamientos
T2 y T8, presentaron diferencias significativas entre sí. Las plántulas
regeneradas en el sistema BIT, mostraron una mayor vigorosidad. En el tratamiento
inmersión de 10 minutos cada 12 horas, crecieron hasta el borde del frasco
de cultivo.
Probablemente las diferencias observadas entre los sistema BIT y RITA®
estén relacionadas con el tamaño efectivo del recipiente de cultivo
para el crecimiento de las plantas, ya que, aunque los dos contenedores son
de un litro de capacidad, en RITA®, se colocan los explantes
sobre un soporte aproximadamente a la mitad del vaso de cultivo, teniendo las
plantas el 50 % del espacio disponible para crecer unos 7,5 cm; en tanto, que
el BIT no tiene soportes y los envases tienen una altura de 14,8 cm de altura,
permitiendo un mayor crecimiento longitudinal de las plantas, lo que podría
representar una ventaja del sistema BIT, si el objetivo del proceso es producir
plantas de mayor tamaño aptas para la aclimatación.
La selección del sistema de inmersión a emplear, depende de la
estrategia de la micropropagación a seguir. Por ejemplo, si se requiere
mayor cantidad de brotes se podría utilizar un sistema de RITA®
(T3) que requiere menos espacio y produce plantas de menor longitud pero con
mayor número de brotes, si se desea obtener plantas con mayor longitud
y vigorosidad para ser aclimatadas o llevadas directamente a campo, se puede
elegir el sistema de BIT (T8).
Análisis de masa fresca
El mayor incremento en masa fresca obtenido fue de 774,39 mg en BIT, en el tratamiento
T8 (10 minutos cada 12 horas). Este tratamiento fue estadísticamente
diferente a todos los demás, con un nivel de confianza del 95 %.
Análisis de masa seca
Los menores valores de masa seca se obtuvieron en los tratamientos control,
el promedio mayor de masa seca de los tratamientos en RITA®,
fue obtenido en el tratamiento que consistió en inmersiones de diez minutos
cada ocho horas (T3); este superó más de cuatro veces a los promedios
obtenidos en el control en RITA®. Sin embargo, no se presentaron
diferencias estadísticas significativas entre los tratamientos en RITA®
(Tabla I).
En lo que respecta a los resultados de masa seca con el empleo del sistema BIT,
el incremento de biomasa seca fue casi ocho veces mayor en el tratamiento de
inmersión de diez minutos cada doce horas (T8), respecto al tratamiento
control respectivo. Los tratamientos T8 y T7, que consistieron en una inmersión
de 10 minutos cada ocho horas (Tabla
I) mostraron diferencias significativas respecto a los otros tratamientos
en BIT.
Presencia de clorofila y coloración
En la Tabla II se observa
el contenido de clorofila a y b de las plantas in vitro de Stevia
rebaudiana. La coloración verde está asociada a la presencia
de clorofila, esta medición se utiliza para determinar el estado fotosintético
y las reacciones relacionadas con el proceso de fotosíntesis de las plantas
(18).
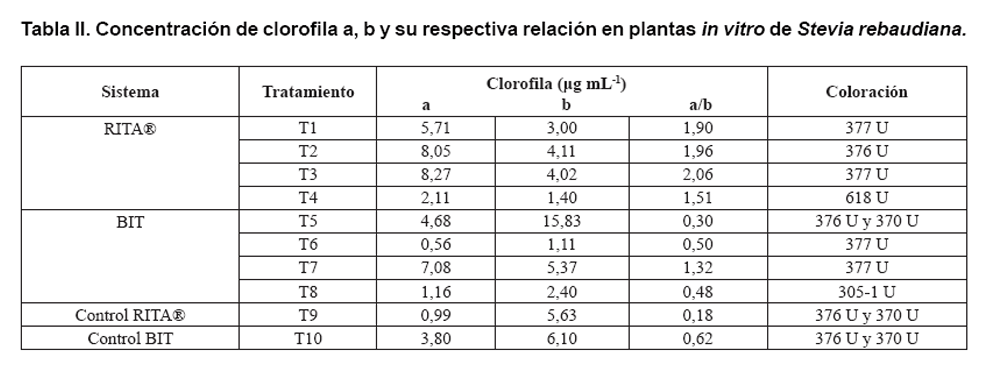
Los colores entre 370 y 377 U corresponden a distintas tonalidades de verde,
siendo el 377 U el más intenso, está presente en los tratamientos
T1 (5 minutos cada ocho horas) y T3 (10 minutos cada ocho horas) de RITA®,
T6 (5 minutos cada 12 horas) y T7 (10 minutos cada ocho horas) de BIT. El tratamiento
T4 (10 minutos cada 12 horas, RITA®) presentó una coloración
amarillenta, que corresponde al color 618U de la escala y el tratamiento T8
(10 minutos cada 12 horas, BIT) mostró una coloración verde-café
(305-1U). Estos dos tratamientos tienen en común los tiempos de inmersión
de mayor duración, diez minutos, y la frecuencia de inmersión
a mayores intervalos de 12 horas, que corresponden a los mayores en duración
y frecuencia que se evaluaron.
La alta concentración de clorofilas significa más centros de recolección
de luz (LHC II) y por lo tanto, se presume que existe un mayor transporte de
electrones, así como probablemente, una mayor tasa de fijación
de CO2. Las coloraciones de los tratamientos de inmersión
por cinco minutos cada 8 y 12 horas (T5, T6), fueron verdes de mayor intensidad
(22). Se reporta que este sistema podría inducir a un comportamiento
fotomixotrófico, como se ha probado en sistemas de inmersión temporal
(BIT), en otras especies, como el plátano (CEMSA). En este cultivo se
encontró que la inmersión completa, combinada con periodos de
ausencia de medio de cultivo puede inducir cambios metabólicos en las
hojas, entre ellos la pigmentación, que podría ofrecer a una forma
de obtención de energía más favorable en la aclimatación
(23).
Las plantas regeneradas en los sistemas de inmersión temporal, se caracterizaron
por su apariencia vigorosa, con mayor grosor de tallo
y área foliar, además presentaron un color verde intenso. Estas
características se evidenciaron en los tratamientos de inmersión
en vasos gemelos (BIT), T8 (10 minutos cada doce horas) y T7 (10 minutos cada
ocho horas) y en el sistema de RITA® en el T2 (cinco minutos
cada 12 horas).
Hiperhidricidad
La hiperhidricidad fue poco frecuente, se presentó en un 5 % de los explantes
del tratamiento de RITA® T2 (cinco minutos cada 12 horas) y en
dos de tratamientos de BIT, T5 (cinco minutos cada ocho horas) y T8 (10 minutos
cada doce horas), se observó el 2,5 y el 5 % de hiperhidricidad, respectivamente.
Por lo tanto, en BIT y en RITA®, la presencia de esta característica
fue de 1,56 % de las plantas regeneradas, por lo que no representa un problema,
como en las plantas crecidas en biorreactor de burbujeo, tratamiento incluido
en los ensayos preliminares, no publicados en este artículo.
En otro estudio, se reportó la presencia de plantas hiperhídricas
en el cultivo de Stevia rebaudiana en biorreactor giratorio de rodillo
(24). En Jarras fermentadoras se determinó que no hubo presencia de hiperhidricidad,
por el contrario, los brotes sumergidos en medio líquido mostraron mayor
número de hojas, longitud de hojas y mayor tasa de multiplicación
en comparación con explantes en medio semi-sólido (25).
Los tratamientos en RITA® T3 (10 minutos de inmersión
cada ocho horas, y BIT T8 (10 minutos de inmersión cada 12 horas) fueron
los únicos que mostraron una diferencia estadística significativa
en la producción promedio de brotes, respecto al tratamiento testigo
que utilizó medio semi-solido (Tabla
I). Esto podría estar relacionado con los periodos de inmersión
que fueron de 10 minutos en ambos tratamientos. Estos resultados difieren de
los obtenidos por otros autores (16), quienes obtuvieron una mayor brotación
en Stevia rebaudiana en todos los tratamientos que utilizaron medio
de cultivo líquido estacionario o en agitación en matraces.
Según un estudio realizado en plátano (CEMSA), en Sistema de Inmersión
Temporal (BIT), se determinó un aumento en el coeficiente de multiplicación
y en la calidad de las plantas con respecto a otros sistemas de cultivo (23).
Por otra parte, en otra investigación, se logró una mejora de
la calidad morfológica de los brotes de plátano CEMSA ¾
cultivados en sistemas de inmersión temporal (26).
Resultados similares se observaron en este trabajo en sistemas BIT, en los tratamientos
con inmersión de 10 minutos de duración T8 (cada doce horas) y
T7 (cada ocho horas). En el T2 en RITA®, con inmersión
de cinco minutos, cada 12 horas, se regeneraron plántulas de mayor calidad
morfológica, con apariencia vigorosa, color verde intenso y mayor área
foliar y tallos de mayor grosor. Así mismo, el cultivo de variedades
de caña de azúcar (Saccharum sp), en sistemas de inmersión
temporal estimuló la producción y el crecimiento de brotes (27).
En otras especies, como Ananas comosus el empleo de inmersión
temporal incrementó la producción de brotes y la masa seca de
las plántulasA.
Estudios realizados en Caladium xhortulanum, arácea ornamental
se obtuvo un coeficiente de multiplicación 12 veces mayor al obtenido
en el cultivo en medios semi sólidos convencionales (28). Los resultados
obtenidos en S. rebaudiana en este estudio coinciden con lo reportado
en otras especies de plantas, ya que la tasa de multiplicación fue superior
en la mayoría de los tratamientos de inmersión temporal empleados,
respecto al sistema de cultivo convencional en medio semi sólido.
Probablemente el incremento en el número de brotes que se presentó
con el empleo de los sistemas de inmersión temporal se relacione con
el sistema de ventilación, ya que cada vez que el sistema inyecta aire
al recipiente de cultivo durante la fase emergida se produce un intercambio
de gases, especialmente de CO2 y etileno que se volatilizan, estos
gases inhiben la multiplicación de brotes en muchas especies; por lo
que, al realizarse un mayor número de inmersiones al día se favorece
la ventilación y el intercambio de gases como el etileno y el CO2
que al acumularse limitan la multiplicación de los brotes, razón
por la cual es indispensable determinar la frecuencia de inmersión adecuada
para cada especie. Autores aseguran que el tiempo de la fase de inmersión
es muy importante, ya que determina la tasa de absorción de nutrientes
y controla la hiperhidricidad. En este trabajo, los tiempos de inmersión
de 10 minutos, tanto en RITA® como en BIT, indujeron la producción
de brotes e incrementaron la masa seca y fresca de los explantes (29).
En este trabajo se obtuvo la producción masiva de plantas de mayor tamaño
y peso, lo que incidió en la calidad de las plántulas regeneradas,
además, con los sistemas de inmersión temporal se obtuvo un incremento
del número de propágulos, que se pueden emplear en subcultivo,
incrementando la tasa de micropropagación. Por otra parte, por tratarse
de un proceso automatizado que provee condiciones de cultivo uniformes, el medio
puede ser renovado fácilmente, sin tener que cambiar de contenedor, los
medios de cultivo pueden esterilizarse por filtración, lo que disminuye
el uso de autoclaves, se requiere de menos recipientes y se siembra una mayor
cantidad de explantes por envase de cultivo.
Como se pudo comprobar en esta investigación, el empleo de cultivo in
vitro de segunda generación, en numerosos sistemas de inmersión
temporal, ofrece muchas ventajas en el proceso de micropropagación a
escala de Stevia rebaudiana, planta de gran interés comercial.
CONCLUSIONES
La mayoría
de los tratamientos en sistemas de inmersión temporal BIT y RITA®
produjeron plantas vigorosas con bajos niveles de hiperhidricidad, mayor número
promedio de hojas y brotes, así como un crecimiento activo con mayor
masa seca promedio. El sistema de cultivo en RITA® T3, con inmersión
de 10 minutos cada ocho horas indujo la regeneración de plantas de novo
con valores promedio de número de brotes, número promedio de hojas,
longitud de tallos, masa fresca y seca superiores al tratamiento control (T9).
El tratamiento T8, BIT con inmersión durante 10 minutos, cada 12 horas,
produjo la regeneración de plantas con siete veces mayor masa fresca
y seca, promedio, respecto al control (T10) además mostró los
mayores índices promedio de brotes.
En cuanto al incremento en longitud, el tratamiento T8 presentó diferencia
significativa respecto a los demás tratamientos.
En este trabajo, el mayor crecimiento de los explantes y el incremento en la
inducción de brotes, se produjo en los dos sistemas de inmersión
temporal (RITA® y BIT), en los tratamientos con tiempos de inmersión
de 10 minutos de duración, lo que podría ser un factor a considerar
en el cultivo a escala de Stevia rebaudiana en sistemas de inmersión
temporal.
AGRADECIMIENTOS
Las investigadoras
agradecen el apoyo financiero de la Vicerrectoría de Investigación
y Extensión del Instituto Tecnológico de Costa Rica y de la Comisión
de Incentivos CONICIT-MICIT (Consejo Nacional de Ciencia y Tecnología-Ministerio
de Ciencia y Tecnología de Costa Rica), que hicieron posible el desarrollo
de la investigación.
Además, se agradece a la Ing. Karol Jiménez por la colaboración
en la ejecución de los ensayos preliminares y el análisis de los
resultados.
BIBLIOGRAFÍA
1. Sairkar, P.;
Chandravanshi, M.K.; Shukla, N.P.; Mehrotra, N.N. y others ‘‘Mass production
of an economically important medicinal plant Stevia rebaudiana using
in vitro propagation techniques’’, Journal of Medicinal Plants
Research, vol. 3, no. 4, 2009, pp. 266–270, ISSN 1996-0875.
2. Ohja, A.; Sharma, V.N. y Sharma, V. ‘‘An efficient protocol for in vitro
clonal propagation of natural sweetener plant (Stevia rebaudiana Bertoni)’’,
African Journal of Plant Science, vol. 4, no. 4, 2010, pp. 319–321,
ISSN 1996-0824.
3. Wölwer-Rieck, U. ‘‘The leaves of Stevia rebaudiana (Bertoni),
their constituents and the analyses thereof: a review’’, Journal of agricultural
and food chemistry, vol. 60, no. 4, 2012, pp. 886–895, ISSN 1520-5118.
4. Ohta, M.; Sasa, S.; Inoue, A.; Tamai, T.; Fujita, I.; Morita, K. y Matsuura,
F. ‘‘Characterization of Novel Steviol Glycosides from Leaves of Stevia
rebaudiana Morita’’, Journal of Applied Glycoscience, vol. 57,
no. 3, 2010, pp. 199-209, ISSN 1344-7882, DOI 10.5458/jag.57.199.
5. Thiyagarajan, M. y Venkatachalam, P. ‘‘Large scale in vitro propagation
of Stevia rebaudiana (bert) for commercial application: Pharmaceutically
important and antidiabetic medicinal herb’’, Industrial Crops and Products,
vol. 37, no. 1, mayo de 2012, pp. 111-117, ISSN 0926-6690, DOI 10.1016/j.indcrop.2011.10.037.
6. Philippe, R.N.; De Mey, M.; Anderson, J. y Ajikumar, P.K. ‘‘Biotechnological
production of natural zero-calorie sweeteners’’, Current Opinion in Biotechnology,
vol. 26, abril de 2014, (ser. Food biotechnology Plant biotechnology), pp. 155-161,
ISSN 0958-1669, DOI 10.1016/j.copbio.2014.01.004.
7. Sergio, G.G.; Yolanda, M.O.; Genovevo, R.J.; César, M.L. y Ildefonso,
A.B.W. Estevia (Stevia rebaudiana Bertoni) un cultivo con potencial productivo
en México [en línea], 1.a ed., edit. Instituto Nacional de
Investigaciones Forestales, Agrícolas y Pecuarias, Merida, Yucatán,
México, 2011, p. 88, ISBN 978-607-425-685-7, [Consultado: 21 de marzo
de 2015], Disponible en: <http://biblioteca.inifap.gob.mx:8080/xmlui/handle/123456789/3234>.
8. Khalil, S.A.; Zamir, R. y Ahmad, N. ‘‘Selection of suitable propagation method
for consistent plantlets production in Stevia rebaudiana (Bertoni)’’,
Saudi Journal of Biological Sciences, vol. 21, no. 6, diciembre de
2014, pp. 566-573, ISSN 1319-562X, DOI 10.1016/j.sjbs.2014.02.005.
9. Alhady, M.R.A.A. ‘‘Micropropagation of Stevia rebaudiana Bertoni—a
new sweetening crop in Egypt’’, Global Journal of Biotechnology & Biochemistr,
vol. 6, no. 4, 2011, pp. 178–182, ISSN 2078-466X.
10. Mehrotra, S.; Goel, M.K.; Kukreja, A.K. y Mishra, B.N. ‘‘Efficiency of liquid
culture systems over conventional micropropagation: A progress towards commercialization’’,
African Journal of Biotechnology, vol. 6, no. 13, 2007, ISSN 1684-5315,
DOI 10.4314/ajb.v6i13.57591, [Consultado: 21 de marzo de 2015], Disponible en:
<http://www.ajol.info/index.php/ajb/article/view/57591>.
11. Watt, M.P. ‘‘The status of temporary immersion system (TIS) technology for
plant micropropagation’’, African Journal of Biotechnology, vol. 11,
no. 76, 20 de septiembre de 2012, ISSN 16845315, DOI 10.5897/AJB12.1693, [Consultado:
21 de marzo de 2015], Disponible en: <http://www.academicjournals.org/ajb/abstracts/abs2012/20Sept/Watt.htm>.
12. Berthouly, M. y Etienne, H. ‘‘Temporary immersion system: a new concept
for use liquid medium in mass propagation’’ [en línea], eds. Hvoslef-Eide,
A.K. y Preil, W., Liquid Culture Systems for in vitro Plant Propagation,
edit. Springer Netherlands, 2005, pp. 165-195, ISBN 978-1-4020-3199-1, [Consultado:
21 de marzo de 2015], Disponible en: <http://link.springer.com/chapter/10.1007/1-4020-3200-5_11>.
13. Murashige, T. y Skoog, F. ‘‘A Revised Medium for Rapid Growth and Bio Assays
with Tobacco Tissue Cultures’’, Physiologia Plantarum, vol. 15, no.
3, 1 de julio de 1962, pp. 473-497, ISSN 1399-3054, DOI 10.1111/j.1399-3054.1962.tb08052.x.
14. Lichtenthaler, H.K. ‘‘Chlorophylls and carotenoids: Pigments of photosynthetic
biomembranes.’’, Methods in Enzymology, vol. 148, 1987, pp. 350-382,
ISSN 1557-7988, DOI 10.1016/0076-6879(87)48036-1.
15. Preil, W. ‘‘General introduction: a personal reflection on the use of
liquid media for in vitro culture’’ [en línea], eds. Hvoslef-Eide,
A.K. y Preil, W., Liquid Culture Systems for in vitro Plant Propagation,
edit. Springer Netherlands, 2005, pp. 1-18, ISBN 978-1-4020-3199-1, [Consultado:
21 de marzo de 2015], Disponible en: <http://link.springer.com/chapter/10.1007/1-4020-3200-5_1>.
16. Javad, S.; Naz, S.; Ilyas, S.; Ali, A.; Aslam, F. y Munir, N. ‘‘Study of
the effect of physical state of medium and different concentrations of sucrose,
ferric ethylenediamine-tetraacetic acid (FeEDTA) and CuSO4 in enhancing the
micropropagation system of Stevia rebaudiana’’, Journal of Medicinal
Plants Research, vol. 6, no. 9, 2012, pp. 1800–1805, ISSN 1996-0875, DOI
10.5897/JMPR11.1655.
17. Takayama, S. y Akita, M. ‘‘The types of bioreactors used for shoots and
embryos’’, Plant Cell, Tissue and Organ Culture, vol. 39, no. 2, 1
de noviembre de 1994, pp. 147-156, ISSN 0167-6857, 1573-5044, DOI 10.1007/BF00033922.
18. Jain, P.; Kachhwaha, S. y Kothari, S.L. ‘‘Improved micropropagation protocol
and enhancement in biomass and chlorophyll content in Stevia rebaudiana
(Bert.) Bertoni by using high copper levels in the culture medium’’, Scientia
Horticulturae, vol. 119, no. 3, 3 de febrero de 2009, pp. 315-319, ISSN
0304-4238, DOI 10.1016/j.scienta.2008.08.015.
19. Das, A.; Gantait, S. y Mandal, N. ‘‘Micropropagation of an elite medicinal
plant: Stevia rebaudiana Bert’’, International Journal of Agricultural
Research, vol. 6, no. 1, 2011, pp. 40–48, ISSN 1816-4897, DOI 10.3923/ijar.2011.40.48.
20. Hassanen, S.A. y Khalil, R. ‘‘Biotechnological studies for improving of
stevia (Stevia rebaudiana Bertoni) in vitro plantlets’’, Middle-East
Journal of Scientific Research, vol. 14, no. 1, 2013, pp. 93–106, ISSN
1990-9233, DOI 10.5829/idosi.mejsr.2013.14.1.194.
21. Puri, M.; Sharma, D. y Tiwari, A.K. ‘‘Downstream processing of stevioside
and its potential applications’’, Biotechnology Advances, vol. 29,
no. 6, noviembre de 2011, pp. 781-791, ISSN 0734-9750, DOI 10.1016/j.biotechadv.2011.06.006.
22. González, M.; Mogollón, N.; Alvarado, G.; Giménez,
A. y Capote, T. ‘‘Efecto del medio de cultivo in vitro y la fuente
nitrogenada sobre el crecimiento del cocuy (Agave cocui Trelease)’’, Bioagro,
vol. 24, no. 1, 2012, pp. 39–44, ISSN 1316-3361.
23. Aragón, C.E.; Escalona, M.; Capote, I.; Cejas, Inaudis.; . Rodríguez,
R.; Sandoval, J.; Roels, S.; Debergh, P. y González-Olmedo, J.L. ‘‘Aspectos
metabólicos del crecimiento y desarrollo de las plántulas de plátano
(CEMSA ¾) micropropagadas en biorreactores de inmersión temporal
(BIT)’’, Cultivos Tropicales, vol. 27, no. 1, 2006, pp. 39-44, ISSN
0258-5936.
24. Bondarev, N.; Reshetnyak, O. y Nosov, A. ‘‘Features of Development of Stevia
rebaudiana Shoots Cultivated in the Roller Bioreactor and their Production
of Steviol Glycosides’’, Planta Medica, vol. 68, no. 8, agosto de 2002,
pp. 759-762, ISSN 00320943, 14390221, DOI 10.1055/s-2002-33809.
25. Kalpana, M.; Anbazhagan, M. y Natarajan, V. ‘‘Utilization of liquid medium
for rapid micropropagation of Stevia rebaudiana Bertoni’’, Journal
of Ecobiotechnology, vol. 1, no. 1, 2009, pp. 16–20, ISSN 20770464.
26. Roels, S.; Escalona, M.; Cejas, I.; Noceda, C.; Rodriguez, R.; Canal, M.J.;
Sandoval, J. y Debergh, P. ‘‘Optimization of plantain (Musa AAB) micropropagation
by temporary immersion system’’, Plant Cell, Tissue and Organ Culture,
vol. 82, no. 1, 1 de julio de 2005, pp. 57-66, ISSN 0167-6857, 1573-5044, DOI
10.1007/s11240-004-6746-y.
27. De Feria, M.; Jiménez, E. y Chávez, M. ‘‘Empleo de sistemas
de inmersión temporal para la multiplicación in vitro
de brotes de Saccharum spp. var’’, Biotecnología Vegetal,
vol. 2, no. 3, 2002, pp. 143-147, ISSN 1609-1841.
28. Daquinta, M.; Mosqueda, O.; González, M.T.; Benega, R. y . Teixeira
da Silv, J. ‘‘Shoot Proliferation of Caladium x hortulanum in a Temporary Immersion
System’’, Floriculture and Ornamental Biotechnology, vol. 1, no. 1,
2007, pp. 70-72, ISSN 1749-0294.
29. Etienne, H. y Berthouly, M. ‘‘Temporary immersion systems in plant micropropagation’’,
Plant Cell, Tissue and Organ Culture, vol. 69, no. 3, 1 de junio de
2002, pp. 215-231, ISSN 0167-6857, 1573-5044, DOI 10.1023/A:1015668610465.
Recibido: 15 de
mayo de 2014
Aceptado: 12 de septiembre de 2014
Ms.C. Silvana
Alvarenga Venutolo, Centro de Investigación en Biotecnología.
Escuela de Biología. ITCR. Cartago. Costa Rica. Email: salvarenga@itcr.ac.cr


