Determinación
de la concentración mínima letal de Glufosinato de amonio para
seleccionar embriones somáticos transformados de soya cultivar INCASoy-27
Determination
of minimum lethal concentration of Glufosinate-ammonium for selection of transformed
somatic embryos of soybean cultivar INCASoy-27
Ms.C.
Jorge L. Pérez-Pérez,I,II Dra.C. Lourdes García
Rodríguez,I Dra.C. Novisel Veitía,I Dra.C.
Idalmis Bermúdez-Caraballoso,I Dr.C. Raúl Collado López,
Damaris Torres RodríguezI
IInstituto
de Biotecnología de las Plantas. Universidad Central “Marta Abreu” de
Las Villas, Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba.
IICentro de Estudios de Biotecnología Vegetal.
Universidad de Granma. Carretera a Manzanillo, km 17.5, Peralejo, Bayamo, Granma,
Cuba.
RESUMEN
El establecimiento
de un programa de transformación genética de plantas requiere
de un sistema de selección in vitro de los tejidos transformados.
En el género Glycine existen pocas referencias que emplean el
Glufosinato de amonio como agente selectivo de embriones somáticos transformados.
Por ello, este trabajo tuvo como objetivo determinar la concentración
mínima letal del herbicida Glufosinato de amonio en embriones somáticos
de soya cultivar cubano INCASoy-27, para usarlo como agente selectivo en programas
de transformación genética. Los embriones somáticos fueron
colocados en medio de cultivo de multiplicación con 20 mg L-1
de ácido 2,4-diclorofenoxiacético y diferentes concentraciones
de Glufosinato de amonio (1,0; 2,0; 3,0; 4,0; 5,0; 6,0 mg L-1). Todas
las concentraciones del agente selectivo causaron necrosis en embriones somáticos
no transformados de soya. El incremento de la concentración del agente
selectivo y el tiempo de cultivo, aumentó la necrosis de los embriones
somáticos. Finalmente se determinó la concentración mínima
letal de Glufosinato de amonio 6,0 mg L-1, en medio de cultivo semisólido,
requerida para su empleo como agente selectivo en la transformación genética
de embriones somáticos de soya cultivar INCASoy-27.
Palabras
clave: agentes, embriogénesis somática, fosfinotricina,
Glycine max, transformación genética.
ABSTRACT
The establishment
of a genetic transformation program requires a selection in vitro system
of transformed tissues. In the Glycine genus exists few references
that employ the Glufosinate-ammoniun that selective agent in transformed somatic
embryos. For this reason this work had as objective to determine the minimum
lethalconcentration of the herbicide Glufosinate-ammoniun in somatic embryos
of Cuban soybean cultivar INCASoy-27, to use as selective agent in genetic transformation
programs. The soybean somatic embryos were placed on multiplication medium that
contained 2,4-dichlorophenoxyacetic acid 20 mg L-1 with different
concentrations of Glufosinate-ammonium (1,0; 2,0; 3,0; 4,0; 5,0; 6,0 mg L-1).
All concentrations of selective agent caused necrosis in not transformed soybean
somatic embryos. The increments of selective agent concentration and culture
time increased the necrosis of somatic embryos. Finally was determined the minimum
lethal concentration of 6,0 mg L-1 Glufosinate-ammoniun in semisolid
medium, that selective agent in the genetic transformation of somatic embryos
of soybean cultivar INCASoy-27.
Key words:
agents, somatic embryogenesis, phosphinothricin, Glycine max, genetic
transformation.
INTRODUCCIÓN
La soya [Glycine
max (L.) Merrill], es uno de los cultivos de mayor importancia económica
en la agricultura mundial, debido al alto contenido de aceite y proteínas
de sus semillas, por lo que es útil para fines alimenticios e industriales
(1).
Debido a su importancia económica se han desarrollado programas de mejora
genética a través de métodos tradicionales, los cuales
presentan limitaciones por el bajo potencial de variabilidad genética
entre cultivares. En este sentido, la transformación genética
ofrece la posibilidad de obtener nuevos cultivares rompiendo las barreras sexuales.
Sin embargo, la transferencia de genes no siempre es estable, debido a la baja
eficiencia y aleatoriedad en la integración del ácido desoxirribonucleico
(ADN) foráneo en el genoma de la célula hospedera, siendo necesario
un sistema de selección de los tejidos transformados (2).
En soya, la mayoría de los trabajos de transformación genética
emplean como agente selectivo el antibiótico higromicina (3, 4, 5). Sin
embargo, a nivel internacional existe un rechazo al empleo de antibióticos
como agentes selectivos, debido al potencial de incorporación de los
genes marcadores de selección en patógenos humanos (6). Cabe resaltar
que pocos trabajos publicados utilizan el herbicida Glufosinato de amonio en
la selección de embriones somáticos transformados de esta especie
(6, 7).
El Glufosinato de amonio es un compuesto sintetizado químicamente, conocido
comercialmente como Basta® y Finale®. Este compuesto contiene como ingrediente
activo fosfinotricina, que es un tripéptido natural producido por la
bacteria Streptomyces hygroscopicus y el componente herbicida de bialafos.
El Glufosinato de amonio es un herbicida inhibidor de la glutamina sintetasa,
enzima que interviene en la asimilación de amonio y en la regulación
del nitrógeno en las plantas (2).
Por lo antes expuesto, para realizar un proceso de selección eficiente
se requiere conocer la mínima concentración letal del agente selectivo
que elimine las células y tejidos no transformados. Por el contrario,
el uso de altas concentraciones puede causar la muerte de aquellas células
donde la resistencia adquirida puede ser inferior a la concentración
empleada.
Este trabajo tuvo como objetivo determinar la concentración mínima
letal del herbicida Glufosinato de amonio en embriones somáticos de soya
cultivar cubano INCASoy-27, para utilizarlo como agente selectivo en programas
de transformación genética.
MATERIALES
Y MÉTODOS
El trabajo se
realizó en el Instituto de Biotecnología de las Plantas en Santa
Clara, Cuba. Se empleó el cultivar de soya INCASoy-27, obtenido en el
Instituto Nacional de Ciencias Agrícolas mediante hibridación
natural en el genotipo brasileño BR-32.
Para los ensayos en condiciones de cultivo in vitro, se partió
de cotiledones cigóticos inmaduros provenientes de vainas de plantas
donantes. Las vainas fueron desinfectadas con agua corriente y detergente. Luego
fueron sumergidas en etanol al 70 % (v/v) durante 20 segundos y posteriormente
se lavaron tres veces con agua destilada estéril. Al finalizar, en cabina
de flujo laminar, se realizó una inmersión en hipoclorito de sodio
(2,0 %) (v/v) durante diez minutos seguido de cuatro enjuagues con agua destilada
estéril.
Los cotiledones cigóticos inmaduros fueron extraídos y colocados
en frascos de cultivo de 250 mL que contenían medio de cultivo de formación
de embriones somáticos, compuesto por las sales MS (8), vitamina B5,
ácido 2,4-diclorofenoxiacético (2,4-D) 40 mg L-1, sacarosa
3,0 %, Gelrite® 0,3 % y pH 7, durante cuatro semanas de cultivo.
Los embriones somáticos fueron transferidos a medio de cultivo de multiplicación,
compuesto por las sales MS, vitamina B5, 2,4-D 20 mg L-1, sacarosa
3,0 %, Gelrite® 0,3 % y pH 5,8 durante tres semanas de cultivo.
Luego los embriones somáticos fueron transferidos a medio de cultivo
de multiplicación enriquecido con diferentes concentraciones de Glufosinato
de amonio. Para ello, se evaluaron seis concentraciones del herbicida (1,0;
2,0; 3,0; 4,0; 5,0; 6,0 mg L-1) y un tratamiento control para un
total de siete tratamientos.
El Glufosinato de amonio se preparó a una concentración de 20
mg mL-1 y se esterilizó por filtración con ayuda de un filtro
de membrana estéril con un tamaño del poro de 0,22 µm. Las
soluciones del agente selectivo fueron adicionadas cuando el medio de cultivo
alcanzó una temperatura aproximada de 40 oC previo a la solidificación.
Para determinar la concentración mínima letal del Glufosinato
de amonio, se realizaron cinco ciclos de selección de embriones somáticos
sin transformar en medio de cultivo de multiplicación que contenía
el agente selectivo. Cada 10 días se realizó el subcultivo durante
siete semanas correspondiendo con los ciclos de selección. En cada subcultivo,
se tomó una muestra de embriones somáticos y fue transferida a
medio de cultivo de multiplicación sin el agente selectivo, para comprobar
la inhibición de la capacidad regenerativa de los embriones somáticos.
Para cada tratamiento se tomaron diez placas de Petri de 5,0 cm de diámetro
que contenían cinco grupos con aproximadamente 30 embriones somáticos
en etapa globular. Para los subcultivos los embriones somáticos fueron
tomados con una espátula y disgregados sobre el medio de cultivo para
facilitar un mayor contacto con el herbicida presente.
En cada subcultivo se describieron los daños causados por el Glufosinato
de amonio y se evaluó el grado de mortalidad de los embriones somáticos
de cada tratamiento.
Para ello, se empleó un microscopio óptico OPTON (Axioskop) y
la escala de evaluación del grado de mortalidad (9): sin afectación
(grado 1), necrosis 25 % (grado 2), necrosis 50 % (grado 3), necrosis 75 % (grado
4) y necrosis total (grado 5).
Las placas Petri fueron selladas con Parafilm® y colocadas en cámara
de crecimiento con luz artificial, intensidad luminosa 68-73 µE m-2
s-1, fotoperíodo de 16/8 horas (luz/oscuridad) a 24±2
oC. La intensidad luminosa dentro de la cámara de crecimiento
se midió con un luxómetro EXTECH 401025.
El análisis de los datos se realizó con ayuda del paquete estadístico
Statistic Packaged for Social Science (SPSS) versión 18. Los
datos referentes al grado de mortalidad de los embriones somáticos se
procesaron mediante la prueba de Kruskal-Wallis/Mann-Whitney (p=0,05).
RESULTADOS
Y DISCUCIÓN
En este trabajo
se logró definir la concentración mínima letal del herbicida
Glufosinato de amonio usado como agente selectivo en embriones somáticos
sin transformar de soya cultivar INCASoy-27, nunca antes descrito en genotipos
cubanos de soya.
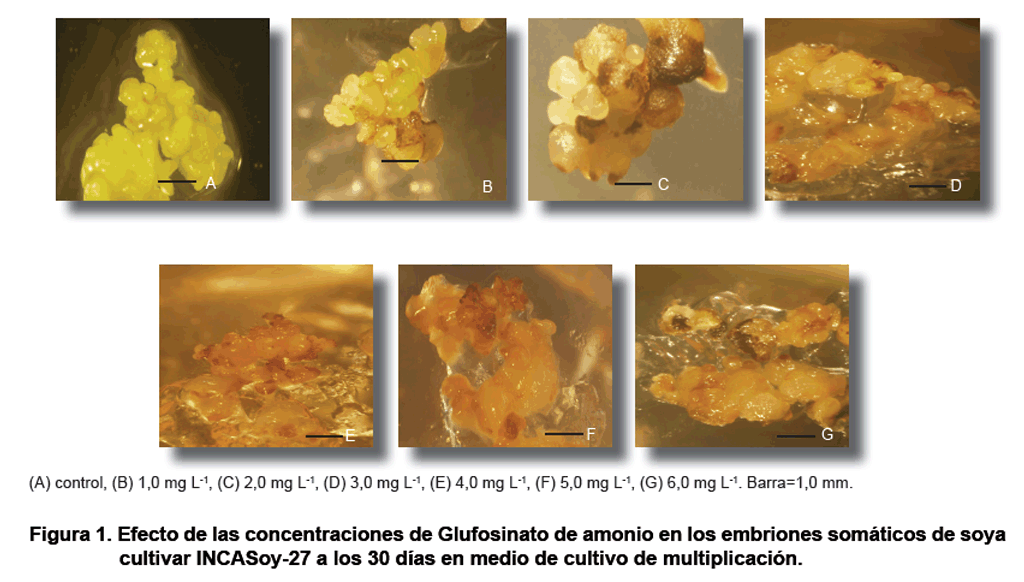
Todas las concentraciones evaluadas de Glufosinato de amonio causaron afectaciones
sobre los embriones somáticos no transformados de soya cultivar INCASoy-27.
A partir de los 15 días de cultivo se observó que los embriones
somáticos adquirieron un color pardo, que se intensificó con el
tiempo de cultivo.
Después de 30 días, los embriones somáticos tenían
un aspecto necrótico, debido al incremento de la concentración
del agente selectivo y el tiempo de cultivo. Sin embargo, en el tratamiento
control sin el agente selectivo, los embriones somáticos mantuvieron
su color amarillo y su capacidad de multiplicación (Figura
1).
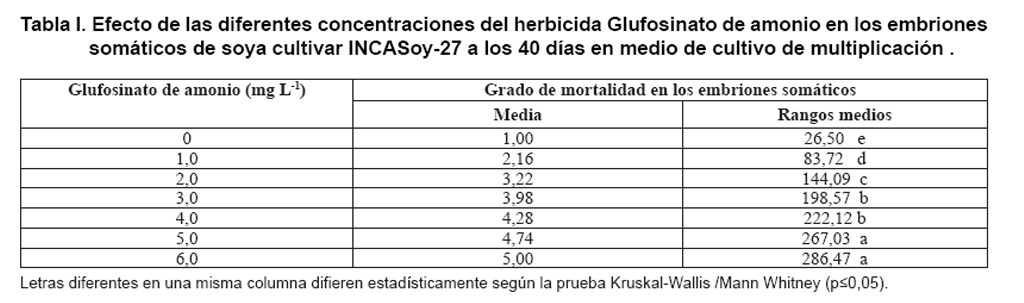
Al analizar el grado de mortalidad a las seis semanas en medio de cultivo con
el agente selectivo, se observó que en la medida que aumentaron las concentraciones
del Glufosinato de amonio se incrementó el grado de afectación
de los embriones somáticos. También se observó que las
concentraciones de 5,0 mg L-1 y 6,0 mg L-1 del agente
selectivo produjeron los mayores valores en el grado de mortalidad, con diferencias
significativas con el resto de los tratamientos (Tabla
I).
Los mayores valores de mortalidad de embriones somáticos se alcanzaron
con las concentraciones de 5,0 y 6,0 mg L-1 de Glufosinato de amonio
con diferencias significativas con el resto de las concentraciones evaluadas.
En estas concentraciones se manifestó entre el 80-100 % de necrosis total
de los embriones somáticos (Figura
2).
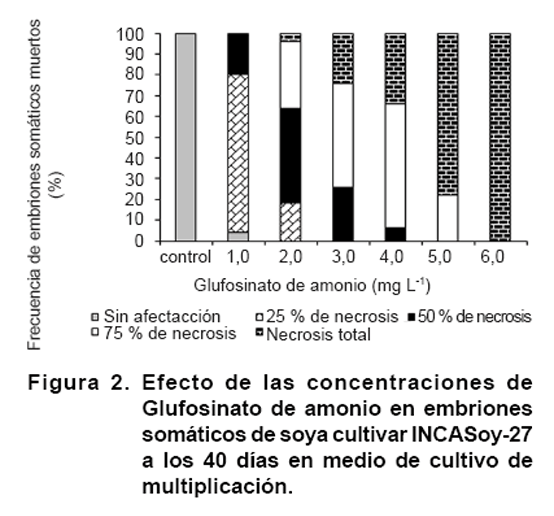
Sin embargo, en las concentraciones con 3,0 y 4,0 mg L-1 del agente
selectivo, se observó necrosis en el 50-100 % de la superficie del tejido
y en la totalidad de los embriones somáticos evaluados (Figura 2).
A partir de estos
resultados se seleccionó 6,0 mg L-1 como la mínima
concentración de Glufosinato de amonio a emplear como agente selectivo
en embriones somáticos transformados de soya cultivar INCASoy-27 en medio
de cultivo semisólido.
Para ello, se tuvo en cuenta que a partir de esta concentración el 100
% de los embriones somáticos evaluados tenían necrosis total.
El necrosamiento observado en los embriones somáticos es un reflejo del
efecto fitotóxico del Glufosinato de amonio, dada la inhibición
de la glutamina sintetasa, una enzima esencial para la asimilación de
amonio y la regulación del nitrógeno en los tejidos (10).
La Sociedad Americana de Ciencias de las Malezas (por sus siglas en inglés:
WSSA, Weed Science Society of America), define la resistencia como
la capacidad heredada de una planta para sobrevivir y reproducirse después
de exponerse a una concentración de herbicida letal en la especie salvaje.
Esta puede ser natural o inducida por Ingeniería Genética, selección
de variantes producidas por cultivo de células y tejidos o mediante mutagénesis
(11).
Por otro lado, la eficiencia de la transformación genética puede
ser mejorada variando la concentración y duración del régimen
de selección o el empleo de diferentes marcadores y agentes de selección.
La literatura consultada (7) refiere el empleo de higromicina 30 mg L-1
o fosfinotricina 80 mg L-1 en medio de cultivo líquido durante
la selección de embriones somáticos transformados de soya. Como
resultado obtuvieron 12 líneas transgénicas con resistencia a
higromicina. Sin embargo, solo dos líneas mostraron resistencia a fosfinotricina,
y en una de ellas se confirmó la presencia del gen bar. Todas
las plantas resultaron estériles, atribuido a la edad de los tejidos
embriogénicos y al método de transformación empleado.
El Glufosinato de amonio se ha probado en un amplio rango de concentraciones,
acorde con el empleo de medio de cultivo líquido o semisólido.
En un estudio, embriones somáticos transformados de soya cultivar Jack,
fueron colocados en medio de cultivo líquido FN-Lite (del inglés:
Finer & Nagasawa Lite) con y sin asparagina, y 5,0 a 35,0 mg L-1
de Glufosinato de amonio. Como resultado, con el empleo de 5,0 mg L-1
de Glufosinato de amonio se inhibió el crecimiento en más del
95 % de los embriones somáticos a las tres semanas de cultivo, con inhibición
total a las cinco semanas (6).
En un segundo estudio, estos autores evaluaron de 0,16 a 0,5 mg L-1
de Glufosinato de amonio en medio de cultivo FN-Lite 50 % sin aparagina. Sin
embargo, la única diferencia encontrada fue que la inhibición
del crecimiento de los embriones somáticos comenzó en la primera
semana de selección con empleo de medio de cultivo FN-Lite 50 %, mientras
que en medio de cultivo FN-Lite normal la inhibición fue notable a partir
de la segunda semana (6).
Los resultados de este trabajo difieren de los descritos previamente (6), atribuidos
al tipo y composición del medio de cultivo. El empleo de medio de cultivo
líquido permite una mayor exposición de los tejidos al contacto
con el agente selectivo y disminuye el tiempo de selección.
Por el contrario, en medio de cultivo semisólido solo las zonas del tejido
en contacto con el medio de cultivo están expuestas al efecto del agente
selectivo, y pueden aparecer embriones somáticos conocidos como falsos
positivos en zonas que no están en contacto con el herbicida presente
en el medio de cultivo.
La literatura consultada (12) refiere el empleo de 5,0 mg L-1 de
Glufosinato de amonio en la selección de nudos cotiledonales de soya
durante cuatro semanas. Después de este periodo observaron necrosis en
los tejidos no transformados, mientras los tejidos transformados formaron brotes
en los cultivares Jack (82,8 %) y Williams (67,7 %).
Otros autores también han observado que de 3,0 a 5,0 mg L-1
de Glufosinato de amonio es suficiente para prevenir la formación de
brotes en nudos cotiledonales de soya (13). Estas concentraciones son similares
a las requeridas para inhibir la multiplicación de embriones somáticos
de soya según indica este estudio.
El Bialafos o tripéptido fosfinotricina que es producido por Streptomyces
hygroscopicus, también ha sido empleado como agente selectivo. En
un estudio, los autores encontraron que ningún brote se formó
a partir de nudos cotiledonales de soya al emplear bialafos a 5,0 mg L-1,
y solo el 5,0 % lograron regenerar brotes al emplear 4,0 mg L-1,
tomando esta última concentración para la selección de
los transformantes (14).
En otras especies de leguminosas como Phaseolus vulgaris se demostró
que 0,50 mg L-1 de Glufosinato de amonio fue suficiente para que
más del 87 % de los callos mostraran necrosis total a las ocho semanas
de cultivo (9).
Las diferencias encontradas en las concentraciones de Glufosinato de amonio
requeridas para inhibir la multiplicación de los embriones somáticos
pudieron estar dadas por la composición celular de este tejido, al estar
constituidos por células diferenciadas en activo proceso de división
celular que difieren de las células totalmente indiferenciadas que conforman
al callo.
También existen estudios que han empleado otros tipos de herbicidas y
confirmado la inhibición de la multiplicación de los embriones
somáticos de soya en medio de cultivo líquido. Tal es el caso
del herbicida Bispyribac-sodio, un inhibidor de la enzima acetolactato sintetasa.
Cuando se empleó 1,0 µM de este herbicida, aparecieron embriones
somáticos del cultivar Jack que no contenían el transgen Os-mALS,
y con 2,0 µM no lograron sobrevivir (15).
Los resultados que se muestran, constituyen la primera referencia de la determinación
de la concentración mínima inhibitoria de Glufosinato de amonio,
para su empleo en la selección de embriones somáticos transformados
de soya en medio de cultivo semisólido.
CONCLUSIONES
Se determinó
la concentración mínima inhibitoria de Glufosinato de amonio 4,0
mg L-1, en medio de cultivo semisólido, requerida para su
empleo como agente selectivo en la transformación genética de
embriones somáticos de soya cultivar INCASoy-27.
BIBLIOGRAFÍA
1. Taski-Ajdukovic,
K.; Djordjevic, V.; Vidic, M. y Vujakovic, M. ‘‘Subunit composition of seed
storage proteins in high-protein soybean genotypes’’, Pesquisa Agropecuária
Brasileira, vol. 45, no. 7, julio de 2010, pp. 721-729, ISSN 0100-204X,
DOI 10.1590/S0100-204X2010000700013.
2. Sundar, I.K. y Sakthivel, N. ‘‘Advances in selectable marker genes for plant
transformation’’, Journal of Plant Physiology, vol. 165, no. 16, 1
de noviembre de 2008, pp. 1698-1716, ISSN 0176-1617, DOI 10.1016/j.jplph.2008.08.002.
3. Wiebke-Strohm, B.; Droste, A.; Pasquali, G.; Osorio, M.B.; Bücker-Neto,
L.; Passaglia, L.M.P.; Bencke, M.; Homrich, M.S.; Margis-Pinheiro, M. y Bodanese-Zanettini,
M.H. ‘‘Transgenic fertile soybean plants derived from somatic embryos transformed
via the combined DNA-free particle bombardment and Agrobacterium system’’, Euphytica,
vol. 177, no. 3, 9 de septiembre de 2010, pp. 343-354, ISSN 0014-2336, 1573-5060,
DOI 10.1007/s10681-010-0249-1.
4. Mariashibu, T.S.; Subramanyam, K.; Arun, M.; Mayavan, S.; Rajesh, M.; Theboral,
J.; Manickavasagam, M. y Ganapathi, A. ‘‘Vacuum infiltration enhances the Agrobacterium-mediated
genetic transformation in Indian soybean cultivars’’, Acta Physiologiae
Plantarum, vol. 35, no. 1, 11 de julio de 2012, pp. 41-54, ISSN 0137-5881,
1861-1664, DOI 10.1007/s11738-012-1046-3.
5. Wiebke-Strohm, B.; Pasquali, G.; Margis-Pinheiro, M.; Bencke, M.; Bücker-Neto,
L.; Becker-Ritt, A.B.; Martinelli, A.H.S.; Rechenmacher, C.; Polacco, J.C.;
Stolf, R.; Marcelino, F.C.; Abdelnoor, R.V.; Homrich, M.S.; Ponte, E.M.D.; Carlini,
C.R.; Carvalho, M.C.C.G.D. y Bodanese-Zanettini, M.H. ‘‘Ubiquitous urease affects
soybean susceptibility to fungi’’, Plant Molecular Biology, vol. 79,
no. 1-2, 1 de marzo de 2012, pp. 75-87, ISSN 0167-4412, 1573-5028, DOI 10.1007/s11103-012-9894-1.
6. Rao, S.S.; Mamadou, L.; McConnell, M.; Polisetty, R.; Kwanyuen, P. y Hildebrand,
D. ‘‘Non-antibiotic selection systems for soybean somatic embryos: the lysine
analog aminoethyl-cysteine as a selection agent’’, BMC Biotechnology,
vol. 9, no. 1, 18 de noviembre de 2009, p. 94, ISSN 1472-6750, DOI 10.1186/1472-6750-9-94,
[PMID: 19922622].
7. Simmonds, D.H. y Donaldson, P.A. ‘‘Genotype screening for proliferative embryogenesis
and biolistic transformation of short-season soybean genotypes’’, Plant
Cell Reports, vol. 19, no. 5, 1 de abril de 2000, pp. 485-490, ISSN 0721-7714,
1432-203X, DOI 10.1007/s002990050760.
8. Murashige, T. y Skoog, F. ‘‘A Revised Medium for Rapid Growth and Bio Assays
with Tobacco Tissue Cultures’’, Physiologia Plantarum, vol. 15, no.
3, 1 de julio de 1962, pp. 473-497, ISSN 1399-3054, DOI 10.1111/j.1399-3054.1962.tb08052.x.
9. Bermúdez-Caraballoso, I.; Collado, R.; García, L.R.; Veitía,
N.; Martirena, A.; Torres, D.; Romero, C.; Angenon, G. y others ‘‘Determinación
de la concentración mínima inhibitoria de Glufosinato de amonio
en callos organogénicos de Phaseolus vulgaris L cv.CIAP7247F’’, Biotecnología
Vegetal, vol. 12, no. 4, 2012, pp. 203-210, ISSN 1609-1841.
10. Vencill, W.K.; Nichols, R.L.; Webster, T.M.; Soteres, J.K.; Mallory-Smith,
C.; Burgos, N.R.; Johnson, W.G. y McClelland, M.R. ‘‘Herbicide Resistance: Toward
an Understanding of Resistance Development and the Impact of Herbicide-Resistant
Crops’’, Weed Science, vol. 60, no. Special Issue, 4 de abril de 2012,
pp. 2-30, ISSN 0043-1745, DOI 10.1614/WS-D-11-00206.1.
11. Lea, P.J. y Miflin, B.J. ‘‘Nitrogen Assimilation and its Relevance to Crop
Improvement’’ [en línea], eds. Foyer, C.H. y Zhang, H., Annual Plant
Reviews, vol. 42, edit. Wiley-Blackwell, 2010, pp. 1-40, ISBN 978-1-4443-2860-8,
[Consultado: 21 de marzo de 2015], Disponible en: <http://onlinelibrary.wiley.com/doi/10.1002/9781444328608.ch1/summary>.
12. Song, Z.; Tian, J.; Fu, W.; Li, L.; Lu, L.; Zhou, L.; Shan, Z.; Tang, G.
y Shou, H. ‘‘Screening Chinese soybean genotypes for Agrobacterium-mediated
genetic transformation suitability’’, Journal of Zhejiang University SCIENCE
B, vol. 14, no. 4, 7 de abril de 2013, pp. 289-298, ISSN 1673-1581, 1862-1783,
DOI 10.1631/jzus.B1200278.
13. Zhang, Z.; Xing, A.; Staswick, P. y Clemente, T.E. ‘‘The use of glufosinate
as a selective agent in Agrobacterium-mediated transformation of soybean’’,
Plant Cell, Tissue and Organ Culture, vol. 56, no. 1, 1 de
enero de 1999, pp. 37-46, ISSN 0167-6857, 1573-5044, DOI 10.1023/A:1006298622969.
14. Liu, S.C.; Zhang, G.C.; Yang, L.F.; Mii, M.; Gai, J.Y. y Zhu, Y.L. ‘‘Bialaphos-resistant
Transgenic Soybeans Produced by the Agrobacterium-mediated Cotyledonary-node
Method’’, Journal of Agricultural Science and Technology, vol. 16,
no. 1, 1 de enero de 2014, pp. 175-190, ISSN 2345-3737.
15. Tougou, M.; Yamagishi, N.; Furutani, N.; Kaku, K.; Shimizu, T.; Takahata,
Y.; Sakai, J.; Kanematsu, S. y Hidaka, S. ‘‘The application of the mutated acetolactate
synthase gene from rice as the selectable marker gene in the production of transgenic
soybeans’’, Plant Cell Reports, vol. 28, no. 5, 15 de febrero de 2009,
pp. 769-776, ISSN 0721-7714, 1432-203X, DOI 10.1007/s00299-009-0679-1.
Recibido: 18 de
marzo de 2014
Aceptado: 23 de septiembre de 2014
Ms.C. Jorge
L. Pérez-Pérez, Instituto de Biotecnología de las
Plantas. Universidad Central “Marta Abreu” de Las Villas, Carretera a Camajuaní
km 5.5, Santa Clara, Villa Clara, Cuba. Email: jperez@udg.co.cu


