La
simbiosis micorrízica arbuscular en plantas de arroz (Oryza sativa
L.) sometidas a estrés hídrico. Parte II Respuesta bioquímica
Mycorrhizae
arbuscular symbiosis in rice plants (Oryza sativa L.) under water stress.
Part II Biochemical response
Ms.C. Michel Ruiz-Sánchez,I Dra.C. Déborah Geada,II
Ms.C. Yaumara Muñoz Hernández,III Ms.C. Alexeis Martínez,III
Ms.C. Yoerlandy Santana,III Ms.C. Mileisy Benítez,III
Dr.C. Ricardo Aroca,IV Dr.C. Juan M. Ruiz-LozanoIV
IInstituto
Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José
de las Lajas, Mayabeque, Cuba, CP 32 700.
IIUniversidad de la Habana, Cuba.
IIIUniversidad Hermanos Saíz Montes de Oca. Pinar del Río.
Calle Martí final. Pinar del Río, Cuba.
IVEstación
Experimental del Zaidín, CSIC, Granada, España.
RESUMEN
Se estima que
la población mundial continúe en ascenso; sin embargo, el recurso
hídrico disponible para enfrentar las cosechas en estos momentos no es
suficiente, es por ello que se trabaja en buscar alternativas que ahorren agua
y mantengan o incrementen los rendimientos en los cultivos agrícolas.
El uso de los hongos micorrízicos arbusculares (HMA) es sin lugar a dudas,
una vía que contribuye a tales propósitos. La investigación
se realizó en la Estación Experimental del Zaidín, Granada,
España, en macetas plásticas, con plantas de arroz micorrizadas
y no micorrizadas, en condiciones semi-controladas, con tres suministros de
agua, sin estrés (25 mL), estrés moderado (10 mL) y estrés
intenso (5 mL), durante 15 días, con el objetivo de evaluar el efecto
de la inoculación de Rhizoglomus intraradices en plantas de
arroz sometidas a estrés hídrico y después de recuperadas,
en algunas variables bioquímicas. Los resultados mostraron que la simbiosis
HMA reduce la acumulación de peróxido de hidrógeno y el
daño oxidativo a los lípidos a partir de un incremento en la acumulación
del antioxidante glutatión. Estos efectos combinados mejoraron el metabolismo
de plantas después de un periodo de estrés hídrico y se
pueden sugerir como indicadores ante condiciones de déficit hídrico
en plantas de arroz micorrizadas.
Palabras
clave: antioxidantes, simbiosis, sequía, estrés, arroz.
ABSTRACT
It is estimated
that the world population will continue to increase; however the water resources
available to meet crop right now is not enough, it is working to find alternatives
that save water and maintain or increase agricultural crop yields. The use of
arbuscular mycorrhizal fungi (AMF) is certainly a way that contributes to such
purposes. The research was conducted at the Experimental Station of Zaidín,
Granada, Spain, in plastic pots with plants of mycorrhizal and non-mycorrhizal
rice in semi-controlled conditions, with three water supplies, no stress (25
mL), moderate stress (10 mL) and severe stress (5 mL) for 15 days, with the
aim of evaluating the effect of the inoculation of Rhizoglomus intraradices
in rice plants under water stress and then retrieved on some biochemical parameters.
The results showed that the symbiosis HMA reduces the accumulation of hydrogen
peroxide and oxidative damage to lipids from an increased accumulation of the
antioxidant glutathione. The combined effects of plant metabolism improved after
a period of water stress and can be suggested as indicators under conditions
of water deficit in plants mycorrhizal rice.
Key
words: antioxidants, symbiosis, drought, stress, rice.
INTRODUCCIÓN
La sequía
es el factor limitante más importante para la producción agrícola
y se está convirtiendo en un problema creciente en muchas regiones del
mundo (1, 2). En el caso del arroz (Oryza sativa L.) es una limitación
importante para su producción en los ecosistemas de secano. Se estima
que 18 millones de toneladas (t) anuales o el 4 % de la producción total
de arroz se pierde por la sequía (3), cantidad que ha sido valorada de
forma conservadora por los EE.UU. en 3,6 mil millones dólares. Adicionalmente,
es importante destacar que no sólo la falta de agua reduce el potencial
de rendimiento, sino también la época y la duración de
la sequía en relación con los procesos fenológicos (4).
Según informes de la FAO, las Naciones Unidas estimó que la población
mundial crecerá de 6,3 billones de habitantes en el 2003 a 8 billones
en el 2025, por lo que se plantea que la producción de arroz debe crecer
en un 40 % para satisfacer su demanda mundial, donde habrá menos disponibilidad
de agua y tierra cultivableA (5).
Ante el avance inminente de la desertificación y la sequía, los
productores instrumentan diferentes estrategias para mitigar los efectos adversos
de estos fenómenos en sus cosechas. Una de esas estrategias es la utilización
de los hongos micorrízicos arbusculares (HMA) (6, 7). Se ha demostrado
que los HMA pueden proteger a las plantas hospederas contra los efectos perjudiciales
del déficit de agua, deficiencia en la absorción de nutrientes
(fósforo), protección contra patógenos, entre otras problemáticas
(8, 9, 10, 11, 12). Los estudios realizados hasta la fecha, han sugerido varios
mecanismos por los que la simbiosis planta-HMA puede aliviar los efectos de
la sequía en las plantas hospederas. Los más importantes son la
absorción directa y la transferencia de agua a través de las hifas
fúngicas al húesped (13, 14, 15), cambios en las propiedades de
retención de agua del suelo (9), mejor ajuste osmótico de las
plantas MA (6, 7), la mejora del intercambio de gases en la planta y uso eficiente
del agua (13), así como la protección contra el daño oxidativo
generado por la sequía (16, 17, 18, 19).
Este último mecanismo se ha reconocido como crucial (10, 18), pues muchas
de las reacciones degenerativas están asociadas con varias tensiones
ambientales, incluidos los déficit de agua, que dan lugar a la producción
de especies reactivas de oxígeno (reactive specieses of oxygen (ROS))
en las plantas, causando un estrés oxidativo adicional. De forma general
las ROS abarcan no solo los radicales libres como el superóxido (O2-)
y los radicales hidroxilo (OH-), sino también el peróxido de hidrógeno
(H2O2); asimismo, se conoce que el oxígeno singlete y radicales OH- son
tan reactivos que su producción debe reducirse al mínimo (20),
mientras que O2- y H2O2 se sintetizan en tasas muy elevadas, incluso en condiciones
óptimas (21, 22). Estos radicales y sus derivados se encuentran entre
las especies más reactivas conocidas en química, capaces de reaccionar
de manera indiscriminada y causar un daño oxidativo a las biomoléculas.
Esto propicia la ocurrencia de fenómenos tales como la peroxidación
lipídica y la desnaturalización de las proteínas (23).
Teniendo en cuenta todo lo antes planteado, el objetivo de este trabajo fue
evaluar el efecto de la inoculación de Rhizoglomus intraradices
en plantas de arroz sometidas a estrés hídrico a los 30 días,
después del trasplante (DDT) y después de recuperadas (DR), sobre
algunas variables bioquímicas.
MATERIALES
Y MÉTODOS
Diseño
experimental
La investigación se realizó en la Estación Experimental
del Zaidín, Granada, España, en el cultivo del arroz (Oryza
sativa L.) bajo condiciones semi-controladas, para lo cual se empleó
el cultivar de ciclo corto INCA LP-5. En la etapa inicial (semillero) se inoculó
el 50 % de las del semillas con Rhizoglomus intraradices, a razón
de 100 g por cada kg de sustrato. Las plantas se trasplantaron a los 15 días
después de la germinación (DDG) a macetas de 400 g. También
se realizó otra inoculación en el momento del trasplante (5 g
de inóculo por maceta), justo debajo de las raíces de arroz.
Condiciones experimentales
Las plantas fueron cultivadas entre 60-70 % de humedad relativa, las temperaturas
de día y noche fueron de 23 y 19 ºC, respectivamente, con un fotoperiodo
de 16 horas luz y ocho de oscuridad y una intensidad de la luz de 250 µE
m-2 s-1, medido con un Licor (Lincoln, NE, EE.UU. modelo
LI-188B).
Durante los primeros 30 días después del trasplante (DDT), cada
planta recibió 25 mL de solución nutritiva (24), con el fósforo
(P) reducido al 25 %, a fin de evitar la inhibición de la colonización
de los HMA. Este volumen de solución nutritiva se aplicó tres
veces por semana en días alternos. Los tratamientos testigos (sin estrés
hídrico) recibieron los 25 mL de solución nutritiva tres veces
por semana. El estrés hídrico moderado consistió en la
aplicación de la misma cantidad de nutrientes disueltos en 10 mL de agua.
El estrés hídrico intenso, consistió en la aplicación
de la misma cantidad de nutrientes disueltos en 5 mL de agua.
Tratamientos:
T1. plantas MA+25 mL (Testigo)
T2. plantas MA+10 mL
T3. plantas MA+5 mL
T4. plantas noMA+25 mL (Testigo)
T5. plantas noMA+10 mL
T6. plantas noMA+5 mL
Los tratamientos fueron distribuidos siguiendo un diseño completamente
aleatorizado. Los datos de cada muestreo fueron sometidos a análisis
de varianza de clasificación simple (ANOVA), seguido por la prueba de
Duncan para (p=0,05) (25).
Suelo y material biológico
El sustrato empleado consistió en una mezcla de suelo procedente de la
Estación Experimental del Zaidín, Granada, España, tamizado
(2 mm), con arena (<1 mm) y vermiculita, en proporción 1:2:6, suelo,
arena y vermiculita (v/v/v). La arena y la vermiculita fueron esterilizadas
a 120 ºC, durante 20 minutos y el suelo se esterilizó a vapor fluente
(a 100 ºC, durante 1 h, tres días consecutivos). El suelo tenía
un pH de 8,1 (agua); 1,81 % de materia orgánica y las siguientes concentraciones
de nutrientes (mg kg-1): nitrógeno (N) 2,5; fósforo
(P) 6,2 (NaHCO3- P extraíble); potasio (K) 132. El hongo micorrízico
arbuscular utilizado fue el aislado EEZ 01, perteneciente a la colección
de la Estación Experimental del Zaidín, Granada, España.
La evaluaciones se realizaron después de transcurrido el periodo de estrés
hídrico a los 45 DDT y de la recuperación de las plantas (25 días
después del estrés) a los 70 DDT, donde se evaluó el potencial
hídrico foliar (MPa), el contenido de peróxido de hidrógeno
(H2O2) (nmol g-1 masa seca (MS)), así
como el daño oxidativo de membrana, mediante la valoración del
malondialdehído (MDA) (nmol g-1 MS), el contenido de glutatión
reducido (nmol g-1 MS), y de ascorbato reducido (nmol g-1
MS).
Parámetros medidos
Potencial hídrico
Se utilizó un sistema integrado por el microvoltímetro HR- 33T,
conectado a una cámara psicrométrica C52 (Wescor Inc, Logan, UT,
USA), tal como describe Porcel (16). Se tomó un disco de la parte central
de la hoja, perteneciente al tercio superior de la planta (0,0005 m2
de diámetro) y se colocó en la cámara. Se estabilizó
la temperatura y el vapor de agua del disco durante 15 minutos antes de realizar
la lectura de potencial hídrico con el microvoltímetro. Se expresó
en (MPa).
Contenido de peróxido de hidrógeno
El contenido de peróxido de hidrógeno se determinó en las
hojas (26), con ligeras modificaciones descritas por otro autor (27) a 508 nm
absorbancia en el espectrofotómetro (Hitachi, modelo U-1900, Japón).
Daño oxidativo a lípidos
El daño oxidativo a lípidos se determinó mediante la lectura
de la absorbancia a 532 nm y 600 nm (28) en espectrofotómetro (Hitachi,
modelo U-1900, Japón), este parámetro se estimó a partir
del contenido de sustancias reactivas de ácido tiobarbitúrico
y se expresó como equivalentes de MDA (23). La curva de calibración
se realizó con MDA, en el rango de 0,1-10 nmol. El blanco para todas
las muestras se preparó mediante la sustitución de la muestra
por el medio de extracción.
Contenido de glutatión reducido
El contenido de glutatión se determinó a 412 nm de absorbancia.
Se realizó una curva patrón a partir de una solución patrón
de glutatión (50 mM) con las siguientes concentraciones: 0, 10, 20, 30,
40 y 50 µM (29).
Contenidos de ascorbato reducido
El ascorbato se cuantificó por fotometría (30), tras la reducción
de 2,6-diclorofenolindofenol (DCPIP). La absorbancia se midió inmediatamente
a 524 nm. El contenido de ascorbato se calculó por referencia a una curva
patrón con ácido ascórbico 2 mM con 0; 0,2; 0,3 y 0,4 mM.
RESULTADOS
Y DISCUSIÓN
En la primera
parte de este artículo se analizó y discutió la respuesta
de las plantas de arroz inoculadas o no y sometidas a diferente intensidad de
estrés hídrico, desde el punto de vista fisiológico de
la eficiencia fotosintética, porcentaje de colonización simbiótica
en la raíz, masa fresca parte aérea y radical, además del
contenido de prolina (31).
En la Figura 1, se muestra
el potencial hídrico de las plantas MA y noMA sometidas a estrés
por un periodo de 15 días (evaluadas a los 45 DDT). Los resultados corroboraron
el efecto inducido por un déficit hídrico en las plantas, con
potenciales que se hacen más negativos con respecto a los tratamientos
testigo que fueron menos negativos (MA+25 mL y noMA+25 mL), sin diferencias
significativas entre MA y noMA. Por otra parte, es importante destacar que los
potenciales hídricos de los tratamientos MA (10 y 5 mL) fueron menos
negativos que los noMA (10 y 5 mL), comportamiento que ha sido informado por
otros autores en el cultivo de tomate (Solanum lycopersicon L.) y lechuga
(Lactuca sativa L.) (16, 32), respectivamente.
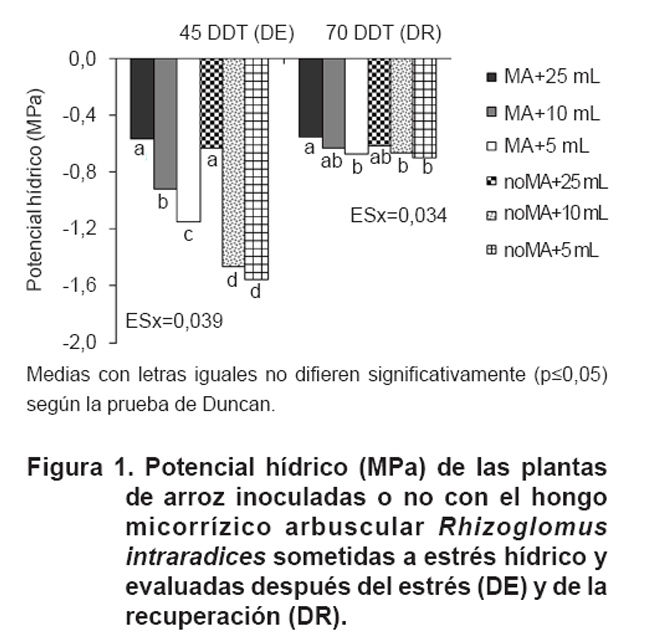
Después de recuperadas las plantas (70 DDT), el potencial hídrico
disminuyó en los tratamientos que fueron sometidos a estrés hídrico,
al punto de no encontrarse diferencias entre las plantas MA con 10 mL y el testigo,
y a su vez, las plantas regadas con 5 mL y las de 10 mL. En el caso de las plantas
noMA, no se aprecian diferencias significativas entre los tratamientos.
El incremento o
la disminución del potencial hídrico de las plantas están
muy relacionados con la presencia de la asociación micorrízica
y con el momento en el que se aplicó el estrés hídrico,
además de la severidad del mismo. Este comportamiento puede deberse a
que las hifas del hongo mejoran este indicador, al igual que la conductividad
hidráulica de la raíz, lo cual disminuye la resistencia de esta
al paso del agua (7, 8), aspecto que ha sido comprobado en plantas de maíz
(Zea maiz) inoculadas con HMA y expuestas a estrés hídrico
(11) y en uva (Vitis vinífera L.) (33). El desarrollo de micelio
extrarradical permite a las raíces tener un mayor acceso al agua del
suelo y aumentar así su hidratación, lo que mejora el metabolismo
vegetal, aún en condiciones de estrés ambiental (8, 9, 12).
Acumulación de peróxido de hidrógeno
A los 45 DDT, el peróxido de hidrógeno (H2O2)
se acumuló en las plantas sometidas a estrés hídrico (Figura
2), especialmente en las plantas noMA y regadas con 5 mL de solución
nutritiva (177 % de aumento en comparación con las plantas noMA bien
regadas). Por el contrario, en las plantas MA regadas con 5 mL de solución
de nutrientes, la acumulación de peróxido de hidrógeno
aumentó (85 %) en comparación con las plantas MA bien regadas.
En todos los regímenes hídricos, la cantidad de peróxido
de hidrógeno acumulado fue mayor en las plantas noMA que en las plantas
MA. Cuando las plantas se recuperaron del estrés hídrico durante
25 días adicionales (70 DDT), la cantidad de peróxido de hidrógeno
acumulado en la parte aérea de la planta fue bajo y no mostró
diferencias significativas entre los tratamientos.
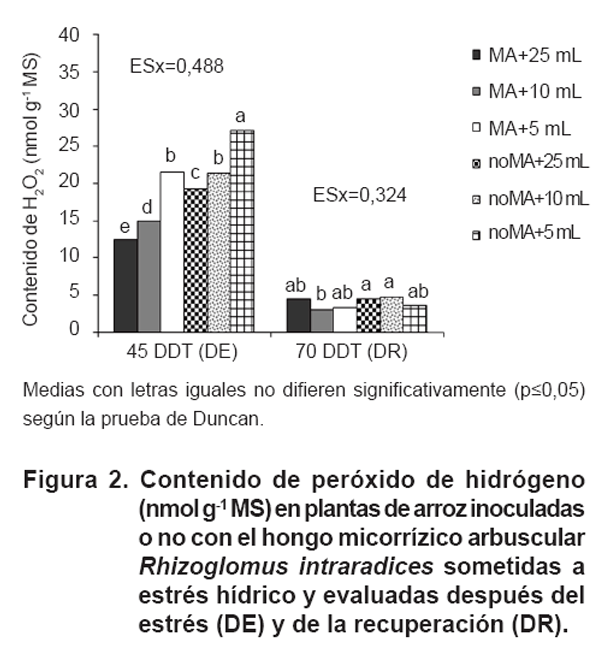
La acumulación
de H2O2 fue mayor en los tratamientos sometidos a sequía,
especialmente en las plantas noMA y regadas con 5 mL de solución de nutrientes.
Las plantas MA también aumentaron su acumulación de H2O2,
pero en menor medida que las plantas noMA. Similar comportamiento se observó
en plantas de Arabidopsis thaliana, cuando fueron sometidas a estrés
por sequía, además de reducir la transpiración y la apertura
de los estomas (11, 19).
Daño oxidativo a lípidos
El daño oxidativo a lípidos se midió como la cantidad de
peróxidos lipídicos formados en los diferentes tratamientos (Tabla
I). Los resultados mostraron claramente que en las plantas MA no aumentó
la peroxidación de lípidos después del periodo de sequía
(45 DDT). Por el contrario, las plantas noMA sometidas a sequía acumularon
más peróxidos lipídicos que las correspondientes plantas
MA. Este efecto fue visible incluso en las plantas no sometidas a sequía
(un aumento del 97 %), aunque fue más evidente en las plantas sometidas
a sequía (un aumento del 116 % en las plantas regadas con 10 mL de solución
de nutrientes y de 155 % en las plantas regadas con 5 mL de solución
de nutrientes). Después de la recuperación (70 DDT), el nivel
de peróxidos lipídicos disminuyó en las plantas noMA, pero
se mantuvo con mayor contenido de peróxido que las plantas MA. En ese
caso, no se encontraron diferencias significativas entre los tratamientos sometidos
a estrés.
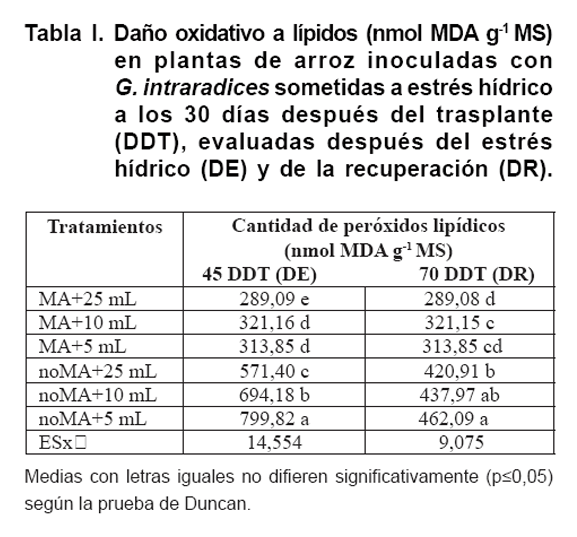
Las plantas de
arroz son muy sensibles al estrés oxidativo (34). En consecuencia, la
cantidad de peróxidos lipídicos fue cuantificada en la parte aérea
de las plantas de arroz en los diferentes tratamientos. La peroxidación
lipídica fue menor en las plantas MA tras el periodo de sequía
(45 DDT), mientras que las plantas noMA acumularon cantidades importantes de
peróxidos lipídicos. Similares resultados se observaron en plantas
de tomate (Solanum lycopersicon L.) inoculadas con MA, pero bajo condiciones
de estrés por salinidad (35).
Contenido de glutatión y ascorbato reducido
Cuando las plantas fueron sometidas a estrés hídrico durante 15
días (45 DDT), la cantidad de glutatión acumulado fue considerablemente
mayor en plantas MA que en plantas noMA (Figura
3).
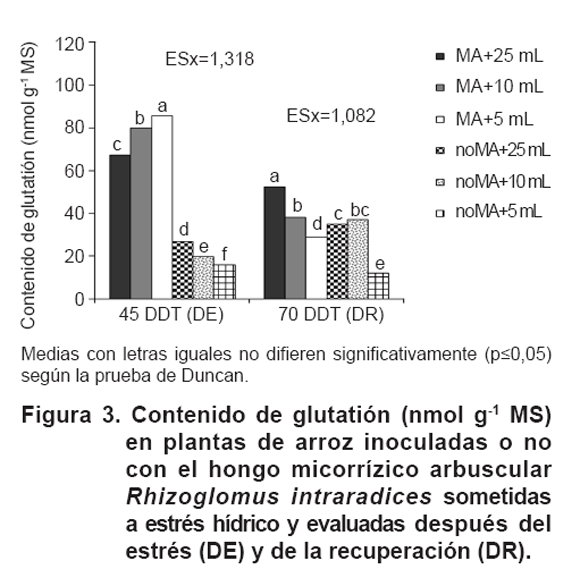
Este efecto se observó en todos los regímenes de agua, incluyendo
los testigos mantenidos con 25 mL de solución de nutrientes (66,73 %
de aumento del contenido de glutatión). Sin embargo, las diferencias
entre las plantas MA y plantas noMA en la cantidad de glutatión acumulado
aumentó cuando la sequía fue más severa, alcanzando el
321,22 % de aumento en las plantas MA regadas con 5 mL de solución de
nutrientes en comparación con sus correspondientes plantas noMA. Cuando
las plantas se recuperaron de la sequía (70 DDT) el contenido de glutatión
continuó siendo más alto en plantas MA que en las plantas noMA,
a excepción de las plantas que habían sido previamente regadas
con 10 mL de solución de nutrientes.
El glutatión existe con dos formas diferentes, la forma reducida y la
forma oxidada; sin embargo, en las plantas el glutatión se mantiene exclusivamente
en la forma reducida (36). Este ejerce su función de antioxidante al
reaccionar con radicales superóxido, peróxido y oxígeno
singlete para la formación de glutatión oxidado (18, 22, 23, 37).
En cuanto al contenido
de ascorbato (Tabla II),
después del periodo de sequía (45 DDT), todos los tratamientos
mostraron un alto nivel; sin embargo, las plantas noMA acumularon más
ascorbato que las plantas MA. La acumulación de ascorbato disminuyó
considerablemente después de la recuperación de la sequía
(70 DDT) y, en este estadio no se encontraron diferencias importantes entre
los tratamientos.
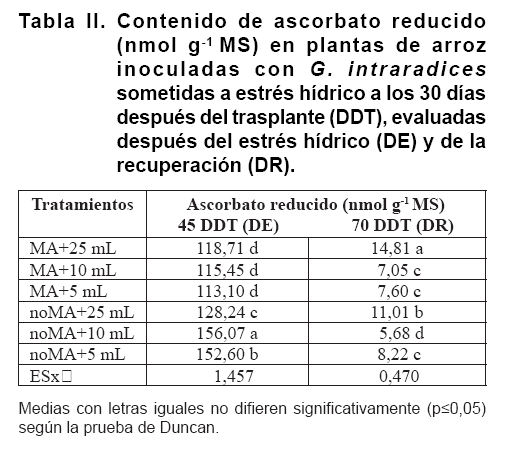
Estos resultados
nos permiten inferir que las plantas MA muestran una mejora de la tolerancia
al estrés, lo cual suele estar relacionado con la mejora del contenido
de compuestos antioxidantes en las plantas (Figura
3; Tabla II). Dada
la toxicidad de ROS, las plantas necesitan disponer de sistemas adecuados de
desintoxicación que permitan la eliminación rápida de estos
compuestos. Estos sistemas incluyen varias enzimas antioxidantes y compuestos
no enzimáticos como ascorbato, glutatión, flavonoides, carotenoides
y tocoferoles (21, 38). Entre estos compuestos no enzimáticos, glutatión
y ascorbato son metabolitos esenciales que regulan las funciones principales
de las células y desempeñan un papel fundamental en la defensa
antioxidante (22, 23, 39).
El ascorbato es un indicador importante para la desintoxicación reductora
del peróxido de hidrógeno (H2O2) en las
plantas. El peróxido generado directamente o después de la conversión
de la superóxido dismutasa es inicialmente degradado a H2O por peroxidasas
de ascorbato utilizando ascorbato como donante de electrones (20, 39, 40).
Bajo estas condiciones, la respuesta antioxidante de la planta ante el estrés
hídrico, se activa por diferentes mecanismos, puesto que en las plantas
MA se acumula más glutatión a los 45 DDT; sin embargo, en el caso
del ascorbato se acumula significativamente más en plantas noMA.
De esta investigación, en sentido general (Parte I y II), se puede concluir
que las plantas de arroz se micorrizaron con porcentajes entre 20 y 50 % en
condiciones aeróbicas. La micorrización tiene marcada influencia
en el crecimiento de las plantas de arroz a largo plazo. La acumulación
de prolina aumentó considerablemente, tanto en plantas MA como en plantas
noMA, después de ser sometidas a estrés hídrico. En cualquier
caso, la cantidad de prolina acumulada fue siempre menor en las plantas MA (31).
Las plantas micorrizadas mostraron menor daño oxidativo propiciado por
la acumulación del antioxidante glutatión y una tendencia a acumular
menos peróxido y daño oxidativo a lípidos después
del estrés.
AGRADECIMIENTO
Este trabajo se
llevó a cabo en el marco del proyecto MICIN-FEDER AGL2008-00898 de la
Estación Experimental del Zaidín, Granada, España y financiado
por AECID (Grant MAE-AECID 2008/09 260940).
BIBLIOGRAFÍA
1. Mostajeran,
A. y Rahimi-Eichi, V. ‘‘Effects of drought stress on growth and yield of rice
(Oryza sativa L.) cultivars and accumulation of proline and soluble
sugars in sheath and blades of their different ages leaves’’, American-Eurasian
Journal of Agricultural & Environmental Sciences, vol. 5, no. 2, 2009,
pp. 264–272, ISSN 1818-6769.
2. Aroca, R.; Porcel, R. y Ruiz-Lozano, J.M. ‘‘Regulation of root water uptake
under abiotic stress conditions’’, Journal of Experimental Botany,
vol. 63, no. 1, 1 de enero de 2012, pp. 43-57, ISSN 0022-0957, 1460-2431, DOI
10.1093/jxb/err266, [PMID: 21914658].
3. Evenson, R.E. Rice Research in Asia: Progress and Priorities, (eds.
Herdt, R.W. y Hossain, M.), edit. IRRI, 1 de enero de 1996, p. 430, ISBN 978-0-85198-997-6.
4. Jongdee, B.; Fukai, S. y Cooper, M. ‘‘Leaf water potential and osmotic adjustment
as physiological traits to improve drought tolerance in rice’’, Field Crops
Research, vol. 76, no. 2–3, julio de 2002, (ser. Improving Tolerance to
Abiotic Sresses in Rainfed Lowland Rice), pp. 153-163, ISSN 0378-4290, DOI 10.1016/S0378-4290(02)00036-9.
5. Bernier, J.; Atlin, G.N.; Serraj, R.; Kumar, A. y Spaner, D. ‘‘Breeding upland
rice for drought resistance’’, Journal of the Science of Food and Agriculture,
vol. 88, no. 6, 30 de abril de 2008, pp. 927-939, ISSN 1097-0010, DOI 10.1002/jsfa.3153.
6. Ruiz-Lozano, J.M. y Aroca, R. ‘‘Host Response to Osmotic Stresses: Stomatal
Behaviour and Water Use Efficiency of Arbuscular Mycorrhizal Plants’’ [en
línea], eds. Koltai, H. y Kapulnik, Y., Arbuscular Mycorrhizas: Physiology
and Function, 2.a ed., edit. Springer Netherlands, 2010, pp. 239-256, ISBN 978-90-481-9488-9,
[Consultado: 4 de abril de 2015], Disponible en: <http://link.springer.com/chapter/10.1007/978-90-481-9489-6_11>.
7. Ruiz-Lozano, J.M.; Porcel, R.; Bárzana, G.; Azcón, R. y Aroca,
R. ‘‘Contribution of Arbuscular Mycorrhizal Symbiosis to Plant Drought Tolerance:
State of the Art’’ [en línea], ed. Aroca, R., Plant Responses to
Drought Stress, edit. Springer Berlin Heidelberg, 2012, pp. 335-362, ISBN 978-3-642-32652-3,
[Consultado: 4 de abril de 2015], Disponible en: <http://link.springer.com/chapter/10.1007/978-3-642-32653-0_13>.
8. Smith, S.E.; Facelli, E.; Pope, S. y Smith, F.A. ‘‘Plant performance in stressful
environments: interpreting new and established knowledge of the roles of arbuscular
mycorrhizas’’, Plant and Soil, vol. 326, no. 1-2, 19 de mayo de 2009,
pp. 3-20, ISSN 0032-079X, 1573-5036, DOI 10.1007/s11104-009-9981-5.
9. Maiti, D.; Toppo, N.N. y Variar, M. ‘‘Integration of crop rotation and arbuscular
mycorrhiza (AM) inoculum application for enhancing AM activity to improve phosphorus
nutrition and yield of upland rice (Oryza sativa L.)’’, Mycorrhiza,
vol. 21, no. 8, 30 de marzo de 2011, pp. 659-667, ISSN 0940-6360, 1432-1890,
DOI 10.1007/s00572-011-0376-0.
10. Smith, S.E. y Smith, F.A. ‘‘Roles of Arbuscular Mycorrhizas in Plant Nutrition
and Growth: New Paradigms from Cellular to Ecosystem Scales’’, Annual Review
of Plant Biology, vol. 62, no. 1, 2011, pp. 227-250, ISSN 1543-5008, 1545-2123,
DOI 10.1146/annurev-arplant-042110-103846, [PMID: 21391813].
11. Bárzana, G.; Aroca, R.; Paz, J.A.; Chaumont, F.; Martinez-Ballesta,
M.C.; Carvajal, M. y Ruiz-Lozano, J.M. ‘‘Arbuscular mycorrhizal symbiosis increases
relative apoplastic water flow in roots of the host plant under both well-watered
and drought stress conditions’’, Annals of Botany, vol. 109, no. 5,
4 de enero de 2012, pp. 1009-1017, ISSN 0305-7364, 1095-8290, DOI 10.1093/aob/mcs007,
[PMID: 22294476].
12. Vallino, M.; Fiorilli, V. y Bonfante, P. ‘‘Rice flooding negatively impacts
root branching and arbuscular mycorrhizal colonization, but not fungal viability’’,
Plant, Cell & Environment, vol. 37, no. 3, 1 de marzo de 2014,
pp. 557-572, ISSN 1365-3040, DOI 10.1111/pce.12177.
13. Aroca, R.; Ruiz-Lozano, J.M.; Zamarreño, Á.M.; Paz, J.A.;
García-Mina, J.M.; Pozo, M.J. y López-Ráez, J.A. ‘‘Arbuscular
mycorrhizal symbiosis influences strigolactone production under salinity and
alleviates salt stress in lettuce plants’’, Journal of Plant Physiology,
vol. 170, no. 1, 1 de enero de 2013, pp. 47-55, ISSN 0176-1617, DOI 10.1016/j.jplph.2012.08.020.
14. Gutjahr, C. y Parniske, M. ‘‘Cell and Developmental Biology of Arbuscular
Mycorrhiza Symbiosis’’, Annual Review of Cell and Developmental Biology,
vol. 29, no. 1, 2013, pp. 593-617, DOI 10.1146/annurev-cellbio-101512-122413,
[PMID: 24099088].
15. Gol, F.M.; Ashraf, S. y Taj, A.Z. ‘‘Effects of two species of mycorrhiza
fungi and drought stress on chlorophyll a, b and total of Ocimum basilicum’’,
International Journal of Farming and Allied Sciences, vol. 3, no. 10,
2014, pp. 1104-1108, ISSN 2322-4134.
16. Porcel, R.; Azcón, R. y Ruiz-Lozano, J.M. ‘‘Evaluation of the role
of genes encoding for ?1-pyrroline-5-carboxylate synthetase (P5CS) during drought
stress in arbuscular mycorrhizal Glycine max and Lactuca sativa plants’’, Physiological
and Molecular Plant Pathology, vol. 65, no. 4, octubre de 2004, pp. 211-221,
ISSN 0885-5765, DOI 10.1016/j.pmpp.2005.02.003.
17. Aroca, R.; Porcel, R. y Ruiz-Lozano, J.M. ‘‘Plant drought tolerance
enhancement by arbuscular mycorrhizal symbiosis’’, ed. Fulton, S.M., Mycorrhizal
Fungi: Soil, Agriculture and Environmental Implications, edit. Nova Science
Publishers lnc, New York, 2011, pp. 229–240, ISBN 978-1-61122-659-1.
18. Noctor, G.; Mhamdi, A.; Chaouch, S.; Han, Y.; Neukermans, J.; Marquez-Garcia,
B.; Queval, G. y Foyer, C.H. ‘‘Glutathione in plants: an integrated overview’’,
Plant, Cell & Environment, vol. 35, no. 2, 1 de febrero de 2012, pp. 454-484,
ISSN 1365-3040, DOI 10.1111/j.1365-3040.2011.02400.x.
19. Porcel, R.; Aroca, R. y Ruiz-Lozano, J.M. ‘‘Salinity stress alleviation
using arbuscular mycorrhizal fungi. A review’’, Agronomy for Sustainable
Development, vol. 32, no. 1, 15 de marzo de 2011, pp. 181-200, ISSN 1774-0746,
1773-0155, DOI 10.1007/s13593-011-0029-x.
20. Gill, S.S. y Tuteja, N. ‘‘Reactive oxygen species and antioxidant machinery
in abiotic stress tolerance in crop plants’’, Plant Physiology and Biochemistry,
vol. 48, no. 12, diciembre de 2010, pp. 909-930, ISSN 0981-9428, DOI 10.1016/j.plaphy.2010.08.016.
21. Mahmood, Q.; Ahmad, R.; Kwak, S.-S.; Rashid, A. y Anjum, N.A. ‘‘Ascorbate
and Glutathione: Protectors of Plants in Oxidative Stress’’ [en línea],
eds. Anjum, N.A., Chan, M.-T., y Umar, S., Ascorbate-Glutathione Pathway and
Stress Tolerance in Plants, edit. Springer Netherlands, 2010, pp. 209-229, ISBN
978-90-481-9403-2, [Consultado: 16 de mayo de 2015], Disponible en: <http://link.springer.com/chapter/10.1007/978-90-481-9404-9_7>.
22. Scheibe, R. y Beck, E. ‘‘Drought, Desiccation, and Oxidative Stress’’
[en línea], eds. Lüttge, U., Beck, E., y Bartels, D., Plant Desiccation
Tolerance, edit. Springer Berlin Heidelberg, 2011, (ser. Ecological Studies,
no. ser. 215), pp. 209-231, ISBN 978-3-642-19105-3, [Consultado: 16 de mayo
de 2015], Disponible en: <http://link.springer.com/chapter/10.1007/978-3-642-19106-0_11>.
23. Suzuki, N.; Koussevitzky, S.; Mittler, R. y Miller, G. ‘‘ROS and redox signalling
in the response of plants to abiotic stress’’, Plant, Cell & Environment,
vol. 35, no. 2, 1 de febrero de 2012, pp. 259-270, ISSN 1365-3040, DOI 10.1111/j.1365-3040.2011.02336.x.
24. Hoagland, D.R. y Arnon, D.I. ‘‘The water-culture method for growing plants
without soil.’’, Circular. California Agricultural Experiment Station,
vol. 347, no. 2, 1950, p. 32, ISSN 0096-0721, CABDirect2.
25. Duncan, D.B. ‘‘Multiple Range and Multiple F Tests’’, Biometrics,
vol. 11, no. 1, 1 de marzo de 1955, pp. 1-42, ISSN 0006-341X, DOI 10.2307/3001478.
26. Patterson, B.D.; MacRae, E.A. y Ferguson, I.B. ‘‘Estimation of hydrogen
peroxide in plant extracts using titanium(IV)’’, Analytical Biochemistry,
vol. 139, no. 2, junio de 1984, pp. 487-492, ISSN 0003-2697, DOI 10.1016/0003-2697(84)90039-3.
27. Aroca, R.; Irigoyen, J.J. y Sánchez-Díaz, M. ‘‘Drought enhances
maize chilling tolerance. II. Photosynthetic traits and protective mechanisms
against oxidative stress’’, Physiologia Plantarum, vol. 117, no. 4,
1 de abril de 2003, pp. 540-549, ISSN 1399-3054, DOI 10.1034/j.1399-3054.2003.00065.x.
28. Dhindsa, R.S.; Plumb-Dhindsa, P. y Thorpe, T.A. ‘‘Leaf Senescence: Correlated
with Increased Levels of Membrane Permeability and Lipid Peroxidation, and Decreased
Levels of Superoxide Dismutase and Catalase’’, Journal of Experimental Botany,
vol. 32, no. 1, 2 de enero de 1981, pp. 93-101, ISSN 0022-0957, 1460-2431, DOI
10.1093/jxb/32.1.93.
29. Smith, S.E. y Read, D. Mycorrhizal Symbiosis [en línea],
3.a ed., edit. Academic Press, London, 2008, p. 800, ISBN 978-0-12-370526-6,
[Consultado: 4 de abril de 2015], Disponible en: <http://www.sciencedirect.com/science/article/pii/B9780123705266500210>.
30. Leipner, J.; Fracheboud, Y. y Stamp, P. ‘‘Acclimation by suboptimal growth
temperature diminishes photooxidative damage in maize leaves’’, Plant, Cell
& Environment, vol. 20, no. 3, 1 de marzo de 1997, pp. 366-372, ISSN
1365-3040, DOI 10.1046/j.1365-3040.1997.d01-76.x.
31. Ruiz Sánchez, M.; Polón Pérez, R.; Vázquez Del
Llano, B.; Muñoz Hernández, Y.; Cuéllar Olivero, N. y Ruiz-Lozano,
J.M. ‘‘La simbiosis micorrizíca arbuscular en plantas de arroz (Oryza
sativa L.) sometidas a estrés hídrico: Parte I. Mejora la
respuesta fisiológica’’, Cultivos Tropicales, vol. 33, no. 4,
diciembre de 2012, pp. 47-52, ISSN 0258-5936.
32. Mujica Pérez, Y. y Batlle Sales, J. ‘‘Funcionamiento de la inoculación
líquida con hongos micorrízicos arbusculares (HMA) en plantas
de tomate (Solanum lycopersicum L.)’’, Cultivos Tropicales,
vol. 34, no. 4, diciembre de 2013, pp. 5-8, ISSN 0258-5936.
33. Vandeleur, R.K.; Sullivan, W.; Athman, A.; Jordans, C.; Gilliham, M.; Kaiser,
B.N. y Tyerman, S.D. ‘‘Rapid shoot-to-root signalling regulates root hydraulic
conductance via aquaporins’’, Plant, Cell & Environment, vol. 37,
no. 2, 1 de febrero de 2014, pp. 520-538, ISSN 1365-3040, DOI 10.1111/pce.12175.
34. Volkov, R.A.; Panchuk, I.I.; Mullineaux, P.M. y Schöffl, F. ‘‘Heat
stress-induced H2O2 is required for effective expression
of heat shock genes in Arabidopsis’’, Plant Molecular Biology, vol.
61, no. 4-5, 1 de julio de 2006, pp. 733-746, ISSN 0167-4412, 1573-5028, DOI
10.1007/s11103-006-0045-4.
35. Maheshwari, R. y Dubey, R.S. ‘‘Nickel-induced oxidative stress and the role
of antioxidant defence in rice seedlings’’, Plant Growth Regulation,
vol. 59, no. 1, 26 de mayo de 2009, pp. 37-49, ISSN 0167-6903, 1573-5087, DOI
10.1007/s10725-009-9386-8.
36. Zhong, H.; Chao, H.; Zhi, Z. y Huai, W. ‘‘Changes in antioxidative enzymes
and cell membrane osmosis in tomato colonized by arbuscular mycorrhizae under
NaCl stress’’, Colloids and Surfaces B-Biointerfaces, vol. 59, 2007,
pp. 128-33, ISSN 0927-7765.
37. Ding, S.; Lu, Q.; Zhang, Y.; Yang, Z.; Wen, X.; Zhang, L. y Lu, C. ‘‘Enhanced
sensitivity to oxidative stress in transgenic tobacco plants with decreased
glutathione reductase activity leads to a decrease in ascorbate pool and ascorbate
redox state’’, Plant Molecular Biology, vol. 69, no. 5, 29 de noviembre
de 2008, pp. 577-592, ISSN 0167-4412, 1573-5028, DOI 10.1007/s11103-008-9440-3.
38. Latowski, D.; Surówka, E. y Strzalka, K. ‘‘Regulatory Role of
Components of Ascorbate–Glutathione Pathway in Plant Stress Tolerance’’
[en línea], eds. Anjum, N.A., Chan, M.-T., y Umar, S., Ascorbate-Glutathione
Pathway and Stress Tolerance in Plants, edit. Springer Netherlands, 2010, pp.
1-53, ISBN 978-90-481-9403-2, [Consultado: 4 de abril de 2015], Disponible en:
<http://link.springer.com/chapter/10.1007/978-90-481-9404-9_1>.
39. Jubany-Marí, T.; Munné-Bosch, S. y Alegre, L. ‘‘Redox regulation
of water stress responses in field-grown plants. Role of hydrogen peroxide and
ascorbate’’, Plant Physiology and Biochemistry, vol. 48, no. 5, mayo
de 2010, (ser. Antioxidants and redox regulation in plants), pp. 351-358, ISSN
0981-9428, DOI 10.1016/j.plaphy.2010.01.021.
40. Sofo, A.; Cicco, N.; Paraggio, M. y Scopa, A. ‘‘Regulation of the Ascorbate–Glutathione
Cycle in Plants Under Drought Stress’’ [en línea], eds. Anjum, N.A.,
Chan, M.-T., y Umar, S., Ascorbate-Glutathione Pathway and Stress Tolerance
in Plants, edit. Springer Netherlands, 2010, pp. 137-189, ISBN 978-90-481-9403-2,
[Consultado: 4 de abril de 2015], Disponible en: <http://link.springer.com/chapter/10.1007/978-90-481-9404-9_5>.
Recibido: 26 de
junio de 2014
Aceptado: 19 de diciembre de 2014
Ms.C. Michel
Ruiz-Sánchez, Instituto Nacional de Ciencias Agrícolas (INCA),
gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32 700. Email:
mich@inca.edu.cu




