Análisis
del crecimiento de un genotipo silvestre de Carica papaya L. cultivado
ex situ y cv. `Maradol Roja´
Analysis
of the growth in wild genotypes of Carica papaya L. grown ex situ
and cv. ´ Maradol Roja ´
Ms.C. Jesús Rodríguez Cabello, Yusnier Díaz Hernández,
Aymara Pérez González, Ms.C. Luis R. Fundora, Dr.C. Pedro Rodríguez
Hernández
Instituto Nacional
de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las
Lajas, Mayabeque, Cuba, CP 32 700.
RESUMEN
La especie Carica
papaya L., es nativa del trópico americano y uno de los frutales
más cultivados a nivel mundial. En Cuba existen problemas que afectan
la producción de este frutal, considerados los más importantes
el reducido número de cultivares explotados comercialmente y la baja
diversidad genética presente en el banco de germoplasma. Sin embargo,
existen genotipos silvestres que constituyen una fuente importante de genes
para los programas de mejoramiento y explotación local, los cuales aún
no se han caracterizado. Estudios de análisis del crecimiento permiten
comprender su comportamiento en diferentes periodos de siembra en condiciones
ex situ e identificar caracteres de crecimiento inicial que posibiliten
el aumento del rendimiento y favorezcan los trabajos de mejoramiento en busca
de genotipos más productivos. Debido a lo antes señalado, el objetivo
de la presente investigación fue realizar estudios del crecimiento del
genotipo papaya silvestre de la cuenca Almendares-Vento. Las semillas para los
experimentos se obtuvieron de frutos colectados in situ. Las medidas
directas en la planta fueron área foliar y peso seco. Para la determinación
de la superficie foliar se empleó una cámara digital y un software.
El análisis computarizado de las imágenes de hojas obtenidas con
la cámara digital permitió estimar el área foliar de forma
simple, rápida y económica. La mayor producción de área
foliar del genotipo silvestre y similar comportamiento en la masa seca y resto
de los indicadores evaluados, indica la disponibilidad de recursos durante toda
la fase de crecimiento, lo cual se asocia con su rendimiento.
Palabras
clave: fisiología del desarrollo, Índices de crecimiento,
biomasa.
ABSTRACT
Carica papaya
L. specie is native from the American tropic and one the most important fruit
trees grown at tropical and subtropical regions of the world. In Cuba, many
problems affect production of this fruit tree where the most important is reduction
of number of exploded commercial varieties and low genetic diversity in germoplasma's
bench. However, wild genotypes constitute an important source of genes for improvement
programs and local explotation, which have not been characterized. Studies of
growth analysis permit understanding his behavior in different planting periods
and ex situ conditions and to identify initial growth characters which
provoke more yield increase and favor improvement research works of the most
productive genotypes. Due to before indicated, the aim of the present investigation
was realized studies of the growth of the genotype wild papaya of the basin
Almendares-Vento. The seeds for the experiments were obtained of fruits collected
in situ. The direct measures in the plant were an area to foliate and
dry weight. For the determination of the surface to foliate used a digital chamber
and software. The analysis computarizado of the images of leaves obtained with
the digital chamber allowed to estimate the area to foliate of simple, rapid
and economic form. The major production of area to foliate of the wild genotype
and similar behavior in the dry mass and rest of the evaluated indicators, indicates
the availability of resources during the whole phase of growth, which associates
with his performance.
Key
words: physiology of the development, Indexes of the growth, biomass.
INTRODUCCIÓN
La especie Carica
papaya L., de la familia Caricaceae es nativa del trópico americano
(1, 2) y uno de los frutales más cultivados en las regiones tropicales
y subtropicales del mundo para el consumo en fresco y por sus variados usos
en la industriaA (3).
En Cuba se plantaron en el año 2011 alrededor de 7 920 ha con una producción
de 135 700 t (4); sin embargo, el mal manejo del cultivo ha propiciado que el
rendimiento sea bajo y los costos de producción altosB. Otro de los problemas
que afecta la producción de papaya es el reducido número de cultivares
explotados comercialmente y la baja diversidad genética presente en el
banco de germoplasma (5).
En el archipiélago cubano existen genotipos de papaya silvestre que producen
abundantes frutos de pequeño a mediano tamaño, los cuales son
aprovechados por la población residente en sus áreas de origen
(6). Estos constituyen una fuente importante de genes para los programas de
mejoramiento y explotación local (7, 8). Sin embargo, la información
que se tiene de estos genotipos es escasa por lo que se hace necesario realizar
estudios de análisis del crecimiento. Los mismos se basan en métodos
cuantitativos que describen todo el sistema de la planta con crecimiento bajo
condiciones naturales, seminaturales o controladas (9), que permiten comprender
su comportamiento en condiciones ex situ en diferentes periodos de
siembra (10).
El análisis del crecimiento se utiliza como una alternativa para explicar
diferencias en el crecimiento de origen genético o debido a modificaciones
ambientales, lo cual constituye una herramienta eficiente para la identificación
de materiales promisorios. Esto permite identificar características de
crecimiento inicial que posibilitan el aumento del rendimiento de la planta
adulta y favorecen los trabajos de mejoramiento en busca de genotipos más
productivos (11, 12, 13). Para ello se recomienda cuantificar el material vegetal
existente en la planta en relación con su sistema asimilador en intervalos
de tiempo sucesivos (14).
A través del análisis del crecimiento se puede definir la época
ideal de siembra y de trasplante de los cultivos. Además, se estudian
las relaciones entre la fuente y sumidero. De las operaciones referidas se obtienen
medidas directas, como masa seca (W), área foliar total (AF), tiempo
(t) e índices derivados como la tasa relativa de crecimiento (TRC), índice
de área foliar (IAF), tasa de asimilación neta (TAN), tasa de
crecimiento del cultivo (TCC), entre otras, que se deben obtener por cálculos
del análisis funcional (15). El índice de área foliar es
uno de los parámetros mas útiles para caracterizar la vegetaciónC.
El área foliar se asocia con muchos procesos agronómicos y fisiológicos
que incluyen el crecimiento, fotosíntesis, transpiración, fotones
entre la percepción y el balance de energíaD. Es por esto que
las mediciones de los incrementos del área foliar y la masa seca son
parámetros significativos en la evaluación del crecimiento de
las plantas. Su adecuada determinación durante el ciclo del cultivo posibilita
conocer su crecimiento y desarrollo, la eficiencia fotosintética y en
consecuencia la producción total de la planta (16).
No obstante, a pesar de la abundante bibliografía existente acerca de
los distintos métodos empleados para el cálculo del área
foliar, su determinación no resulta fácil, de no contar con el
equipamiento necesario para lograrlo de manera sencilla (17, 18). Sin embargo,
con el desarrollo de la informática se abrieron nuevas posibilidades
para la medición del área foliar (19). Algunos investigadores
emplean el escáner de mesa y software para procesamiento de imágenes,
como método efectivo, rápido y económico (20). A pesar
de esto, cultivos como Carica papaya L. con hojas de más de
80 cm de diámetro y 50 cm de longitud (21), no pueden ser escaneadas,
de modo que se necesitan modificaciones a estos métodos para lograr el
propósito deseado.
Debido a lo antes señalado, el objetivo de la presente investigación
fue determinar el área foliar a través de una cámara digital
y un software libre para análisis de imágenes (ImageJ), que permita
los análisis del crecimiento del genotipo papaya silvestre de la provincia
Mayabeque, en comparación con el cultivar `Maradol Roja´.
MATERIALES
Y MÉTODOS
Los experimentos
se realizaron en el Departamento de Fisiología y Bioquímica Vegetal
del Instituto Nacional de Ciencias Agrícolas (INCA), situado en el km
3 ½ de la carretera San José a Tapaste, municipio San José
de las Lajas, provincia Mayabeque, ubicado a los 23°00’ de latitud norte
y 82°12’ de longitud oeste y 138 m. s. n. m.
Para los experimentos ex situ, se emplearon semillas de frutos de plantas
de papaya silvestre colectadas en las alturas del nacimiento de las cuencas
Almendares-Vento y Noreste de la Habana.
El área se encuentra enmarcada entre las coordenadas geográficas:
23° 00’ 00” N y 23° 03’ 27” S, 82° 01’ 27” E y 82° 08’ 20” O.
Se utilizó como control el cultivar ´Maradol Roja´ proveniente
de semillas certificadas, por ser de origen cubano y el de mayor importancia
económica en Cuba y en países del áreaE.
Para ubicar las plantas del genotipo silvestre in situ, se analizó
la información de la bibliografía disponible y criterios de los
pobladores locales acerca de estas poblaciones en el área. Para la prospección
se organizaron expediciones y recorridos en los meses desde febrero hasta mayo
de 2008. Participaron especialistas del Instituto de Ecología y Sistemática
(IES), del INCA, de la Estación de Flora y Fauna “Escaleras de Jaruco”
(EFFEJ) y campesinos o personas residentes permanentes en la zona de prospección.
La metodología empleada consistió en ubicar en un mapa la región
de interés y seleccionar las parcelas o cuadrantes, así como planificar
los recorridos a seguir, de acuerdo a las características del área
e información de la población localF. El tamaño
de los cuadrantes varió entre 100 y 1000 m2 en dependencia del relieve
(22).
Una vez ubicadas las plantas se les realizó un seguimiento a las que
ya presentaban frutos (11 plantas) hasta su colecta, luego de que aparecieran
tres o cuatro rayas amarillas en el mismo (5). Cuando el fruto cambió
completamente el color se extrajeron las semillas, las cuales fueron colocadas
a la sombra al aire libre. Una vez secas, se depositaron en un frasco con tapa
y se conservaron a temperatura ambiente hasta la siembra.
Para las evaluaciones ex situ se emplearon dos períodos de siembra.
Se tuvo presente que a pesar de que la siembra de papaya con garantía
de riego se realiza todo el año, se recomiendan los meses donde los vectores
tienen bajas poblaciones o el desarrollo de los virus es lento, lo cual coincide
con los meses de bajas temperaturas y menos lluviosos (21). Para la siembra
sin riego, los productores aprovechan las precipitaciones en las fases fenológicas
de crecimiento y desarrollo que coinciden con los meses más lluviosos.
Por todo lo anterior, el primer periodo de siembra fue designado como “invierno”,
debido a que el tratamiento para la pregerminación de las semillas se
realizó en el mes de diciembre y la siembra se efectuó en el mes
de enero. Este periodo coincidió con los meses de menores temperaturas
y precipitaciones, que comprende los meses desde noviembre hasta abril. El otro
periodo de siembra se designó como “verano”, debido a que la siembra
se efectuó en el mes de mayo, cuando las temperaturas comienzan a ascender,
de modo que el trasplante y la fase de crecimiento
y desarrollo, coincidió con los meses de temperaturas y precipitaciones
máximas que comprende los meses desde junio hasta septiembre.
Para el estudio del crecimiento y desarrollo del cultivo se incluyeron cuatro
índices de crecimiento: tasa de crecimiento relativo (TCR), tasa de asimilación
neta (TAN), índice de área foliar (IAF) y tasa de crecimiento
del cultivo (TCC) al trasplante, floración y fructificación, en
invierno y verano del 2010, con el fin de aportar mayor conocimiento a este
genotipo silvestre.
Las medidas directas obtenidas fueron área foliar y peso seco de las
plantas. Para la determinación de la superficie foliar al momento del
trasplante, floración y fructificación se evaluaron cinco plantas
representativas por genotipos con el empleo de una cámara fotográfica
y un software libre para análisis de imágenes (ImageJ), mostrada
en la Figura 1.
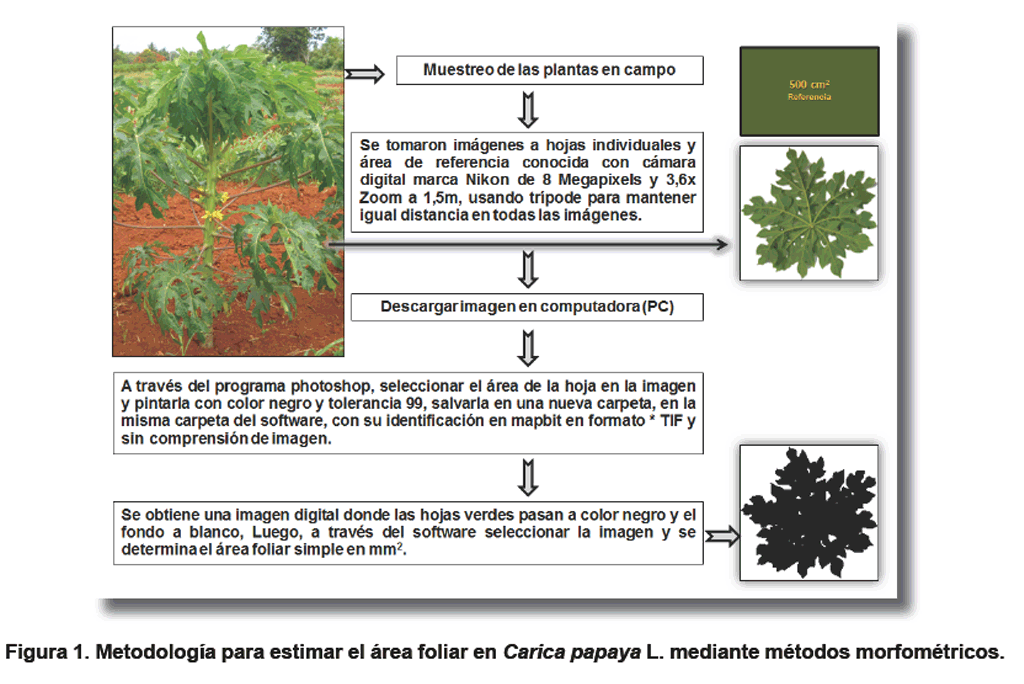
La evaluación del crecimiento en la masa seca de los órganos de
las plantas (hojas y tallo g planta-1) se realizó mediante muestreos
destructivos. Los órganos fueron pesados y luego secados en estufa a
80 oC hasta llegar a masa seca constante. Para calcular la masa seca total se
sumaron las masas secas de los diferentes órganos.
A partir de las medidas directas, se utilizaron las fórmulas propuestas
(23), con el fin de calcular los índices de crecimiento mediante las
derivadas siguientes:
TCR= (LnW2 – LnW1) / (T2 – T1), (g g-1 d-1)
TAN = (W2 – W1) / (T2 – T1) * (Ln AF2 – Ln AF1) / (AF2 – AF1), (g m-2
d-1)
TCC: (1/AS) * (W2 – W1) / (T2 – T1), (g m-2 d-1)
IAF = AF / AS, (Adimensional)
Donde: IAF: índice de área foliar; AF: área foliar; AS:
área de suelo; TCR: tasa de crecimiento relativo; W: peso seco; T: tiempo;
TCC: tasa de crecimiento del cultivo; TAN: tasa de asimilación neta.
El análisis estadístico consistió en Intervalos de Confianza
con significación de p<0,05. El procesamiento de los datos se realizó
con el empleo del paquete de programas SPSS v. 21 (24), para verificar diferencias
entre muestreos, bajo un diseño experimental completamente al azar.
RESULTADOS
Y DISCUSIÓN
Variables
e indicadores del crecimiento y desarrollo
La acumulación de biomasa de la parte aérea de la planta (hojas
y tallo) y área foliar en las etapas tempranas de crecimiento, trasplante,
floración y fructificación, exhibieron similar tendencia, con
los mayores valores en la fase reproductiva (Tabla
I).

Esto pudiera deberse a que en las etapas vegetativas de las especies anuales
la planta produce biomasa de manera eficiente y sostenida en respuesta a la
capacidad fotosintética.
Las hojas fueron los órganos aéreos que tendieron a acumular mayor
biomasa, lo cual se relaciona con el hecho de que estas aumentan su complejidad
y funcionabilidad a lo largo del ciclo del cultivo (25). Además, las
hojas son el principal órgano de la planta en esta etapa y a su formación
y crecimiento se dedica la mayor parte de los fotoasimilados resultantes del
metabolismo vegetal (26).
No se apreció diferencias entre los genotipos en el trasplante, en ninguna
de las variables. El área foliar osciló entre 107,2 cm2
en el genotipo silvestre y 128,8 cm2 en el cultivar `Maradol Roja´.
Estos valores son ligeramente inferiores a los obtenidos previamente en plantas
de 40 días de germinadas las semillas para este cultivarE, donde se encontraron
valores promedio en el área foliar entre 144,3 y 154,2 cm2.
Luego del trasplante en ambos genotipos hubo un incremento acelerado de las
variables del crecimiento hasta la floración, que continuó hasta
la fructificación. Esto se debió a que durante los primeros estadios
de la planta, se favorece notablemente su crecimiento vegetativo y en consecuencia,
el aumento del área foliar es directamente proporcional al aumento de
la masa en este órgano. Los especialistas reconocen en la intensidad
de esa etapa de expansión del área foliar, la eficiencia vegetal
en términos de aprovechamiento de la radiación solar (27). Además,
el tiempo entre el trasplante y la fase fenológica de la floración
es más prolongada que el resto de las fases evaluadas, lo cual propició
mayor acumulación de radiación solar que influyó sobre
la disminución en la velocidad de la tasa de crecimiento y temperatura,
como condicionantes fundamentales del desarrollo.
Al comparar la masa seca total en el momento de floración y fructificación,
no se apreciaron diferencias entre genotipos y sí entre periodos de siembra.
En papaya silvestre el acumulado fue de 206,4 g en invierno y 126,3 g en verano,
mientras que ´Maradol Roja´ acumuló 171,7 g y 111,6 g en
iguales periodos de siembra. Esto confirmó que el potencial genético
de las plantas y las condiciones ambientales afectan la velocidad del crecimiento
vegetal. Este resultado coincidió con otros autores quienes señalaron
que la temperatura es uno de los factores físicos de mayor importancia
que influye directamente en el crecimiento y longitud de la planta durante su
ciclo vegetativo (28).
La producción de masa seca total es el resultado de la eficiencia del
follaje del cultivo en la intercepción y utilización de la radiación
solar disponible durante el ciclo de crecimiento (29). Sin embargo, esta eficiencia
puede estar influenciada por la cantidad de radiación solar, la habilidad
de las hojas para fotosintetizar, el índice de área foliar, la
arquitectura de la planta, la respiración, entre otros, lo que se resume
en factores internos de crecimiento relacionados con el genotipo y factores
externos relacionados con el ambiente y las prácticas de manejo utilizadas
durante el ciclo (30, 31).
En contraste con la masa seca, el área foliar en la floración
y fructificación, además de la diferencia entre periodos de siembra,
mostró diferencias entre genotipos en los dos periodos, lo cual indicó
mayor intercepción de la radiación solar en el genotipo silvestre.
Un incremento del área foliar, también aumenta la masa seca, pero
solo hasta el punto donde se encuentre el índice de área foliar
óptimo (32).
Los resultados referidos revelaron que las hojas del genotipo silvestre y del
cultivar `Maradol Roja´ pudieran ser de formas diferentes. También
cabe la posibilidad de que el limbo del cultivar comercial sea más grueso
que el del genotipo silvestre, de modo que influye más en la masa seca
que en el área foliar. Esto estaría dado por estar el cultivar
comercial adaptado al riego abundante, mientras el genotipo silvestre tiende
a acumular menos agua en sus hojas al no disponer de riego en sus áreas
naturales, lo que se pudiera ver reflejado en el menor grosor del limbo. Las
diferencias en el área foliar entre invierno y verano en la floración
y fructificación, se debieron a que en invierno las plantas acumularon
más hojas que en verano, al necesitar más tiempo para florecer,
producto de la precocidad en la floración en verano respecto al inviernoG.
Tasa del crecimiento relativo (TCR)
El índice TCR se muestra en la Figura
2. Se apreció similar comportamiento entre los genotipos en los dos
periodos y diferentes momentos de evaluación. La tendencia de la TCR
fue ascendente durante la fase de vivero, con valores entre 0,2030 gg-1d-1
y 0,2306 gg-1d-1 al trasplante en `Maradol Roja´
y en el genotipo silvestre, respectivamente. Este resultado fue producto del
aumento en la masa seca foliar en este período, pues la TCR depende de
la masa seca en el tiempo, equivalente a la actividad de la demanda (33). Valores
inferiores a estos fueron obtenidos en plantas evaluadas en la etapa de vivero
en los cultivares `Maradol Roja´ y `Tainung-1´ (34).
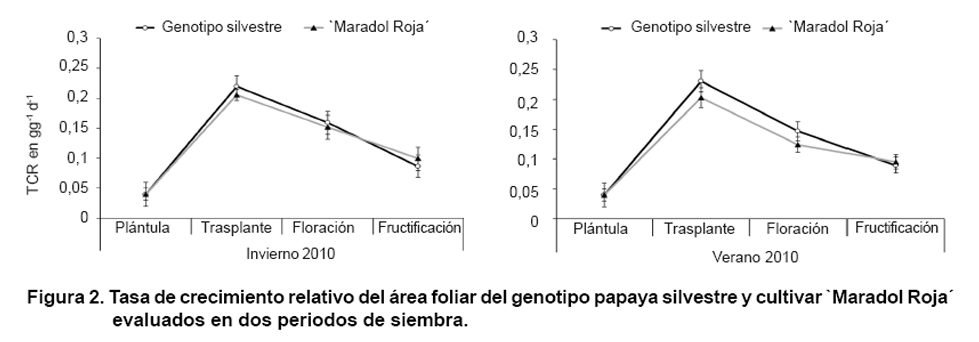
Luego del trasplante se produjo un retardo o disminución en la velocidad
del crecimiento abrupto hasta la floración. El mismo continuó
de forma menos acelerada durante la antesis, con los valores más bajos
en la fructificación, donde se encontró 0,0896 gg-1d-1
y 0,0950 gg-1d-1 en invierno-2010, mientras en verano-2010
se obtuvo 0,0871 gg-1d-1 y 0,0990 gg-1d-1en
papaya silvestre y `Maradol Roja´, respectivamente. Esto se debió
a que al incrementarse la masa seca, la respiración de mantenimiento
(Rm) se hizo mayor que en la etapa anterior y por tanto disminuyó la
TCR.
Los resultados mostrados en la Figura
2 se atribuyen, en primer lugar, a que los momentos de evaluación
no se realizaron con similar frecuencia de tiempo, de modo que existió
mayor diferencia en días entre la evaluación realizada desde el
trasplante hasta la floración. Precisamente esta etapa coincidió
con la recuperación de las plantas luego del estrés sufrido al
trasplante en el periodo seco.
La tendencia decreciente de la TCR coincidió con la obtenida en estudios
realizados en uchuva (Physalis peruviana), con lo cual se concluyó
que la TCR es un parámetro de crecimiento muy sensible a las condiciones
climáticas donde se desarrolló el cultivo (35). Un aspecto importante
a tener en cuenta, es que en la fase fenológica de desarrollo de la planta,
los órganos reproductivos son más activos y demandan mayor cantidad
de biomasa, lo cual influyó desfavorablemente en el ritmo de crecimiento
de las nuevas hojas y del tallo.
Esto corrobora lo señalado acerca de la correlación existente
entre el proceso de crecimiento y desarrollo de diversas partes de la planta
(25). Cuanto más activo es el crecimiento de una parte de la planta,
más demandará materiales disponibles y tanto más se restringirá
el crecimiento en otras partes.
El incremento en la masa seca total de la planta en función del tiempo
en cada intervalo analizado, estuvo en correspondencia con la TRC en ambos genotipos,
lo cual reveló la eficiencia de las mismas como productor de nuevo material,
en dependencia de la fotosíntesis total y de la respiración.
Tasa de asimilación neta (TAN)
En la tasa de asimilación neta (TAN) mostrada en la Figura
3, se encontró similar comportamiento a los análisis de la
TCR. No se apreció diferencias entre el genotipo silvestre y el cv `Maradol
Roja´ en los diferentes momentos de evaluación, lo que indicó
que la eficiencia fotosintética fue similar en ambos genotipos.

La eficiencia de las plantas como sistema asimilatorio se observó durante
la fase de vivero, con tendencia ascendente hasta el trasplante, lo que reveló
mayor eficiencia fotosintética promedio al aumentar la ganancia de masa
seca por unidad de tejido asimilatorio y por unidad de tiempo, como fue previamente
planteado (25).
La TAN disminuyó en el tiempo en ambos genotipos hasta la fructificación,
debido a que la eficiencia de absorción de radiación tiende a
disminuir conforme la planta aumenta el área foliar y en general el tamaño.
Por tanto, la arquitectura del follaje en la absorción de radiación
y en el subsiguiente crecimiento vegetal será cada vez más relevante,
porque a medida que una planta crece y emite mayor número de hojas, aumenta
el autosombreado entre ellas. Esto crea un ambiente lumínico muy heterogéneo
entre las unidades del follaje que genera a su vez, una gran variabilidad en
el rendimiento fotosintético de las distintas hojas individuales (36).
En consecuencia, la relación entre crecimiento y área foliar será
menos directa para las plantas más grandes y con follajes más
complejos, respecto a la comúnmente observada en los estudios con plantas
pequeñas. En cultivares de papaya se demostró que para el desarrollo
de las plantas en el vivero, el efecto de la intensidad de luz, la temperatura
y en parte el autosombreamiento foliar permitieron explicar el 40 % de las diferencias
obtenidas en la eficiencia fotosintética de las plantas (37).
Índice del área foliar (IAF)
Los resultados del IAF se muestran en la Figura
4. Se apreció que en ambos genotipos el comportamiento en los dos
periodos y momentos de evaluación fue similar. `Maradol Roja´ alcanzó
valores extremos entre 2,11 en las plantas al trasplante en invierno y 2,60
en la fructificación del verano.
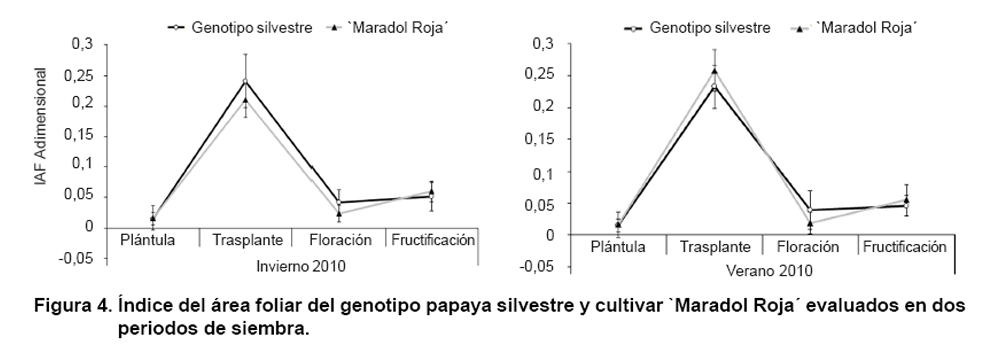
La pronunciada ascendencia del IAF al trasplante fue provocada por el rápido
crecimiento de las plantas en corto tiempo en la fase de vivero. Además,
el área de suelo en las bolsas es muy reducida con relación al
área foliar, que en la papaya presenta hojas de mayores dimensiones en
correspondencia con su altura.
La acumulación de asimilados responde de manera directa a la expansión
y duración del área foliar, por lo que al incrementarse esta,
la respiración de mantenimiento (Rm) se incrementa, de modo que se necesita
más eficiencia del sistema fotosintético y de la raíz para
enviar los fotoasimilados y nutrientes hacia los vertederos (34).
Sin embargo, luego del trasplante y con un marco de plantación más
amplio, se incrementó la masa seca foliar y el área foliar. Esto
evidenció mayor correspondencia entre el área foliar y el área
de suelo con influencia en la reducción del IAF en la floración
con relación al trasplante, con valores entre 0,19 en verano para `Maradol
Roja´ y 0,41 en invierno para el genotipo silvestre.
Desde la floración y durante la antesis y fructificación, el IAF
tendió a incrementarse ligeramente. Se corroboró así, lo
señalado acerca de que la expansión y duración del área
foliar es lenta durante los primeros estadios, para luego aumentar durante los
períodos de antesis y desarrollo del fruto (38). El desarrollo foliar
favorece la radiación solar, que es uno de los factores clave para las
plantas por su implicación en el proceso fotosintético, de modo
que diferencias en la capacidad de absorción de luz pueden determinar
también importantes diferencias en crecimiento y reproducción
(39).
Tasa de crecimiento del cultivo (TCC)
La TCC (Figura 5) fue
ascendente hasta el trasplante en ambos genotipos, debido al crecimiento activado
de las plantas en esta fase; sin embargo, no se apreciaron diferencias entre
periodos de siembra. Este resultado contrasta con los obtenidos en evaluaciones
realizadas a genotipos de papayas (40). Estos autores encontraron tasas de crecimiento
muy lentas desde mediados de noviembre hasta marzo, cuando las temperaturas
son más bajas, para luego ocurrir un crecimiento acelerado cuando las
temperaturas aumentaron.
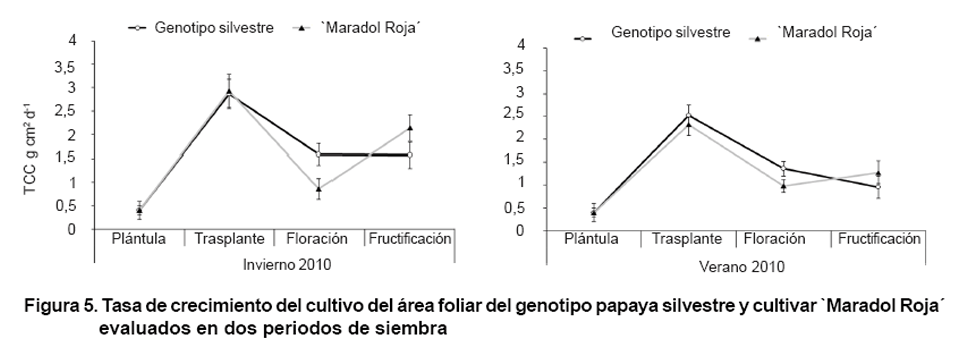
A pesar de la mayor masa seca y área foliar apreciada desde el trasplante
hasta la floración (Tabla
I), la TCC fue inferior en este periodo respecto a la fase de vivero. No
obstante, en la fase de floración de ambos periodos de siembra, el genotipo
silvestre superó a `Maradol Roja´. Esto confirmó en el genotipo
silvestre mayor ganancia de biomasa vegetal por área de superficie ocupada
por la planta en esta etapa. Este aspecto es importante, pues en las hojas se
sintetizan los carbohidratos que van a repartirse entre los diferentes órganos
(14), lo cual permite mayor tasa de crecimiento vegetativo que influye en el
aumento de rendimiento del cultivo.
Después de la floración y hasta la fructificación, la velocidad
del crecimiento en la TCC fue menos pronunciada en el genotipo silvestre, mientras
que en `Maradol Roja´ tendió a incrementarse; sin embargo, en la
fase de fructificación no se apreciaron diferencias entre los genotipos
en los respectivos periodos de siembra.
En condiciones naturales, el genotipo de papaya silvestre depende del clima,
por lo que el crecimiento es altamente dependiente de la radiación que
el follaje pueda interceptar y de la eficiencia de conversión de ésta
en materia seca, que a su vez depende de los recursos disponibles y del genotipo.
En este genotipo, el crecimiento acelerado en las primeras etapas permite interceptar
los rayos solares y cubrir mayor área de sombreo en el suelo. Se disminuye
así la perdida de agua por evaporación y controla las plantas
en la competencia por el hábitat.
CONCLUSIONES
El análisis
computarizado de las imágenes de hojas obtenidas con la cámara
digital permitió determinar en forma simple, rápida y económica
el área de hojas en la especie Carica papaya L. Las diferencias
encontradas en el área foliar entre los genotipos evaluados y TCC en
la fase de floración, son debido a la expresión genética
de los mismos. Si bien el fenotipo estuvo influenciado por el periodo de siembra,
el componente genético fue determinante en el comportamiento de ambos,
como pudo evidenciarse en los resultados. La mayor producción de área
foliar del genotipo silvestre y similar comportamiento en la masa seca y resto
de los indicadores evaluados, refleja la disponibilidad de recursos durante
toda la fase de crecimiento, lo cual se asocia con su rendimiento. Se evidenció
la adaptación del genotipo silvestre a las condiciones ex situ
y la posibilidad de su recomendación para los trabajos de mejoramiento
en la búsqueda de nuevos cultivares más productivos.
BIBLIOGRAFÍA
1. Colectivo de
Autores INIVIT Instructivo técnico del cultivo de la fruta bomba
[en línea], edit. Asociación Cubana de Técnicos Agrícolas
y Forestales, 2010, ISBN 978-959-7210-11-5, [Consultado: 21 de agosto de 2015],
Disponible en: <http://www.libreroonline.com/cuba/libros/172/colectivo-de-autores-inivit/instructivo-tecnico-del-cultivo-de-la-fruta-bomba.html>.
2. Maselli, A.; Rosales, L.C.; Guevara, Y. y Suárez H, Z. ‘‘REACTION
OF THE GENERA Carica AND Vasconcellea MATERIALS TO Erwinia papayae, Meloidogyne
incognita AND Rotylenchulus reniformis’’, Revista de Protección Vegetal,
vol. 25, no. 3, diciembre de 2010, pp. 157-165, ISSN 1010-2752.
3. Cruz, M. y Portal, O. ‘‘Estrategias para la obtención de plantas transgénicas
de papaya con resistencia al virus de la mancha anular de la papaya (PRSV)’’,
Biotecnología vegetal, vol. 10, no. 4, 2010, pp. 195-207, ISSN
1609-1841.
4. González, J.E.; González, R.E. y Veliz, E. ‘‘Morfofisiología
de posturas de papaya irrigadas con tres calidades diferentes de agua’’, Centro
Agrícola, vol. 39, no. 4, 2012, pp. 31-37, ISSN 0253-5785.
5. Alonso Esquivel, M.; Tornet Quintana, Y.; Ramos Ramírez, R.; Farrés
Armenteros, E.; Aranguren González, M. y Rodríguez Martínez,
D. ‘‘Caracterización y evaluación de dos híbridos de papaya
en Cuba’’, Agricultura técnica en México, vol. 34, no.
3, septiembre de 2008, pp. 333-339, ISSN 0568-2517.
6. Rodríguez Cabello, J.; Díaz Hernández, Y.; Pérez
González, A.; Natali Cruz, Z. y Rodríguez Hernández, P.
‘‘Evaluación de la calidad y el rendimiento en papaya silvestre (Carica
papaya L.) de Cuba’’, Cultivos Tropicales, vol. 35, no. 3, septiembre
de 2014, pp. 36-44, ISSN 0258-5936.
7. Rodríguez, J.; Rodríguez, P.; González, M.E. y Martínez-Gómez,
P. ‘‘Molecular characterization of Cuban endemism Carica cubensis Solms using
random amplified polymorphic DNA (RAPD) markers’’, Agricultural Sciences,
vol. 01, no. 03, 2010, pp. 95-101, ISSN 2156-8553, 2156-8561, DOI 10.4236/as.2010.13012.
8. Díaz Hernández, Y.; Torres de la Noval, W.; Rodríguez
Cabello, J. y Rodríguez Hernández, P. ‘‘Respuesta de plantas de
papaya silvestre (Carica cubensis Solms) al estrés hídrico y su
recuperación: aspectos fisiológicos y del crecimiento’’, Cultivos
Tropicales, vol. 35, no. 3, septiembre de 2014, pp. 55-61, ISSN 0258-5936.
9. Rojas, T.V.; Soto, C.M. y Montero, W.R. ‘‘Análisis del crecimiento
de cinco híbridos de zanahoria ( Daucus carota l.) mediante la metodología
del análisis funcional’’, Agronomía Costarricense, vol.
36, no. 2, 2012, ISSN 2215-2202, [Consultado: 21 de agosto de 2015], Disponible
en: <http://revistas.ucr.ac.cr/index.php/agrocost/article/view/9819>.
10. Hernández Córdova, N. y Soto Carreño, F. ‘‘Determinación
de índices de eficiencia en los cultivos de maíz y sorgo establecidos
en diferentes fechas de siembra y su influencia sobre el rendimiento’’, Cultivos
Tropicales, vol. 34, no. 2, junio de 2013, pp. 24-29, ISSN 0258-5936.
11. Maqueira, L.A.; Pérez, S.A. y Torres, W. ‘‘Crecimiento y productividad
de variedades de arroz de diferentes ciclos en dos fechas de siembra en la época
de frío en Los Palacios, Pinar del Río’’, Cultivos Tropicales,
vol. 31, no. 4, diciembre de 2010, pp. 00-00, ISSN 0258-5936.
12. Hernández Córdova, N. y Soto Carreño, F. ‘‘Influencia
de tres fechas de siembra en el crecimiento y rendimiento de especies de cereales
cultivadas en condiciones tropicales. Parte II. Cultivo del sorgo (Sorghum
bicolor I. Moench var. Isiap Dorado)’’, Cultivos Tropicales, vol. 33, no.
2, junio de 2012, pp. 50-54, ISSN 0258-5936.
13. Hernández Córdova, N. y Soto Carreño, F. ‘‘Influencia
de tres fechas de siembra sobre el crecimiento y rendimiento de especies de
cereales cultivados en condiciones tropicales. Parte I. Cultivo del maíz
(Zea mayz L.)’’, Cultivos Tropicales, vol. 33, no. 2, junio
de 2012, pp. 44-49, ISSN 0258-5936.
14. Cuéllar, N.D. y Arrieta, J.M. ‘‘Evaluación de respuestas fisiológicas
de la planta arbórea Hibiscus rosasinensis L.(Cayeno) en condiciones
de campo y vivero’’, Revista Corpoica (Colombia), vol. 11, no. 1, 2010,
pp. 61–72, ISSN 0122-8706.
15. Sedano-Castro, G.; González-Hernández, V.A.; Engleman, E.M.
y Villanueva-Verduzco, C. ‘‘Dinámica del crecimiento y eficiencia fisiológica
de la planta de calabacita’’, Revista Chapingo Serie Horticultura,
vol. 11, no. 2, 2005, pp. 291–297, ISSN 1027-152X.
16. Cardona Ayala, C.; Araméndiz Tatis, H. y Barrera Causil, C. ‘‘Estimación
del área foliar de papaya (Carica papaya L.) basada en muestreo
no destructivo’’, Revista U.D.C.A Actualidad & Divulgación
Científica, vol. 12, no. 1, junio de 2009, pp. 131-139, ISSN 0123-4226.
17. Fiallos, F.R.G. y Forcelini, C.A. ‘‘Peso de hojas como herramienta para
estimar el área foliar en soya’’, Revista Ciencia y Tecnología,
vol. 4, no. 1, 2011, pp. 13–18, ISSN 1850-0870.
18. Jerez Mompie, E.; Martín Martín, R. y Díaz Hernández,
Y. ‘‘Estimación de la superficie foliar en dos variedades de papa (Solanum
tuberosum L.) por métodos no destructivos’’, Cultivos Tropicales,
vol. 35, no. 1, marzo de 2014, pp. 57-61, ISSN 0258-5936.
19. Kolukisaoglu, Ü. y Thurow, K. ‘‘Future and frontiers of automated screening
in plant sciences’’, Plant Science, vol. 178, no. 6, junio de 2010,
pp. 476-484, ISSN 0168-9452, DOI 10.1016/j.plantsci.2010.03.006.
20. Guerrero, N.R.; Quintero, M.A.O. y Naranjo, J.C.P. ‘‘Determinación
del área foliar en fotografías tomadas con una cámara web,
un teléfono celular o una cámara semiprofesional’’, Revista
Facultad Nacional de Agronomía Medellín, vol. 65, no. 1,
2012, pp. 6399–6405, ISSN 0304-2847.
21. Aportela, D. y Castro Ladín, L. Fundamentos teóricos prácticos
sobre el cultivo y cosecha de la papaya. Carica papaya (L.) [en
línea], edit. Editorial Universitaria, 2001, ISBN 978-959-16-0111-7,
[Consultado: 21 de agosto de 2015], Disponible en: <http://www.libreroonline.com/cuba/libros/11991/aportela-daysi-castro-ladin-l/fundamentos-teoricos-practicos-sobre-el-cultivo-y-cosecha-de-la-papaya-carica-papaya-l.html>.
22. Baena, M.; Jaramillo, S. y Montoya, J. E. Material de apoyo a la capacitación
en conservación in situ de la diversidad vegetal en áreas protegidas
y en fincas [en línea], Instituto Internacional de Recursos Fitogenéticos,
Cali, Colombia. 2003. 130 pp. ISBN 92-9043-600-X, [Consultado: 21 de agosto
de 2015], Disponible en: <https://www.bioversityinternational.org/fileadmin/_migrated/uploads/tx_news/Material_de_apoyo_a_la_capacitaci%C3%B3n_en_conservaci%C3%B3n_In_Situ_de_la_diversidad_vegetal_en_areas_protegidas_y_en_fincas_905.pdf>
23. Hunt, R. Basic
Growth Analysis [en línea], edit. Springer Netherlands, Dordrecht,
1990, ISBN 978-0-04-445373-4, [Consultado: 21 de agosto de 2015], Disponible
en: <http://link.springer.com/10.1007/978-94-010-9117-6>.
24. IBM SPSS Statistics [en línea], versión 21, [Windows], edit.
IBM Corporation, U.S, 2011, Disponible en: <http://www.ibm.com>.
25. Barraza, F.V.; Fischer, G. y Cardona, C.E. ‘‘Estudio del proceso de crecimiento
del cultivo del tomate (Lycopersicon esculentum Mill.) en el Valle
del Sinú medio, Colombia’’, Agronomía Colombiana, vol.
22, no. 1, 2004, pp. 81–90, ISSN 0120-9965.
26. Palomo, A. y others ‘‘Análisis de crecimiento de variedades de algodón
transgénicas y convencionales’’, Revista Fitotecnia Mexicana,
vol. 24, no. 2, 2003, pp. 197–202, ISSN 0187-7380.
27. Andrade, E.F.; Aguirrezábal, L.A. y Rizzalli, R.H. ‘‘Crecimiento
y rendimientos comparados’’ [en línea], en: Andrade, F.H. y Sadras,
V.O., Bases para el manejo del maíz, el girasol y la soja, edit. Instituto
Nacional de Tecnología Agropecuaria, 2000, pp. 61-96, ISBN 978-987-521-016-5,
[Consultado: 24 de agosto de 2015], Disponible en: <https://books.google.com.cu/books/about/Bases_para_el_manejo_del_ma%C3%ADz_el_giraso.html?id=3FkbAQAAMAAJ&redir_esc=y>.
28. González, N.; Alberto, L.; Ortiz, P.; Ernesto, R.; Andrio Enríquez,
E.; Ibarra, T.; Daniel, A. y Covarrubias Prieto, J. ‘‘Fenología, crecimiento
y sincronía floral de los progenitores del híbrido de maíz
QPM H-374C’’, Revista mexicana de ciencias agrícolas, vol. 2,
no. 4, agosto de 2011, pp. 489-500, ISSN 2007-0934.
29. Santos Castellanos, M.; Segura Abril, M.; López, Ñ. y Eduardo,
C. ‘‘Análisis de crecimiento y relación fuente-demanda de cuatro
variedades de papa (Solanum tuberosum L.) en el municipio de zipaquirá
(Cundinamarca, Colombia)’’, Revista Facultad Nacional de Agronomía,
Medellín, vol. 63, no. 1, junio de 2010, pp. 5253-5266, ISSN 0304-2847.
30. Díaz-López, E.; Morales-Rosales, E.J.; Franco-Mora, O. y Domínguez-López,
A. ‘‘Atenuación de luz, radiación interceptada y rendimiento de
maíz en función del fósforo’’, Terra Latinoamericana,
vol. 29, no. 1, 2011, pp. 65-72, ISSN 2395-8030.
31. Jerez Mompies, E. y Martín Martín, R. ‘‘Comportamiento del
crecimiento y el rendimiento de la variedad de papa (Solanum tuberosum
L.) Spunta’’, Cultivos Tropicales, vol. 33, no. 4, diciembre de 2012,
pp. 53-58, ISSN 0258-5936.
32. Soto, F.; Hernández, N. y Plana, R. ‘‘Influencia de la temperatura
en la duración de las fases fenológicas del trigo harinero (Triticum
aestivum ssp. aestivum) y triticale (X Triticum secale Wittmack)
y su relación con el rendimiento’’, Cultivos Tropicales, vol.
30, no. 3, septiembre de 2009, pp. 32-36, ISSN 0258-5936.
33. Ho, C.; Grange, I. y Shaw, F. ‘‘Source/sink regulation’’, ed. Baker,
D.A., Transport of Photoassimilates, edit. Logman Scientific & Tecnical,
Essex, England, 1989, pp. 306–343.
34. Miranda, D. y Gil, A.I. ‘‘Effect of five substrates on growth indices of
papaya (Carica papaya L.) plants under glasshouse conditions’’, Revista
Colombiana de Ciencias Hortícolas, vol. 1, no. 2, 2007, pp. 142-153,
ISSN 2011-2173.
35. Mazorra, M.F.; Quintana, A.P.; Miranda, D.; Fischer, G. y Cháves,
B. ‘‘Análisis sobre el desarrollo y la madurez fisiológica del
fruto de la uchuva (Physalis peruviana L.) en la zona de Sumapaz (Cundinamarca)’’,
Agronomía Colombiana, vol. 21, no. 3, 2003, pp. 175–189, ISSN
2357-3732.
36. Villar Montero, R.; Ruiz Robleto, J.; Quero Pérez, J.L.; Poorter,
H.; Valladares Ros, F. y Marañón, T. Tasas de crecimiento
en especies leñosas: aspectos funcionales e implicaciones ecológicas
[en línea], edit. España. Ministerio de Medio Ambiente y Medio
Rural y Marino, 2008, ISBN 978-84-8014-738-5, [Consultado: 21 de agosto de 2015],
Disponible en: <http://digital.csic.es/handle/10261/47933>.
37. Baiyeri, K.P. y others ‘‘Seedling emergence and growth of pawpaw (Carica
papaya) grown under different coloured shade polyethylene’’, International
Agrophysics, vol. 20, no. 2, 2006, p. 77, ISSN 0236-8722.
38. Hernández, M.S.; Casas, A.; Martínez, O. y Galvis, J.A. ‘‘Análisis
y estimación de parámetros e índices de crecimiento del
árbol de maraco (Theobroma bicolor H.B.K.) a primera floración’’,
Agronomia Colombiana, vol. 12, no. 1, 1995, pp. 182-191, ISSN 0120-9965.
39. Del Rio, T.; González, P.; Media, S. y Escudero, A. ‘‘Estudio
comparativo de la disposición de las hojas y su eficiencia en la captura
de la luz en la copa de tres especies arbóreas mediterráneas’’,
6o Congreso Forestal Español, edit. Sociedad Española de Ciencias
Forestales, España, 2013, ISBN 978-84-937964-9-5.
40. García, E.V.; Avendaño, E.E.R. y Flores, R.A. ‘‘Fenología
y unidades calor de genotipos de papayo en el sur de tamaulipas, México’’,
Revista Fitotecnia Mexicana, vol. 31, no. 3, 2008, pp. 45–48, ISSN
0187-7380.
Recibido: 21 de noviembre
de 2014
Aceptado: 24 de marzo de 2015
Ms.C. Jesús
Rodríguez Cabello, Instituto Nacional de Ciencias Agrícolas
(INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32
700. Email: jesus@inca.edu.cu





