Evaluación
de indicadores que caracterizan la acción protectora del quitosano en
Nicotiana tabacum L. vs Phytophthora nicotianae Breda de Haan
Evaluation
of indicators characterizing the protective action of chitosan in tobacco (Nicotiana
tabacum L.) vs Phytophthora nicotianae Breda de Haan
Ms.C.
Dianevys González-Peña Fundora, Ms.C. Daimy Costales Menéndez,
Dr.C. Alejandro Falcón Rodríguez
Instituto Nacional
de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las
Lajas, Mayabeque, Cuba, CP 32700.
RESUMEN
El quitosano es
un polímero de glucosamina con importantes propiedades como compuesto
antimicrobiano e inductor de respuestas defensivas en plantas, el cual emerge
como una alternativa ecológica al empleo de pesticidas. El objetivo del
presente trabajo fue evaluar el efecto que ejerce este polímero en el
crecimiento y la esporulación de un aislado de Phytophthora nicotianae
Breda de Haan, así como en la actividad glucanasa en plantas de tabaco
(Nicotiana tabacum L.) infectadas con el patógeno. Para ello
se inoculó un disco con micelio de
P. nicotianae en placas Petri con medio de cultivo PDA-V8 y diferentes
concentraciones de quitosano. La inhibición del crecimiento del micelio
estuvo marcada por el tipo de ácido disolvente y las concentraciones
empleadas. Se observó una relación directa entre el efecto inhibitorio
y los niveles del polímero en el medio de cultivo. Además, disminuyó
la esporulación de P. nicotianae al adicionar hasta 3,0 g L-1
y hubo un efecto biostático del crecimiento de la colonia, pero no biocida.
Por otra parte, las plantas de tabaco de 30 días de sembradas, tratadas
con quitosano o inoculadas con el aislado SS-11 a través de la raíz,
variaron la concentración de proteínas y la actividad glucanasa
en el tiempo. También se alcanzó un 26 % de protección
vegetal al aplicar 0,5 g L-1 del polímero a plantas de tabaco. Los resultados
muestran el efecto del quitosano como inhibidor del desarrollo de P. nicotianae,
así como su potencialidad para incrementar la actividad glucanasa y la
protección del cultivo ante la presencia de este patógeno.
Palabras
clave: glucosamina, oomycete, glucanasa, tabaco, priming.
ABSTRACT
Chitosan is a
glucosamine polymer with significant properties as antimicrobial compound and
elicitor of defense response on plants, which emerges as an ecological alternative
to pesticides uses. The aim of the research was to evaluate the effect of this
polymer on the growth and sporulation of an isolate of Phytophthora nicotianae
Breda de Haan; as well as in the glucanase activity on tobacco (Nicotiana
tabacum L.) plants infected with the pathogen. For this purposes, a disc
with P. nicotianae mycelium was placed in Petri dishes with PDA-V8
culture medium and different chitosan concentrations. The inhibition of the
mycelium growth was determined by the chitosan dissolvent and the concentrations
used. A direct relationship between the inhibitory effect and the levels of
the polymer in the culture medium was observed. In addition, P. nicotianae
sporulation decreased when added up to 3,0 g L-1 and there was a biostatic effect
in the colony, but not biocide. In the other hand, tobacco plants of 30 days
old, treated with chitosan and/or inoculated through the root with the SS-11
isolate, changed their protein concentration and glucanase activity over time.
Moreover, a 26 % of plant protection was observed when 0,5 g L-1 of the polymer
was applied to tobacco plants. The results show the effect of the chitosan as
inhibitor of P. nicotianae development and it’s potential to increase
glucanase activity and crop protection against this pathogen.
Key words:
glucosamine, oomycete, glucanase, tobacco, priming.
INTRODUCCIÓN
El cultivo de
tabaco (Nicotiana tabacum L.) a nivel de semillero es severamente afectado
por la enfermedad conocida como pata prieta, causada por el patógeno
Phytophthora nicotianae Breda de Haan (1896). Esta se caracteriza por
un necrosamiento de la región basal del tallo que avanza a todas las
partes de la planta y provoca su muerte (1). En Cuba se combate con técnicas
de manejo integrado, la selección de variedades de tabaco menos susceptibles
y la aplicación de productos biológicos y químicos (2).
No obstante, la incidencia de la enfermedad persiste, por lo que es necesario
buscar nuevas alternativas al empleo de pesticidas, que en su mayoría
constituyen contaminantes del ecosistema.
En este marco emerge el quitosano, un polisacárido de D-glucosamina,
parcialmente acetilado, con enlaces ß-1,4, que se obtiene en cantidades
industriales a través de la desacetilación básica de la
quitina que forma parte del exoesqueleto de los crustáceos. Su carácter
policatiónico le confiere importantes propiedades antimicrobianas e inductoras
de respuestas defensivas en plantas, las que varían en dependencia del
grado de acetilación, polimerización y del pH (3, 4, 5). Aunque
en la mayoría de las investigaciones se emplea el ácido acético
como disolvente, algunos autores han demostrado que la utilización de
otros ácidos como el ascórbico, clorhídrico y el láctico,
etc., pudieran influir en las potencialidades de uso del polímero (6,
7).
Varios estudios muestran que el quitosano inhibe el crecimiento y la formación
de estructuras vegetativas y reproductivas de algunos microorganismos patógenos
de plantas y animales, a través de la desestabilización de las
paredes y membranas celulares, induciendo la lisis celular; sin embargo, no
afecta de igual manera a todos los organismos, aunque el mecanismo de acción
no está completamente dilucidado (4, 8, 9, 10).
Algunos autores plantean además, que este compuesto puede inducir un
estado de priming que le permite a la planta responder con mayor velocidad
a la futura presencia de un estrés (11, 12). A su vez, se ha comprobado
una mayor actividad de proteínas relacionadas con la patogénesis
(Pathogenesis Related proteins, PRs, por sus siglas en inglés) cuya expresión
disminuye la susceptibilidad de las plantas al ataque de agentes biológicos
(13, 14). Entre las PRs se encuentran glucanasas (PR2), quitinasas (PR3, PR4,
PR8 y PR11) y peroxidasas (PR9), por solo mencionar algunas (15).
Las glucanasas son esenciales en la protección del tabaco contra algunas
de sus principales enfermedades, como el moho azul y la pata prieta, causadas
por Peronospora tabacina y P. nicotianae, respectivamente, si se toma
en cuenta que la enzima degrada polímeros de glucano y ambos microorganismos
presentan este polisacárido en la pared celular (16).
Se ha demostrado que diferentes derivados de quitosano inducen respuestas defensivas
en plantas de tabaco, aún sin estar en contacto con patógenos,
y que estas varían en dependencia del grado de acetilación, peso
molecular, vía y momento de aplicación del compuesto (17); sin
embargo, no ha sido evaluada la respuesta defensiva de la planta a la inoculación
con este microorganismo, ni en combinación con plántulas elicitadas
con quitosano.
A partir de lo anterior el trabajo tiene como objetivo determinar el efecto
del quitosano en el crecimiento y formación de esporas de un aislado
de P. nicotianae, así como evaluar la inducción de actividad
glucanasa y la protección de plantas de tabaco inoculadas con este patógeno.
MATERIALES
Y MÉTODOS
Polímero
de quitosano. Se empleó un polímero de quitosano de masa
molecular 1,35*105 (viscosimetría) y grado de acetilación 12 %
(espectroscopía IR), obtenido mediante desacetilación básica
de quitina de langosta cubana, suministrada por los laboratorios farmacéuticos
Mario Muñoz. Se utilizaron tres ácidos por separado para comparar
su efecto como disolvente, los cuales fueron: láctico, clorhídrico
y acético al 1 %, mientras que en los demás experimentos solo
se utilizó el ácido acético. El pH se ajustó con
KOH a 5,6 en todos los casos.
Cultivo microbiano. Se utilizó un aislado de Phytophthora
nicotianae (Pn) denominado SS-11, raza 0, grupo 1, proveniente del cultivar
Habana 92, procedente del Instituto de Investigaciones del Tabaco (IIT). Para
el cultivo del microorganismo se empleó el medio papa-dextrosa-agar (PDA),
al cual se le adicionó carbonato de calcio (2,0 g L-1), Asparagina
(2,0 g L-1), y V8 (jugo de verduras que contiene: tomate, apio, espinacas,
remolacha, lechuga, perejil, berro y zanahoria) al 20 %, de la línea
comercial Del Frutal (Guatemala). El pH se ajustó a 5,6 con KOH. El medio
de cultivo se esterilizó en autoclave durante 15 minutos y se vertió
en placas Petri de 90 mm de diámetro.
Las placas se inocularon con discos de 10 mm de diámetro con micelio
de SS-11 y se incubaron a 27 °C en condiciones de oscuridad.
Cultivo de plantas de tabaco. Las semillas del cultivar Corojo 99 del
IIT, se sembraron en un sustrato en la proporción 1:1(v/v) de suelo y
turba ácida. Las plantas se mantuvieron en condiciones semicontroladas
a temperatura de 25 °C y en régimen de 16/8 horas de luz/oscuridad.
A los 30 días de germinadas, con aproximadamente 5 cm de altura y un
par de hojas verdaderas desarrolladas, se removieron del sustrato, se lavaron
varias veces con agua destilada y se colocaron en tubos Eppendorf de 2 ml que
contenían 1 ml de solución nutritiva de Hoagland y quitosano a
diferentes concentraciones, en dependencia de los experimentos. Se utilizaron
20 plantas por tratamiento.
Efecto del quitosano en el crecimiento micelial de P. nicotianae. Los
ensayos se realizaron en placas Petri de vidrio (90 mm de diámetro) las
cuales contenían 25 ml de medio de cultivo con diferentes concentraciones
de quitosano. El medio y las soluciones se esterilizaron por separado en autoclave
a 120 °C durante 15 minutos y luego se mezclaron antes de verter. En el
centro de las placas se colocaron discos de 10 mm de diámetro con micelio
de SS-11 de entre siete y nueve días de crecimiento. Las placas se incubaron
a 27 °C en oscuridad. Se realizaron 10 réplicas por tratamiento.
Efecto de los disolventes del quitosano en el crecimiento micelial de P.
nicotianae. El quitosano se disolvió en los ácidos acético,
láctico y clorhídrico al 1 %. Se utilizaron las concentraciones
de 0, 0,5 y 1,0 g L-1 de quitosano, correspondientes a cada disolvente.
Se establecieron controles para cada ácido que se empleó y se
determinó el diámetro de la colonia cuando el control llegó
al borde de la placa.
Los datos se procesaron mediante un diseño bifactorial con descomposición
en los factores ácido disolvente y concentración, cada uno con
tres niveles.
Efecto de la concentración de quitosano en el desarrollo de P. nicotianae.
Los tratamientos consistieron en diferentes concentraciones de quitosano: 0,
0,25, 0,5, 1,0, 1,5, 2,0, 2,5 y 3,0 g L-1 y se determinó el
crecimiento radial de SS-11 cuando las colonias alcanzaron el extremo de las
placas. Se realizó además, un conteo de zoosporas en cámara
de Neubauer. Para ello se adicionó 10 mL de agua destilada por placa
y suavemente se maceró la colonia con espátula de Drygalski, sin
destruir el agar. Las placas se incubaron a 4 °C durante dos horas, seguido
de un choque térmico durante 30 minutos a 37 °C.
Respuestas defensivas en plantas de tabaco
Activación de respuestas defensivas en hojas de tabaco ante la aplicación
de quitosano. Las raíces de las plantas de tabaco se expusieron
a las concentraciones 0,05, 0,5 y 1,0 g L-1 de quitosano, mientras
que los controles se sumergieron en agua a la cual se le ajustó el pH
a 5,6. Transcurridas dos horas, se lavaron y se pusieron en los viales con la
solución nutritiva. A las 72 horas de haber estado en contacto con las
soluciones se hizo la extracción del material vegetal de las hojas para
determinar la concentración de proteínas y la actividad glucanasa.
Dinámica de respuestas defensivas en hojas de plantas de tabaco inoculadas
con P. nicotianae. Las raíces de las plantas de tabaco se expusieron
durante 120 horas a discos de 10 mm de diámetro con micelio de SS-11
que se colocaron en los viales con solución nutritiva. Los controles
se mantuvieron en igualdad de condiciones, excepto que no entraron en contacto
con el patógeno. La extracción del material vegetal para evaluar
la concentración de proteínas y la actividad glucanasa se realizó
a las 24, 48, 72 y 120 horas de haber entrado en contacto con el patógeno.
Respuesta defensiva en hojas de plántulas de tabaco inoculadas con
P. nicotianae y previamente tratadas con quitosano. Las plantas de tabaco
se expusieron durante dos horas a 1,0 g L-1 de quitosano, mientras
que los controles se mantuvieron en agua destilada este tiempo. Las plantas
se lavaron y excepto las que luego constituyeron el control positivo, las demás
se colocaron en contacto con el microorganismo. La determinación de proteínas
y la actividad glucanasa se realizó a los extractos que se obtuvieron
del material vegetal a las 48 y 96 horas de interactuar las plantas con el patógeno.
Extracción del material vegetal. La extracción del material
vegetal se realizó a razón de 1 g de foliolo/1,2 mL de buffer
de extracción (Ac-Na+ 0,05M, pH 5,2 + NaCl 1M + EDTA 0,005M+ Mercaptoetanol
0,005M), al macerar en morteros de porcelana el primer par de hojas verdaderas.
El extracto se centrifugó durante 15 minutos a 5000 rpm a 5 °C, se
desechó el pellet y el sobrenadante volvió a centrifugarse a 12000
rpm por 10 minutos. El sobrenadante se colectó y conservó a -20
°C hasta hacer las determinaciones proteicas y enzimáticas.
Determinación de proteínas y actividades enzimáticas.
El contenido de proteínas se determinó mediante la metodología
micro- Lowry, descrita por SunA , con el empleo de una curva patrón
de BSA y se expresó como mg de proteína por gramo de tejido vegetal
fresco.
La actividad ß-1,3 glucanasa se evaluó de acuerdo a la metodología
descrita por Falcón (18) y se cuantificó la liberación
de azúcares reductores de laminarina (Sigma) como sustrato, por acción
de las enzimas del extracto. El total de azúcares reductores se determinó
por el método colorimétrico de Somogyi (19) y los resultados se
expresaron como actividad específica (UAE min-1 mg proteína-1),
definiéndose una unidad de actividad enzimática como la liberación
de un microgramo de glucosa equivalente por minuto por mg de proteína.
Para esto se empleó una curva patrón de glucosa a 520 nm.
Protección de plantas de tabaco contra P. nicotianae tratadas con
quitosano. Las raíces de las plantas de tabaco se sumergieron en
agua (pH-5,6), 0,05 g L-1 y 0,5 g L-1 de quitosano durante
dos horas y luego de ser lavadas con agua destilada, se colocaron en viales
con 1 mL de solución nutritiva. A las 16 horas, las plantas entraron
en contacto con discos de 10mm de diámetro de micelio de SS-11. El grado
de infección se evaluó a las 72 horas de exposición al
patógeno, para lo cual se utilizó una modificación de la
escala de infección empleada por Falcón (17) (Tabla
I).

Tabla I. Escala de infección
de P. nicotianae en las plantas de tabaco.
Los datos
de la escala de infección se usaron para calcular el índice de
infección de cada tratamiento según la fórmula I.I. = [(grado
de infección x de observaciones)/N x 5] x 100, donde N es el número
total de plantas en el tratamiento y 5 es el máximo grado de afectación
en la escala de invasión. A partir del índice de infección
se calculó también el porcentaje de protección en los tratamientos
con relación al control.
Análisis estadístico
Los resultados se procesaron estadísticamente mediante un ANOVA bifactorial
para evaluar el efecto de los disolventes de la quitosana en el crecimiento
de las colonias de P. nicotianae y un ANOVA simple para los demás
ensayos antimicrobianos. También se emplearon los intervalos de confianza
en los ensayos con plantas y las medias se compararon mediante la prueba de
Tukey para p<0,05. Los datos del ensayo de protección se procesaron
mediante la prueba no paramétrica de Kruskal Wallis, y de Mann-Whitney
de comparación de medias para p<0,05. Se empleó el paquete
estadístico SPSS 11.5 versión para Windows (20).
RESULTADOS
Y DISCUSIÓN
El crecimiento
del aislado SS-11 de P. nicotianae en medio de cultivo se afectó
por la presencia de quitosano. El análisis bifactorial reflejó
que existe interacción significativa entre el ácido disolvente
y la concentración utilizada. La mayor inhibición del patógeno
se obtuvo con los ácidos acético y láctico (4,47 y 4,28
cm de crecimiento, respectivamente) sin diferencias entre ellos a 1,0 g L-1.
Con el empleo de 0,5 g L-1 el acético resultó ser más
efectivo en la contención del desarrollo del microorganismo, razón
por la cual se continuó empleando como disolvente en los demás
ensayos.
Los experimentos demostraron que la influencia de la concentración de
quitosano y la acción sinérgica con el ácido empleado como
disolvente, resulta significativa en la inhibición del microorganismo
(Figura 1). Resultados
similares obtuvieron Romannazi et al., (6) al comprar el efecto de
varios disolventes donde se obtuvo que el acético permitió mayor
inhibiciön que otros como el clorhídrico, el L-ascórbico,
fórmico, L-glutámico, láctico, maleico, málico,
y succínico. La actividad antifúngica del quitosano debe entonces
ser cuidadosamente comparada si se tiene en cuenta que sus potencialidades varían
en dependencia del ácido en que se disuelva, entre otros factores.
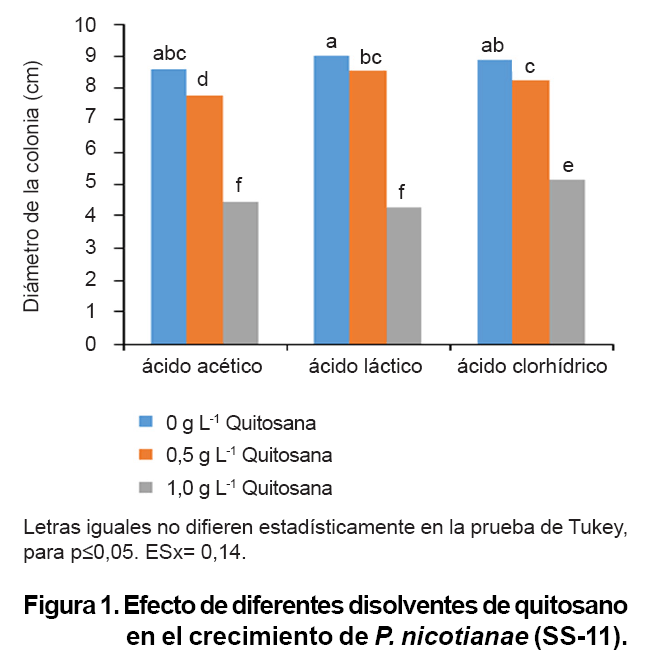
Efecto
de la concentración de quitosano en el desarrollo de P. nicotianae.
Durante el desarrollo de la colonia de P. nicotianae en presencia de
quitosano se observó que el primer tratamiento en alcanzar el extremo
de la placa fue el equivalente a la menor concentración (0,5 g L-1),
seguida del control positivo (Figura
2A). Los valores de crecimiento disminuyeron a medida que aumentaron las
concentraciones de quitosano. Entre todos los tratamientos hubo diferencias
significativas y la concentración de 3,0 g L-1 fue la que
inhibió por completo el crecimiento de
SS-11; sin embargo, al trasladarse los discos no crecidos a medio fresco sin
quitosano el microorganismo desarrolló una nueva colonia con lo cual
se corroboró el efecto biostático del polímero, pero no
biocida.
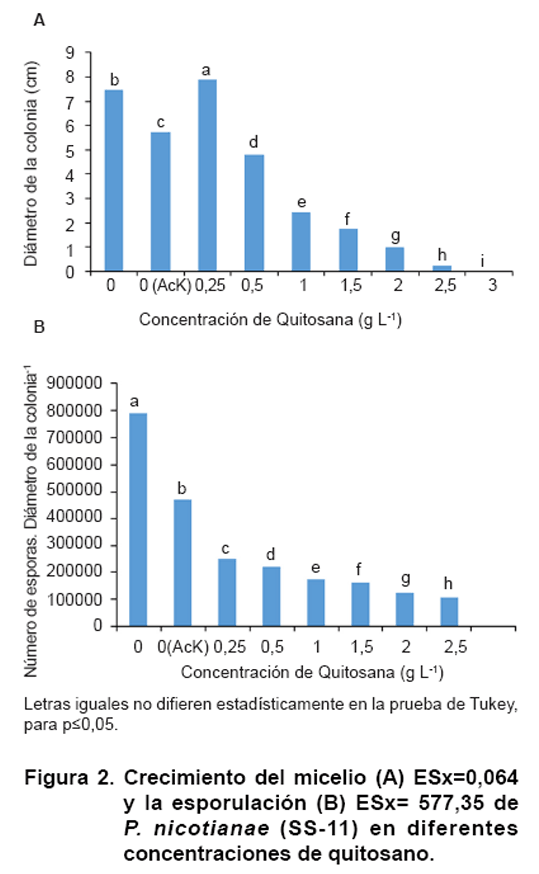
El número de zoosporas por diámetro de la colonia disminuyó
escalonadamente con el incremento de los niveles de quitosano, observándose
diferencias significativas entre todos los tratamientos. El menor valor se obtuvo
con la mayor concentración del polímero 2,5 g L-1 (1.1*105
esporas mL).
La actividad antimicrobiana del quitosano se informa contra una amplia variedad
de microorganismos y se plantea que la concentración mínima necesaria
para inhibir el crecimiento varía en dependencia de numerosos factores,
tales como: grado de acetilación, polimerización, pH de la solución
y organismo diana, entre otros (3, 10, 21).
Los resultados de este trabajo muestran que en presencia de 3,0 g L-1
de quitosano se inhibe significativamente el crecimiento del aislado SS-11 de
P. nicotianae, a diferencia de otros autores que han logrado similar
disminución del crecimiento de aislados de esta especie con una concentración
menor (22), lo que muestra la importancia del organismo diana en la evaluación
de las propiedades de este polímero (3). Esta concentración no
ejerce una acción biocida, lo cual se comprobó al pasar el disco
con micelio al medio PDA-V8 donde se formó una nueva colonia. Las diferencias
existentes con el trabajo de Falcón (22), donde 2,0 g L-1
de quitosano inhibió por completo el crecimiento de un aislado de P.
nicotianae, puede deberse al empleo de aislados diferentes aun cuando sea
la misma especie y la utilización de distintos de medios de cultivo.
El medio
PDA suplementado con jugo V8 empleado en este trabajo permitió al microorganismo
un mayor desarrollo y puede inducir una activación superior de enzimas
para la degradación de sustratos y la absorción de nutrientes
del medio. Debido a esto, la inhibición del crecimiento de SS-11 pudiera
necesitar una concentración mayor del polímero, comparado con
otros aislados de la misma especie.
Se han observado diferencias en el crecimiento de aislados de diversos hongos
y oomycetes cuando se colocaron en diferentes medios de cultivo con quitosano
(23). En tal caso, el crecimiento en PDA fue superior al crecimiento en el medio
agar agua, a la vez que la inhibición fue superior en este último,
donde se observaba un micelio aéreo menos denso. En la mayoría
de los casos coincidió la disminución del diámetro de la
colonia con el aumento de las concentraciones de quitosano desde 0,5 g L-1
hasta 2 g L-1, en especial para Pythium ultimum Trow y Fusarium
oxysporum Schltdl., aunque para Pochonia rubescens Zare, W. Gams &
López-Llorca y Beauveria bassiana (Bals.-Criv.) Vuill. se observó
un incremento del micelio, mostrando que el organismo diana es un factor determinante
a la hora de evaluar el efecto de este polímero sobre el desarrollo microbiano.
Otros autores han evaluado el crecimiento de diferentes microorganismos y observaron
también inhibición de su desarrollo, aunque con concentraciones
diferentes de quitosano, que oscilan desde 0,01 mg L-1 hasta 5 g
L-1, como muestran varias revisiones en la temática (3, 21,
24).
Una respuesta interesante que se obtuvo fue el hecho de que a la menor concentración
empleada (0,25 g L-1) el crecimiento superó al control (Figura
2A). Lo anterior puede deberse a que ante un estrés, como puede ser
la presencia de quitosano, el microorganismo dirige su metabolismo a tratar
de perpetuar la especie y acelera su crecimiento; sin embargo, cuando estas
concentraciones son elevadas el daño celular puede ser mayor o el microorganismo
pudiera detectar estos cambios como un ambiente muy adverso y a la vez, redirigir
su metabolismo hacia un enlentecimiento hasta alcanzar un nuevo entorno con
mejores condiciones.
Un comportamiento similar fue informado en investigaciones anteriores en el
crecimiento de Fusarium dimerium cuando se emplearon concentraciones entre 500
y 2000 ppm de quitosano y en la esporulación de Alternaria alternata
(Fr.) Keissl. con dosis desde 5 hasta 15g.L-1 en los que se observó un
incremento del crecimiento por encima del control (25, 26).
La esporulación, evaluada a través de la liberación de
zoosporas al medio, también se afectó al emplear el quitosano
en el medio de cultivo. Los resultados mostraron que a medida que aumentaba
la concentración de quitosano este proceso disminuía sustancialmente,
incluso en el caso que el polímero favoreció el crecimiento del
micelio de P. nicotianae (Figura
2B). Este hecho resulta de gran importancia, pues en particular las zoosporas
se consideran el propágulo infeccioso más importante de los Oomycetes,
ya que estas estructuras pueden alcanzar grandes distancias desplazándose
a través del agua.
La inhibición de la esporulación de otros patógenos ha
sido observada por varios autores, aunque los rangos de concentraciones de quitosano
necesarias para disminuir los niveles de esporas varían considerablemente
en dependencia del organismo diana, de las concentraciones y las propiedades
físico-químicas de este compuesto. En el caso de A. alternata,
se comprobó que quitosanos de diferentes pesos moleculares podían
afectar la esporulación y germinación de un aislado de esta especie
(26). En dicha investigación se emplearon concentraciones superiores
a las del presente trabajo (5-25 g L-1) y observaron que 25 g L-1
inhibía totalmente la esporulación de A. alternata. También
se compararon el efecto de diferentes concentraciones (1- 2 g L-1)
y pesos moleculares de quitosano disminuyendo la esporulación de Rizopus
stolonifer (Ehrenb.:Fr.) en el medio de cultivo (27), aunque en estos casos
la inhibición dependió más del peso molecular del quitosano
que de las concentraciones empleadas.
En general, tanto el crecimiento de la colonia como la esporulación in
vitro del aislado SS-11 fueron dependientes de la concentración
de quitosano. Esto parece estar dado por la naturaleza policatiónica
de este polímero, ya que se sugiere que los grupos aminos libres deben
interactuar con las cargas negativas de la membrana y provocar desbalances iónicos
que conllevan a la alteración del paso de nutrientes al microorganismo
y, por tanto, a la lisis celular, como se ha observado con Neurospora crassa
(8).
Activación de respuestas defensivas en hojas de tabaco ante la aplicación
de quitosano. La concentración de proteínas en hojas de plantas
de tabaco varió con las dosis de quitosano evaluadas (Figura
3A). En los tratamientos con quitosano se observó un aumento estadísticamente
significativo de los niveles proteicos en relación al control después
de 72 horas de haber sido embebidas las raíces en las soluciones del
polímero, destacándose el efecto de las concentraciones 0,5 y
1,0 g L-1. La actividad glucanasa; sin embargo, disminuyó
en relación al control para dichos tratamientos y con 0,05 g L-1
se obtuvo los menores niveles de esta enzima (Figura
3B).
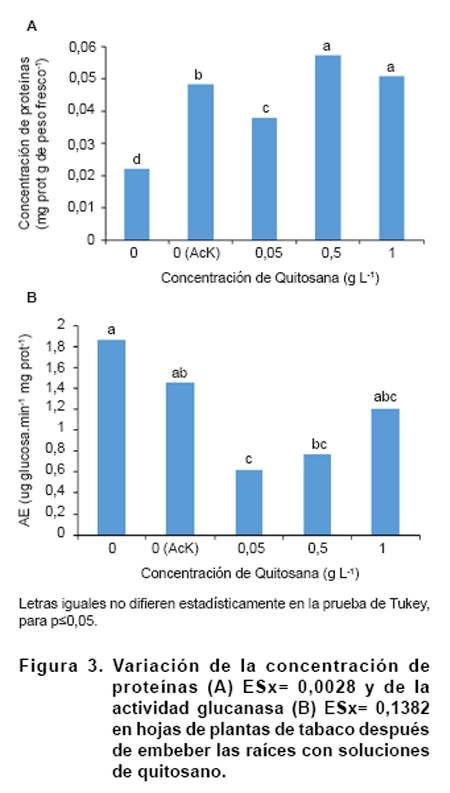
Los incrementos de las concentraciones de proteína en presencia de un
elicitor como el quitosano pueden estar dados por la reorganización de
las funciones del vegetal hacia la formación de compuestos que le permitan
frenar el avance del supuesto patógeno. La enzima glucanasa no incrementó
su actividad, aunque se puede crear un estado de priming que le facilite
al vegetal responder con mayor velocidad y fortaleza al ataque de patógenos
(28). Este consistiría en no aumentar necesariamente sus niveles de actividades
enzimáticas cuando entre en contacto con el elicitor, pero sí
dispararlos cuando la presencia de patógenos sea detectado, con lo cual
se incrementaría la velocidad de reconocimiento, respuesta y la magnitud
de la resistencia al nuevo estrés biótico.
Dinámica
de actividad glucanasa en hojas de plantas de tabaco inoculadas con P. nicotianae.
Las concentraciones de proteínas en los tratamientos con y sin contacto
con el aislado SS-11 se mostraron similares entre sí, excepto a las 120
horas en que hubo un incremento en las plantas infectadas en relación
al control (Figura 4A).
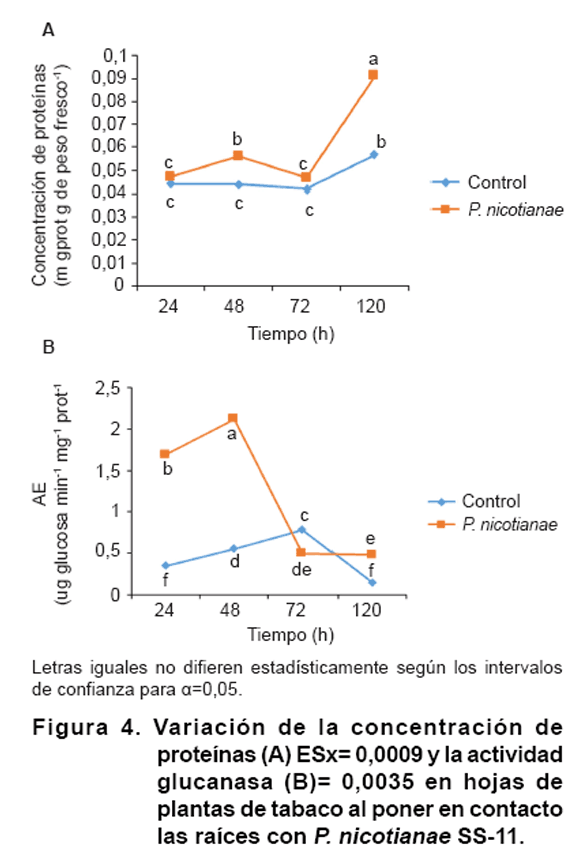
La actividad glucanasa varió durante los momentos evaluados. En la mayor
parte del tiempo, la actividad enzimática fue superior en las plantas
inoculadas con SS-11 que en el control, observándose el máximo
valor (2,13 µg glucosa min-1 mg prot-1) a las 48
horas cuando se cuadriplicaron los valores en relación al testigo (Figura
4B).
La respuesta defensiva del tabaco ante P. nicotianae presenta pocos
estudios y hasta el momento no se conoce que se hayan realizado dinámicas
de la actividad glucanasa en respuesta a un aislado virulento de este patógeno.
A las 120
horas hubo una elevada concentración de proteínas; sin embargo,
el proceso infeccioso prosiguió (datos no mostrados). La actividad glucanasa,
en ese instante, fue inferior a la observada a las 48 horas, lo que puede sugerir
que otras enzimas y proteínas de diversos tipos pudieron estar involucradas
en esa respuesta. Otra hipótesis puede estar relacionada con el estado
de priming esperado, el cual pudo no ser suficiente en la magnitud
y velocidad requeridas para inducir una resistencia capaz de detener el avance
del patógeno, como señalan Balmer et al., (29).
Por el contrario, la inducción de actividad glucanasa fue inmediata a
la inoculación por SS-11 (Figura
4B) lo que demuestra un rápido reconocimiento del patógeno
por la planta, puesto que las paredes celulares del microorganismo son de glucano,
principalmente. No obstante, aunque la actividad enzimática se incrementó
en los primeros dos días, disminuyó en los días subsiguientes.
Este comportamiento podría deberse a un silenciamiento de la respuesta
defensiva en la planta por el patógeno, debido a que los primeros niveles
elevados de glucanasa no sean suficientes para detener la infección y
a que otras respuestas defensivas necesarias para elevar la resistencia basal
de la planta no sean rápida y suficientemente activadas.
Respuesta defensiva en hojas de plántulas de tabaco inoculadas con P.
nicotianae y previamente tratadas con quitosano. Las plantas que estuvieron
en interacción con SS-11 incrementaron estadísticamente la concentración
de proteínas foliares por encima del control a las 48 y 96 horas de inoculadas
con el patógeno (Figura
5A).
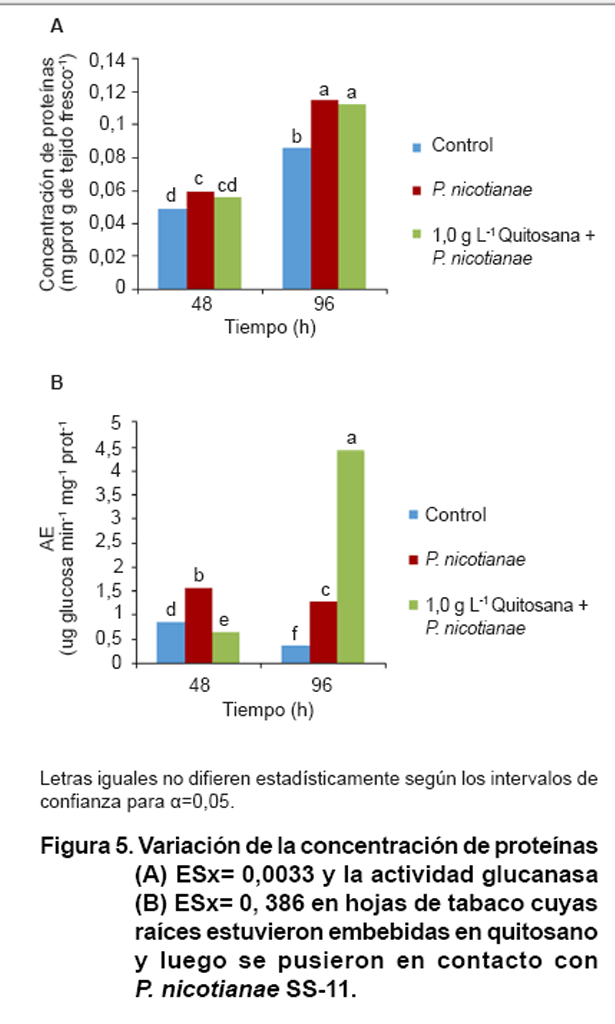
Por otra parte, se observó que en el tratamiento que incluía la
presencia de quitosano y P. nicotianae, aunque los valores no diferían
del testigo a las 48 horas de tratadas las plantas, hubo un incremento de los
niveles proteicos a las 96 horas, similares a los obtenidos con el tratamiento
del patógeno solamente (Figura
5A).
La actividad glucanasa fue diferente para cada momento evaluado (Figura
5B). A las 48 horas las plantas en contacto con el microorganismo mostraban
mayores niveles de actividad que los demás tratamientos. A las 96 horas
los valores de actividad de los dos grupos de plantas inoculadas
(con y sin quitosano) estuvieron por encima del control.
Los incrementos de la actividad glucanasa observados en las plantas inoculadas
y previamente tratadas con quitosano muestran que se pudo inducir un estado
de priming que aún no había alcanzado su máximo
potencial a las 48 horas pero que a las 96 incrementó los niveles de
la enzima casi 10 veces. Estos resultados coinciden con los informados por Falcón
et al., (30) en plantas de tabaco cultivar Criollo 98, las que después
de 72 horas de tratadas con 1,0 g L-1 del mismo polímero de
quitosano incrementaron al doble los valores de actividad glucanasa.
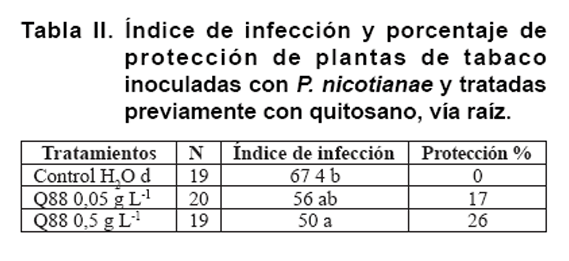
Protección de plantas de tabaco contra P. nicotianae tratadas
con quitosano. El tratamiento previo con quitosano redujo el índice de
infección de las plantas de tabaco inoculadas con P. nicotianae
(Tabla II). La concentración
más baja (0,05 g L-1) provocó una disminución
del índice de infección en 17 % aunque sin diferencias con el
control, mientras que la mayor concentración del polímero (0,5
g L-1) redujo la infección en 26 % y fue diferente estadísticamente
del control.
Las diferencias
de protección se reflejaron también en los porcentajes de frecuencia
de los diferentes grados de infección, de acuerdo a la escala empleada
(Figura 6). De esta
forma, la concentración del polímero de 0,5 g L-1 redujo
el porcentaje de plantas muertas e infectadas hasta el nivel de las hojas e
incrementó el porcentaje de plantas solo afectadas hasta el nivel de
la raíz, lo que redundó en la reducción del índice
de infección obtenido. Así mismo, la menor concentración
del polímero redujo el porcentaje de plantas afectadas hasta el nivel
de las hojas a costa de un incremento en el número de plantas afectadas
hasta las raíces, hipocotilos y cotiledones (Figura
6).
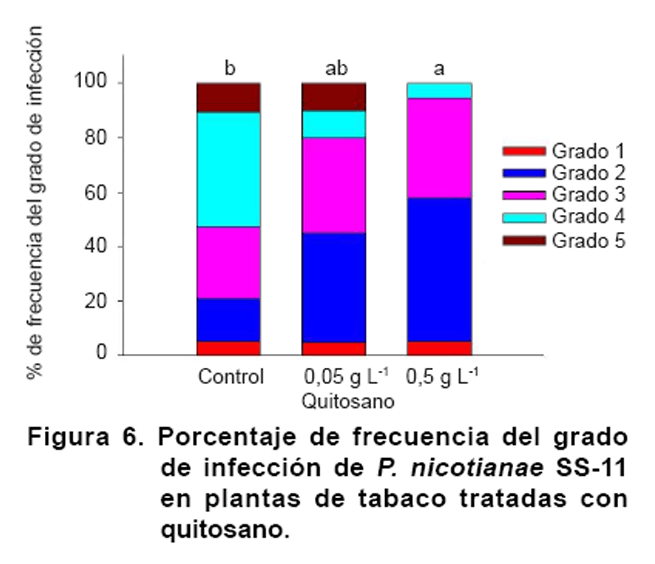
Los resultados de la Figura
6 demuestran que concentraciones de quitosano de 0,5 g L-1 reducen
el índice de infección del patógeno en plántulas
de tabaco en las condiciones del ensayo ejecutado y las protegen en un 26 %
(Tabla II).
La protección del tabaco contra la infección por P. nicotianae
observada está relacionada con la estimulación de resistencia
sistémica inducida en la planta y no con la actividad antimicrobiana
directa que estos derivados tienen sobre este patógeno, ya que la forma
de aplicación del polímero no influyó directamente sobre
el microorganismo.
La inclusión
del quitosano en la interacción compatible del tabaco con P. nicotianae
permitió corroborar que esta puede inhibir el crecimiento y esporulación
de microorganismos e inducir resistencia sistémica en plantas susceptibles
contra sus patógenos.
Los resultados permiten asumir que en condiciones naturales del cultivo del
tabaco se pueden aprovechar las ventajas de los efectos biológicos del
quitosano para lograr un alto nivel de protección contra P. nicotianae
y otros patógenos del suelo. Se debe tomar en cuenta, además,
que la combinación de diferentes solventes, formas y momentos de aplicación
de los derivados de quitosano deben provocar una reducción de los niveles
de microorganismos patógenos en la rizosfera, ya sea por acción
antimicrobiana, como por estimulación de las respuestas defensivas y
de crecimiento en plantas.
AGRADECIMIENTOS
Los autores quieren
agradecer a la Fundación Internacional para la Ciencia (International
Foundation for Science (IFS)) por su contribución a las investigaciones
del Grupo de Productos Bioactivos del INCA que se recogen en esta publicación.
El apoyo de esta organización se realizó a través del proyecto
F-4446-2F, mediante financiamiento para equipamiento, reactivos, material informático
e información científica.
BIBLIOGRAFÍA
1. Erwin, D.C.
y Ribeiro, O.K. Phytophthora diseases worldwide. [en línea],
edit. The American Phytopathological Society, St Paul, Minnesota, USA, 1996,
p. 562, ISBN 0-89054-212-0, CABDirect2, [Consultado: 21 de agosto de 2015],
Disponible en: <http://www.cabdirect.org/abstracts/19971001256.html;jsessionid=49B916D21F37512B0B7EB60CAC0A50C0>.
2. Fernández Morales, A.A.; Martínez, M.L.; Ariosa, M.D. y Toledo,
V. ‘‘Detección y prácticas de manejo de la enfermedad pata prieta
causada por Phytophthora Nicotianae en el cultivo del tabaco’’, Agroecología,
vol. 7, no. 1, 2012, p. 8, ISSN 1989-4686.
3. Badawy, M.E.I. y Rabea, E.I. ‘‘A Biopolymer Chitosan and Its Derivatives
as Promising Antimicrobial Agents against Plant Pathogens and Their Applications
in Crop Protection’’, International Journal of Carbohydrate Chemistry,
vol. 2011, 19 de junio de 2011, p. e460381, ISSN 1687-9341, DOI 10.1155/2011/460381.
4. Hadwiger, L.A. ‘‘Multiple effects of chitosan on plant systems: Solid science
or hype’’, Plant Science, vol. 208, julio de 2013, pp. 42-49, ISSN
0168-9452, DOI 10.1016/j.plantsci.2013.03.007.
5. Salachna, P. y Zawadzinska, A. ‘‘Effect of chitosan on plant growth, flowering
and corms yield of potted freesia’’, Journal of Ecological Engineering,
vol. 15, no. 3, 2014, pp. 97-102, ISSN 2299-8993, DOI 10.12911/22998993.1110223.
6. Romanazzi, G.; Gabler, F.M.; Margosan, D.; Mackey, B.E. y Smilanick, J.L.
‘‘Effect of Chitosan Dissolved in Different Acids on Its Ability to Control
Postharvest Gray Mold of Table Grape’’, Phytopathology, vol. 99, no.
9, 11 de agosto de 2009, pp. 1028-1036, ISSN 0031-949X, DOI 10.1094/PHYTO-99-9-1028.
7. Rashid, N.; Rehman, M.S.U. y Han, J.-I. ‘‘Use of chitosan acid solutions
to improve separation efficiency for harvesting of the microalga Chlorella
vulgaris’’, Chemical Engineering Journal, vol. 226, 15 de junio
de 2013, pp. 238-242, ISSN 1385-8947, DOI 10.1016/j.cej.2013.04.062.
8. Palma-Guerrero, J.; Huang, I.-C.; Jansson, H.-B.; Salinas, J.; Lopez-Llorca,
L.V. y Read, N.D. ‘‘Chitosan permeabilizes the plasma membrane and kills cells
of Neurospora crassa in an energy dependent manner’’, Fungal Genetics
and Biology, vol. 46, no. 8, agosto de 2009, pp. 585-594, ISSN 1087-1845,
DOI 10.1016/j.fgb.2009.02.010.
9. Kong, M.; Chen, X.G.; Xing, K. y Park, H.J. ‘‘Antimicrobial properties of
chitosan and mode of action: A state of the art review’’, International
Journal of Food Microbiology, vol. 144, no. 1, 15 de noviembre de 2010,
(ser. The 16th CBL (Club des Bactéries Lactiques) Symposium, May 2009,
Toulouse, France), pp. 51-63, ISSN 0168-1605, DOI 10.1016/j.ijfoodmicro.2010.09.012.
10. Younes, I. y Rinaudo, M. ‘‘Chitin and Chitosan Preparation from Marine Sources.
Structure, Properties and Applications’’, Marine Drugs, vol. 13, no.
3, 2 de marzo de 2015, pp. 1133-1174, DOI 10.3390/md13031133.
11. Falcón-Rodríguez, A.B.; Costales, D.; Cabrera, J.C. y Martínez-Téllez,
M.Á. ‘‘Chitosan physico–chemical properties modulate defense responses
and resistance in tobacco plants against the oomycete Phytophthora nicotianae’’,
Pesticide Biochemistry and Physiology, vol. 100, no. 3, julio de 2011,
pp. 221-228, ISSN 0048-3575, DOI 10.1016/j.pestbp.2011.04.005.
12. Mahdavi, B. y Rahimi, A. ‘‘Seed priming with chitosan improves
the germination and growth performance of ajowan (Carum copticum) under salt
stress’’, EurAsian Journal of BioSciences, vol. 7, 2013, pp. 69–76,
ISSN 1307-9867, DOI http://dx.doi.org/10.5053/ejobios.2013.7.0.
13. Hadrami, A. El.; Adam, L.R.; Hadrami, I. El. y Daayf, F. ‘‘Chitosan in Plant
Protection’’, Marine Drugs, vol. 8, no. 4, 30 de marzo de 2010, pp.
968-987, ISSN 1660-3397, DOI 10.3390/md8040968.
14. Ashutosh Rai, P.U. ‘‘Differential Expression of Pathogenesis Related Protein
Genes in Tomato during Inoculation with A. Solani’’, Journal of Plant Pathology
& Microbiology, vol. 05, no. 01, 2014, ISSN 21577471, DOI 10.4172/2157-7471.1000217,
[Consultado: 21 de agosto de 2015], Disponible en: <http://www.omicsonline.org/open-access/differential-expression-of-pathogenesis-related-protein-genes-in-tomato-during-inoculation-with-a-solani-2157-7471.1000217.php?aid=23433>.
15. Bengyella, L. y Pranab, R. ‘‘Engineered pathogenesis related and antimicrobial
proteins weaponry against Phytopthora infestans in potato plant: A review’’,
Biotechnology and Molecular Biology Reviews, vol. 5, no. 4, 2010, pp.
61–66, ISSN 1538-2273.
16. Lusso, M. y Kuc, J. ‘‘The effect of sense and antisense expression of the
PR-N gene for ß-1,3-glucanase on disease resistance of tobacco to fungi
and viruses’’, Physiological and Molecular Plant Pathology, vol. 49,
no. 4, octubre de 1996, pp. 267-283, ISSN 0885-5765, DOI 10.1006/pmpp.1996.0054.
17. Falcón, A.B.; Cabrera, J.C.; Costales, D.; Ramírez, M.A.;
Cabrera, G.; Toledo, V. y Martínez-Téllez, M.A. ‘‘The effect of
size and acetylation degree of chitosan derivatives on tobacco plant protection
against Phytophthora parasitica nicotianae’’, World Journal of Microbiology
and Biotechnology, vol. 24, no. 1, 23 de junio de 2007, pp. 103-112, ISSN
0959-3993, 1573-0972, DOI 10.1007/s11274-007-9445-0.
18. Falcón-Rodríguez, A.B.; Cabrera, J.C.; Ortega, E.; Martínez-Téllez,
M.A. y others ‘‘Concentration and physicochemical properties of chitosan derivatives
determine the induction of defense responses in roots and leaves of tobacco
(Nicotiana tabacum) plants.’’, American Journal of Agricultural
and Biological Sciences, vol. 4, no. 3, 2009, pp. 192–200, ISSN 1557-4989.
19. Somogyi, M. ‘‘Notes on sugar determination’’, Journal of biological
chemistry, vol. 195, no. 1, 1952, pp. 19–23, ISSN 0021-9258; 1083-351X.
20. IBM SPSS Statistics [en línea], versión 11.5, [Windows], edit.
IBM Corporation, U.S, 2011, Disponible en: <http://www.ibm.com>.
21. González-Peña Fundora, D.; Falcón Rodríguez,
A.; Gómez Izaguirre, G. y Fernández Morales, A. ‘‘La quitosana:
potencialidades antimicrobianas contra hongos y Oomycetes’’, Fitosanidad,
vol. 17, no. 2, 10 de enero de 2014, pp. 111-115, ISSN 1818-1686.
22. Falcón Rodríguez, A.; Rodríguez, A.T.; Ramírez,
M.A.; Rivero, D.; Martínez, B.; Cabrera, J.C.; Costales, D.; Cruz, A.;
González, L.G.; Jiménez, M.C.; Jiménez, L.; Hernández,
I.; Gonzáles Peña, D. y Márquez, R. ‘‘Chitosans as bioactive
macromolecules to protect conomically relevant crops from their main pathogens’’,
Biotecnología Aplicada, vol. 27, no. 4, diciembre de 2010, pp.
305-309, ISSN 1027-2852.
23. Palma-Guerrero, J.; Jansson, H.-B.; Salinas, J. y Lopez-Llorca, L. v. ‘‘Effect
of chitosan on hyphal growth and spore germination of plant pathogenic and biocontrol
fungi’’, Journal of Applied Microbiology, vol. 104, no. 2, 1 de febrero
de 2008, pp. 541-553, ISSN 1365-2672, DOI 10.1111/j.1365-2672.2007.03567.x.
24. Xing, K.; Zhu, X.; Peng, X. y Qin, S. ‘‘Chitosan antimicrobial and eliciting
properties for pest control in agriculture: a review’’, Agronomy for Sustainable
Development, vol. 35, no. 2, 15 de octubre de 2014, pp. 569-588, ISSN 1774-0746,
1773-0155, DOI 10.1007/s13593-014-0252-3.
25. Lam, N.D. y Diep, T.B. ‘‘A preliminary study on radiation treatment of chitosan
for enhancement of antifungal activity tested on fruit-spoiling strains’’, Nuclear
Science and Technology, vol. 2, no. 2, 2003, pp. 54–60, ISSN 0022-3131,
1881-1248.
26. Sánchez-Domínguez, D.; Bautista-Baños, S. y Castillo,
P. ‘‘Efecto del quitosano en el desarrollo y morfología de Alternaria
alternata (Fr.) Keissl’’, Anales de Biología, vol. 28,
2006, pp. 23–32, ISSN 1989-2128.
27. Hernández-Lauzardo, A.N.; Bautista-Baños, S.; Velázquez-del
Valle, M.G.; Méndez-Montealvo, M.G.; Sánchez-Rivera, M.M. y Bello-Pérez,
L.A. ‘‘Antifungal effects of chitosan with different molecular weights on in
vitro development of Rhizopus stolonifer (Ehrenb.:Fr.) Vuill’’, Carbohydrate
Polymers, vol. 73, no. 4, 5 de septiembre de 2008, pp. 541-547, ISSN 0144-8617,
DOI 10.1016/j.carbpol.2007.12.020.
28. Pastor, V.; Luna, E.; Mauch-Mani, B.; Ton, J. y Flors, V. ‘‘Primed plants
do not forget’’, Environmental and Experimental Botany, vol. 94, octubre
de 2013, (ser. Cross-stress tolerance and stress «memory» in plants),
pp. 46-56, ISSN 0098-8472, DOI 10.1016/j.envexpbot.2012.02.013.
29. Balmer, A.; Pastor, V.; Gamir, J.; Flors, V. y Mauch-Mani, B. ‘‘The ‘prime-ome’:
towards a holistic approach to priming’’, Trends in Plant Science,
vol. 20, no. 7, julio de 2015, pp. 443-452, ISSN 1360-1385, DOI 10.1016/j.tplants.2015.04.002.
30. Falcón Rodríguez, A.; Costales Menéndez, D.; Martínez
Téllez, M.Á. y Gordon, T.A. ‘‘Respuesta enzimática y de
crecimiento en una variedad comercial de tabaco (Nicotiana tabacum,L.)
tratada por aspersión foliar de un polímero de quitosana’’, Cultivos
Tropicales, vol. 33, no. 1, marzo de 2012, pp. 65-70, ISSN 0258-5936.
Recibido: 27 de
octubre de 2014
Aceptado: 4 de marzo de 2015
Ms.C. Dianevys
González-Peña Fundora, Instituto Nacional de Ciencias Agrícolas
(INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700.
Email: dianevys@inca.edu.cu







