Efecto
del Pectimorf® en el cultivo de ápices de plantas in vitro
de yuca (Manihot esculenta Crantz), clones `CMC-40´ y `Señorita´
Effect
of the Pectimorf®
in meristem tip in vitro culture cassava (Manihot esculenta
Crantz), clone´CMC-40´ and ´Señorita´
Ms.C. Lorenzo
Suárez Guerra, María M. Hernández Espinosa
Instituto
Nacional Ciencias Agrícolas (INCA), gaveta postal 1, San José
de las Lajas, Mayabeque, Cuba, CP 32700.
RESUMEN
El desarrollo de
metodologías más eficientes y sostenibles en la obtención
de material in vitro de yuca (Manihot esculenta Crantz), favorece
al mejoramiento de la calidad de la semilla y el saneamiento del material vegetal,
por ello se trazó como objetivo evaluar la efectividad del Pectimorf®
(mezcla de oligogalacturónidos), sustancia inocua y natural producida
en Cuba, a emplearse como posible complemento o sustituto de los reguladores
del crecimiento empleados tradicionalmente en el medio de cultivo para el crecimiento
de ápices meristemáticos de yuca. Se demostró que el Pectimorf®
en el medio de cultivo, posibilitó el establecimiento in vitro
de los ápices en clones de yuca ´CMC-40´ y ´Señorita´
y favoreció el crecimiento de los explantes. Los resultados contribuyen
al esclarecimiento de los mecanismos de acción de esta sustancia y su
aplicación futura en las unidades de propagación masiva de plantas
del país.
Palabras
clave: micropropagación, oligosacáridos,
medio de cultivo, meristemas.
ABSTRACT
The development
of more efficient and more sustainable methodologies in the material obtaining
yucca (Manihot esculenta Crantz) in vitro, the improvement
of the quality of the seed and vegetable material sanitation, are the objectives
of this work to evaluate the effectiveness of Pectimorf® (mixture
of oligogalacturonides), innocuous and natural substance taken place in Cuba,
to be used as possible complement or substitute of the growth regulators used
traditionally in the propagating medium of yucca meristematics tip. It was demonstrated
that Pectimorf® in the means of cultivation, possible to establish
in vitro of the meristem tip cultivation in yucca clones ´CMC-40´
and ´Señorita´ and it stimulated the explant growth too.
The results contribute to understand the mechanisms of action of this substance
and their future application in vitro plant resorts in Cuba.
Key words:
micropropagation, oligosaccharides, cultivation medium, meristems.
INTRODUCCIÓN
La yuca (Manihot
esculenta Crantz) es un cultivo muy versátil, plantado por pequeños
campesinos en más de 100 países (1), como alimento, tiene la facilidad
de deshidratarse y almacenarse durante varios años (2). La producción
mundial de yuca en el año 2012 alcanzó los 282 millones de toneladas,
lo que representó un incremento del 7 % con respecto al volumen del 2011.
Las perspectivas futuras apuntan a una continua expansión de la producción
de yuca, pues continúa siendo un cultivo estratégico para la seguridad
alimentaria en el alivio de la pobreza (1).
En Cuba, este cultivo constituye un valioso alimento desde la época de
los aborígenes y forma parte del surtido de raíces y tubérculos
que el pueblo cubano denomina viandas. Es un componente importante en la dieta
tradicional básica de la población; además, en la dieta
animal, donde también se emplea su follaje, tanto en los bancos de proteína
para la ganadería como en la confección de concentrados para la
alimentación de cerdos y aves. Según el Ministerio de la Agricultura
(3), la Proyección estratégica (2010- 2015) previó un incremento
en superficie y rendimientos del cultivo durante los próximos años.
Para cumplir este reto es imprescindible aumentar los volúmenes de semillas
demandados por los agricultores cubanos.
Dentro de la estrategia varietal nacional, definida por el Instituto de Investigaciones
en Viandas Tropicales (INIVIT), se encuentran los clones ‘CMC-40’ y ‘Señorita’.
El primero tiene la particularidad de que su ciclo es corto (de 6-10 meses)
y tiene una alta productividad; mientras que el clon ´Señorita´
es de ciclo largo, más de 10 meses, pero se destaca por su excelente
calidad culinaria.
Este cultivo se propaga vegetativamente y su multiplicación es generalmente
tediosa y lenta (4). Los agricultores cubanos han perpetuado esta vianda al
utilizar semillas asexuales (estacas o pedazos de tallos) en siembras repetidas,
lo que constituye un riesgo, debido a que es posible diseminar plagasA,
por lo que la obtención de material de plantación de alta calidad
constituye una necesidad básica para nuestros productores en la expansión
del cultivo.
La baja disponibilidad de material certificado de semilla de yuca (Manihot
esculenta C.) en el país, similar al resto de los cultivos de reproducción
agámica, pudiera solucionarse mediante la aplicación de las técnicas
de cultivo in vitro. Según plantean diferentes autoresB
(5, 6), estas ofrecen múltiples ventajas como recuperar el vigor y la
productividad de las plantas. De igual forma puede contribuir a la producción
de grandes volúmenes de ‘semilla’ de alta calidad, así como también
permite la propagación de plantas libres de virus y de cualquier otro
patógeno.
El desarrollo de métodos eficientes y rápidos de regeneración
de plantas de yuca mediante el cultivo in vitro de tejidos, ya sea
por embriogénesis somáticaA (7, 8, 9) u organogénesisC,
D (10), generalmente resultan exigentes en cuanto a la composición
del medio de cultivo, especialmente en lo referente al empleo de reguladores
del crecimiento, por lo que sería importante lograr el empleo de productos
bioactivos de producción nacional en la propagación in vitro
de la yuca (Manihot esculenta C.), como alternativa para mejorar la
eficacia económica del proceso; entre estos productos bioactivos puede
citarse el Pectimorf®, elaborado por el Departamento de Fisiología
y Bioquímica Vegetal, del Instituto Nacional de Ciencias Agrícolas
(INCA), Mayabeque, CubaE.
El Pectimorf® es un producto natural e inocuo, constituido por
una mezcla de oligosacáridos biológicamente activos, obtenidos
a partir de la pectina cítrica, cuyo principio activo es una mezcla de
a-1,4-oligogalacturónidos con grado de polimerización (GP) entre
9 y 16 (11). Es considerado un potente elicitor de defensa en plantas (12, 13)
y estimulante del crecimiento y diferenciación celular de diferentes
especies vegetalesE (14).
La respuesta de esta mezcla de oligogalacturónidos (OG), cuyo efecto
es similar al de las auxinas o citoquininas, puede estar dada principalmente
al balance hormonal del explante y de la composición de reguladores del
crecimiento en el medio de cultivo; además, regulan entre otros procesos,
la interacción entre auxinas, citoquininas, giberelinas y etileno, lo
cual valida a esta sustancia como una alternativa promisoria en la biotecnología
vegetal cubana (15, 16).
Sin embargo, hasta el momento no se conoce el efecto que provoca el Pectimorf®
en el cultivo in vitro de ápices meristemáticos de yuca
(Manihot esculenta C.), clones `CMC-40´ y `Señorita´,
es posible la sustitución total o parcial de ANA (ácido naftalenacético)
y 6-BAP (6-bencilaminopurina), reguladores empleados tradicionalmente en los
medios de cultivo para esta etapa, por el Pectimorf®.
MATERIALES
Y MÉTODOS
El trabajo se
desarrolló en el Laboratorio de Biotecnología del Departamento
de Genética y Mejoramiento de Plantas del Instituto Nacional de Ciencias
Agrícolas (INCA), ubicado en el municipio San José de Las Lajas,
provincia Mayabeque.
Material Vegetal
Se utilizaron dos clones procedentes del banco de germoplasma cubano de yuca,
perteneciente al Instituto de Investigaciones de Viandas Tropicales (INIVIT),
Santo Domingo, Villa Clara, con características contrastantes en cuanto
a ciclo, productividad y otros caracteres morfoagronómicos.
Características del clon ´CMC-40´
Plantas de porte semi-erecto, con más de dos ramificaciones. Tallos de
color marrón oscuro, follaje joven verde-rojizo, pecíolos rojos,
hojas adultas verdes, hojas jóvenes rosadas, hojas 5-7 lóbulos
simples, pecíolos inclinados hacia arriba, de forma irregular. Posee
más de 10 raíces por planta, de superficie rugosa y crecimiento
oblicuo, sésiles, cónicas o cilíndricas, de color castaño
oscuro la película externa, corteza rosada y pulpa blanca. Dentro de
sus principales características se destacan su alta productividad y ciclo
corto (de 6-10 meses).
Características del clon ´Señorita´
Plantas de porte erecto, no ramificadas o poco ramificadas. Tallo muy vigoroso
y de entrenudos cortos. Tallo verde amarillo, con yemas de color amarillo-rosado,
hojas verdes con los nervios y pecíolos ligeramente rosados en adultas,
en las hojas jóvenes los pecíolos son rojos por la parte superior
y verde-rojo por la parte inferior. Posee raíces cortas y de color blanco,
cada planta produce un promedio de 8–12, bastante superficiales, lo cual facilita
la cosecha. El ciclo es largo, más de 10 meses. En este clon se destaca
su excelente calidad culinaria.
Se tomaron estacas de 15-20 cm de longitud de plantas adultas de los clones
antes mencionados y se plantaron en macetas de 14 cm de diámetro superior
y una altura de 10 cm, que contenían un sustrato compuesto por una mezcla
en volumen de 25 % de materia orgánica (cachaza descompuesta) y 75 %
de suelo Ferralítico Rojo compactado (17), en una relación 1:2
v/v. Los brotes crecieron en umbráculo con estructura metálica,
paredes de tela antiáfidos, techo de nylon con cubierta de malla de sombra
negra de polipropileno (30 %) y piso de cemento. El riego se realizó
periódicamente (dos veces/semana), a fin de mantener la humedad en el
sustrato por encima del 85 %.
Cuatro semanas después de la plantación, se cortaron brotes de
las estacas de los clones antes mencionados y se dividieron en secciones de
3 a 5 cm de longitud con dos yemas; los que se llevaron al laboratorio.
Preparación y desinfección de los explantes
Los explantes fueron desinfectados según la metodología propuesta
por MederoA. En la cabina de flujo laminar se extrajo ápices
meristemáticos de 0,5-0,7 mm de longitud con el empleo de un estéreo-
microscopio marca CARLZEISS con aumento de (4X). Posteriormente, los ápices
meristemáticos fueron establecidos en tubos de ensayo (25/150 mm) con
20 mL de medio sólido. Se utilizó el medio basal MS (Murashige
y Skoog, 1962) (18), además tiamina (1 mg L-1), mioinositol
(100 mg L-1), sacarosa
(20 mg L-1) y agar (6,5 mg L-1) como agente gelificante.
Transcurridos 21 días se extrajo el ápice de las plantas in
vitro obtenidas, de tamaño 0,8-1,0 mm de longitud con el empleo
del estéreo- microscopio marca CARLZEISS con aumento de (4X). Se utilizó
un total de 15 explantes por tratamiento para cada cultivar.
Fueron empleadas diferentes concentraciones de Pectimorf® como
sustituto y complemento de los reguladores del crecimiento ANA (ácido
naftalenacético) y 6-BAP (6- bencilaminopurina) empleados en el medio
control para el crecimiento y desarrollo de ápices meristemáticos
de yuca. Se mantuvo en todos los casos el Ácido giberelico (AG3)
para facilitar la elongación de los segmentos nodales. La Tabla
I muestra las características de cada tratamiento.

Reguladores del crecimiento
• Ácido naftalenacético (ANA): reactivo procedente de Merck
• Ácido giberelico (AG3): reactivo procedente de Merck
• 6 bencilaminopurina (6-BAP): reactivo procedente de Merck
• Pectimorf®: procedente del Instituto Nacional de Ciencias Agrícolas
(INCA). Laboratorio de Fisiología y Bioquímica Vegetal, Mayabeque,
Cuba.
Condiciones de cultivo
La esterilización se llevó a cabo en autoclave, durante 20 minutos
a 121 0C con 1.5 atmósferas de presión. El material vegetal fue
colocado en cámaras de cultivo con temperatura de 25 ± 2 °C,
humedad relativa de 80-90 % y luz artificial con un fotoperiodo de 16 horas
luz, con una intensidad luminosa de 18,75 µmol m-2 s-1.
Al cabo de los 21 días se realizaron las siguientes observaciones: altura
(cm), se midió con una regla graduada desde la base del tallo hasta la
parte superior del follaje; número de hojas:se realizó un conteo
individual de las hojas por vitroplanta; número de raíces: se
contó el número de raíces totales por vitroplanta; coloración
de los brotes: se determinó con la ayuda del código de colores
hexadecimalF.
Se utilizó un diseño completamente aleatorizado con 10 explantes
por tratamiento, los experimentos se repitieron dos veces en tiempo y los datos
obtenidos de las observaciones altura, número de hojas y raíces
fueron procesados estadísticamente mediante un análisis de varianza
de clasificación simple (ANOVA completamente aleatorizado) y las medias
se compararon según la prueba de Duncan (p≤0,05). Para el procesamiento
de los datos se utilizó el paquete estadístico SPSS sobre Windows
(19). En todos los casos, previamente se chequeó la distribución
normal y la homogeneidad de varianza.
RESULTADOS
Y DISCUSIÓN
Durante la primera
semana de establecidos, se observaron algunas alteraciones en el color y la
morfología de los ápices en los tratamientos donde se empleó
el Pectimorf®, presumiblemente debido al aumento de la velocidad
de crecimiento o división celular en esta primera fase. A pesar de ello,
los ápices presentaron una coloración verde lima (32CD32) y a
partir de los restantes días continuaron su crecimiento normalmente.
Como se observa en la Tabla
II hubo diferencias significativas entre los tratamientos, mostrando una
respuesta diferenciada de las variables en ambos clones. En cuanto a la altura
de las vitroplantas, en el clon ´CMC- 40´, el tratamiento 3, con
5 mg L-1
de Pectimorf® en sustitución de ANA, donde alcanzó
el mayor valor de altura de 2,88 cm sin diferencias significativas con el control
que contenía ANA y BAP, ni de los tratamientos 6 y 7 donde se añadió
el Pectimorf® a 5 y 10 mg L-1 respectivamente en presencia
de ANA y sustitución del BAP. Los resultados indican que el producto
logró compensar el efecto de la auxina (ANA) en ausencia de esta en el
medio; sin embargo, no se produjo un efecto depresivo (antagónico) marcado
cuando estuvo presente.
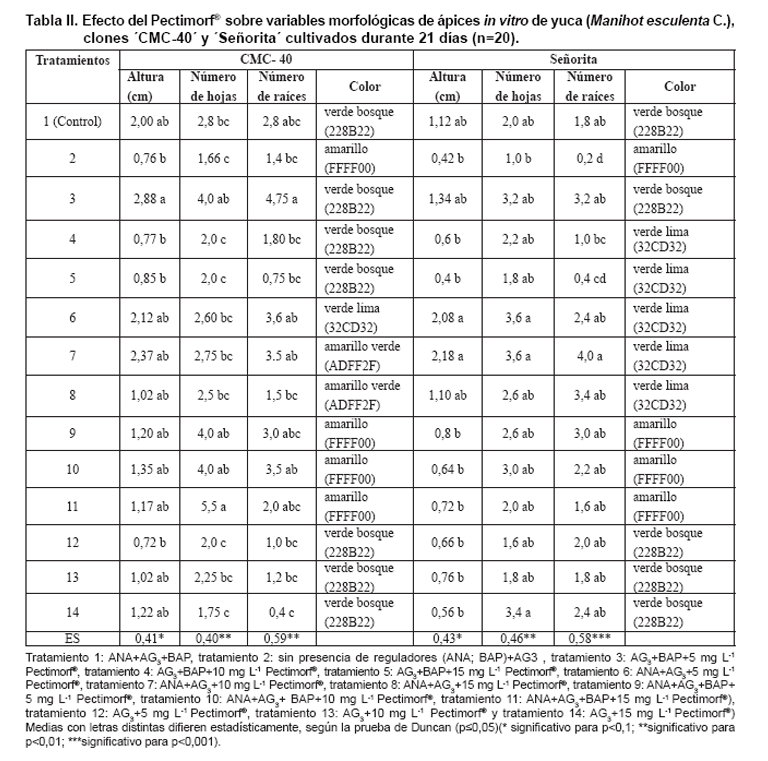
En el clon ´Señorita´ los máximos valores de altura
se obtuvieron en los tratamientos 6 y 7, donde se empleó el Pectimorf®
en presencia de ANA y AG3 a las concentraciones de 5 y 10 mg L-1,
los cuales no difirieron estadísticamente entre ellos y alcanzaron valores
por encima de los 2 cm de altura; ambos tratamientos no difirieron del tratamiento
control, tratamiento 3 (6-BAP + 5 mg L-1 Pectimorf®)
y del tratamiento donde se empleó el Pectimorf® en presencia
de ANA a la concentración de 15 mg L-1. En este caso fue necesaria
la presencia de ANA + Pectimorf®, donde el producto tuvo un efecto
similar a las citoquininas al suplir la ausencia de BAP y estimular el crecimiento
de los ápices de yuca.
El efecto de las citoquininas en el crecimiento y la morfogénesis in
vitro es importante pues se considera que si la relación auxina/citoquinina
en el medio de cultivo es baja, favorece la formación de tallos y lo
contrario promueve el enraizamiento (20, 21). Este balance está determinado
por las concentraciones endógenas de auxinas y citoquininas presentes
en el explante. Usualmente en los ápices la citoquinina endógena
es baja debido a que el principal sitio de síntesis son las raíces,
por lo que la adición exógena en el medio de cultivo favorece
el crecimiento de los meristemos.
Para este carácter podemos plantear que el tratamiento 3, donde se sustituyó
el ANA por 5 mg L-1 Pectimorf® fue capaz de estimular
el crecimiento de los meristemos en ´CMC-40´; aunque sin diferir
de otros; sin embargo, el clon ´Señorita´ requirió
la presencia de la auxina y concentraciones de 5 y 10 mg L-1 de Pectimorf®
tratamientoB (5), lo que hace pensar que el contenido endógeno de auxinas
en este clon es inferior, por lo que se necesita su adición exógena
para lograr el balance apropiado para el crecimiento de los ápices.
Para el número de hojas, en el clon ´CMC-40´, cuando se utilizó
el Pectimorf® en la concentración de 15 mg L-1
de Pectimorf®, en presencia de ambos reguladores, las vitroplantas
alcanzaron 5,5 hojas sin diferenciarse estadísticamente del tratamiento
3 (en ausencia de ANA y 5 mg L-1 de Pectimorf® ),
pero sí del resto de los tratamientos. Las hojas desarrolladas en el
tratamiento 3, tenían una coloración verde bosque (228B22), lo
cual no ocurrió en el tratamiento 11 (ANA, BAP, AG3 y 15 mg
L-1 de Pectimorf®), ya que estas fueron de color amarillo
(FFFF00). Es muy probable que haya ocurrido un desbalance hormonal que trajo
consigo alteraciones en la síntesis de pigmentos relacionados con la
clorofila.
En el clon ´Señorita´, los máximos valores en cuanto
al número de hojas se obtuvieron en los tratamientos 6, 7 y 14, los cuales
no difirieron estadísticamente entre ellos, ni con el resto de los tratamientos
empleados excepto del tratamiento 2, correspondiente al medio sin reguladores
del crecimiento (ANA, BAP) ni Pectimorf, en el cual las hojas tenían
un color amarillo (FFFF00) también presente en los tratamientos 9, 10
y 11. En el resto de los tratamientos las hojas fueron de color verde primavera
(00FF7F).
En el clon ´CMC-40´ el mejor tratamiento para el número de
raíces fue el 3, que contenía 6-BAP y 5 mg L-1 Pectimorf®,
sin diferencias significativas con el control ni con los tratamientos 6, 7,
9, 10 y 11 que contenían ANA y 5 y 10 mg L-1 de Pectimorf®
respectivamente, en el caso de los dos primeros y ANA y BAP con 5, 10 y 15 mg
L-1 de Pectimorf® en el caso de los tres últimos.
Al parecer, esta variable no dependió de las concentraciones exógenas
para la movilización de las auxinas en la formación de raíces.
En el número de raíces para el clon ´Señorita´
el mayor valor fue el tratamiento 7, con ANA y 10 mg L-1 de Pectimorf®,
sin diferencias significativas con los tratamientos que contenían 0,02
mg L-1 de ANA en todas las concentraciones de Pectimorf®,
ni del tratamiento control en presencia de ANA y BAP y de los tratamientos 12,
13 y 14 sin ANA y BAP con las otras concentraciones de Pectimorf®.
Se observó que las concentraciones ensayadas de este producto contribuyeron,
en gran medida, al desarrollo del sistema radicular.
En la Figura 1, se observa
un engrosamiento de las raíces, lo cual podría ocurrir producto
del desbalace hormonal auxina/citoquinina, que pudo producir un exceso en los
niveles endógenos del explante y al interaccionar con el AG3
influyó en el engrosamiento de este órgano en ambos clones, este
suceso no ocurrió en el resto de los tratamientos.

La rizogénesis
in vitro es un proceso complejo en el que se debe profundizar, ya que
influyen múltiples factores entre los que se encuentran la composición
del medio de cultivo y el origen del explante inicial (especie, genotipo y edad
fisiológica).
Al parecer la rizogénesis es un proceso menos afectado en la yuca por
la presencia de reguladores en el medio de cultivo, ya que en los tratamientos
donde se empleó Pectimorf® como sustituto total de los
reguladores ANA y BAPD (7, 10) se obtuvieron los peores resultados en el clon
´CMC-40´; sin embargo, la ausencia de dichos reguladores afectó
en menor medida al clon ´Señorita´, ya que estos tratamientos
obtuvieron medias superiores al clon ´CMC-40´, fundamentalmente
en las concentraciones 10 y 15 mg L-1 Pectimorf® y
la coloración fue verde bosque (228B22) (Figura
2). En esta figura se observa que la coloración de las hojas fue
amarillo (FFFF00) para ambos clones en el tratamiento 2, correspondiente al
medio libre de los reguladores del crecimiento ANA y 6-BAP y sin Pectimorf,
al parecer la presencia de AG3 no es suficiente para activar los
mecanismos fisiológicos que promuevan una respuesta en la formación
de algunos pigmentos de las hojas, como sobre la altura de los brotes.

La acción de las giberelinas va dirigido principalmente sobre el crecimiento
de los entrenudos, eliminar la dormancia de yemas y semillas, inducir y acelerar
la floración e intervenir en la tuberización (22, 23).
Sin embargo, otros autores demostraron un efecto sinérgico del Pectimorf®
con AIA (24), que repercutió en el incremento del porcentaje de germinación
de cápsulas de semilla artificial de caña de azúcar, sin
reacción en la interacción del oligosacárido con la giberelina,
aunque en el tratamiento donde se combinaron el Pectimorf® con
ambos reguladores del crecimiento (AIA y GA3) fue donde se logró el mayor
número de plantas.
En el cultivo de
la yuca (Manihot esculenta C.) son numerosos los autores que emplean
como reguladores del crecimiento en los protocolos de micropropagación,
la auxina ácido naftalenacético (ANA) y la citoquinina bencilaminopurina
(6-BAP), para lograr una mayor eficiencia del proceso (9, 10).
Los oligogalacturónidos también se emplean en diferentes procesos
biotecnológicos como: crecimiento de plántulas de yuca (Manihot
esculenta C.) (24), cultivo de embriones de Citrus macrophylla
WG, cultivo de brotes de malanga (Colocassia spp) (25),
formación de callos embriogénicos de mandarina ´Cleopatra´
(Citrus reshni Hort. ex Tan) (16) y ápices meristemáticos
de bananos (Musa spp.)E.
Son numerosos los trabajos que corroboran que Pectimorf® ejerce
un efecto similar al de las auxinas, en el establecimiento in vitro
de yemas de boniato (Ipomea batata L.) (26), quienes emplearon Pectimorf®
(10 mg L-1) en sustitución de ácido indol-3-acético
(0,05 mg L-1) y ácido giberélico (10 mg L-1),
donde fue posible el crecimiento de las yemas en todas las concentraciones empleadas
de Pectimorf®.
En caña de azúcar (Sacharum spp.), en la fase de histodiferenciación
de callos el mayor número de embriones y la mayor sincronía ocurrió
en aquellas combinaciones en las cuales el 2,4-D se redujo a la mitad y a la
concentración de 5 mg L-1 del oligosacárido (27).
En la propagación in vitro del Spathiphyllum spp. (14)
se observó que el tratamiento consistente en la reducción del
6-BAP a la mitad de la concentración a utilizar en el medio control (0,5
mg L-1) y la adición de 10 mg L-1 de Pectimorf®
produjo la mayor cantidad de brotes en las plantas.
En el cultivar ´CMC-40´ la inclusión del Pectimorf®
a la concentración más baja (5 mg L-1) en sustitución
del ANA (0,02 mg L-1), combinado con la citoquinina (6-BAP) (0,04
mg L-1) resultó superior en altura, número de hojas
y raíces, aunque sin diferencias del control; sin embargo, en el clon
´Señorita´, se requirió la presencia del ANA (0,04
mg L-1) y concentraciones de 5 y 10 mg L-1 de Pectimorf®
para alcanzar los mejores resultados de altura, número de hojas y raíces
e incluso estos tratamientos repercutieron sobre el color de las hojas, lo cual
evidenció que resultaran suficientes para promover la formación
de pigmentos en las hojas. Teniendo en cuenta que, entre ambos tratamientos,
en el caso de este clon no hubo diferencias significativas, pudiéramos
emplear 5 mg L-1 de Pectimorf® con 0,02 mg L-1
ANA. Esta diferencia en el comportamiento de ambos clones, hace pensar que el
contenido endógeno de auxinas en `Señorita´ fue inferior,
por lo que resultó necesaria la adición exógena del Pectimorf®
en presencia de esta en el medio para igualar los valores de los indicadores.
De estos resultados, es necesario resaltar que el empleo del Pectimorf®
favoreció el establecimiento in vitro de ápices de yuca
(Manihot esculenta C.) en los clones `CMC-40´ y `Señorita´;
sin embargo, su efecto no fue idéntico en ambos clones, lo cual demuestra
la influencia del genotipo a la hora de establecer modificaciones en cualquier
metodología, principalmente cambios en los reguladores del crecimiento
y sus concentraciones en los medios de cultivo.
AGRADECIMIENTOS
Agradecer al Departamento
de Fisiología y Bioquímica, en especial a la Dra. Inés
M. Reynaldo Escobar del Instituto Nacional de Ciencias Agrícolas (INCA),
provincia Mayabeque por facilitar el Pectimorf® y a la Tec. Miladys
Sánchez Quintana, por ayudar en el montaje de los experimentos desarrollados
en este trabajo.
BIBLIOGRAFÍA
1. Ghanem, H. The
state of food insecurity in the world. [en línea], (eds. Dawe, D.,
Stamoulis, K., y Wiebe, K.), edit. Electronic Publishing Policy and Support
Branch Communication Division FAO, Rome, Italy, 2009, ISBN 978-92-5-106288-3,
[Consultado: 8 de septiembre de 2015], Disponible en: <http://www.fao.org/docrep/012/i0876e/i0876e00.htm>.
2. Nassar, N.M.A.; Junior, O.P.; Sousa, M.V. y Ortiz, R. ‘‘Improving Carotenoids
and Amino-Acids in Cassava’’, Recent Patents on Food, Nutrition & Agriculture,
vol. 1, no. 1, 1 de enero de 2009, pp. 32-38, ISSN 2212-7984, 1876-1429.
3. Pérez, J.L. ‘‘Proyección Estratégica hasta el 2015’’,
Programa Integral de los Cultivos Varios, 1.a ed., edit. Liliana, La
Habana, Cuba, 2010, p. 95, ISBN 978-959-7111-55-9.
4. Santana, M.A.; Romay, G.; Matehus, J.; Villardón, J.L. y Demey, J.R.
‘‘Simple and low-cost strategy for micropropagation of cassava (Manihot
esculenta Crantz)’’, African Journal of Biotechnology, vol. 8,
no. 16, 2009, ISSN 1684-5315, DOI 10.4314/ajb.v8i16.62061, [Consultado: 8 de
septiembre de 2015], Disponible en: <http://www.ajol.info/index.php/ajb/article/view/62061>.
5. Medero, V.V.; Borroto, C.; Rodríguez, S.; Gómez, R.; López,
J.; García, M.; Ventura, J.; Espinosa, J.; Cabrera, M.; Martínez,
M.; Torres, M.; Torres, Y.; Álvarez, M. y García, J. ‘‘Embriogénesis
somática a partir de meristemos axilares en yuca’’, Biotecnología
Vegetal, no. 1, 2000, pp. 27-32, ISSN 2074-8647.
6. Onuoch, C.I. y Onwubiku, N.J.C. ‘‘Micropropagation of cassava (Manihot
esculenta Crantz) using different concentration of Benzyaminiopurin (BAP)’’,
Journal of Engineering and Applied Sciences, vol. 2, no. 7, 2007, pp.
1229-1231, ISSN 1816-949x, 1818-7803.
7. Li, H.-Q.; Sautter, C.; Potrykus, I. y Puonti-Kaerlas, J. ‘‘Genetic transformation
of cassava (Manihot esculenta Crantz)’’, Nature Biotechnology,
vol. 14, no. 6, junio de 1996, pp. 736-740, ISSN 1087-0156, DOI 10.1038/nbt0696-736.
8. Medina, R.D.; Faloci, M.M.; Neffa, V.S. y Mroginski, L.A. ‘‘Embriogénesis
somática y regeneración de plantas de mandioca (Manihot esculenta
Crantz) de cultivares de interés para Argentina’’, Revista de
Investigaciones Agropecuarias, vol. 32, no. 3, 2003, pp. 143-160, ISSN
0325-8718, 1669-2314.
9. Ochoa, J.C.; Chavarriaga, P.; López, C. y others ‘‘Embriogénesis
somática y producción de callo embriogénico friable de
dos cultivares de yuca (Manihot esculenta Crantz)’’, Revista Colombiana
de Biotecnología, vol. 14, no. 2, 2012, pp. 20–27, ISSN 0123-3475.
10. Mapayi, E.F.; Ojo, D.K.; Oduwaye, O.A. y Porbeni, J.B.O. ‘‘Optimization
of In-Vitro Propagation of Cassava (Manihot esculenta Crantz) Genotypes’’,
Journal of Agricultural Science, vol. 5, no. 3, 2013, p. 261, ISSN
1916-9760, DOI 10.5539/jas.v5n3p261.
11. Cabrera, J.; Iglesias, R. y Hormaza, J. Procedimiento de obtención
de una mezcla de oligosacáridos pécticos estimuladora del enraizamiento
vegetal, Instituto Nacional de Ciencias Agrícolas, Cuba, no. 155,
2003.
12. Hernández-Mata, G.; Mellado-Rojas, M.E.; Richards-Lewis, A.; López-Bucio,
J.; Beltrán-Peña, E. y Soriano-Bello, E.L. ‘‘Plant Immunity Induced
by Oligogalacturonides Alters Root Growth in a Process Involving Flavonoid Accumulation
in Arabidopsis thaliana’’, Journal of Plant Growth Regulation, vol.
29, no. 4, 30 de mayo de 2010, pp. 441-454, ISSN 0721-7595, 1435-8107, DOI 10.1007/s00344-010-9156-x.
13. Galletti, R.; Ferrari, S. y Lorenzo, G.D. ‘‘Arabidopsis MPK3 and MPK6 Play
Different Roles in Basal and Oligogalacturonide- or Flagellin-Induced Resistance
against Botrytis cinerea’’, Plant Physiology, vol. 157, no.
2, 1 de octubre de 2011, pp. 804-814, ISSN , 1532-2548, DOI 10.1104/pp.111.174003,
[PMID: 21803860].
14. Hernández, M.M.; Suárez, L. y Valcárcel, M. ‘‘Empleo
del Pectimorf en la micropropagación de Spathiphyllum sp.’’,
Cultivos Tropicales, vol. 30, no. 3, septiembre de 2009, pp. 56-58,
ISSN 0258-5936.
15. Hernández, A.; Ascanio, M.O.; Morales, M. y León, A. La
historia de la clasificación de los suelos de Cuba, edit. Félix
Varela, La Habana, Cuba, 2006, p. 98, ISBN 959-07-0145-0.
16. Hernández, R.M.; Diosdado, E.; Coll, F. y Cabrera, J.C. ‘‘Efecto
de los biorreguladores del crecimiento en la embriogénesis somática
demandarina Cleopatra (Citrus reshni Hort. ex Tan.)’’, Cultivos
Tropicales, vol. 31, no. 3, septiembre de 2010, pp. 00-00, ISSN 0258-5936.
17. Hernández, A.; Pérez, J.; Bosch, D. y Castro, N. Clasificación
de los suelos de Cuba 2015, edit. Ediciones INCA, Mayabeque, Cuba, 2015,
p. 93, ISBN 978-959-7023-77-7.
18. Murashige, T. y Skoog, F. ‘‘A revised medium for rapid growth and bio assays
with tobacco tissue cultures’’, Physiologia Plantarum, vol. 15, no.
3, 1962, pp. 473–497, ISSN 1399-3054.
19. IBM SPSS Statistics [en línea], versión 17, [Windows],
edit. IBM Corporation, U.S, 2011, Disponible en: <http://www.ibm.com>.
20. Buchanan, B.B.; Gruissem, W. y Jones, R.L. Biochemistry & Molecular
Biology of Plants, 1.a ed., edit. American Society of Plant Physiologists
Rockville, MD, Maryland, USA, 22 de marzo de 2002, p. 1408, ISBN 978-0-943088-39-6.
21. Pernisová, M.; Klíma, P.; Horák, J.; Válková,
M.; Malbeck, J.; Soucek, P.; Reichman, P.; Hoyerová, K.; Dubová,
J. y Friml, J. ‘‘Cytokinins modulate auxin-induced organogenesis in plants via
regulation of the auxin efflux’’, Proceedings of the National Academy of
Sciences, vol. 106, no. 9, 2009, pp. 3609–3614, ISSN 0369-8211, 2250-1746.
22. Bari, R. y Jones, J.D.G. ‘‘Role of plant hormones in plant defence responses’’,
Plant Molecular Biology, vol. 69, no. 4, 16 de diciembre de 2008, pp. 473-488,
ISSN 0167-4412, 1573-5028, DOI 10.1007/s11103-008-9435-0.
23. Lalitha, N.; Kih, S.; Banerjee, R.; Chattopadhya, S.; Saha, A.K. y Bindroo,
B.B. ‘‘High frequency multiple shoot induction and in vitro regeneration
of mulberry (Morus indica L. cv. S-1635)’’, International Journal
of Advanced Research, vol. 1, 2013, pp. 22–26, ISSN 2320-5407.
24. Suárez, L.; Cervone, F.; Hernández, M.M. y Sánchez,
M. ‘‘Aclimatización de plántulas de yuca (Manihot esculenta).
Aporte al estudio de los mecanismos de acción de Pectimorf’’, IX Congreso
Internacional de Biotecnología Vegetal, Ciego de Ávila, Cuba,
2013, ISBN 978-959-16-2045-3.
25. Hernández, M.M.; Suárez, L.; Castilla, Y.; González,
M.E.; Valcárcel, M. y López, M. ‘‘Empleo de una mezcla de oligogalacturónidos
en la micropropagación de la malanga (Colocasia sp.), var. «Camerum
14»’’, XV Congreso Científico del INCA, edit. Ediciones
INCA, Mayabeque, Cuba, 2006, ISBN 959-7023-36-9.
26. González, O.; Falcón, A.; Hernández, M.; Iglesias,
R.; Silva, J.J.; López, M.; Rodríguez, J.E.; Arias, L.; Cabrera,
J.C. y Oliva, E. ‘‘Evaluación del efecto del Pectimorf®
en el establecimiento in vitro de yemas axilares de boniato clon CEMSA
78-354’’, Biotecnología Vegetal, vol. 4, no. 2, 2004, pp. 115–119,
ISSN 1609-1841, 2074-8647.
27. Cid, M.; González-Olmedo, J.L.; Lezcano, Y. y Nieves, N. ‘‘Influencia
del Pectimorf sobre la calidad de la semilla artificial de la Caña de
azúcar (Saccharum sp.)’’, Cultivos Tropicales, vol.
27, no. 1, 2006, pp. 31–34, ISSN 0258-5936, 1819-4087.
Recibido: 5 de
enero de 2015
Aceptado: 11 de junio de 2015
Ms.C.
Lorenzo Suárez Guerra, Instituto Nacional Ciencias Agrícolas
(INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700.
Email: lguerra@inca.edu.cu



