Crecimiento,
relaciones hídricas y aprovechamiento nutricional en el tomate inoculado
con un inoculante micorrízico en soporte líquido
Growth,
water relations and efficiency in nutrients utilization by tomato plants inoculated
with a mycorrhizal inoculant in liquid support
Dr.C. José
M. Dell’Amico,I Dr.C. Félix Fernández,II
Dr.C. Emilio Nicolás Nicolás,III Dra.C. María
de J. Sánchez-BlancoIII
IInstituto
Nacional Ciencias Agrícolas (INCA), gaveta postal 1, San José
de las Lajas, Mayabeque, Cuba, CP 32700.
IIEmpresa
SYMBORG, Campus de Espinardo 7 edif. CEEIM CP 30100, Murcia, España.
IIICentro
de Edafología y Biología Aplicada del Segura (CEBAS-CSIC), Murcia,
España.
RESUMEN
El trabajo se
realizó con el objetivo de conocer los efectos de diferentes dosis de
un inoculante micorrizógeno en soporte líquido en variables del
crecimiento, las relaciones hídricas y la eficiencia en el aprovechamiento
de los nutrientes de plantas de tomate. Para su realización, se cultivaron
en macetas plantas de tomate del cultivar INCA 9 [1] colocadas en un invernadero
de policarbonato. Se estudiaron tres dosis (D1, D2 y D3) 75 (D1), 150 (D2) y
300 esporas planta-1 (D3), aplicadas en la siembra mediante su inyección
por el sistema de fertirriego y un tratamiento control, sin inocular. A los
25 y 40 días después de la germinación (DDG) se realizaron
evaluaciones de variables fúngicas, de crecimiento en biomasa seca, del
potencial hídrico foliar y sus componentes, la conductancia estomática
y a los 40 DDG se realizó un análisis foliar para evaluar la concentración
foliar de nutrientes y la eficiencia de utilización de estos. Los resultados
mostraron, que con cualquiera de las dosis aplicadas se alcanzan beneficios
importantes de la simbiosis, con incrementos en las variables fúngicas,
el contenido de biomasa seca, las relaciones hídricas y la mejor eficiencia
en la utilización de los nutrientes. Sin embargo, en general, solo con
la aplicación de la dosis D1 se obtuvieron estos beneficios, resultando
en este trabajo la dosis más adecuada y rentable.
Palabras
clave: tomate,
hongos del suelo, crecimiento, relaciones planta agua, nutrición.
ABSTRACT
The work was performed
in order to know the effects of different doses of a mycorrhizal inoculant in
liquid support in growth variables, water relations and efficiency in the use
tomato plants nutrients. For its realization, tomato plants INCA 9 [1] were
grown in pots and placed in a polycarbonate greenhouse. Three doses were studied
(D1, D2 and D3) 75 (D1), 150 (D2) and 300 spores plant-1, applied in seeding
through injection by irrigation system and a non-inoculated control. At 25 and
40 days after germination (DDG ) evaluation of fungal variables, growth on dry
biomass, leaf water potential and its components, stomatic conductance the concentration
of foliar nutrients and efficiency use of these. The results showed that with
any of the applied doses important benefits are achieved by symbiosis with increases
of fungal variables, the content of dry biomass, water relations and the best
efficiency in the use of nutrients. However, in general only with the application
of the D1 dose, these benefits were obtained, resulting in this work the most
appropriate and economic dose.
Key words:
tomato, soil fungi, growth, plant water relations, nutrition.
INTRODUCCIÓN
El interés
fundamental que ha despertado la asociación de las plantas con los Hongos
Micorrízicos Arbusculares (HMA), se debe a su universalidad entre las
familias de plantas vasculares, su inespecificidad aparente al inocularlas y
a evidencias numerosas de su influencia en el crecimiento de las plantas mediante
una incorporación mayor de nutrientes y la mejora de sus relaciones hídricas
(1, 2).
En los ecosistemas naturales y semi-naturales, los HMA son el grupo más
abundante y funcionalmente los más importantes en el suelo y responsables
de la dependencia micotrófica del 90 % de las plantas terrestres (3).
Es debido, a sus efectos benéficos en las plantas que son aplicados en
la práctica agrícola como biofertilizantes. Además, su
empleo reduce considerablemente el impacto ambiental en las zonas agrícolas
(4, 5).
Estos productos, generalmente son elaborados en soporte sólido y en Cuba,
en el Instituto Nacional de Ciencias Agrícolas (INCA) a partir del año
2000 se obtuvo un inoculante en soporte líquido, LicoMic (6) lo que permite
su empleo a través de sistemas de riego y así diversificar las
vías de aplicación de estos hongos con mayor eficiencia en dosis
adecuadas y rentables.
Por lo antes expuesto, se realizó el siguiente trabajo con el objetivo
fundamental de conocer los efectos de diferentes dosis de un inoculante micorrizógeno
en soporte líquido en variables del crecimiento, las relaciones hídricas
y la eficiencia en el aprovechamiento de los nutrientes de plantas de tomate.
MATERIALES
Y MÉTODOS
El trabajo se
realizó en la finca experimental del Centro de Edafología y Biología
Aplicada del Segura (CEBAS-CSIC), en la localidad de Santomera-Murcia, España.
Semillas de Solanum lycopersicon L. variedad INCA 9 [1] de crecimiento
determinado, correspondiente al programa de mejoramiento genético del
tomate del INCA-MES, fueron sembradas de forma directa en recipientes (macetas)
de 5 L de capacidad que contenían un sustrato compuesto de suelo-arena
lavada-vermiculita mezclados en relación 3:2:1 v/v. Las características
del suelo utilizado aparecen en la Tabla
I.

Tratamientos
Se estudiaron cuatro tratamientos: tres dosis (D1, D2 y D3) de un inoculante
micorrizógeno en soporte líquido a base de Glomus fasciculatun
actualmente Glomus cubensis (7), 75 (D1), 150 (D2) y 300 esporas planta-1
(D3), aplicadas en la siembra. Estas dosis se compararon frente a un tratamiento
Control, sin inoculación. A cada tratamiento correspondieron 25 macetas
distribuidas siguiendo un diseño completamente aleatorizado y fueron
colocadas en un invernadero de policarbonato equipado con un sistema de refrigeración
tipo cooling.
La inoculación se realizó por el sistema de riego, empleando una
bomba inyectora con caudal de 30 L h-1. Para la aplicación
de las diferentes dosis se insertaron válvulas en las líneas de
riego que permitieron independizar cada tratamiento (dosis) y poder realizar
una inoculación correcta.
El riego se llevó a cabo mediante un sistema de fertirriego y a cada
recipiente (maceta) se le colocó un emisor (gotero) de 2 L h-1
de entrega y un dispositivo para la distribución uniforme del agua en
la superficie del sustrato.
A partir de la siembra hasta el inicio de la germinación el riego fue
con agua solamente a razón de 0,5 L aplicado dos veces por día
a cada recipiente para asegurar una buena germinación. Después
de germinadas las plantas, estas recibieron 0,40 L dos veces por semana hasta
12 días después de la siembra. A partir de esta fecha se inició
la fertirrigación, adicionando a un tanque de 2000 L los siguientes fertilizantes:
NH4 NO3 (96 %) ____________ 86 g
KNO3 (99,8 %) _________ 1430 g
Ca (NO3)2 (91 %) ____________ 828 g
H3PO4 (72 %) ___________ 408 g
HNO3 (54 %) ____________ 352 g
Al inicio el fertiriego se aplicó a razón de 0,40 L por recipiente
tres veces por semana y se mantuvo así hasta el inicio del cuajado de
los frutos, momento en el cual se comenzó a regar diariamente. El riego
y la fertirrigación siempre se aplicaron por igual a todos los tratamientos.
Los resultados del análisis del agua utilizada para el riego del experimento
se muestran a continuación:
PH _______________ 7,90
C.E. _____________ 1,166 mmhos cm-1
S.T.D. ___________ 0,830 g L-1
Estos valores demuestran que el agua utilizada fue de buena calidad.
Evaluaciones realizadas
Variables fúngicas
• Colonización radical: método de Azul de Tripan (8).
• Ocupación porcentual fúngica (9).
• Dependencia Micorrízica (DM) en base a la producción de masa
seca total y mediante la fórmula:

Las evaluaciones
fueron realizadas en raicillas de tres plantas por tratamiento y en dos momentos
de muestreos, a los 25 y 40 días de germinadas (DDG). Para la colonización
y la ocupación porcentual las muestras fueron observadas en un estéreomicroscopio
y microscopio Olympus.
Potencial hídrico foliar (Ψf) (Mpa) y sus componentes. Se midió
en cinco plantas por tratamiento a los 25 y 40 DDG. La primera evaluación
se realizó entre las 9:00 y 10:00 a.m. y la segunda entre las 5:00 y
6:00 a.m. (antes del alba) y para ello se utilizó una cámara de
presión (Soil Moisture Equipment Co, Santa Bárbara, C A). Para
el potencial osmótico actual foliar (ΨO act. foliar)
inmediatamente después de evaluar el Ψf las hojas se cubrieron con
papel aluminio y se congelaron en nitrógeno líquido y para la
determinación del potencial osmótico saturado foliar (ΨOsat
foliar) se tomaron hojas aledañas a las seleccionadas para
la medida de Ψf y se colocaron en cámaras de hidratación
con agua destilada, a la oscuridad y entre 6 y 8 ºC durante 24 horas. Inmediatamente
después se envolvieron con papel aluminio para su congelación
en nitrógeno líquido y se almacenaron en congelador a – 80 ºC.
Posteriormente se descongelaron a temperatura ambiente, se colocaron en Ependorf
con pequeños orificios en su base, estos se colocaron dentro de otro
similar sin perforar y por centrifugación durante tres minutos a 3 000
rpm se extrajo el jugo celular. A partir de alícuotas de 100 µL,
se determinó el potencial osmótico actual (ΨO act. foliar)
y el potencial osmótico saturado foliar (ΨOsat foliar)
con un osmómetro de presión de vapor Wescor 5500.
El potencial de presión (Ψp) se calculó a partir de la diferencia
entre el potencial hídrico foliar y el potencial osmótico foliar
actual, mediante la siguiente ecuación:
Ψp= Ψf - ΨO act. foliar (Mpa).
Conductancia estomática
(gs). Estas evaluaciones se realizaron en tres plantas por tratamiento a los
25 y 40 DDG. En todos los casos las evaluaciones se comenzaron a las 10:30 a.m.
utilizando un porómetro de difusión steady state (LICOR-1600,
LICOR, Reino Unido). Para las evaluaciones correspondientes al potencial hídrico
foliar y conductancia estomática se tomaron hojas del tercio superior
de las plantas y bien expuestas al sol.
Masa seca de raíz y parte aérea. Estas variables se evaluaron
en dos momentos del ciclo vegetativo de las plantas, a los 25 y 40 DDG. Para
ello se tomaron 10 plantas por tratamiento y fueron separadas en raíz
y parte aérea y secados en estufa de tiro forzado a 75 ºC hasta
peso constante.
Análisis mineral. A los 40 DDG se realizó un análisis foliar
con el objetivo de conocer los efectos de los tratamientos en las concentraciones
(%) de Nitrógeno (N), Fósforo (P), Potasio (K), Calcio (Ca) y
Magnesio (Mg). Para ello, se tomaron cinco muestras por tratamiento, compuestas
por 15 hojas totalmente desarrolladas y tomadas al azar.
Las determinaciones minerales se realizaron en un laboratorio especializado
en este tipo de análisis. Los porcentajes de N y P se determinaron por
el método del reactivo de Nessler y por espectrometría y las concentraciones
de K, Ca y Mg mediante un espectrofotómetro de absorción atómica
Shimadzu AA-680 (Shimadzu Co. Ltd. Kyoto, Jp.). La eficiencia de la utilización
de los nutrientes fue definida como la cantidad de biomasa producida por unidad
de nutriente en los tejidos y fue calculada por la relación:
Producción de biomasa aérea (g) (10)
Concentración de nutrientes (%)
Los datos del porcentaje de colonización micorrízica fueron transformados
por la función 2arcsen√x. Esta variable, al igual que los otros
indicadores evaluados fue sometida a un análisis de varianza de clasificación
simple (ANOVA). Para el procesamiento de los datos y la comparación de
medias, se utilizó el programa estadístico SPSS 10.0 para Windows
y las medias con diferencias significativas se compararon según la prueba
de Rangos Múltiples de Duncan para p≤0,05.
RESULTADOS
Y DISCUSIÓN
Al analizar el
comportamiento de la colonización micorrízica (Tabla
II), se encontró que tanto a los 25, como a los 40 DDG no se encontraron
diferencias significativas en las plantas inoculadas con las diferentes dosis
estudiadas y los porcentajes de colonización más altos se presentaron
a los 40 DDG, correspondiendo con la etapa de fructificación del tomate
y en las plantas inoculadas. Cabe señalar que las plantas del tratamiento
control presentaron, en ambos momentos, valores de infección mínimos,
mientras que las correspondientes a los tratamientos inoculados presentaron
valores relativamente altos en comparación con lo informado por otros
investigadores trabajando en este cultivo (11).

El hecho de no existir diferencias significativas en los porcentajes de colonización
entre las dosis estudiadas de este inoculante en formulación líquida,
corroboró la eficacia de la inoculación con este producto, comportamiento
que ha sido señalado con anterioridadA.
Por otra parte, los por cientos de ocupación fúngica, que representan
la intensidad de la colonización micorrízica, aumentaron considerablemente
con el desarrollo del cultivo. A los 25 DDG los valores de esta variable fueron
significativamente mayores en las plantas inoculadas con la dosis (D2) y a los
40 DDG no se apreciaron diferencias estadísticamente significativas entre
las diferentes dosis. El hecho de existir una ocupación fúngica
mayor a los 40 DDG justifica una eficiencia simbiótica mayor, al existir
más estructuras fúngicas en el interior de las células
radicales, y por tanto, un intercambio hongo-hospedera mayor, independientemente
de la dosis empleada.
En cuanto a la dependencia micorrízica (DM), a los 25 DDG se encontró
un comportamiento similar al del porcentaje de colonización y a los 40
DDG, la mayor dependencia micorrízica correspondió a las plantas
inoculadas con D2, seguidas por las plantas de los tratamientos D1 y D3, respectivamente.
Resulta oportuno señalar que a los 40 DDG la DM disminuyó en las
plantas inoculadas con D1 y D3, con respecto a los 25 DDG, mientras que los
valores en las inoculadas con D2 se mantuvieron similares.
Es de destacar que en esta variable no existieron diferencias estadísticamente
significativas entre las plantas inoculadas con D1 y D2 en los momentos evaluados,
lo que sugiere que la simbiosis fue efectiva independientemente del número
de esporas aplicado y las plantas inoculadas alcanzaron un crecimiento de la
biomasa total entre un 40 y 54 % mayor que las no inoculadas a los 25 DDG.
En este sentido, en el cultivo del olivo (Olea europaea) se encontraron
valores de DM entre 39 y 62 %, en dependencia de la cepa de Glomus empleada
(10). En la especie Oyedaea verbesinoides (12) inoculando con la cepa
Glomus manihotis han informado valores elevados de DM.
Otros investigadores señalan que las especies leñosas presentan
una dependencia micorrízica mayor que las herbáceas, lo que al
parecer está asociado a la carencia de pelos absorbentes. Por otra parte,
existen evidencias de que las plantas con raíces ramificadas son más
dependientes de las asociaciones micorrízicas que las no ramificadas.
Otros estudios sugieren además, que las raíces fibrosas de especies
tropicales son colonizadas rápidamente con una respuesta mayor en el
crecimiento como resultado de la simbiosis (13).
En la Tabla III se presentan
los valores de Ψf y sus componentes ΨO act.foliar y Ψp,
así como del ΨOsat foliar donde se encontró, que
a los 25 DDG las plantas inoculadas con la dosis D1 presentaron los valores
más altos de Ψf con diferencias significativas con el resto de los
tratamientos, de igual forma ocurrió con los valores de Ψp, aunque
en este caso no hubo diferencias significativas con respecto a las otras dosis
empleadas y sí con las plantas control. En cuanto al ΨO act.foliar,
esta variable fue igual en todos los tratamientos y en el ΨO sat.foliar
los valores más negativos correspondieron a las plantas inoculadas con
las dosis D3 y D1, respectivamente, sin que se apreciaran diferencias estadísticamente
significativas entre ellas.
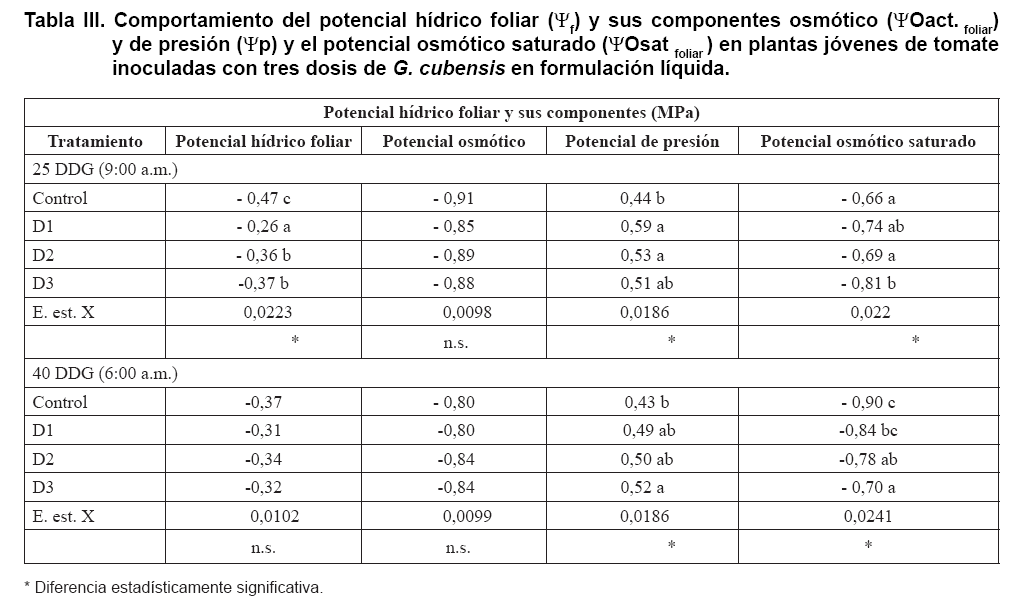
A los 40 DDG no existieron diferencias significativas entre las variables Ψf
y su componente ΨO act. foliar entre las plantas de los tratamientos en
estudio, aunque los valores menos negativos correspondieron a las plantas de
los tratamientos D1 y D3, con valores muy similares. En cuanto al Ψp, no
se encontraron diferencias entre las plantas inoculadas con las tres dosis aplicadas,
pero sí de estas con las del tratamiento control.
En el caso del ΨOsat foliar aun cuando las plantas del tratamiento control
presentaron los valores más negativos, seguidas por las inoculadas con
D1, no se evidenció la ocurrencia del proceso de ajuste osmótico,
teniendo en cuenta los valores de Ψp alcanzado por las plantas de estos
tratamientos.
En general, la inoculación micorrízica con cualquiera de las dosis
empleadas favoreció las relaciones hídricas de las plantas en
ambos momentos evaluados, aunque atendiendo a los valores del Ψf no se
manifestaron síntomas de deficiencia hídrica en las plantas de
ninguno de los tratamientos, indicando que el riego fue efectivo y aplicado
uniformemente a todas las plantas.
Los beneficios de esta simbiosis mutualista en las relaciones hídricas
de diferentes variedades de tomate han sido informados anteriormente con distintas
cepas, dosis, tipos de inoculantes y formas de inoculación (14, 15).
Estos resultados también coinciden con quienes informan que la extensa
red de hifas del micelio extramatrical producida por la simbiosis micorrízica
actúa como una extensión de la raíz en el suelo (16), por
lo que la planta obtiene una disponibilidad adicional de absorción de
nutrientes, principalmente N, P y agua en el suelo (17). Por otra parte otros
señalan que los HMA previenen la formación de espacios grandes
entre las raíces y el suelo, lo que facilita la continuidad del agua
a través de la interfase suelo-raíz (18).
Además de los efectos beneficiosos de los hongos micorrízicos
arbusculares en la fisiología de las plantas, se le han atribuido beneficios
en otros procesos ecológicos, incluyendo sus contribuciones a la estructura
del suelo (19) lo que reviste una importancia vital para la sostenibilidad de
los agroecosistemas. También, se ha se señalado que tienen una
influencia marcada en la formación de los agregados del suelo a través
de procesos bioquímicos, biofísicos y biológicos, los cuales
incluyen las acciones mecánicas de las hifas, la excreción de
glicoproteínas y otros compuestos extracelulares y las interacciones
con la biota del suelo (1). Estos aspectos, sin lugar a dudas, favorecen las
relaciones hídricas del suelo y por consiguiente incrementan la disponibilidad
del agua para las plantas.
En la Tabla IV se representan
los resultados de las evaluaciones de conductancia estomática (gs) de
las plantas.
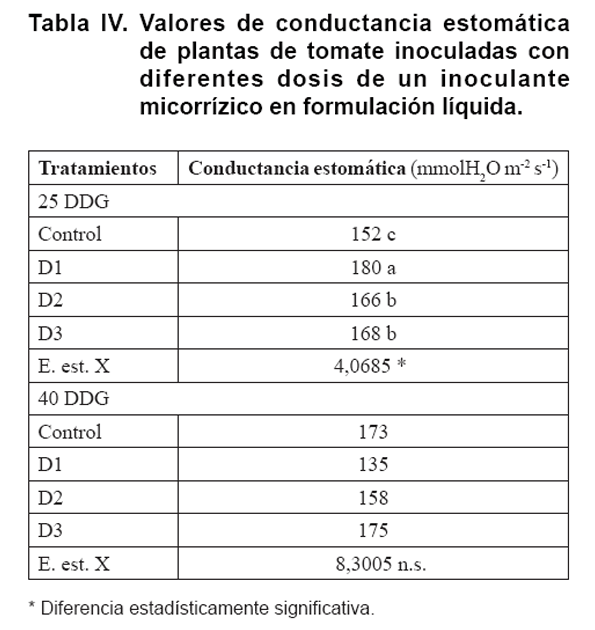
A los 25 DDG los valores más altos de esta variable correspondieron a
las plantas inoculadas con D1, presentando diferencias estadísticamente
significativas con las plantas de los tres tratamientos restantes. Por otra
parte, los valores más bajos se produjeron en las plantas del tratamiento
control, mientras que a los 40 DDG no se presentaron diferencias significativas
en las plantas de los tratamientos estudiados.
Estos resultados indican, que tanto en la gs, como en el Ψf los efectos
beneficiosos de la inoculación fueron menos evidentes en la medida que
se desarrolló el cultivo (40 DDG), incluso en el caso de gs los valores
de esta variable en las plantas inoculadas con D1 y D2 fueron los más
bajos. También, hay que tener en cuenta que estas variables dependen
en gran medida de las condiciones ambientales reinantes en el momento de la
medida y responden además, a muchas perturbaciones vinculadas al continuo
hidráulico suelo-planta-atmósfera.
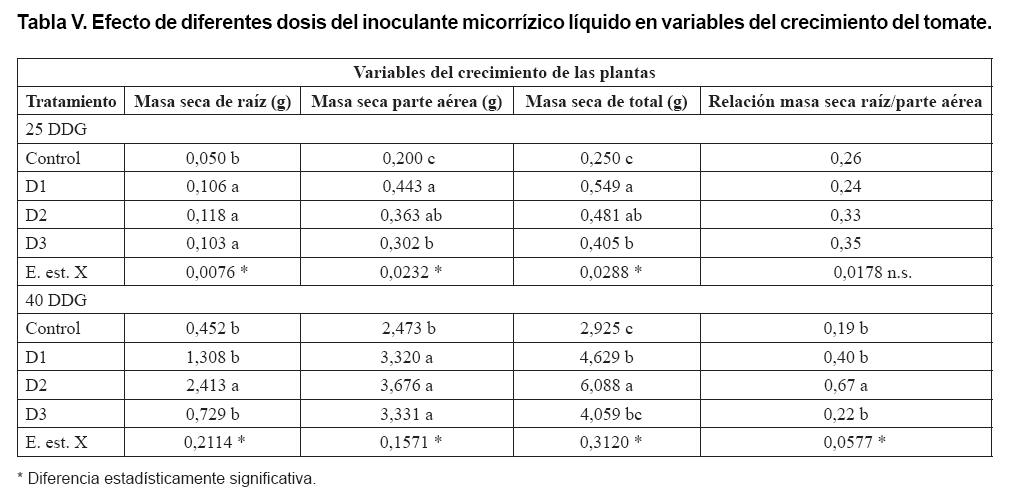
El efecto de los tratamientos de inoculación en la acumulación
de biomasa seca de las plantas se presentan en la Tabla
V, donde se encontró que tanto a los 25, como a los 40 DDG existió
un efecto beneficioso notorio de la inoculación con HMA en la masa seca
de raíz, aérea y total, destacándose generalmente en ese
sentido las plantas inoculadas con las dosis D1 y D2. Sin embargo, en la relación
masa seca de raíz/parte aérea solamente se presentaron diferencias
estadísticamente significativas a los 40 DDG a favor de las plantas inoculadas
con D2, mientras que las correspondientes al tratamiento control presentaron
los valores más pequeños.
Es de señalar que existe un gran número de evidencias acerca de
los beneficios de la micorrización en el crecimiento de las plantas,
en tomate (20), en tabaco Nicotiana tabacum (21), en pimiento Capsicun
annum (22), en arroz Oryza sativa, (16, 23, 24) en trigo duro
Triticum durum (25) en sorgo Sorghum vulgare (26), entre otros,
debido fundamentalmente a una absorción de nutrientes mayor, principalmente
de fósforo (27). Además, se ha demostrado que estos hongos de
forma natural se asocian con otros microorganismos que también contribuyen
de forma positiva al crecimiento de las plantas.
Por otra parte, tanto en el cultivo del tomate, como en el trigo, se ha comprobado
que la inoculación micorrízica en formulación líquida
resultó más efectiva que en soporte sólido (EcoMic) debido,
fundamentalmente, a algunas propiedades que le confiere el medio líquido
a las esporas, que favorecen la germinación y la capacidad infectiva
de estas.
Al analizar los resultados en cuanto a la concentración foliar de nutrientes
(Tabla VI A) se encontró,
que no se presentaron diferencias significativas entre las plantas de los diferentes
tratamientos, en relación con las concentraciones foliares de N, Ca y
Mg y solo estas diferencias se presentaron en las concentraciones de P y K,
sin que se apreciara un efecto sólido de los tratamientos de inoculación
ya que en el caso del P, así como en el resto de los nutrientes, generalmente
las concentraciones mayores correspondieron a las plantas del tratamiento control
y las inoculadas con D2 y en el caso específico del K, la concentración
mayor correspondió a las plantas inoculadas con D3 y D2 y los valores
más bajos se presentaron en las inoculadas con D1. Por otra parte, se
observó que los valores más bajos de concentración se presentaron
en el P y el Mg. Estos resultados, al parecer, están asociados a que
el mayor crecimiento aumentó la demanda de nutrientes, principalmente
de P y esto provocó una disminución de las concentraciones de
nutrientes en la biomasa de las plantas inoculadas. Este comportamiento fue
observado con anterioridad por investigadores que trabajan con diferentes especies
de pastos (28, 29).
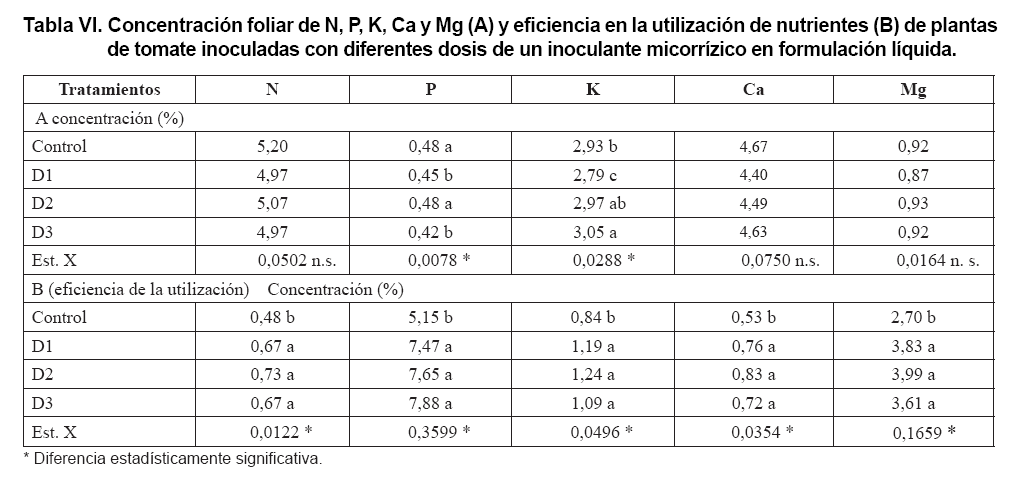
Sin embargo, la inoculación micorrízica favoreció considerablemente
la eficiencia en la utilización de los nutrientes (Tabla
VI B) y en todos los casos la eficiencia resultó mayor en las plantas
de los tratamientos de inoculación, sin diferencias estadísticamente
significativas entre ellas.
Es de destacar, que la magnitud mayor de eficiencia de utilización se
presentó en el P y el Mg, contrario a lo observado en su concentración
y las más bajas correspondieron al N y al Ca.
Estos resultados indican, que las plantas inoculadas con cualquiera de las dosis
estudiadas emplearon con mayor eficiencia los nutrientes del suelo en la producción
de biomasa aérea que las del tratamiento control. Resultados similares
fueron encontrados cuando se trabajó con posturas de tabaco en semilleros
tecnificados (21). Por otra parte, (Roberts 2006) citado por (Stewart 2007)
sugirió muy acertadamente que mejorar la eficiencia del uso de los nutrientes
es un reto importante que debe enfrentar la agricultura en general, existen
las herramientas para lograr este objetivo, siendo el empleo de este tipo de
biofertilizantes un elemento de suma importancia (30). Sin embargo, se debe
evitar que estas mejoras se realicen en perjuicio de los productores o del medio
ambiente, es decir, evitar la disminución de los rendimientos y disminuir
el empleo de los fertilizantes químicos.
CONCLUSIONES
Por los resultados
alcanzados en cada una de las variables analizadas y el efecto beneficioso producido
en ellas por el empleo de las dosis aplicadas de LicoMic, resulta evidente recomendar
la aplicación de la dosis D1 como adecuada y económicamente rentable,
independientemente de continuar los estudios en el empleo de dosis menores y
en otros aspectos relacionados con la absorción de nutrientes.
BIBLIOGRAFÍA
1. Harris-Valle,
C.; Esqueda, M.; Valenzuela-Soto, E.M. y Castellanos, A.E. ‘‘Tolerancia al estrés
hídrico en la interacción planta-hongo micorrízico arbuscular:
metabolismo energético y fisiología’’, Revista Fitotecnia
Mexicana, vol. 32, no. 4, 2009, pp. 265–271, ISSN 0187-7380.
2. Pérez-Moreno, J. y Negreros-Castillo, P. ‘‘Los hongos micorrízicos
arbusculares y su implicación en la producción y manejo de especies
neotropicales forestales, con énfasis en meliáceas’’, Interciencia,
vol. 36, no. 8, 2011, pp. 564–569, ISSN 0378-1844.
3. Smith, S.E. y Read, D.J. Mycorrhizal Symbiosis, edit. Academic Press,
25 de octubre de 1996, p. 621, ISBN 978-0-08-053719-1.
4. Miransari, M. ‘‘Contribution of arbuscular mycorrhizal symbiosis to plant
growth under different types of soil stress’’, Plant Biology, vol.
12, no. 4, 1 de julio de 2010, pp. 563-569, ISSN 1438-8677, DOI 10.1111/j.1438-8677.2009.00308.x.
5. Pérez, A.; Rojas, S.J. y Montes, V.D. ‘‘Hongos formadores de micorrizas
arbusculares: una alternativa biológica para la sostenibilidad de los
agroecosistemas de praderas en el Caribe colombiano’’, Revista Colombiana
de Ciencia Animal, vol. 3, no. 2, 2011, pp. 366-385, ISSN 2027-4297.
6. Fernández, F.; Dell’Amico, J.M. y Pérez, Y. Inoculante
micorrizógeno líquido, no. WO 2006/060968 A1, pp. 1-15.
7. Rodríguez, Y.; Dalpé, Y.; Séguin, S.; Fernández,
K.; Fernández, F. y Rivera, R.A. ‘‘Glomus cubense sp. nov., an arbuscular
mycorrhizal fungus from Cuba’’, Mycotaxon, vol. 118, no. 1, 5 de enero
de 2012, pp. 337-347, DOI 10.5248/118.337.
8. Phillips, J.M. y Hayman, D.S. ‘‘Improved procedures for clearing roots and
staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment
of infection’’, Transactions of the British Mycological Society, vol.
55, no. 1, agosto de 1970, pp. 158-IN18, ISSN 0007-1536, DOI 10.1016/S0007-1536(70)80110-3.
9. Giovannetti, M. y Mosse, B. ‘‘An Evaluation of Techniques for Measuring Vesicular
Arbuscular Mycorrhizal Infection in Roots’’, New Phytologist, vol.
84, no. 3, 1 de marzo de 1980, pp. 489-500, ISSN 1469-8137, DOI 10.1111/j.1469-8137.1980.tb04556.x.
10. Porras-Soriano, A.; Soriano-Martín, M.L.; Porras-Piedra, A. y Azcón,
R. ‘‘Arbuscular mycorrhizal fungi increased growth, nutrient uptake and tolerance
to salinity in olive trees under nursery conditions’’, Journal of Plant
Physiology, vol. 166, no. 13, 1 de septiembre de 2009, pp. 1350-1359, ISSN
0176-1617, DOI 10.1016/j.jplph.2009.02.010.
11. Fundora, L.R.; Mena, A.; Rodríguez, Y.; González, P.J.; Rodríguez,
P. y González-Peña, D. ‘‘Estabilidad de la eficiencia de la cepa
Glomus mosseae en la respuesta del tomate a condiciones de estrés
hídrico fuera de su periodo óptimo’’, Cultivos Tropicales,
vol. 29, no. 4, diciembre de 2008, pp. 47-53, ISSN 0258-5936.
12. Flores, C. y Cuenca, G. ‘‘Crecimiento y dependencia micorrízica de
la especie pionera y polenectarífera Oyeda verbesinoides (tara
amarilla), asteraceae’’, Interciencia, vol. 29, no. 11, noviembre de
2004, pp. 632-637, ISSN 0378-1844.
13. Zangaro, W.; Nishidate, F.R.; Camargo, F.R.S.; Romagnoli, G.G. y Vandressen,
J. ‘‘Relationships among arbuscular mycorrhizas, root morphology and seedling
growth of tropical native woody species in southern Brazil’’, Journal of
Tropical Ecology, vol. 21, no. 05, septiembre de 2005, pp. 529–540, ISSN
1469-7831, DOI 10.1017/S0266467405002555.
14. Dell’Amico, J.; Rodríguez, P.; Torrecillas, A.; Morte, A. y Sánchez-Blanco,
M.J. ‘‘Water and growth parameter responses of tomato plant associated with
arbuscular mycorrhizae during drought and recovery’’, Journal of Agricultural
Science, vol. 138, 2002, pp. 387-393, ISSN 0021-8596.
15. Dell’Amico, J.M.; Fernández, F.; Nicolás, E.; López,
L.F. y Sánchez-Blanco, M.J. ‘‘Respuesta fisiológica del tomate
a la aplicación de dos inoculantes a base de Glomus sp1 (INCAM
4) por dos vías de inoculación diferentes’’, Cultivos Tropicales,
vol. 28, no. 2, 2012, pp. 51–58, ISSN 0258-5936.
16. Mena Echevarría, A.; Fernández Suárez, K.; Jerez Mompie,
E.; Olalde Portugal, V. y Serrato, R. ‘‘Influencia de la inoculación
con Glomus Hoi-Like y un conglomerado de especies de HMA en el crecimiento
de plantas de sorgo sometidas o no a estrés hídrico’’, Cultivos
Tropicales, vol. 32, no. 1, marzo de 2011, pp. 16-27, ISSN 0258-5936.
17. Ruiz Sánchez, M.; Ruiz - Lozano, J.M. y Muñóz Hernández,
Y. ‘‘Las acuaporinas, su relación con los hongos micorrízicos
arbusculares y el transporte de agua en las plantas’’, Cultivos Tropicales,
vol. 32, no. 3, septiembre de 2011, pp. 18-26, ISSN 0258-5936.
18. Augé, R.M. ‘‘Arbuscular mycorrhizae and soil/plant water relations’’,
Canadian Journal of Soil Science, vol. 84, no. 4, 1 de noviembre de
2004, pp. 373-381, ISSN 0008-4271, DOI 10.4141/S04-002.
19. Rillig, M.C. y Mummey, D.L. ‘‘Mycorrhizas and soil structure’’, New
Phytologist, vol. 171, no. 1, 1 de julio de 2006, pp. 41-53, ISSN 1469-8137,
DOI 10.1111/j.1469-8137.2006.01750.x.
20. Mujica Pérez, Y. y Batlle Sales, J. ‘‘Funcionamiento de la inoculación
líquida con hongos micorrízicos arbusculares (HMA) en plantas
de tomate (Solanum lycopersicum L.)’’, Cultivos Tropicales,
vol. 34, no. 4, diciembre de 2013, pp. 5-8, ISSN 0258-5936.
21. Cruz Hernández, Y.; García Rubido, M.; Hernández Martínez,
J.M. y León González, Y. ‘‘Influencia de las micorrizas arbusculares
en combinación con diferentes dosis de fertilizante mineral en algunas
características morfológicas de las plántulas de tabaco’’,
Cultivos Tropicales, vol. 33, no. 3, septiembre de 2012, pp. 23-26,
ISSN 0258-5936.
22. Montero, L.; Duarte, C.; Cun, R. y Cabrera, J.A. ‘‘Efectividad de biofertilizantes
micorrízicos en el rendimiento del pimiento (Capsicum annuum
L. var. Verano 1) cultivado EN diferentes condiciones de humedad del sustrato’’,
Cultivos Tropicales, vol. 31, no. 3, septiembre de 2010, pp. 00-00,
ISSN 0258-5936.
23. Fernández, F.; Dell’Amico, J.M.; Angoa, M.V. y de la Providencia,
I.E. ‘‘Use of a liquid inoculum of the arbuscular mycorrhizal fungi Glomus hoi
in rice plants cultivated in a saline Gleysol: A new alternative to inoculate’’,
Journal of Plant Breeding and Crop Science, vol. 3, no. 2, 2011, pp. 24–33,
ISSN 2006-9758.
24. Ruiz Sánchez, M.; Polón Pérez, R.; Vázquez Del
Llano, B.; Muñoz Hernández, Y.; Cuéllar Olivero, N. y Ruiz-Lozano,
J.M. ‘‘La simbiosis micorrizíca arbuscular en plantas de arroz (Oryza
sativa L.) sometidas a estrés hídrico: Parte I. Mejora la
respuesta fisiológica’’, Cultivos Tropicales, vol. 33, no. 4,
diciembre de 2012, pp. 47-52, ISSN 0258-5936.
25. Ruiz-Sánchez, M.; Aroca, R.; Muñoz, Y.; Polón, R. y
Ruiz-Lozano, J.M. ‘‘The arbuscular mycorrhizal symbiosis enhances the photosynthetic
efficiency and the antioxidative response of rice plants subjected to drought
stress’’, Journal of Plant Physiology, vol. 167, no. 11, 15 de julio
de 2010, pp. 862-869, ISSN 0176-1617, DOI 10.1016/j.jplph.2010.01.018.
26. Plana, R.; González, P.J.; Fernández, F.; Calderón,
A.; Marrero, Y. y DellAmico, J.M. ‘‘Efecto de dos inoculantes micorrízicos
arbusculares (base líquida y sólida) en el cultivo del trigo duro
(Triticum durum)’’, Cultivos Tropicales, vol. 29, no. 4, diciembre
de 2008, pp. 35-40, ISSN 0258-5936.
27. Andrade, S. a. L.; Mazzafera, P.; Schiavinato, M.A. y Silveira, A.P.D. ‘‘Arbuscular
mycorrhizal association in coffee’’, The Journal of Agricultural Science,
vol. 147, no. 02, abril de 2009, pp. 105–115, ISSN 1469-5146, DOI 10.1017/S0021859608008344.
28. Johnson, N.C.; Rowland, D.L.; Corkidi, L. y Allen, E.B. ‘‘Plant winners
and losers during grassland n-eutrophication differ in biomass allocation and
mycorrhizas’’, Ecology, vol. 89, no. 10, 1 de octubre de 2008, pp.
2868-2878, ISSN 0012-9658, DOI 10.1890/07-1394.1.
29. Costa, K.A. de P.; Faquin, V.; Oliveira, I.P. de.; Severiano, E. da C.;
Simon, G.A. y Carrijo, M.S. ‘‘Extração de nutrientes pela fitomassa
do capim-marandu sob doses e fontes de nitrogênio’’, Revista Brasileira
de Saúde e Produção Animal, vol. 10, no. 4, 16 de
diciembre de 2009, ISSN 1519-9940, [Consultado: 19 de junio de 2015], Disponible
en: <http://www.rbspa.ufba.br/index.php/rbspa/article/view/1410>.
30. Stewart, W.M. ‘‘Consideraciones en el uso eficiente de nutrientes’’, Informaciones
Agronómicas, vol. 67, 2007, pp. 1–7, ISSN 2222-0178.
Recibido: 31 de octubre
de 2014
Aceptado: 14 de enero de 2015
Dr.C.
José M. Dell’Amico, Instituto Nacional Ciencias Agrícolas
(INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700.
Email: amico@inca.edu.cu






