
Evaluación de la resistenciA al falso Orobanche causado por Nocardia sp. en Nicotiana spp.
Evaluation of resistance to false Orobanche caused by Nocardia sp. on Nicotiana spp.
Dr.C. Yunior
M. Morán Gómez,I
Juan L. Pérez Rodríguez,II Dr.C. Antonio
Núñez Mansito,II Dra.C. Rosario Domínguez
Larrinaga,I Dr.C. Gilberto Torrecilla Guerra,II Dra.C.
María del C. Córdoba Sellés,III Dr.C. Felipe
L. Herrera IslaIV
IInstituto
de Investigaciones del Tabaco (IIT), carretera a Tumbadero, km 8 ½ San
Antonio de los Baños. Artemisa. CP 32500.
IIEstación
Experimental del Tabaco de Cabaiguán, carretera a Santa Lucía,
km 2, Cabaiguán, Sancti Spíritus. Cuba.
IIIUniversidad
Politécnica de Valencia (UPV), camino de Vera s/n, 46022 Valencia. España.
IVUniversidad
Central “Martha Abreu” de Las Villas, carretera a Camajuaní, km 5 ½,
Santa Clara. Villa Clara. Cuba.
RESUMEN
El falso Orobanche afecta a la producción tabacalera de Cuba. Las plantas afectadas desarrollan abundante proliferación de brotes y tumores en las raíces, muestran enanismo y raquitismo. Los cultivares de tabaco Negro cubano son susceptibles a Nocardia sp., agente causal de esta enfermedad. La incorporación de genes de resistencia a este agente fitopatógeno en los cultivares cubanos, mediante el mejoramiento genético tradicional, constituirá un elemento de peso en la estrategia de manejo integrado de esta enfermedad. Sin embargo, no se conocen fuentes de resistencia a la enfermedad dentro de Nicotiana spp., ni se dispone de un procedimiento para la búsqueda de estas fuentes en la amplia diversidad de accesiones presentes en el banco de germoplasma de tabaco de Cuba. El objetivo de esta investigación es desarrollar un procedimiento de evaluación del nivel de resistencia frente al agente causal del falso Orobanche de las accesiones del banco de germoplasma de tabaco de Cuba. Catorce accesiones de diferentes especies y tipos de tabaco fueron inoculadas con la cepa T42 de Nocardia sp. A partir de la manifestación de los síntomas se elaboró una escala visual empírica que permite calcular el grado de afectación de las plantas. En correspondencia con el grado de afectación se ubicaron las accesiones en cuatro niveles de reacción (resistente, moderadamente resistente, moderadamente susceptible y susceptible). Se identificaron accesiones resistentes a la enfermedad dentro del banco de germoplasma de tabaco de Cuba. También dentro de cultivares evaluados de susceptibles se encontraron plantas portadoras de genes de resistencia con las que se pudiera comenzar de inmediato un programa de mejoramiento genético por selección de líneas puras.
Palabras clave: bacteria, tumor, proliferación de brotes, germoplasma, resistencia.
ABSTRACT
False Orobanche affects tobacco production in Cuba. Diseased plants development abundant shoot proliferation and tumour in the root, and they’re showing dwarfism and rickets. Cuban Black tobacco cultivars are susceptible to Nocardia sp., causal agent of this disease. The incorporation of resistance genes into Cuban cultivars through genetic improvement will be an important element in the strategy for integrated management of this disease. However, there were not known sources of resistance to the disease and there isn’t an available procedure for the assessment of potential resistance sources present in the tobacco germplasm of Cuba. The objective of this research is to develop a method of assessing the level of resistance to the causal agent of false Orobanche of tobacco germplasm accessions. Fourteen accessions of different species and types of tobacco were inoculated with T42 strain of Nocardia sp. From the showing of symptoms was developed an empiric visual scale for calculating the plant’s damage degree. Accessions were located into four levels of reaction (resistant, moderately resistant, moderately susceptible and susceptible) according to plant’s damage degree. Resistant genotypes were identified within the tobacco germplasm bank of Cuba. Also within susceptible evaluated cultivars , plants carrying resistance genes were found with which they could immediately begin a genetic improvement program by selection of pure lines.
Key words: bacteria, tumour, shoot proliferation, germplasm, resistance.
INTRODUCCIÓN
La enfermedad
denominada “falso Orobanche” es uno de los factores que afectan la producción
tabacalera de Cuba. En los primeros estadios, las plantas de tabaco afectadas
desarrollan pequeños sobrecrecimientos blancos en cualquier posición
de la raíz principal o en las raíces laterales secundarias o terciariasA.
Con el desarrollo de los síntomas, de las excrecencias de masas blanquecinas
jugosas e irregulares, comienzan a diferenciarse pequeños brotes con
hojas abortadas sin clorofila. En esta etapa, también se pueden observar
tumores en las raíces que pueden alcanzar hasta ocho centímetros
de diámetro. Durante estas etapas que ocurren bajo tierra, las estructuras
que se desarrollan se asemejan a una planta de Orobanche ramosa L.
que se encuenta entre las fases fenomenológicas de “nódulos” y
“emergencia”; en las cuales la planta parásita se observa con un bulbo
carnoso del cual emerge un tallo con una o dos ramas con varias inflorescencias
sin abrir; todas estas estructuras son de color amarillo pálidoA.
Alrededor de los 45 días después del trasplante de las plántulas
de tabaco a la vega, esta enfermedad induce la producción de estructuras
que muestran una clara diferencia con O. ramosa, de ahí que
el trastorno se denomine “falso Orobanche”. En este período, los sobrecrecimientos
que despuntan sobre la superficie del suelo, con la exposición a la luz
solar comienzan a tomar una coloración verdosa y la apariencia de los
brotes normales de la planta de tabaco. Estos brotes diferenciados a partir
de las masas blanquecinas pueden llegar a producir órganos vegetales,
como si se tratara de una planta de tabaco independiente y es en este momento
que los síntomas pueden ser fácilmente observados en el campoA.
El primer informe de esta enfermedad en el cultivo del tabaco (Nicotiana
tabacum L.) en el país fue realizado en la segunda mitad del siglo
pasadoA y desde entonces ha tenido un notable incremento en su distribución
y en la intensidad de los daños causados(1).
En la zona central del país, en el cultivar de tabaco negro ‘Pelo de
Oro’, se determinaron pérdidas económicas que en promedio ascendían
hasta los $ 2 511,73 pesos por hectárea, derivadas en lo fundamental
al enanismo, raquitismo y clorosis en las plantas afectadas, lo que influye
negativamente en el rendimiento y la calidad del cultivoA.
Recientemente se demostró que el agente causal de esta enfermedad es
un actinomiceto perteneciente al género Nocardia (2). La identificación
del agente causal del falso Orobanche abre nuevos espacios de acción
para realizar el manejo integrado de esta enfermedad del tabaco. En este sentido
la incorporación de la resistencia al agente a los cultivares comerciales
de tabaco, mediante el mejoramiento genético, constituirá un elemento
de peso en su futuro manejo, como lo ha sido para otros cultivos afectados por
diversos agentes fitopatógenos (3, 4). La determinación de fuentes
de resistencia en los materiales presentes en los bancos de germoplasma es de
gran importancia, pues permitiría la incorporación de genes de
resistencia a los cultivares de interés (5).
Sin embargo, poco se ha avanzado en la búsqueda de materiales del género
Nicotiana que muestren resistencia frente al falso Orobanche. En la
década de los 90 del siglo pasado se determinó que los cultivares
comerciales de tabaco Negro cubano (N. tabacum) ‘C-30’, ‘Cabaiguán-72’,
‘Habana-92’, ‘Burley-37’ y ‘Corojo’, aunque resultaron afectados por la enfermedad,
presentaron en ese orden menos afectaciones que el cultivar ‘Pelo de Oro’A.
Este resultado indica la posibilidad de encontrar fuentes de resistencia a esta
enfermedad.
Actualmente no se conocen fuentes de resistencia a la enfermedad dentro de Nicotiana
spp., ni se dispone de un procedimiento para la búsqueda de estas fuentes
en la amplia diversidad de accesiones presentes en el banco de germoplasma de
tabaco de Cuba. Para lograr esto es necesario disponer de una escala para la
evaluación del grado de resistencia de las plantas, frente al agente
etiológico de la enfermedad.
En concordancia con lo anterior, el objetivo de esta investigación fue
desarrollar un procedimiento de evaluación del grado de resistencia frente
al agente causal del falso Orobanche en las accesiones pertenecientes al banco
de germoplasma de tabaco de Cuba, en base a una escala empírica de observación
de los síntomas de la enfermedad en condiciones controladas.
MATERIALES Y MÉTODOS
Preparación
del ensayo
Germoplasma empleado. Se emplearon 14 accesiones pertenecientes al género
Nicotiana presentes en el banco de germoplasma del Instituto de Investigaciones
del Tabaco de Cuba, ubicado en la Estación Experimental de Tabaco de
Cabaiguán, Sancti Spíritus, donde se encuentra una de las colecciones
más grandes de América Latina y del Caribe con más de 800
accesiones de Nicotiana tabacum L. y 40 especies silvestres del géneroB.
Siete accesiones fueron de tabaco tipo Virginia (N. tabacum cv. ‘Fogia
D’ Oro’; ‘LAFC 53’; ‘Virginia 110’; ‘Virginia SL 32’; ‘Novaga 768’; ‘K 358’),
dos de tipo Negro (N. tabacum cv ‘Habana 92’; ‘Corojo 2006’), uno de
tipo Oriental (N. tabacum cv ‘Xanthi UR’) y las cuatro restantes fueron
especies silvestres (Nicotiana alata; Nicotiana nesophila;
Nicotiana sylvestris; Nicotiana rustica cv. ‘3001’).
Estos materiales se seleccionaron para este estudio porque en áreas tabacaleras
con presencia natural del patógeno, se observó que mostraban un
comportamiento diferencial en la expresión de los síntomas. Algunas
de ellas, como los cultivares de tabaco Negro y Virginia, mostraban gran cantidad
de tumores en las raíces y el desarrollo excesivo de rebrotes abortados
en raíces y cuello del tallo; mientras que las especies, o no mostraban
ningún tipo de sintomatología, o su expresión era muy leve.
Preparación del inóculo del agente causal del falso Orobanche.
De una placa con medio de cultivo D2 sólido (6) sembrada por agotamiento
desde hacía 10 días con la cepa Nocardia sp. T42, agente
causal del falso Orobanche (2) se tomó una colonia pura y sin agar de
1 mm de diámetro con un asa de platino. La colonia se transfirió
a un frasco Erlenmeyer de 500 mL de capacidad con 200 mL de medio D2 líquido.
Siguiendo este mismo proceder, se inocularon otros dos frascos Erlenmeyer en
iguales condiciones. Este preinóculo se incubó durante siete días
a 30 °C con agitación constante en zaranda orbital a 150 rpm.
Con este preinóculo se inocularon 100 frascos Erlenmeyers de 100 mL de
capacidad contentivos de 45 mL de medio D2 líquido. Cada frasco Erlenmeyer
se inoculó con 5 mL del preinóculo. El inóculo se incubó
durante siete días a 30 °C con agitación constante en zaranda
orbital a 150 rpm. El cultivo del microorganismo se realizó de manera
separada en alícuotas de 45 mL para favorecer la aireación del
medio, ya que este microorganismo muestra una alta dependencia del oxígeno
en su desarrollo (2).
Al concluir el tiempo de incubación cada uno de los cultivos se filtraron
por papel cuantitativo de filtración lenta (Whatman 390) empleando embudos
de cristal. Este procedimiento se realizó sobre la mesa de trabajo. Para
garantizar la homogeneidad del inóculo toda la masa microbiana, obtenida
en el papel de filtro se resuspendió vigorosamente en 1 000 mL de solución
salina estéril (solución acuosa de NaCl al 0,85 %) en un beaker
de 5 000 mL de capacidad.
Mediante el procedimiento de recuento de viables en placa (7), realizado a la
suspensión bacteriana se estableció que la concentración
celular de Nocardia sp. cepa T42 fue de 6,2 x108 UFC mL-1.
Procedimiento de inoculación de las plántulas correspondientes
a cada accesión del banco. En una bandeja plástica de dimensiones
50 x 40 x 10 cm, desinfectada con hipoclorito de sodio al 5 % por 30 minutos,
se vertieron nueve litros de solución salina estéril y a este
volumen se le agregó el litro de inóculo, estimándose una
concentración poblacional para la cepa T42 de alrededor de 6,2 x107
UFC mL-1 en el nuevo volumen. La altura del líquido vertido
no sobrepasó los 5 cm en el depósito empleado, con lo que se garantizó
que solamente las raíces de las plántulas pudieran sumergirse
en el inóculo.
Las plántulas de las diferentes accesiones de 45 días de edad
se obtuvieron en semilleros de bandejas flotantes con sustrato (turba negra
húmica-sustratos agrícolas Ltda. Chile-, mezclada con 10 % de
Fertizol [Zeolita] Empresa Geominera Oriente. Cuba) esterilizado en autoclave
a
121 °C, 1 013 hPa, 45 min.
Por cada entrada del banco se tomaron 20 plántulas al azar y se amarraron
por el tallo con un cordel para formar un grupo. Cada grupo se identificó
con el nombre de la entrada y las raíces de las plántulas se lavaron
con abundante agua corriente para eliminar todo el sustrato adherido a ellas.
Los 14 grupos de plantas se sumergieron en el inóculo, durante cuatro
horas y a intervalos de una hora se homogenizó el contenido del recipiente,
agitándolo suavemente de forma manual durante cinco minutos.
Trasplante de las plantas inoculadas. Todas las plántulas inoculadas
se trasplantaron en bolsas de polietileno negro de 1 L de capacidad rellenas
con 500 g de Pardo Sialítico sin diferenciación de carbonatos
(8). Este se obtuvo de una vega tabacalera de Cabaiguán con antecedentes
históricos de manifestación del falso Orobanche. Antes de llenar
las bolsas todo el suelo se tamizó, se mezcló exhaustivamente
y se esterilizó en autoclave a 121 °C a una presión de 1 013
hPa durante 45 minutos. El valor de pH del suelo luego de la esterilización,
determinado como pH en KCl fue de 6,05. Se empleó este tipo de suelo
para asegurar la persistencia del agente luego del trasplante, pues se ha observado
que en las zonas tabacaleras afectadas por la enfermedad, esta se manifiesta
en algunos tipos de suelos y en otros noC. En cada bolsa se plantaron dos plántulas
con un total de 10 bolsas por accesión.
También se trasplantaron directamente en bolsas con suelo estéril
otras 10 plántulas de cada accesión, obtenidas del mismo semillero
(dos plantas por bolsa). Estas plántulas no inoculadas constituyeron
los controles del experimento. Todas las plantas se mantuvieron hasta el momento
de su evaluación en condiciones de aislador a 30 ± 2 °C y
cada tres días recibieron un riego de mantenimiento.
Evaluación de las plantas de tabaco. La evaluación se realizó
a los 45 días del trasplante. Para esto se extrajeron las plantas de
las bolsas y se lavaron con abundante agua corriente, para eliminar el suelo
de las raíces. Se procedió con el máximo cuidado para no
desprender ningún brote o tumor. Las mediciones del tamaño de
las estructuras (brotes y tumores) se realizaron con ayuda de un Pie de Rey.
RESULTADOS Y DISCUSIÓN
Las plantas evaluadas en el estudio mostraron cuatro tipos de expresión de tumores y brotes. Estos tipos de expresión de los síntomas causados por esta enfermedad, se definieron a partir de un criterio visual empírico que describió la magnitud del desarrollo de los tumores y proliferaciones de brotes en las raíces y el cuello del tallo de los materiales evaluados en el experimento, teniendo en cuenta la medición del tamaño de estas estructuras y su grado de diferenciación. Los elementos descriptivos de cada uno de los cuatro tipos de expresión se detallan en la Tabla I y la figura.

En todas las accesiones donde se presentaron los síntomas se pudo apreciar
que la raíz principal resultó la de mayor afectación. También
se observó que una misma planta podía presentar tumores y brotes
de diferentes tipos, pero generalmente en esa planta los tumores y brotes de
tipo 1 y 2 superaban en número a los tumores y brotes de tipo 3 y 4.
Para poder elaborar la escala de evaluación se necesitó una medida
del grado de afectación de cada accesión frente al agente causal
del falso Orobanche. Esta variable que se denominó “Grado medio de afectación”
(GMA) se calculó a partir de cuatro tipos de expresión de los
tumores y los brotes que causó el agente causal de esta enfermedad en
los diferentes materiales evaluados, empleando la siguiente fórmula:
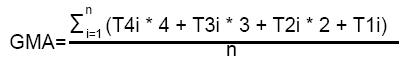
donde:
- T4i: total de tumores y brotes tipo 4 de la planta i
- T3i: total de tumores y brotes tipo 3 de la planta i
- T2i: total de tumores y brotes tipo 2 de la planta i
- T1i: total de tumores y brotes tipo 1 de la planta i
- n: número de plantas evaluadas (solo las vivas)
En la Tabla II se muestran
tres ejemplos de las fichas elaboradas para el cálculo del GMA que mostraron
tres de las accesiones empleadas en el estudio.
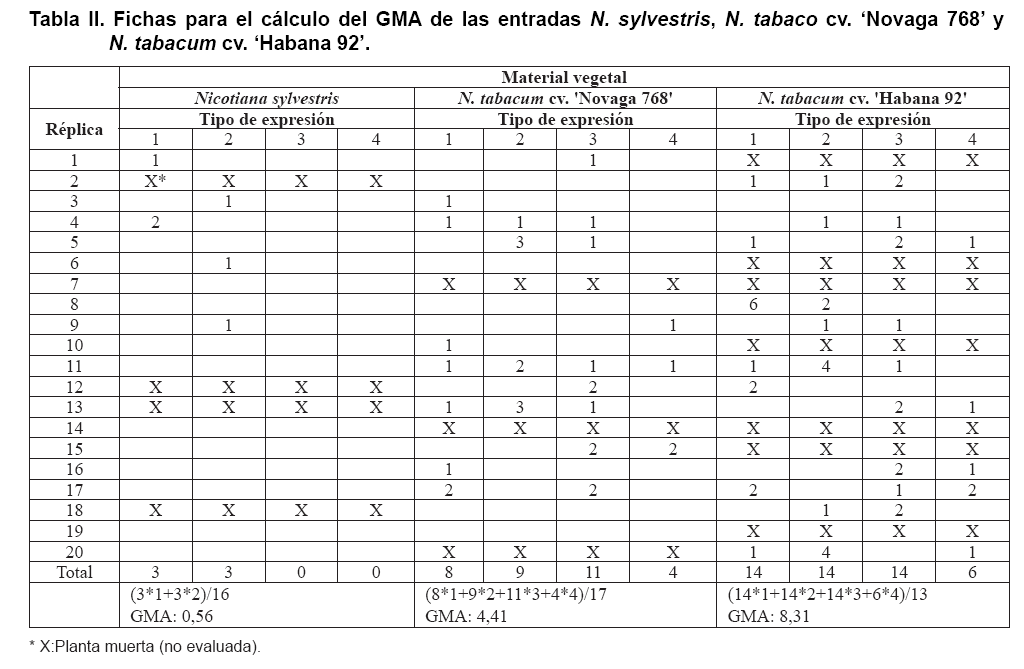
Con respecto a las plantas muertas encontradas en el material inoculado, es
importante mencionar que también dentro de las plantas testigo hubo materiales
muertos. En general los síntomas encontrados en estas plantas muertas
se describieron como marchitamiento de la planta, ennegrecimiento y pudrición
en la raíz (síntomas estos que nunca han sido asociados a la manifestación
del falso Orobanche y sí asociados a hongos fitopatógenos del
suelo). El diagnóstico de laboratorio confirmó la presencia de
Phytophthora nicotianae Brenda de Hann (agente causal de la Pata Prieta).
Posiblemente la causa de la infección se deba a los riegos realizados
con agua no estéril con presencia de los propágulos del hongo
(zoosporas), ya que se ha planteado que el agua de riego contaminada es una
de las principales fuentes de inóculo y modo de dispersión de
este agente fitopatógeno (9).
Es fundamental disponer, como mínimo, de una cantidad de 20 réplicas
de plantas por cada accesión para realizar el estudio y para los cálculos
del GMA en cada accesión no se deben emplear menos de 10 plantas.
Escala de evaluación de la reacción de los materiales ante el
agente causal del falso Orobanche. La designación de los grados de escala
de resistencia siguió un criterio empírico, pero se tuvo en cuenta
un grupo de elementos que permitieron correlacionar, de una manera razonable,
el valor calculado de la variable “Grado medio de afectación” con la
respuesta de resistencia de un determinado material.
Debido a que los cultivares comerciales de tabaco cubano son un conjunto de
genotipos homocigóticos (10), se valoró la posibilidad de encontrar,
dentro de una entrada evaluada como resistente, una pequeña proporción
de individuos mostrando síntomas de la enfermedad. De este modo, se estableció
que la proporción de individuos con síntomas dentro de la accesión
considerada resistente no debe ser superior al 40 % del total evaluado y la
expresión de brotes y tumores en estos individuos, no debe ser superior
al tipo 2, ni el total de tumores o brotes en cada individuo debe ser mayor
de 2.
En concordancia con lo anterior el “Grado medio de afectación” para una
accesión que se determine resistente debe de ser inferior o igual a la
unidad. La presencia de algún individuo aberrante (extremada cantidad
de tumores o brotes en estados avanzados) dentro de este grupo de plantas resistentes
no debe considerarse para el cálculo. Aquellas accesiones con GMA≤1,
pero que no cumplan con el requisito de que, al menos el 60 % de sus individuos
no presenten síntomas, serán ubicadas dentro del grupo de las
moderadamente resistentes, al igual que aquellas accesiones con valores del
“Grado medio de afectación” entre 1 y 4.
En la Tabla III se resumen
los cuatro niveles de la escala empírica propuesta para evaluar la reacción
de resistencia a los 45 días de ser trasplantadas del semillero e inoculadas
con el agente causal de la enfermedad falso Orobanche, de los genotipos del
banco de germoplasma de tabaco, en base al grado medio de afectación
calculado.
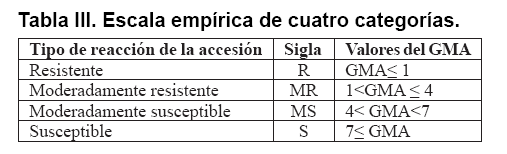
Las escalas
empíricas han sido ampliamente empleadas para definir, de un modo simple,
el grado de respuesta de los materiales presentes en colecciones de germoplasma
de diversos cultivos frente a un patógeno particular. Todas, en sus extremos,
ubican los tipos de reacciones resistente y susceptible. Difieren en lo fundamental
en la cantidad de grados intermedios que utilizan para caracterizar adecuadamente
la reacción del material durante el enfrentamiento al organismo fitopatógeno,
empleando en algunos casos hasta nueve grados de reacción (5, 11, 12).
Esta caracterización se basa siempre en la observación que se
realiza de los síntomas que manifiestan las plantas retadas con el agente
patógeno y la evaluación puede realizarse en condiciones de campo
o invernadero (11, 13, 14, 15).
La escala de cuatro grados desarrollada en este estudio reúne las características
descritas para la escala empírica. Esta escala permite la caracterización
de la reacción de los materiales presentes en el germoplasma de tabaco
frente al agente causal del falso Orobanche y constituye una importante herramienta
para determinar las posibles fuentes de resistencias presentes en el banco de
germoplasma de tabaco de Cuba. Este es el primer procedimiento del que se dispone
para determinar la respuesta de resistencia del genero Nicotiana frente
al agente causal del falso Orobanche.
Es importante establecer la presión de inóculo para este ensayo
en un valor cercano a 107 UFC mL-1 de la cepa T42 de Nocardia
sp., ya que esta variable es crítica para que los resultados sean repetibles,
reproducibles y confiables. Se ha estimado que la concentración mínima
de propágulos de este agente fitopatógeno que debe estar presente
en el suelo debe ser superior a 1,2 x 103UFC g-1, para
que las plantas de tabaco que se trasplanten a este suelo manifiesten la enfermedadC.
El potencial de inóculo empleado en este estudio, al ser superior (en
más de 10 000 veces) a la concentración mínima requerida
para que las plantas trasplantadas en un suelo contaminado del agente causal
de esta enfermedad expresen los síntomas, es una garantía de que
las entradas evaluadas de resistente realmente lo sean (al menos durante el
período evaluado) y al enfrentarse a un trasplante a una vega contaminada
con el agente patógeno seguirán comportándose de igual
manera.
Otro elemento fundamental a tener en cuenta es el hecho de que la evaluación
de los materiales se realice siempre a los 45 días de la inoculación
con el agente causal, para así lograr la reproducibilidad de los resultados,
pues aunque en este estudio se está manejando el término de resistencia,
realmente esa condición no se evalúa en todas las etapas del desarrollo
fenomenológico de la planta de tabaco, por lo que no se puede afirmar
nada sobre un comportamiento posterior de los materiales evaluados como “resistentes”.
Se plantea que la reacción de la planta ante un patógeno es o
bien de inmunidad, o sea que ni siquiera en las condiciones más favorables
es atacada, o bien de resistencia que puede variar desde un nivel muy alto hasta
ser imperceptible o nula, lo cual da una respuesta de alta susceptibilidad (16,
17).
En la Tabla IV se muestran
los resultados de la aplicación de los criterios del procedimiento propuesto
a las 14 accesiones del banco de germoplasma de tabaco empleadas en este estudio,
al evaluar la reacción de los materiales a los 45 días de haber
sido inoculadas con el agente causal del falso Orobanche.
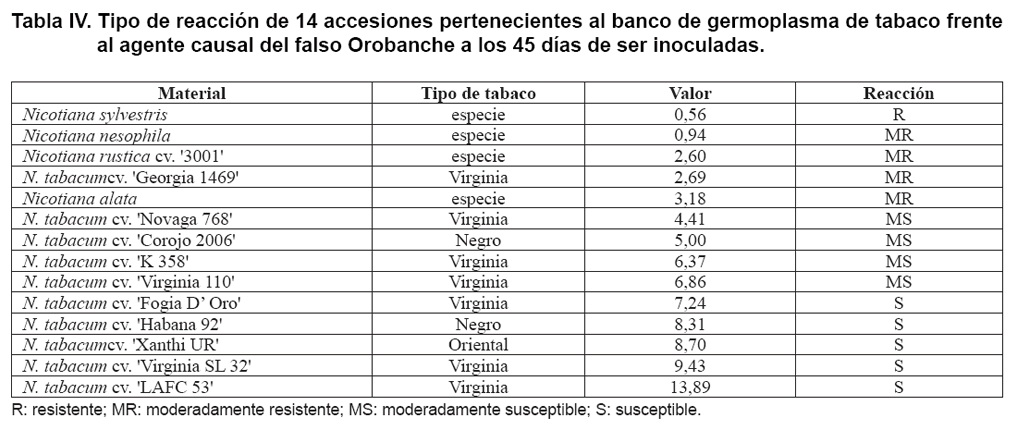
De los 14 materiales evaluados, la especie N. sylvestris resultó
resistente. Los materiales moderadamente resistentes resultaron ser N. nesophila,
N. rustica cv. ‘3001’, N. tabacum cv. ‘Georgia 1469’ y N.
alata. De los cultivares de N. tabacum, ‘Novaga 768’, ‘Corojo
2006’, ‘K 358’, ‘Virginia 110’, ‘Fogia D’ Oro’, ‘Habana 92’, ‘Xanthi UR’, ‘Virginia
SL 32’ y ‘LAFC 53’, los cuatro primeros reaccionaron como moderadamente susceptibles
y los restantes cinco resultaron susceptibles.
Nicotiana nesophila, a pesar de que en el cálculo de GMA tuvo
un valor inferior a uno, no se incluyó dentro de los genotipos resistentes,
porque tuvo un porcentaje de individuos con síntomas superior al 40 %
(43,8 %; 7 sintomáticos de 16 evaluados).
El hecho de que N. tabacum cv. ‘Habana 92’ se ubicara como susceptible
está en concordancia con lo expresado por MéndezA
y con lo que se observa en la producción (1).
De forma general, se apreció la existencia de genotipos resistentes dentro
de las especies pertenecientes al banco de germoplasma de tabaco. Este hecho
es de gran importancia e interés para los genetistas porque les permite
disponer de fuentes con genes de resistencia a esta enfermedad (5, 18, 19, 20,
21).
Aunque la presencia de plantas asintomáticas dentro de una accesión
que haya sido evaluada como susceptible no es un elemento que indique directamente
que ese material presenta genes de resistencia a la enfermedad (pues pudiera
deberse a dificultades imputables a otros factores del proceso de infección
ajenos a la planta) no se debe despreciar la posibilidad de que en verdad ese
material presente dichos genes. Como se ha explicado, los cultivares comerciales
de tabaco cubano son una mezcla de genotipos homocigóticos seleccionados
para determinados caracteres estables (10), por lo que es posible encontrar
en el conjunto de individuos de esta accesión designada como susceptible,
alguna planta que presente genes de resistencia para esta enfermedad, ante la
cual no se ha hecho ningún tipo de selección para este carácter
con anterioridad.
Este pudiera ser el caso de la tercera réplica evaluada del cultivar
‘Habana 92’ (Tabla I),
quien se mostró asintomática durante todo el experimento. Con
posterioridad a este estudio, esta planta se inoculó tres veces en la
raíz en diferentes estados fenomenológicos y nunca manifestó
lo síntomas de la enfermedad, a la vez que mantuvo un desarrollo normal
a diferencia de otras plantas testigo del mismo cultivar que sí enfermaron
al inocularlas con el agente causal de esta enfermedad. Con este tipo de plantas
se puede comenzar de inmediato un proceso de selección de líneas
puras, siguiendo el esquema de Johannsen (22) y de una forma rápida incorporar
la resistencia a este cultivar, sin necesidad de buscar fuentes de resistencia
en cruces intraespecíficos, ni mucho menos interespecíficos.
La introducción de genes de resistencia de una especie a otra por repetidos
cruzamientos es un proceso muy largo en el tiempo, el cual usualmente toma muchas
generaciones híbridas antes de que el cruzamiento tenga éxito
(20).
La introducción en la práctica agrícola del procedimiento
aquí descrito requerirá de la validación del mismo a través
de la realización de experimentos de campo en áreas tabacaleras
naturalmente afectadas, que permitan determinar si el uso de los rangos de la
escala propuesta para condiciones controladas se ajusta al comportamiento de
las accesiones en las condiciones de campo y durante períodos más
largos de evaluación de los materiales.
Se ha planteado que la exactitud y precisión de las escalas de evaluación
dependen del entrenamiento del evaluador más que del tipo de intervalo
seleccionado y que la reproducibilidad se obtiene con la práctica y la
discusión de resultados. Por lo tanto, en la medida en que esta escala
sea puesta a punto en los diferentes ensayos y en los sucesivos años,
surgirán los ajustes necesarios para que finalmente se constituya en
una herramienta que pueda responder a las necesidades planteadas (23).
CONCLUSIONES
• Se desarrolló
el primer procedimiento para la determinación de la respuesta de resistencia
del material presente en el germoplasma de tabaco de Cuba frente al agente causal
del falso Orobanche, el cual se establecerá en una importante herramienta
para el trabajo de los fitomejoradores.
• Este procedimiento emplea una escala de cuatro niveles para la evaluación
de las accesiones que las ubica en resistente, moderadamente resistente, moderadamente
susceptible y susceptible.
• Para que los resultados de este ensayo sean repetibles, reproducibles y confiables
se requiere de una presión de inóculo con un valor cercano a 107
UFC mL-1 de la cepa T42 de Nocardia sp., y el empleo de
una cantidad mínima de 20 réplicas de plantas por cada accesión,
para realizar el estudio y para los cálculos del GMA en cada accesión
no se deben emplear menos de 10 plantas.
BIBLIOGRAFÍA
1. Ministerio
de la Agricultura. Guía para el cultivo del tabaco 2008-2009,
edit. AGRINFOR, La Habana, Cuba, 2008, p. 47, ISBN 978-959-246-204-5.
2. Morán, Y.; Chacón, O.; Córdoba-Sellés, M. del
C.; Domínguez-Larrinaga, R.; Herrera, L. y Borrás-Hidalgo, O.
‘‘Identification and Molecular Characterization of Nocardia sp. as
a New Causal Agent of Tobacco False Broomrape’’, Journal of Phytopathology,
vol. 161, no. 2, 1 de febrero de 2013, pp. 86-91, ISSN 1439-0434, DOI 10.1111/jph.12029.
3. Tadesse, W.; Reents, H.J.; Hsam, S.L.K. y Zeller, F.J. ‘‘Relationship of
seedling and adult plant resistance and evaluation of wheat germplasm against
tan spot (Pyrenophora tritici-repentis)’’, Genetic Resources and
Crop Evolution, vol. 58, no. 3, 22 de junio de 2010, pp. 339-346, ISSN
0925-9864, 1573-5109, DOI 10.1007/s10722-010-9577-1.
4. Hayes, R.J.; McHale, L.K.; Vallad, G.E.; Truco, M.J.; Michelmore, R.W.; Klosterman,
S.J.; Maruthachalam, K. y Subbarao, K.V. ‘‘The inheritance of resistance to
Verticillium wilt caused by race 1 isolates of Verticillium dahliae
in the lettuce cultivar La Brillante’’, Theoretical and Applied Genetics,
vol. 123, no. 4, 13 de mayo de 2011, pp. 509-517, ISSN 0040-5752, 1432-2242,
DOI 10.1007/s00122-011-1603-y.
5. Lagarde, P.; Medina, A.; Ramis, C. y Maselli, A. ‘‘Evaluación de la
resistencia a la bacteriosis común causada por Xanthomonas phaseoli
en plantas F3 de caraota (Phaseolus vulgaris)’’, Fitopatología
Venezolana, vol. 23, no. 2, 2013, pp. 35-39, ISSN 0798-0035.
6. Schaad, N.W.; Jones, J.B. y Chun, W. Laboratory guide for identification
of plant pathogenic bacteria. [en línea], 3.a ed., edit. APS Press,
2001, ISBN 0-89054-263-5, [Consultado: 10 de septiembre de 2015], Disponible
en: <http://www.apsnet.org/apsstore/shopapspress/Pages/42635.aspx>.
7. Prescott, L.M.; Harley, J.P. y Klein, D.A. Microbiología [en
línea], 7.a ed., edit. McGRAW HILL, 2009, p. 1124, ISBN 978-84-481-6827-8,
[Consultado: 10 de septiembre de 2015], Disponible en: <http://www.elkar.eus/es/liburu_fitxa/microbiologia-de-prescott-harley-y-klein-7.-ed/willey-joanne-m./9788448168278>.
8. Hernández, A.; Pérez, J.; Bosch, D. y Castro, N. Clasificación
de los suelos de Cuba 2015, edit. Ediciones INCA, Mayabeque, Cuba, 2015,
p. 93, ISBN 978-959-7023-77-7.
9. Das, A.K.; Bawage, S.S.; Nerkar, S.G. y Kumar, A. ‘‘Detection of Phytophthora
nicotianae in water used for irrigating citrus trees by Ypt1 gene based
nested PCR’’, Indian Phytopathology, vol. 66, no. 2, 2013, pp. 132–134,
ISSN 0367-973X, 2248-9800.
10. López, M. del C.; Espino, E. y García, H. ‘‘Capero-1: primer
híbrido androestéril comercial de tabaco negro cubano (Nicotiana
tabacum L.)’’, Cultivos Tropicales, vol. 29, no. 1, marzo de 2008,
pp. 51-51, ISSN 0258-5936.
11. Sharma, B.P.; Forbes, G.A.; Manandhar, H.K.; Shrestha, S.M. y Thapa, R.B.
‘‘Determination of Resistance to Phytophthora infestans on Potato Plants in
Field, Laboratory and Greenhouse Conditions’’, Journal of Agricultural Science,
vol. 5, no. 5, 15 de abril de 2013, p. 148, ISSN 1916-9760, DOI 10.5539/jas.v5n5p148.
12. Pérez, W.; Ñahui, M.; Ellis, D. y Forbes, G.A. ‘‘Wide Phenotypic
Diversity for Resistance to Phytophthora infestans Found in Potato Landraces
from Peru’’, Plant Disease, vol. 98, no. 11, 7 de mayo de 2014, pp.
1530-1533, ISSN 0191-2917, DOI 10.1094/PDIS-03-14-0306-RE.
13. Sharma, M.; Rathore, A.; Mangala, U.N.; Ghosh, R.; Sharma, S.; Upadhyay,
H.D. y Pande, S. ‘‘New sources of resistance to Fusarium wilt and sterility
mosaic disease in a mini-core collection of pigeonpea germplasm’’, European
Journal of Plant Pathology, vol. 133, no. 3, 3 de febrero de 2012, pp.
707-714, ISSN 0929-1873, 1573-8469, DOI 10.1007/s10658-012-9949-9.
14. Mota, F.C.; Alves, G.C.S.; Giband, M.; Gomes, A.; Sousa, F.R.; Mattos, V.S.;
Barbosa, V.H.S.; Barroso, P.A.V.; Nicole, M.; Peixoto, J.R. y others ‘‘New sources
of resistance to Meloidogyne incognita race 3 in wild cotton accessions
and histological characterization of the defence mechanisms’’, Plant Pathology,
vol. 62, no. 5, 2013, pp. 1173–1183, ISSN 1365-3059.
15. Vasudevan, K.; Vera Cruz, C.M.; Gruissem, W. y Bhullar, N.K. ‘‘Large scale
germplasm screening for identification of novel rice blast resistance sources’’,
Frontiers in Plant Science, vol. 5, 2 de octubre de 2014, p. 505, ISSN
1664-462X, DOI 10.3389/fpls.2014.00505, [PMID: 25324853PMCID: PMC4183131].
16. Isla de Bauer, M. de L. de la. Fitopatología, edit. Ed.
Limusa, México, D.F, 1987, p. 384, ISBN 978-968-18-2352-8.
17. Vanderplank, J.E. Disease Resistance in Plants, edit. Elsevier,
2 de diciembre de 2012, p. 209, ISBN 978-0-323-16198-5.
18. Lebeau, A.; Daunay, M.-C.; Frary, A.; Palloix, A.; Wang, J.-F.; Dintinger,
J.; Chiroleu, F.; Wicker, E. y Prior, P. ‘‘Bacterial Wilt Resistance in Tomato,
Pepper, and Eggplant: Genetic Resources Respond to Diverse Strains in the Ralstonia
solanacearum Species Complex’’, Phytopathology, vol. 101, no. 1, 26
de agosto de 2010, pp. 154-165, ISSN 0031-949X, DOI 10.1094/PHYTO-02-10-0048.
19. Chen, X.; Vosman, B.; Visser, R.G.; Vlugt, R.A. van der. y Broekgaarden,
C. ‘‘High throughput phenotyping for aphid resistance in large plant collections’’,
Plant Methods, vol. 8, no. 1, 17 de agosto de 2012, p. 33, ISSN 1746-4811,
DOI 10.1186/1746-4811-8-33, [PMID: 22901796].
20. Gururani, M.A.; Venkatesh, J.; Upadhyaya, C.P.; Nookaraju, A.; Pandey, S.K.
y Park, S.W. ‘‘Plant disease resistance genes: Current status and future directions’’,
Physiological and Molecular Plant Pathology, vol. 78, abril de 2012,
pp. 51-65, ISSN 0885-5765, DOI 10.1016/j.pmpp.2012.01.002.
21. Merk, H.L. y Foolad, M.R. ‘‘Parent–offspring correlation estimate of heritability
for late blight resistance conferred by an accession of the tomato wild species
Solanum pimpinellifolium’’, Plant Breeding, vol. 131, no.
1, 1 de febrero de 2012, pp. 203-210, ISSN 1439-0523, DOI 10.1111/j.1439-0523.2011.01898.x.
22. Müller-Wille, S. ‘‘Hybrids, pure cultures, and pure lines: from nineteenth-century
biology to twentieth-century genetics’’, Studies in History and Philosophy
of Science Part C: Studies in History and Philosophy of Biological and Biomedical
Sciences, vol. 38, no. 4, diciembre de 2007, pp. 796-806, ISSN 1369-8486,
DOI 10.1016/j.shpsc.2007.09.012.
23. Ploper, L.D.; Escobar, D.; Ivancovich, A.; Diaz, C.G.; Sillon, M.; Formento,
N.; De Souza, J.C.; Cabrera de Alvarez, G.; González, V. y Galvez, M.R.
‘‘Propuesta de protocolo para muestreo y evaluación de la roya asiática
de la soja en Argentina’’, Avance agroindustrial - Estación Experimental
Agro-Industrial Obispo Colombres, vol. 27, no. 3, 2006, pp. 35–37, ISSN
0326-1131.
Recibido: 7 de
mayo de 2014
Aceptado: 26 de septiembre de 2014
Dr.C. Yunior M. Morán Gómez, Instituto de Investigaciones del Tabaco (IIT), carretera a Tumbadero, km 8 ½ San Antonio de los Baños. Artemisa. CP 32500. Email: biologia8@iitabaco.co.cu