RESEÑA
BIBLIOGRÁFICA
Influencia
de la inoculación micorrízica en los abonos verdes. Efecto sobre
el cultivo principal. Estudio de caso: el maíz
Influence
of mycorrhizal inoculation on green manures. Effect on the main crop. A case
study: corn
Dra.C.
Gloria M. Martín, Dr.C. Ramón Rivera
Instituto Nacional
de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las
Lajas, Mayabeque, Cuba, CP 32700.
RESUMEN
El valor de los
abonos verdes como vía para el suministro de nitrógeno ha sido
reconocido durante siglos por los agricultores. Otro beneficio asociado a la
utilización de este tipo de plantas es que incrementan la actividad y
diversidad de los microorganismos del suelo, como los hongos micorrízicos
arbusculares (HMA). En la presente reseña bibliográfica se resumen
algunos resultados obtenidos en el mundo y en Cuba en relación con la
definición e importancia de los abonos verdes, la evaluación del
aprovechamiento del nitrógeno y la sustitución de otras fuentes
nitrogenadas por estos cultivos en los sistemas agrícolas. Así
mismo, se abordan las características y beneficios de los HMA, su papel
en la nutrición vegetal, los factores que influyen en su eficiencia y
el efecto del establecimiento de la simbiosis sobre la optimización del
suministro de nutrientes. Por último, se brindan algunas consideraciones
acerca de la inoculación micorrízica y rotación con abonos
verdes, y algunos resultados con el maíz. El empleo de alternativas nutricionales
para los cultivos, como las dos mencionadas en este trabajo, es una necesidad
impostergable, dada la importancia de la conservación del medio ambiente,
obtener alimentos saludables y el precio cada vez más alto de los fertilizantes
en el mercado mundial.
Palabras
clave: micorrizas, nutrición de las plantas.
ABSTRACT
The value of the
green manures as nitrogen supply has been recognized during centuries by farmers.
Another benefit associated to the use of these plant types is that they increase
the activity and diversity of the soil microorganisms, such as the arbuscular
mycorrhizical fungus. In the present bibliographical revision it summarizes
some results obtained in the world and in Cuba in relation to the definition
and importance of green manures, the evaluation of the use of nitrogen and the
substitution of other nitrogen sources by these plants in the agricultural systems.
Likewise, characteristics and benefits of the arbuscular mycorrhizical fungus
(AMF) are approached, their function in the plant nutrition, factors that influence
in this efficiency, the effect of the symbiosis establish in the optimization
of the nutritious supply. Lastly, some considerations are offered about the
mycorrhizical inoculation and rotation with green manures and some results obtained
with corn. The use of these two nutritional alternatives for plants is inevitable,
given the importance of the environment conservation, to obtain healthy foods
and the higher price of fertilizers in the world market.
Key words:
mycorrhizae, plant nutrition.
INTRODUCCIÓN
La adopción
de técnicas agroecológicas para la producción agrícola
tiene como uno de sus objetivos reducir la dependencia de insumos externos y
favorecer los procesos biológicos de fijación del nitrógeno
(N) y el ciclo de los nutrientes. Mediante el empleo de los abonos verdes se
favorecen las medidas de control de la erosión del suelo y se disminuye
la incidencia de plantas arvenses (1).
De ese modo, el valor de los abonos verdes como vía para el suministro
de nitrógeno ha sido el más reconocido durante siglos por los
agricultores. Este efecto consiste, fundamentalmente, en el aporte de N de las
leguminosas, en simbiosis con bacterias del género Rhizobium,
a través de la fijación biológica del nitrógeno
(FBN) y posterior mineralización del N en el suelo, lo que reduce los
requerimientos de fertilizantes nitrogenados de los cultivos (2).
Otro beneficio asociado a la utilización de los abonos verdes es que
incrementan la actividad y diversidad de los microorganismos del suelo, como
los fijadores de N y los hongos micorrízicos arbusculares (HMA).
Los hongos micorrízicos arbusculares son organismos biotróficos
obligatorios, que se asocian con raíces de plantas vasculares terrestres,
epífitas, acuáticas y también con rizoides y talos de briofitas
y otros vegetales basales, formando una relación simbiótica mutualista
denominada micorriza arbuscular y micotalia para vegetales con y sin raíces,
respectivamente. En las últimas décadas se les ha prestado una
gran atención debido al papel que tienen en la adquisición de
nutrientes por las plantas (3).
La efectividad micorrízica es la capacidad de un simbionte de influir
positivamente sobre el crecimiento de la planta, aumentar el número de
propágulos en el suelo o mejorar la transferencia de nutrientes a la
planta (4). Con la inoculación de cepas eficientes de HMA la fertilización
se hace más eficiente, se reducen las dosis de fertilizantes a aplicar
a las plantas micorrizadas y de esta forma se disminuyen los efectos de la contaminación
de los suelos y las aguas (5).
Inherente al uso de los abonos verdes se encuentra la asociación de estos
con las poblaciones nativas de HMA y así provocar modificaciones cualitativas
y cuantitativas en la población de estos hongos del suelo y en la colonización
de los cultivos posterioresA
(6); aunque por lo general, esta micorrización no llega a ser totalmente
efectiva y los cultivos responden a la inoculación con cepas eficientes
de HMA (7).
En Cuba se han efectuado algunos trabajos recientes que abordan, tanto el efecto
de diferentes especies de abonos verdes en la multiplicación de propágulos
de HMA en el suelo y el establecimiento de la simbiosis en el cultivo posterior
(8, 9, 10, 11), como, la inoculación micorrízica de especies de
leguminosas, lo que trae por consecuencia no solo una estimulación del
crecimiento y desarrollo de este tipo de plantas ,sino también un beneficio
directo al cultivo principal sembrado en secuencia (12).
Precisamente, uno de los retos dentro de la agricultura sostenible, es garantizar
un suministro adecuado de nutrientes para asegurar altos rendimientos, por lo
que el empleo de los abonos verdes, su inoculación con cepas eficientes
y su integración con el manejo efectivo de la simbiosis micorrízica,
se destacan por sus posibilidades y beneficios. En la presente revisión
bibliográfica se resumen algunos resultados obtenidos en el mundo y en
Cuba en relación con estos aspectos.
ABONOS
VERDES. DEFINICIÓN E IMPORTANCIA
Los abonos verdes
constituyen una práctica agronómica que consiste en la incorporación
de una masa vegetal no descompuesta de plantas cultivadas con la finalidad de
mejorar la disponibilidad de nutrientes y las propiedades del suelo. En la actualidad
se ha ampliado la definición a las plantas que se siembran para la cobertura
del suelo, protegerlo de la erosión, controlar las arvenses y uso como
alimento animal y humano.
Las leguminosas tienen gran valor como abonos verdes debido al aporte de N por
el proceso de FBN en asociación con bacterias del género Rhizobium,
aunque se pueden cultivar otras especies de crecimiento rápido y de buena
producción de masa verde, como las gramíneas y las combinaciones
de algunas de ellas en forma de mezcla (13).
Las funciones de los abonos verdes están asociadas a la protección
del suelo contra la erosión y reducción de la temperatura y de
la evaporación del agua. Mejoran las propiedades físicas, químicas
y biológicas del suelo; incrementan su contenido en materia orgánica,
así como el aporte, reciclaje y movilización de nutrientes; ayudan
en el control natural contra los nematodos, las plagas, y controlan las arvensesB.
Entre los principales beneficios en el uso de los abonos verdes están
la reducción del empleo de herbicidas y plaguicidas, aumento del rendimiento
y calidad de los cultivos, conservación de la humedad y la materia orgánica
del suelo, disminución de los costos de fertilización y elevación
de los ingresos con la venta de semillasB
(14).
La selección de especies y la forma de uso de los abonos verdes debe
cumplir algunos requisitos, entre los que se encuentran: adecuarse al sistema
de producción utilizado por el agricultor; con bajo costo de implantación
y conducción; ser resistentes a plagas; ser de rápido crecimiento;
producir un efecto favorable al aumentar el rendimiento de los cultivos y tener
una mayor rentabilidad en relación al sistema tradicional (15).
La principal limitante en la adopción del empleo de los abonos verdes
es que, según algunos productores, para producir suficiente masa verde,
deben recibir nutrientes y atenciones culturales, mientras que en esa etapa
el área ocupada no produce alimentos. Esta es una concepción errónea
de su uso. El análisis correcto debe ser que al mejorarse el suelo, se
podrán obtener cosechas mayores, con ahorros de fertilizantes y se conserva
el principal recurso natural con que se cuenta, el sueloC.
Otra limitante de la utilización de los abonos verdes a gran escala son
los problemas relacionados con el alto costo de las semillas y la dificultad
de obtener una sincronía entre la liberación de los nutrientes
contenidos en estas plantas y la demanda del cultivo principal (16).
Entre las opciones prácticas de su uso está el sembrarlos en sucesión
o en bandas dentro de los campos cultivados, o en asociación, tanto con
cultivos de ciclo corto o perennes. Si se insertan dentro de las especies presentes
en los pastizales cumplirían doble función de mejoradores del
suelo y como alimento animalB.
Para que los abonos verdes sean adoptados, es necesario que los productores
perciban que pueden obtener más de un beneficio de su cultivo. De ahí
que se fomente la innovación por parte de los agricultoresD.
INFLUENCIA
SOBRE LAS CARACTERÍSTICAS FÍSICAS Y QUÍMICAS DEL SUELO
La aplicación
de abonos verdes al suelo mejora sus propiedades, aunque en zonas tropicales
no siempre este efecto es cuantificable a corto plazo, debido a que la descomposición
de las plantas ocurre rápidamente bajo condiciones de altas temperaturas
y humedad (17).
Efectos físicos
Se ha demostrado que los abonos verdes/cultivos de cobertura influyen directamente
en las características físicas de los suelos, debido a la adición
de materia orgánica y al aumento y proliferación de las raíces.
Las características físicas más influenciadas por los abonos
verdes/cultivos de cobertura son agregación, capacidad de retención
del agua, densidad, velocidad de infiltración y aireación (18).
Estos efectos dependen de la calidad, la cantidad y el tipo de manejo, dado
al material adicionado, de los factores climáticos y de las propiedades
de los suelos.
La preparación biológica del suelo a través de las raíces
de los abonos verdes, contribuye a la descompactación del suelo, aumentando
su porosidad, la aireación, el índice de infiltración de
agua, mejorando el drenaje y facilitando la penetración del sistema radicular
de los cultivos comerciales que le suceden.
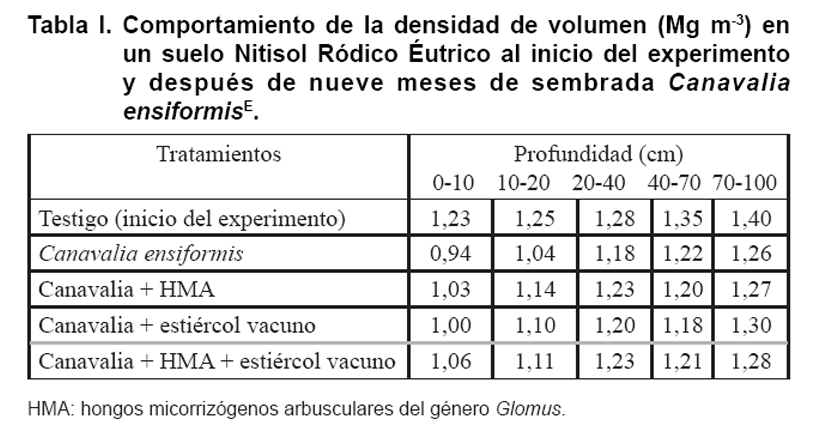
En la Tabla I se muestran
los resultados de la evaluación de la densidad de volumen de un suelo
Nitisol Ródico Éutrico al inicio de un experimento y posterior
siembra de la especie de abono verde Canavalia ensiformis, crecida
durante nueve mesesE.
Al comienzo de la investigación el suelo presentaba compactación
a partir de los 20 cm de profundidad, con valores de 1,28 hasta 1,40 Mg m-3.
Al sembrarse el abono verde, los valores de la compactación del suelo
disminuyeron hasta los 70 cm de profundidad y los autores informaron que pudo
deberse a que la raíz pivotante de Canavalia ensiformis alcanza
de 50 a 60 cm de profundidad, teniendo un efecto muy fuerte de laboreo biológico
descompactador en el suelo.
Numerosos estudios han demostrado que con la incorporación de los abonos
verdes/cultivos de cobertura al suelo se logran apreciables incrementos en el
número y tamaño de los agregados bajo diferentes ecosistemas.
En ese sentido, al utilizar la rotación Vicia villosa-maíz
(Zea mays) se observó que esta asociación fue la más
efectiva en la estabilización de los agregados y se reflejó en
el aumento de la productividad del maíz (19).
Al respecto, se informa que la descomposición de las raíces y
tallos del centeno (Secale cereale) y las sustancias liberadas de dicho
proceso contribuyen de forma efectiva al ciclado de nutrientes en el suelo y
la formación y estabilización de los agregados. Estos últimos
tienen importancia en mantener la estructura del suelo y la productividad, debido
a que mejoran las características del suelo como la retención
de humedad, difusión de los gases, conductividad hidráulica y
disminuyen la erodabilidad (20).
La preparación biológica del suelo a través de las raíces
de los abonos verdes/cultivos de cobertura contribuye a la formación
de los agregados del sueloF.
Por ejemplo la utilización en Paraguay del nabo forrajero (Raphanus
sativus var. oleiferus), de raíces pivotantes profundas,
capaces de romper camadas compactas de suelo; después de su descomposición,
estas raíces dejan canales que favorecen la infiltración de agua
y la penetración de raíces de cultivos posterioresB.
Otros estudios han demostrado la positiva influencia que tienen las especies
Crotalaria juncea y Sesbania rostrata sobre los índices
de materia orgánica, humedad natural, distribución y estabilidad
de los agregados del suelo. El comportamiento más efectivo de estas dos
especies en la mejora del suelo con relación al resto de las especies
evaluadas estuvo en correspondencia con el alto volumen de fitomasa (verde y
seca) que estas especies incorporan, así como por la calidad de este
material (alta relación C:N). Estos altos volúmenes provocaron
variación significativa de la materia orgánica del suelo, la cual
mejoró la capacidad de retención del agua de este suelo, así
como las características físicas del suelo (21).
Además, el empleo de los abonos verdes/cultivos de cobertura impiden
el impacto directo de las gotas de lluvia sobre el suelo, evitando su desagregación
y la formación del sellamiento superficial del mismo, aumentando la infiltración
y evitando la erosión, se atenúa la velocidad del escurrimiento
superficial del agua, disminuyendo el arrastre de las partículas del
sueloF.
Efectos químicos
Los abonos verdes/cultivos de cobertura en crecimiento, así como sus
residuos (parte aérea y raíces) promueven importantes efectos
sobre la fertilidad química del suelo. Los principales efectos químicos
esperados con la utilización de los abonos verdes/cultivos de cobertura
sonF:
Acrecenta el contenido y disponibilidad de nutrientes en el suelo, por el aumento
en la formación de ácidos orgánicos que favorecen el proceso
de meteorización de los minerales del suelo y el incremento de la solubilización
de nutrientes poco disponibles, principalmente del fósforo. También
aumentan el contenido de nitrógeno por la fijación biológica
a través de las leguminosas empleadas como abono verde y se acentúa
el reciclaje de elementos lavados (nitrógeno, calcio, magnesio, potasio,
entre otros) por medio de la biomasa de especies con raíces profundas.
Neutralización de elementos tóxicos como el aluminio, a través
de la formación de complejos orgánicos.
Mejora la capacidad de adsorción y almacenamiento de nutrientes por acumulación
de materia orgánica.
Mejora la distribución de nutrientes en el perfil de suelo, favoreciendo
el transporte de calcio y magnesio y la liberación de nutrientes, principalmente
de fósforo, durante la descomposición de los sistemas radiculares.
Elevación del pH del suelo, por la mineralización de aniones orgánicos
a CO2 y H2O.
La influencia de los abonos verdes en el contenido de nitrógeno de los
suelos es atribuida a la incorporación del N derivado de la FBN, si se
utilizan plantas de la familia de las leguminosas, que aumentan su disponibilidad
para los cultivos en sucesión y tornan positivo el balance del nutriente
en el sistema suelo-plantaG.
Con la rápida mineralización de las leguminosas, se liberan significativas
cantidades de N y otros elementos, que favorecen el crecimiento de las plantas
y la fracción no aprovechada queda como efecto residual (22).
En Filipinas se evaluaron ocho especies de leguminosas como sustitutas de la
fertilización nitrogenada, obteniendo como resultado que en dos años
Sesbania rostrata y Crotalaria juncea acumularon nitrógeno
en exceso del requerido por el cultivo del arroz; además, aumentaron
el carbono orgánico del suelo y el nitrógeno total (23).
Los abonos verdes reducen la adsorción de P, efecto asociado al incremento
del tenor de materia orgánica del suelo, lo que conlleva a la formación
de complejos que bloquean los sitios de adsorción en la superficie de
óxidos e hidróxidos de Fe y Al (24).
También se ha comprobado que el sistema radical de las leguminosas posee
facilidad para extraer del suelo elementos nutritivos poco solubles en especial
el fósforo. Entre las plantas más eficientes en este aspecto se
encuentran Lupinus albus, Fagopyrun esculentun, Eucaliptus
gummifera, Brassica napus, Cajanus cajan y Arachis
hypogaea (25).
En relación a este tema, se ha renovado el interés en el uso de
plantas movilizadoras de P disponible, empleadas como abono verde, para incrementar
la disponibilidad de este elemento en el cultivo principal. Estas especies de
plantas, como Tithonia diversifolia, muestran habilidad para obtener
fosfatos menos lábiles del suelo y acumularlos en su biomasa, incluso
en niveles superiores a sus propias necesidades o requerimientos del elemento
(26).
Algunas de estas especies, bajo condiciones de déficit de P, en suelos
de pH neutro o ligeramente alcalino, pueden autoabastecerse del elemento y dejar
disponible una fracción para otros cultivos, debido a sus exudados radicales
que provocan descensos de pH en la rizosfera y movilizan al P presente en esta
zona del suelo (27).
Un efecto benéfico de los abonos verdes es el reciclaje de nutrientes,
si se utilizan plantas que expanden su sistema radical a horizontes profundos
del suelo y absorben nutrientes de estas capas. Después del corte y mineralización
de las plantas, ocurre la liberación gradual de los nutrientes disponibles
para los cultivos en el horizonte superficial (24).
En Cuba, al realizar estudios acerca de la influencia que sobre algunas propiedades
químicas del suelo tiene la incorporación de abonos verdes, se
ha encontrado un efecto positivo de estas plantas sobre el contenido de cationes
intercambiables y P asimilable en el sueloH.
En el contenido de K del suelo, las especies que ejercieron los mayores incrementos
en este índice fueron Mucuna aterrimum, Canavalia ensiformis,
Dolichos lablab y Crotalaria juncea. Los abonos verdes incorporados
incrementaron los contenidos de Ca, Mg y P asimilable del suelo (Tabla
II).
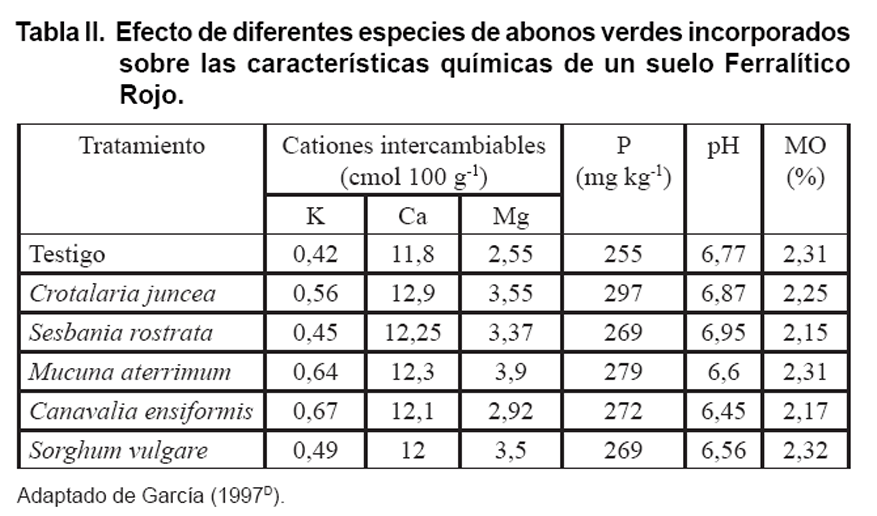
Coincidiendo con esto, se plantea que el fósforo proveniente de la descomposición
de los abonos verdes/cultivos de cobertura o de la materia orgánica del
suelo, constituye una cantidad importante que alimenta gradualmente al fósforo
de la solución del suelo, aumentando la eficiencia de absorción
por las plantas. Además, los abonos verdes/cultivos de cobertura reciclan
gran cantidad de potasio a través de su biomasa, al igual que calcio
y magnesio, ayudando a mantener niveles satisfactorios de estos nutrientes en
forma disponible para las plantasF.
EVALUACIÓN
DEL APROVECHAMIENTO DEL NITRÓGENO DE LOS ABONOS VERDES
El uso eficiente
de nutrientes ha ganado más atención con el incremento de los
costos de fertilización y la continua preocupación por el impacto
ambiental (28). Para cuantificar el aprovechamiento de los nutrientes se han
desarrollado diversas metodologías. Entre estas, el método de
las diferencias se basa en la suposición que la cantidad de nutrientes
del suelo que toma el cultivo es independiente de la cantidad del nutriente
aplicado.
El método de las diferencias se ejecuta a través de la evaluación
de la absorción del N en dos parcelas, una sin fertilizante nitrogenado
(o fuente orgánica nitrogenada), donde se estima la cantidad de N que
aporta el suelo y otra parcela, a la que se le adiciona fertilizante o abono
orgánico, en la que se evalúa la cantidad de N que el cultivo
absorbe, del suelo y de la fuente añadida, y por cálculo de la
diferencia de N absorbido por las plantas de la parcela con la adición
de nutrientes, menos la parcela sin esta aplicación, se estima la cantidad
del N derivado de la fuente aplicada, que fue absorbida por el cultivo (28).
Es un método muy representativo, de fácil aplicación en
condiciones de parcelas experimentales o áreas de producción y
en el cual se logra calcular con rapidez los efectos de la aplicación
de nutrientes. Sin embargo, tiene como desventaja que en experimentos con respuesta
a la fertilización, las plantas de las parcelas fertilizadas toman más
N del suelo que las no fertilizadas (efecto primming), lo cual se atribuye
a un efecto de la fuente de N aplicada sobre la disponibilidad del elemento
en el suelo (29).
Las plantas fertilizadas crecen más vigorosas, desarrollan mejor sus
raíces y exploran así un mayor volumen de suelo (30). Los abonos
verdes parecen provocar el efecto primming, al liberar N del suelo como consecuencia
de su incorporación (31).
La eficiencia del N incorporado con los abonos verdes depende, además,
del volumen y calidad del material incorporado, de efectos alelopáticos,
control de arvenses y patógenos, conocidos en su conjunto como efecto
de rotación (32).
UTILIZACIÓN
DEL ISÓTOPO 15N EN LOS ESTUDIOS
SOBRE LOS ABONOS VERDES
El 15N
se utiliza en la investigación agrícola para la cuantificación
de la FBN, eficiencia y aprovechamiento de las fuentes nitrogenadas y el estudio
de la dinámica del N en el suelo, agua y plantas (22).
En los estudios sobre la dinámica del N, es difícil distinguir
el origen de este elemento. El uso del 15N puede estimar con precisión
las rutas que el N sigue en el sistema (33). Es un método muy exacto;
sin embargo, su empleo es costoso y requiere de equipamiento y condiciones especiales
de aplicación, por lo que casi siempre se emplea en ambientes controlados,
no representativos de las condiciones de producción.
El método de dilución isotópica se basa en las diferencias
en composición isotópica de las diferentes fuentes de N disponible
para el crecimiento de las plantas. Así es posible estudiar y cuantificar
la absorción que realiza la planta con independencia de la fuente de
nutrientes que se emplee (29).
Para la determinación de la eficiencia de la fertilización nitrogenada
se utilizan dos parámetros muy relacionados; el primer es el porcentaje
de N derivado del fertilizante (% Nddf), que es una cuantificación isotópica,
independiente del rendimiento y sensible para detectar diferencias entre los
tratamientos de fertilización. El segundo es la eficiencia de recuperación
del N-fertilizante (ERNF), que es dependiente del rendimiento y se basa en el
balance de masas, obtenido por cálculo en cadena y, por consiguiente,
sujeto a mayor error experimental (22).
La aplicación del método de las diferencias presenta resultados
más similares a los obtenidos con el método isotópico en
la medida que el suelo tenga menores contenidos de materia orgánica y
N totalI.
En algunas investigaciones conducidas con el objetivo de evaluar el aprovechamiento
del N de los abonos verdes, tanto por el método isotópico como
por el de las diferencias, se ha demostrado que en términos de suministro
de nutrientes, Crotalaria juncea y Mucuna pruriens aportaron
al cultivo del arroz (Oryza sativa) entre 25-38 % del N total absorbido
(31).
Por su parte, otros autores han encontrado que del 5 al 17 % del N es recuperado
por el cultivo del trigo (Triticum aestivum) en sucesión, del
7 al 12 % del N se pierde por lavado o volatilización y del 50 al 78
% es retenido en el suelo (34).
En estudios desarrollados en Cuba en el cultivo del arroz, empleando técnicas
isotópicas, se obtuvo mediante análisis de 15N, que
el abono verde Sesbania rostrata no contribuyó directamente
al N total contenido en las plantas, al menos en su primer ciclo, a pesar de
haber estimulado significativamente la acumulación de N por el cultivo,
que siempre presentó similar proporción de 15N en exceso
(semejante dilución isotópica) con y sin la incorporación
del abono verde. La baja disponibilidad de N derivado de la leguminosa, pudo
estar asociada con la baja tasa de mineralización del N orgánico,
debido a las condiciones reductoras existentes por la rápida inundación
del suelo tras la incorporación de las plantas; además, el efecto
de este abono verde en las condiciones del estudio sugiere que este material
estimuló la actividad microbiana, causando un efecto priming proporcional
a la disponibilidad del N nativo del suelo y del fertilizante (35).
Diversos autores han estudiado el efecto de los abonos verdes en la nutrición
del maíz (Zea mays) y han encontrado coeficientes de aprovechamiento
que varían entre 30 y 72 %. Las causas de la baja eficiencia pudieran
ser por lavado, desnitrificación, volatilización e inmovilización
del N por los microorganismos del suelo (22, 36).
En resultados de Cuba, se han informado coeficientes de aprovechamiento del
N derivado de los abonos verdes que fluctuaron entre 20 al 50 %, las oscilaciones
dependieron de la especie de abono verde evaluada, o su combinación con
dosis complementarias de fertilizante mineral, que pueden acelerar el proceso
de mineralización de los abonos verdes incorporados y aumentar el coeficiente
de aprovechamiento del N (37).
SUSTITUCIÓN
DE OTRAS FUENTES NITROGENADAS POR LOS ABONOS VERDES EN LOS SISTEMAS AGRÍCOLAS
La sustitución de fertilizantes minerales por orgánicos se ha
visto limitada por la necesidad de producirlos en el mismo lugar donde van a
ser utilizados (38). En ese sentido, los abonos verdes tienen cierta ventaja
sobre otros abonos orgánicos.
En la India, se ha indicado que con la incorporación de Sesbania
rostrata se puede suplir el 50 % del fertilizante nitrogenado en el arroz
(Oryza sativa) (39, 40). Los rendimientos de este cultivo, después
de la incorporación de 20 t ha-1 de Vigna unguiculata
como abono verde, fueron superiores al testigo sin N. El tratamiento combinado
de Vigna más 60 kg N ha-1 de fertilizante mineral
rindió el doble de arroz que el testigo y un 24 % superior al tratamiento
con la dosis óptima de fertilización de 120 kg N ha-1
(41).
En estudios realizados en Cuba en este mismo cultivo (arroz), se ha encontrado
que la aplicación del 50 % de la dosis óptima de fertilizante
mineral, unida a la incorporación de Sesbania rostrata, posibilitó,
durante dos cosechas consecutivas, incrementar el rendimiento agrícola
en más de 1 t ha-1 de arroz cáscara.
Al estudiar el coeficiente de aprovechamiento del N de los abonos verdes, determinado
por el método isotópico, se ha encontrado un 42 % del N-Mucuna
pruriens por el arroz y un 20 % del N-Crotalaria juncea por
el maíz. Al combinar fertilizantes nitrogenados y abonos verdes, el efecto
fue aditivo con un incremento de los rendimientos, que superó al tratamiento
de mayor dosis de fertilizante mineral (31).
La contribución de los abonos verdes al rendimiento del maíz fue
equivalente a la aplicación de 97, 91, 89 y 78 kg N ha-1 para
Mucuna pruriens, Crotalaria juncea, Cajanus cajan
y Arachys hipogaea respectivamente (42). El maíz tuvo una mayor
respuesta en el aumento de los rendimientos y contenido foliar de N y fósforo
(P) en sucesión con leguminosas empleadas como abono verde, en comparación
a la sucesión con gramíneas (43).
En el maíz, el empleo combinado de Canavalia ensiformis, junto
a la inoculación micorrízica del cultivo principal, permitió
que este cultivo alcanzara rendimientos en masa seca similares a los obtenidos
con el control de producción, en condiciones de microparcelas, con una
reducción del 50 % de la dosis del fertilizante mineral aplicado (44).
En el cultivo de la papa (Solanun tuberosum) en Cuba, la canavalia
sustituyó hasta el 50 % de sus necesidades de fertilizante N. Los más
altos rendimientos se obtuvieron al combinar la canavalia y 40 kg N ha-1,
al sustituir hasta el 75 % de la dosis recomendada de fertilizante mineral (38).
El uso combinado de abonos verdes y fertilizantes minerales promovieron el aumento
de los tenores de nutrientes, con disminución de la acidez potencial
del suelo y aumento de los contenidos de calcio y magnesio en la parte aérea
de la caña de azúcar (Saccharum spp.) (33).
En China, en un sistema de cultivo intensivo, se determinó que el empleo
de los cultivos de cobertura maíz (Zea mays), crisantemo (Chrysanthemum
seguetum) y amaranto comestible (Amaranthus mangostanus), en rotación
con el pepino (Cucumis sativus) reducen el riesgo de pérdidas
de N y favorecen la disponibilidad de P y K. Además, incrementan la población
y la diversidad de la biomasa microbiana del suelo, lo que contribuye al aumento
del rendimiento de cultivo principal (45).
En Chile, el uso de la mezcla de los cultivos de cobertura Trifolium subterraneum,
Medicago polymorpha y T. michelianum en el cultivo de la vid
(Vitis vinifera L.) cv. Cabernet Sauvignon, en suelos de baja fertilidad,
presentó claras ventajas sobre la fertilización empleada tradicionalmente,
en términos de mejora de la nutrición nitrogenada del cultivo.
El estudio demostró que los abonos verdes tienen una incidencia positiva
sobre el incremento de la masa seca y contenido de N, como consecuencia del
elevado aporte de este elemento que realizan las leguminosas, semejante a la
contribución realizada por la fertilización nitrogenada. Mediante
técnicas isotópicas se pudo comprobar que alredor del 20 % del
N total acumulado por el cultivo provino de las leguminosas (46).
En Brasil, al estudiar diferentes abonos verdes en sucesión con cultivos
hortícolas, se encontró que este sistema de cultivo contribuyó
al aumento de la productividad de lechuga (Lactuca sativa) y zanahoria
(Daucus carota), con incrementos en la masa fresca y seca de ambas
especies hortícolas, obteniéndose resultados superiores a los
200 g de masa fresca por planta, destacándose las rotaciones con Canavalia
ensiformis y la mezcla de Mucuna aterrimum y Zea mays,
que fueron superiores a las producciones obtenidas en presencia de Cajanus
cajan, estiércol vacuno y abono orgánico tipo bocashiJ.
HONGOS
MICORRIZÓGENOS ARBUSCULARES (HMA)
Las micorrizas
son asociaciones simbióticas mutualistas existentes entre ciertos hongos
del suelo y las raíces de las plantas superiores. Los hongos se benefician
con el suministro de fuentes carbonadas provenientes de la planta y esta se
beneficia por la mayor exploración del suelo, lo que aumenta la capacidad
de absorción de agua, nutrientes minerales y el crecimiento y desarrollo
de las plantasA.
CARACTERÍSTICAS
Y BENEFICIOS
Entre la funciones
y beneficios que las micorrizas le brindan a las plantas están el incremento
de la capacidad de absorción de agua y nutrientes, por lo que ayudan
al hospedante a resistir mejor las condiciones adversas de suelo y clima, favorecen
el aumento de la biomasa y producción de los cultivos, así como
también contribuyen a la formación de agregados estables en el
suelo (6, 47, 48).
Se han definido tres tipos de asociaciones micorrízicas, al tomar en
consideración sus características morfoanatómicas y ultraestructurales:
Ectomicorrizas, Ectendomicorrizas y Endomicorrizas. Las endomicorrizas no son
detectadas visiblemente, forman una red externa de hifas y penetran el interior
de las células corticales sin llegar a colonizar el endodermo. Es el
grupo más difundido en el planeta y se divide en varios subtipos, de
los cuales el más representativo es el arbuscular, que es el más
importante en los ecosistemas tropicales.
La extensa red de hifas extrarradicales juega un importante papel en la conservación
del suelo, al mejorar la agregación del mismo. La producción de
componentes orgánicos por las hifas de HMA y otros microorganismos en
la micorrizosfera puede ayudar a unir los microagregados en macroagregados (49).
La propagación de los HMA se da a través de esporas, micelio y
fragmentos de raíces colonizadas, que de manera conjunta constituyen
los propágulos y colonizan las raíces de las plantas hospedantes
para desarrollarse y dar origen a nuevos propágulos (50). La mayor cantidad
de propágulos en el suelo se encuentra en los primeros 15-20 cm de profundidad,
en relación directa con la aireación y contenido de materia orgánica
(51).
La simbiosis micorrízica en cultivos de ciclo corto se desarrolla de
manera secuencial, al pasar por diferentes fases de crecimiento, tanto microbianas
(latencia, exponencial, estabilización o meseta y muerte o esporulación
total), como vegetal, de acuerdo a las fases fenológicas de la planta
hospedante. En el inicio de la fructificación de las plantas, siempre
se encuentran mayores valores de porcentaje de colonización y micelio
y menores de esporas, que al finalizar la cosecha, lo que evidencia una relación
estrecha con el suministro de carbono hacia las raíces (52).
PAPEL DE
LOS HMA EN LA NUTRICIÓN VEGETAL
La inoculación
de las plantas con especies efectivas de HMA provoca un marcado incremento en
los procesos de absorción y traslocación de nutrientes, ya sea
por interceptación, flujo de masa o difusión.
Este beneficio es complejo y puede ser resultado de varios mecanismos, como
aumento de la superficie de exploración del suelo, elevación de
la capacidad absorbente de las raíces, toma de nutrientes no accesibles
a las raíces no micorrizadas, beneficio de otros microorganismos en la
rizosfera, amortización de los efectos adversos del pH del suelo, aluminio,
manganeso, otros metales pesados, salinidad, estrés hídrico y
ataque de patógenos (53, 54, 55).
El principal mecanismo de absorción de N es por flujo de masa, que es
el transporte de la solución del suelo a lo largo del gradiente de potencial
de agua, regulado por la transpiración (56).
El aumento en la absorción de N en forma de NH4+
y NO3-, se facilita por los HMA en simbiosis efectiva
con el hospedante y provoca la toma de los nutrientes, necesarios para la estimulación
del crecimiento vegetal. En condiciones de bajos niveles, los HMA propician
la absorción de los nutrimentos menos disponibles (57).
Los HMA juegan un papel vital en la toma del P presente en los suelos, principalmente
en las zonas tropicales donde las cantidades asimilables de este elemento son
bajas. El mecanismo para incrementar la absorción vía HMA se desarrolla
a partir de la capacidad de explorar un mayor volumen de sustrato y aumentar
la capacidad absorbente de las raíces (interceptación) y por difusión,
que es el transporte de nutrientes a lo largo de un gradiente de concentración
(57).
Además, las micorrizas pueden acelerar la absorción de P no disponible
para las plantas por la interacción entre los exudados radicales de algunas
especies de plantas que son capaces de solubilizar P (25).
El K y Mg son encontrados en altas concentraciones, tanto en las plantas micorrizadas
como en las que no lo están. Estos elementos se mueven en la solución
del suelo con mayor facilidad que el P. En algunos casos la elevada absorción
de estos nutrientes coincide con un efecto indirecto para eliminar deficiencias
de P (52); aunque, algunos trabajos experimentales sugirieron que la participación
de los HMA en la adquisición de K representa una vía importante
con que las plantas cuentan para obtener este elemento.
FACTORES
QUE INFLUYEN EN LA EFICIENCIA DE LOS HMA
Numerosos factores
bióticos y abióticos influyen sobre el establecimiento y funcionamiento
de la simbiosis micorrízica.
Luz: en las zonas con alta radiación solar, los niveles de colonización
son generalmente elevados; sin embargo, si se ve atenuada, la respuesta de las
plantas a esta simbiosis disminuye. La alta colonización depende, entre
otros factores, del incremento de la tasa fotosintética, lo que implica
una mayor producción e intercambio de metabolitos (52).
Temperatura: los HMA se forman bajo rangos de temperatura que oscilan
entre 18 y 40 ºC, con el óptimo para la mayoría de las especies,
cercano a los 30 ºC. La influencia de la temperatura en las plantas micorrizadas
con HMA es variable y está relacionada con la combinación exacta
de especie de hongo-hospedante, así como la fase de desarrollo de las
plantas (54).
pH: la respuesta de los HMA al pH ha sido estudiada debido a su efecto
en la productividad de las plantas, el efecto directo en la fisiología
del endófito y la planta hospedante y el efecto indirecto vía
cambios en la Capacidad de Cambio de Bases (CCB). Las diferentes especies de
HMA toleran diversos rangos de pH (58).
En los estudios de selección de especies de HMA con alta eficiencia simbiótica,
hay que tener en cuenta el efecto del pH, ya sea sobre la productividad de la
asociación o sobre los mecanismos de reproducción fúngicos
(52). Algunas especies de HMA no se adaptan a condiciones de pH diferentes al
suelo nativo de donde fueron aisladas, por eso se considera al pH esencial en
el establecimiento de especies de HMA por tipo de suelo (54).
Estacionalidad: en regiones geográficas donde sea posible contrastar
al menos dos épocas climáticas como lluviosa y seca, la diversidad
de especies nativas de HMA y su funcionalidad pueden variar (51). Factores externos
como la estacionalidad y el manejo influyen en la propagación de los
HMA y pueden afectar las simbiosis en condiciones de campo (59).
En varios trabajos realizados por diferentes autores se pudo comprobar la influencia
del tipo de suelo sobre el funcionamiento micorrízico y la estacionalidad,
pues en suelos con mal drenaje y alta retención de humedad, los mayores
porcentajes de colonización se encuentran durante la estación
seca (60), mientras que en suelos con buen drenaje, los mayores porcentajes
de colonización se encuentran en la estación lluviosa (61, 62,
63).
Cobertura del suelo: Como los HMA son simbiontes obligatorios, su distribución
en suelos cultivados está fuertemente influenciada por la vegetación
(6).
En barbecho, la micorrización natural de las plantas está pobremente
desarrollada y no se ha encontrado correlación entre la población
de esporas y la duración del barbecho (64), pero el número de
esporas de HMA se incrementó significativamente con el aumento del número
de especies (diversidad) de arvenses presentes en el barbecho (65).
Mientras el suelo se mantenga al desnudo durante su preparación, la viabilidad
de las hifas decrece bruscamente, por ausencia de plantas hospedantes o si en
el esquema de rotación de cultivos, se introducen plantas no micótrofas
(49).
Al realizar análisis de frecuencia de aparición de esporas nativas
de HMA por tipo de cobertura, se ha encontrado que los sistemas agroforestales,
seguidos por el bosque natural, presentaron los mayores promedios de colonización
radical, por encima del 30 %. Por el contrario, las coberturas de parcelas,
monocultivo y potrero presentaron los valores de porcentaje de colonización
radical más bajos (51).
En otros estudios, se ha demostrado que la simbiosis micorrízica arbuscular
nativa fue más efectiva en ecosistemas con coberturas altamente heterogéneas,
de allí la importancia que tiene promover sistemas de producción
agrícola agrobiodiversos (66).
Dependencia micorrízica de las plantas (DM): está dada
por el grado de relación existente entre la planta y el hongo para obtener
la máxima productividad en un nivel de fertilidad de suelo dado y es
una propiedad intrínseca de las plantas (4, 53).
El cálculo de la DM no se puede extrapolar a condiciones naturales donde
se desarrolla la micorrización nativa (52). Los requerimientos de nutrientes
y una baja capacidad de absorción, si no hay micorrizas, se correlacionan
con una alta DM, que no es igual a una elevada respuesta del cultivo ante la
inoculación (47).
Las plantas pueden ser agrupadas según el grado de la DM en plantas micorrízicas
obligadas; presentan un crecimiento muy reducido en ausencia de la simbiosis
con HMA, las tasas de colonización son superiores al 60 %. Plantas micorrízicas
facultativas; tienen un sistema radical más profuso y desarrollado, aunque
bajo condiciones edáficas adversas responden a la micorrización.
Las tasas de colonización son inferiores al 50 %. Plantas no micorrízicas;
no forman la asociación (4).
Efectividad micorrízica: es la capacidad de un endófito
de influir positivamente sobre el crecimiento de la planta, aumentar el número
de propágulos o mejorar la transferencia de nutrientes. Es resultado
de la interacción fisiológica entre los simbiontes (4).
Está determinada por el tipo de hongo micorrizógeno, la planta
hospedante, la interfase simbiótica y el tipo específico de suelo
o sustrato, su grado de fertilidad y disponibilidad de agua (39). La principal
forma de cuantificar la efectividad micorrízica es mediante la evaluación
de la respuesta de la planta hospedante en su crecimiento (4).
Las cepas nativas en ocasiones no originan la mayor efectividad, lo cual puede
estar relacionado con una baja concentración de propágulos nativos,
o que presentan una mayor adaptabilidad y posible funcionalidad microbiana,
pero esto no siempre significa una mayor eficiencia micorrízica (52,
67).
Especificidad suelo-cepa: la respuesta positiva a la inoculación
con HMA depende de tres factores; la especie inoculada, cantidad de propágulos
micorrízicos presentes y el tipo de suelo y su fertilidad. Este último
define cuáles son las especies eficientes para una condición edafoclimática,
aunque la efectividad alcanzada por la inoculación depende del manejo
dado a la planta y al suelo (67).
Uno de los resultados más importantes encontrados en Cuba fue que, con
independencia de los cultivos estudiados, existió para cada suelo una
cepa de HMA altamente eficiente, con cuya inoculación se obtuvieron las
mayores respuestas. Es decir se encontró una alta especificidad suelo-cepa
eficiente y este efecto fue completamente reproducible en los diferentes años
en que se repitieron los experimentosA.
Lo anterior indudablemente es un elemento positivo y de alta repercusión
para el manejo de las asociaciones micorrízicas en los cultivos, ya que
facilita la selección de las cepas eficientes para una determinada condición.
La mayoría de los HMA no presentan una alta especificidad con el hospedante,
lo cual es una de las bases del manejo de la inoculación en secuencias
de cultivos. Normalmente ocurre una selectividad entre las especies de una población
de HMA y la planta, por influencia de las condiciones edáficas (50, 68).
Las especies del género Glomus tienen un amplio rango de distribución
funcional con predominio en ecosistemas de alta y media fertilidad, donde resultan
extremadamente eficientes y competitivas. Los resultados obtenidos en Cuba permitieron
extender dicho rango a las condiciones de baja fertilidad y establecer que la
especie Glomus cubense es la de mejores resultados en suelos Ferralíticos
Rojos, al estudiarse la efectividad de esta cepa en la inoculación de
diferentes cultivos (67, 69, 70).
Al analizar los datos de más de 100 experimentos conducidos en suelos
con historiales de agricultura de altos y bajos insumos y con diferentes cultivos,
se observó que la respuesta de la planta a la inoculación con
diferentes cepas de HMA en suelos con agricultura de bajos insumos, estuvo relacionada
con las propiedades asociadas con los tipos de suelos. Las cepas Glomus
fasciculatum-like y G. etunicatum-like tuvieron una alta eficiencia
en suelos relativamente ricos en nutrientes y materia orgánica; Paraglomus
occultum y G. mosseae-like se comportaron mejor en suelos relativamente
pobres en nutrientes y G. mosseae y G. manihotis, en suelos
de mediana fertilidad (71).
Estos autores no encontraron relación significativa entre la respuesta
de la planta a la inoculación de las cepas de HMA y las propiedades del
suelo en los sitios donde se practicó una agricultura de altos insumos,
debido probablemente a la variación inducida por el uso de diferentes
especies de plantas hospederas y a la modificación de las propiedades
del suelo por la historia de la producción intensiva. Concluyeron que
el conocimiento del comportamiento de las cepas de HMA en ambientes determinados,
puede ser la clave para el manejo eficiente de la simbiosis micorrízica,
vía inoculación, en los agroecosistemas.
Disponibilidad de nutrientes: depende del tipo de suelo y de los suministros
de nutrientes necesarios para complementar los requerimientos de los cultivos.
Con muy alta disponibilidad de nutrientes se obtienen los menores efectos de
la inoculación con cepas eficientes y se alcanza la mayor efectividad
con disponibilidad media. Si esta es baja o nula, tampoco funciona adecuadamente
la simbiosis y se obtienen plantas con menor crecimiento y baja efectividad
de la inoculación (47, 72, 73).
Se estima que la asociación entre el hospedante y los HMA consume entre
5-10 % de los productos de la fotosíntesis, costo que será compensado
si la planta se encuentra en condiciones subóptimas de suministro de
nutrientes (53).
Para que la simbiosis sea eficiente, la disponibilidad de nutrientes en el sistema
debe ser inferior a la comúnmente utilizada para las plantas no micorrizadas.
La obtención de plantas con óptimo crecimiento en presencia de
cantidades menores de nutrientes se debe al incremento en eficiencia del proceso
de absorción de estos por las plantas micorrizadas y, por tanto, al aumento
del coeficiente de aprovechamiento de los nutrientes (67). La alta disponibilidad
de nutrientes hace decrecer la presencia de estructuras micorrízicas
en el interior de las raíces, lo que indica que la disminución
en la efectividad micorrízica es consecuencia de un mal funcionamiento
o de la inhibición de la simbiosis. En suelos de baja fertilidad se hace
necesaria una mayor cantidad de estructuras fúngicas para garantizar
el funcionamiento adecuado de la simbiosis (57).
EFECTO
DE LA MICORRIZACIÓN SOBRE LA OPTIMIZACIÓN DEL SUMINISTRO DE NUTRIENTES
La aplicación
conjunta de la inoculación y dosis bajas de fertilizantes minerales aumentan
la efectividad de la simbiosis, lo cual se expresa en el incremento de la colonización
micorrízica y el rendimiento y se obtiene una dosis óptima de
fertilizantes menor que la recomendada para obtener volúmenes de producción
similares, en ausencia de inoculación (48, 67).
La aplicación de dosis superiores a las óptimas para las plantas
micorrizadas reduce la simbiosis micorrízica hasta casi inhibirla; sin
embargo, los rendimientos no disminuyen, lo que indica que las plantas garantizan
sus requerimientos nutricionales pero no a través de la micorrización.
Las dosis óptimas de fertilizantes para las plantas micorrizadas dependen
de los cultivos en cuestión y de la fertilidad del suelo (53, 74).
La disminución de las dosis de nutrientes con el empleo de HMA oscila
entre 25–50 % de la dosis de fertilizante mineral recomendada para cada cultivo
(75), lo que se logra a expensas de incrementos en la absorción de los
nutrientes provenientes del suelo y de los fertilizantes y conduce a incrementos
en los coeficientes de aprovechamiento de estos, así como a una disminución
de los índices críticos de los elementos en el suelo (67).
INOCULACIÓN
MICORRÍZICA Y ROTACIÓN CON ABONOS VERDES
A través
de la rotación de cultivos, las plantas eficientes en la multiplicación
de los HMA, como Helianthus annuus, Crotalaria juncea, Canavalia
ensiformis, Cajanus cajan y Stizolobium aterrimum, aumentan
la cantidad de inóculo en el suelo, lo que favorece la colonización
de los cultivos siguientes y mejora su nutrición y producción
(6, 76).
La inoculación con cepas eficientes de HMA eleva el número de
esporas en cualquier tipo de secuencia, aunque depende del número de
inoculaciones, del cultivo en cuestión y hasta del cultivo precedente
(67).
Así, en estudios realizados en condiciones de microparcelas, se ha encontrado
una multiplicación de los propágulos iniciales de HMA, desde 83
esporas en 50 g de suelo, al inicio de la secuencia, hasta llegar a valores
entre 731 y 1594 esporas en 50 g de suelo, dependiendo los valores encontrados,
de las especies que intervinieron en las secuencias evaluadas y en su inoculación
micorrízica o no (Tabla
III)C.

El crecimiento de los abonos verdes micótrofos origina, en ausencia de
la inoculación micorrízica, una elevación del porcentaje
de colonización nativa en el cultivo sucesor (6).
Este efecto está directamente relacionado con la elevación del
número de propágulos nativos que se produce con el crecimiento
de este tipo de plantas (49), aunque en ocasiones, este desarrollo no logra
una reproducción adecuada de los HMA del suelo o una respuesta positiva
de las plantas, porque los propágulos se encuentran en muy bajas cantidades
o las especies presentes no son efectivas (67).
Si los abonos verdes son inoculados con una cepa efectiva de HMA, incrementan
el contenido de inóculos micorrízicos en el suelo y el crecimiento
de los cultivos posteriores (77).
El uso de los abonos verdes no se debe circunscribir a la aplicación
conjunta con cepas de HMA al sembrarlos, sino que su mayor importancia debe
estar dada por la inoculación inicial de las especies de abonos verdes
con cepas eficientes de HMA. De esta manera se lograría la reproducción
de la micorriza en el suelo, el crecimiento más vigoroso del abono verde
y la conformación de un sustrato con muy alta concentración de
propágulos eficientes que facilite una efectiva y más económica
micorrización de las plantas (67, 78).
En ciertos tipos de suelo y sistemas agroproductivos, el empleo de los abonos
verdes no garantiza totalmente los requerimientos nutricionales para una micorrización
efectiva, en estos casos es necesario suplementar con algunas cantidades de
abono orgánico o mineral, las cuales son muy inferiores a las que se
aplican en sistemas productivos intensivos o en presencia de cultivos no micorrizados
(67).
En función de esto, se ha demostrado que en la rotación canavalia-maíz
y en presencia de la inoculación micorrízica, se reducen las dosis
de N necesarias para alcanzar un rendimiento máximo estable en hasta
un 75 % de la dosis recomendada para ese tipo de suelo, y esa disminución
está en función directa del N que fue capaz de aportar el abono
verde, derivado del proceso de fijación biológica del N (11).
Otro efecto de los HMA sobre las leguminosas está en la simbiosis tripartita
con bacterias del género Rhizobium. La simbiosis con las bacterias
provee de N fijado biológicamente, mientras que los HMA aumentan la absorción
de P, que favorece la FBN. Las leguminosas proveen a las bacterias y a los HMA
de fotosintatos (73).
Canavalia ensiformis es una planta de alto potencial de colonización
por HMA, y es capaz de propiciar la colonización del cultivo siguiente
en la sucesión (50).
En Cuba se ha encontrado que la canavalia multiplica en grandes cantidades los
propágulos micorrízicos nativos en el sueloA, por lo que se hace
interesante el estudio de la introducción y multiplicación de
cepas eficientes a través de la inoculación de esta planta.
En relación con esto, estudios recientes han demostrado que la canavalia
inoculada con cepas eficientes según el tipo de suelo, es capaz de multiplicar
los propágulos micorrízicos y favorecer la colonización
micorrízica efectiva del cultivo posterior (12).
SISTEMAS
AGRÍCOLAS MICORRIZADOS EFICIENTEMENTE
Los sistemas agrícolas
micorrizados eficientemente son aquellos donde, a través de la inoculación
de cepas eficientes de HMA, las plantas logran un mejor funcionamiento de la
simbiosis micorrízica, reflejado en un mayor crecimiento, absorción
de nutrientes y rendimientos, en comparación a aquellas plantas que no
fueron inoculadas (7).
Por lo tanto, el uso de estos microorganismos edáficos en la agricultura
constituye una alternativa frente a los fertilizantes minerales. Desde el punto
de vista ecológico, su utilización permite reducir el uso de energía,
la degradación del agroecosistema y las pérdidas de nutrientes
de los suelos agrícolas. En adición, se mantiene la capacidad
productiva del sistema, se preserva la biodiversidad y se contribuye con una
producción más estable y sostenida a largo plazo en equilibrio
con el entorno.
Estos sistemas son válidos para condiciones de bajos insumos y para una
agricultura tecnificada que permita obtener altos rendimientos y se potencie
la vida del suelo. Al mismo tiempo se disminuyen las contaminaciones por aplicaciones
excesivas de fertilizantes y los efectos negativos de la sequía (67).
Aquellos suelos dominados por hongos nativos con elevada efectividad no son
indicados para la inoculación. En este caso los HMA precisan ser manejados
para mantener su población en niveles altos, lo que permitirá
ser utilizados en programas de inoculación (53).
El mayor número de especies e inóculos de HMA se encuentra en
los sistemas de bajos insumos (80). Muchas prácticas agrícolas
empleadas en los sistemas de altos insumos tienen relativamente poca población
de HMA nativos, mientras que los sistemas orgánicos aumentan su población
pues evitan el uso de agroquímicos y favorecen la biodiversidad (81).
La utilización de las micorrizas como biofertilizantes no implica que
se pueda dejar de fertilizar, sino que la fertilización se hace más
eficiente y puede disminuirse la dosis a aplicar en rangos de 50-80 %.
En estos momentos, se hace necesaria la compatibilidad entre la simbiosis micorrízica
y el manejo adecuado de la fertilización y la necesidad de redefinir
para los cultivos micorrizados con cepas eficientes, los requerimientos de fertilizantes
e índices críticos de los nutrientes en el suelo, esto se debe
introducir de forma consciente como base para la explotación agrícola.
ROTACIÓN
DEL MAÍZ CON ABONOS VERDES E INOCULACIÓN MICORRÍZICA
Con la introducción
de las rotaciones leguminosas-maíz, disminuye la dependencia de los agricultores
a los insumos externos, aumenta la rentabilidad del sistema, el balance de nutrientes
se hace positivo y mejora la calidad de los suelos (82). El empleo de canavalia
en sucesión con el cultivo del maíz hace que este eleve sus rendimientos
hasta 6,3 t ha-1 y tenga un aprovechamiento de 40-60 % del N-abonos
verdes. Los rendimientos obtenidos en maíz son equivalentes a los obtenidos
con 200 kg N ha-1 de fertilizante mineral (83).
La incorporación de abonos verdes promueve la absorción de NPK
por el cultivo del maíz, debido a la mayor disponibilidad de los elementos
estimulada por el abono verde (84). El uso de fertilizantes minerales en dosis
bajas aumenta el impacto benéfico de los abonos verdes sobre el cultivoC.
El incremento de los rendimientos de maíz, sembrado después de
incorporar leguminosas fue de 1,1-3,2 t ha-1 y de 1,4-3,8 t ha-1
en zonas de bajas y altas precipitaciones, respectivamente y recomiendan que
junto a la incorporación de leguminosas, se deben aplicar dosis menores
de fertilizantes minerales para aumentar el coeficiente de aprovechamiento del
N (85).
En las condiciones de Cuba, los abonos verdes tienen una influencia positiva
sobre el rendimiento del maíz. Este, sembrado en sucesión con
canavalia, tuvo rendimientos similares a la variante con fertilización
mineral y superior al testigo absoluto en 1 t ha-1. Este tipo de
respuesta tiene muy buenos resultados con independencia de la época del
año en que se emplee (38).
En estudios realizados para evaluar la respuesta del maíz a la inoculación
micorrízica, se ha informado que las plantas inoculadas con HMA acumularon
un 40 % más de masa seca y N que las no inoculadas, al crecer en un suelo
con residuos de alfalfa (Medicago sativa) (86). El empleo de la cepa
Glomus fasciculatum en maíz posibilitó un incremento
de los rendimientos que osciló entre 21-77 %, según el tipo de
suelo (87).
Por otra parte, el maíz presentó una alta colonización
con cepas nativas de HMA, al ser sembrado en sucesión con un pastizal
o un barbecho con plantas micótrofas, que facilitaron la propagación
de los endófitos micorrízicos nativos (88).
El efecto del cultivo precedente en el crecimiento del maíz es debido,
en parte, al aumento del número de propágulos de HMA causado por
el cultivo precedente. Al respecto, se ha informado que el maíz en sucesión
con girasol (Helianthus annuus) aumentó en un 49 % de masa seca
en comparación con tratamientos sin inocular y aumentó la colonización
radical del cultivo (76).
El manejo de los HMA a través de los abonos verdes puede ser una práctica
útil dentro de la agricultura sostenible. Los abonos verdes de invierno
multiplicaron los inóculos nativos de HMA en el suelo, con alta colonización
del maíz sucesor y aumento de la densidad de las hifas extrarradicales.
El grado de micorrización del maíz (% de colonización)
fue correlacionado con el crecimiento y los rendimientos del maíz (89).
Los abonos verdes elevan significativamente la colonización por HMA del
cultivo posterior y su empleo combinado con fertilizantes minerales complementa
las necesidades de N del cultivo, con una disminución significativa de
las dosis a emplear, debido a la promoción de la absorción por
los HMA (90).
CONSIDERACIONES
GENERALES
Los abonos verdes,
aunque se conocen desde hace milenios, no se emplean muy frecuentemente en la
agricultura convencional y la altamente tecnificada. Muchos productores hacen
rechazo a su empleo, dado fundamentalmente, porque no dominan sus diferentes
formas de uso, no se trata de que el productor se adapte al abono verde, es
que los abonos verdes se adapten a las condiciones agroproductivas donde serán
empleados.
Si se emplean de forma conjunta con biofertilizantes como los HMA, no solo se
estará potenciando su crecimiento y desarrollo, sino que además,
se aumentarán los beneficios ofrecidos al cultivo principal. Mediante
la inoculación de los abonos verdes, plantas que en su mayoría
se reproducen mediante semilla botánica, se facilita la inoculación
de plantaciones establecidas o de cultivos que se reproducen por vía
agámica y que son más difíciles de inocular.
El empleo de alternativas nutricionales para los cultivos, como las dos mencionadas
en este trabajo, es una necesidad impostergable, dada la importancia de la conservación
del medio ambiente, obtener alimentos saludables y el precio cada vez más
alto de los fertilizantes en el mercado mundial.
Notas al
pie
A
Sánchez, C. Manejo de las asociaciones micorrízicas arbusculares
y abonos verdes en la producción de posturas de cafeto en algunos tipos
de suelo. Tesis de Doctorado, INCA, La Habana, Cuba, 2001, 105 p.
B
Florentín, M. A.; Peñalva, M.; Calegari, A. y Derpsch, R. Abonos
verdes y rotación de cultivos en siembra directa. Pequeñas propiedades.
(ser. Conservación de suelos), Inst. MAG–GTZ San Lorenzo, Paraguay, 2001,
84 p.
C
Martín, G. M. Manejo de la inoculación micorrízica arbuscular,
la Canavalia ensiformis y la fertilización nitrogenada en plantas
de maíz (Zea mays) cultivadas sobre suelos Ferralíticos
Rojos de La Habana. Tesis de Doctorado, Universidad Agraria de la Habana, La
Habana, Cuba, 2009, 101 p.
D
CIDICCO. Catálogo de abonos verdes/cultivos de cobertura (AVCC) empleados
por pequeños productores de los trópicos. Informe Final del Proyecto
2000 FS 125 “Catálogo de sistemas de cultivos de cobertura y abonos verdes
(CCAV) empleados por pequeños agricultores de los trópicos, Inst.
CIDICCO, Honduras, 2003, 17 p.
E
Borges, M. Influencia de la Canavalia ensiformis (L) en algunas propiedades
de un suelo Ferralítico Rojo. Tesis de Maestría, Universidad Agraria
de La Habana, La Habana, Cuba, 2009, 60 p.
F
Vallejos, F.; Kliever, I.; Florentín, M. A.; Casaccia, J.; Calegari,
A. y Derpsch, R. Abonos verdes y rotación de cultivos en siembra directa.
Sistemas de producción tractorizados. (ser. conservación de suelos),
Inst. MAG–GTZ San Lorenzo, Paraguay, 2001, p. 92.
G
Pozzi, C. Estudo de sistemas de uso do solo en rotações de culturas
en sistemas agricolas brasileiros: dinâmica de nitrogênio
e carbono no sistema solo–planta–atmosfera. Tesis de Doutorado, Universidad
Federal Rural do Rio de Janeiro, Rio de Janeiro, Brasil, 2005, 120 p.
H
García, M. Contribución al estudio y utilización de los
abonos verdes en cultivos económicos desarrollados sobre un suelo Ferralítico
Rojo de la Habana. Tesis de Doctorado, INCA, La Habana, Cuba, 1997, 100 p.
I
Álvarez, M. Los abonos verdes: una alternativa para la producción
sostenible de maíz en las condiciones de los suelos Ferralíticos
Rojos de la Habana. Tesis de Maestría, INCA-UNAH, La Habana, Cuba, 2000,
69 p.
J
de Almeida, K. Adubos verdes na producao de alface e cenoura, sob sistema organico.
Tese de Doutorado, Universidade Estadual Paulista, Faculdade de Ciencias Agronomicas,
Brasil, 2009, 114 p.
BIBLIOGRAFÍA
1. Barroso, G.
R. P.; Carvalho, J. O. M.; dos Santos, M. R. A.; Ferreira, M. G. R. y Marcolan,
A. L. ‘‘Teor de macronutrientes em plantas utilizadas como adubo verde’’. Saber
Científico, vol. 2, no. 1, 2009, pp. 37-42, ISSN 1982-792X.
2. Oberson, A.; Nanzer, S.; Bosshard, C.; Dubois, D.; Mäder, P. y Frossard,
E. ‘‘Symbiotic N2 fixation by soybean in organic and conventional cropping systems
estimated by 15N dilution and 15N natural abundance’’.
Plant and Soil, vol. 290, no. 1-2, 6 de enero de 2007, pp. 69-83, ISSN
0032-079X, 1573-5036, DOI 10.1007/s11104-006-9122-3.
3. de Souza, F. A.; Stürmer, S. L.; Carrenho, R. y Trufem, T. S. F. B.
‘‘Classificação e taxonomia de fungos micorrízicos arbusculares
e sua diversidade e ocorrência no Brasil’’. En: eds. Siqueira J. O., Souza
F. A., Cardoso E. J. B. N., y Tsai S. M., Micorrizas: 30 anos de pesquisas no
Brasil, edit. Lavras: UFLA, Brasil, 2010, pp. 15-73, ISBN 85-87692-90-9.
4. Janos, D. P. ‘‘Plant responsiveness to mycorrhizas differs from dependence
upon mycorrhizas’’. Mycorrhiza, vol. 17, no. 2, 2007, pp. 75-91, ISSN
0940-6360, 1432-1890, DOI 10.1007/s00572-006-0094-1.
5. de Miranda, J. C. C. y de Miranda, L. N. ‘‘Micorriza arbuscular e uso de
adubos verdes em solos de Cerrado’’. En: de Carvalho A. M. y Amabile R. F.,
Cerrado: adubação verde, edit. Embrapa, Planaltina, DF, 2006,
pp. 211-236, ISBN 85-7075-027-8.
6. Espindola, J. A. A.; Almeida, D. L. de; Guerra, J. G. M.; Silva, E. M. R.
da y Souza, F. A. de. ‘‘Influência da adubação verde na
colonização micorrízica e na produção da
batata-doce’’. Pesquisa Agropecuária Brasileira, vol. 33, no.
3, 1998, pp. 339-347, ISSN 1678-3921.
7. Rivera, R.; Fernández, F.; Fernández, K.; Ruiz, L.; Sánchez,
C. y Riera, M. ‘‘Advances in the management of effective Arbuscular mycorrhizal
symbiosis in tropical ecosystesm’’. En: Mycorrhizae in Crop Production, edit.
Haworth Food & Agricultural Products Press, Binghamton, 10 de julio de 2006,
pp. 151–196, ISBN 978-1-56022-307-8.
8. Sánchez, C.; Caballero, D.; Cupull, R.; González, C.; Rivera,
R. y Urquiaga, S. ‘‘Los abonos verdes y la inoculación micorrízica
de plántulas de Coffea arabica sobre suelos Cambisoles Gléyicos’’.
Cultivos Tropicales, vol. 30, no. 1, marzo de 2009, pp. 00-00, ISSN
0258-5936.
9. Rivera, R. ‘‘Abonos verdes e inoculación micorrízica de posturas
de cafeto sobre suelos Fersialíticos Rojos Lixiviados’’. Cultivos
Tropicales, vol. 31, no. 3, septiembre de 2010, pp. 75–81, ISSN 0258-5936.
10. Sánchez, C.; Rivera, R.; Caballero, D.; Cupull, R.; González,
C. y Urquiaga, S. ‘‘Abonos verdes e inoculación micorrízica de
posturas de cafeto sobre suelos Ferralíticos Rojos Lixiviados’’. Cultivos
Tropicales, vol. 32, no. 3, 2011, pp. 11–17, ISSN 0258-5936.
11. Martín, G. M.; Rivera, R.; Arias, L. y Rentería, M. ‘‘Effect
of Canavalia ensiformis and arbuscular mycorrhizae on corn crops’’.
Cuban Journal of Agricultural Science, vol. 43, no. 2, 2009, pp. 185-192,
ISSN 0864-0408.
12. Martín, A. G. M.; Rivera, E. R.; Arias, P. L. y Pérez, D.
A. ‘‘Respuesta de la Canavalia ensiformis a la inoculación micorrízica
con Glomus cubense (cepa INCAM-4), su efecto de permanencia en el cultivo del
maíz’’. Cultivos Tropicales, vol. 33, no. 2, 2012, pp. 20-28,
ISSN 0258-5936.
13. Álvarez, M.; García, M. y Treto, E. ‘‘Revisión bibliográfica:
Los abonos verdes: una alternativa natural y económica para la agricultura’’.
Cultivos Tropicales, vol. 16, no. 3, 1995, pp. 9–24, ISSN 0258-5936.
14. Marinho, G. J. G.; Ndiaye, A.; Linhares, de A. R. y Azevedo, E. J. A. ‘‘Cultivos
de cobertura como indicadores de procesos ecológicos’’. LEISA Revista
de Agroecología, vol. 22, no. 4, 2007, pp. 20–22, ISSN 1729-7419.
15. Sodré, F. J.; Cardoso, A. N.; Carmona, R. y Carvalho, A. M. de. ‘‘Fitomassa
e cobertura do solo de culturas de sucessão ao milho na Região
do Cerrado’’. Pesquisa Agropecuária Brasileira, vol. 39, no.
4, abril de 2004, pp. 327-334, ISSN 0100-204X, DOI 10.1590/S0100-204X2004000400005.
16. de Resende, A. S.; Quesada, D. M.; Xavier, R. P.; Guerra, J. G. M.; Boddey,
R.; Alves, B. J. R. y Urquiaga, S. ‘‘Uso de leguminosas para adubação
verde: importância da relação talo/folha’’. Agronomia,
vol. 35, no. 1-2, 2001, pp. 77–82, ISSN 0365-2718.
17. Sangakkara, U. R.; Liedgens, M.; Soldati, A. y Stamp, P. ‘‘Root and Shoot
Growth of Maize (Zea mays) as Affected by Incorporation of Crotalaria
juncea and Tithonia diversifolia as Green Manures’’. Journal
of Agronomy and Crop Science, vol. 190, no. 5, 2004, pp. 339-346, ISSN
1439-037X, DOI 10.1111/j.1439-037X.2004.00111.x.
18. Breland, T. ‘‘Green manuring with clover and ryegrass catch crops undersown
in spring wheat: effects on soil structure’’. Soil Use and Management,
vol. 11, no. 4, 1995, pp. 163-167, ISSN 1475-2743, DOI 10.1111/j.1475-2743.1995.tb00950.x.
19. Calegari, A. y Pavan, M. ‘‘Effects of corn winter green manure rotation
on soil agregation’’. Arquivos de Biología e Tecnología,
vol. 38, no. 1, 1995, pp. 45–53, ISSN 1678-4324.
20. Kavdir, Y. y Smucker, A. J. M. ‘‘Soil aggregate sequestration of cover crop
root and shoot-derived nitrogen’’. Plant and Soil, vol. 272, no. 1-2,
2005, pp. 263-276, ISSN 0032-079X, 1573-5036, DOI 10.1007/s11104-004-5294-x.
21. García, M.; Álvarez, M. y Treto, E. ‘‘Estudio comparativo
de diferentes especies de abonos verdes y su influencia en el cultivo del maíz’’.
Cultivos Tropicales, vol. 23, no. 3, 2002, pp. 19–30, ISSN 0258-5936.
22. Urquiaga, S. y Zapata, F. Manejo eficiente de la fertilización nitrogenada
de cultivos anuales en América Latina y el Caribe. edit. Embrapa Agrobiología,
Río de Janeiro, Brasil, 2000, 110 p., ISBN 85-87578-02-2.
23. Lehmann, J.; Poidy, N.; Schroth, G. y Zech, W. ‘‘Short-term effects of soil
amendment with tree legume biomass on carbon and nitrogen in particle size separates
in Central Togo’’. Soil Biology and Biochemistry, vol. 30, no. 12,
1998, pp. 1545-1552, ISSN 0038-0717, DOI 10.1016/S0038-0717(97)00153-3.
24. Espíndola, J. A.; de Almeida, D. L. y Guerra, J. G. M. ‘‘Estratégias
para utilização de leguminosas para adubação verde
em unidades de produção agroecológica.’’. Embrapa Agrobiologia,
no. 174, 2004, p. 24, ISSN 1517-8498.
25. Shibata, R. y Yano, K. ‘‘Phosphorus acquisition from non-labile sources
in peanut and pigeonpea with mycorrhizal interaction’’. Applied Soil Ecology,
vol. 24, no. 2, octubre de 2003, pp. 133-141, ISSN 0929-1393, DOI 10.1016/S0929-1393(03)00093-3.
26. Pypers, P.; Verstraete, S.; Thi, C. P. y Merckx, R. ‘‘Changes in mineral
nitrogen, phosphorus availability and salt-extractable aluminium following the
application of green manure residues in two weathered soils of South Vietnam’’.
Soil Biology and Biochemistry, vol. 37, no. 1, 2005, pp. 163-172, ISSN
0038-0717, DOI 10.1016/j.soilbio.2004.06.018.
27. Cifuentes, A. R.; Escobar, R. N.; Hernández, V. E. y González,
G. A. ‘‘Asociación lupino-maíz en la nutrición fosfatada
en un Andosol’’. Terra Latinoamericana, vol. 19, no. 2, 2001, pp. 141–154,
ISSN 2395-8030.
28. Stewart, W. M. ‘‘Consideraciones en el uso eficiente de nutrientes’’.
Informaciones Agronómicas, vol. 67, 2007, pp. 1–7, ISSN 2222-0178.
29. Broeshart, H. ‘‘Quantitative measurement of fertilizer uptake by crops’’.
Netherlands Journal of Agricultural Science, vol. 22, no. 4, 1974,
pp. 245–254, ISSN 1573-5214.
30. Kuzyakov, Y.; Friedel, J. K. y Stahr, K. ‘‘Review of mechanisms and quantification
of priming effects’’. Soil Biology and Biochemistry, vol. 32, no. 11–12,
2000, pp. 1485-1498, ISSN 0038-0717, DOI 10.1016/S0038-0717(00)00084-5.
31. Muraoka, T.; Ambrosano, E. J.; Zapata, F.; Bortoletto, N.; Martins, A. L.
M.; Trivelin, P. C. O.; Boaretto, A. E. y Scivittaro, W. B. ‘‘Eficiencia de
abonos verdes (crotalaria y mucuna) y urea, aplicados solos o juntamente,
como fuentes de N para el cultivo de arroz’’. Terra Latinoamericana,
vol. 20, no. 1, 2002, pp. 17–23, ISSN 0187-5779, 2395-8030.
32. Alvarez, M.; García, M. y Treto, E. ‘‘Eficiencia del nitrógeno
incorporado con los abonos verdes en el cultivo del maíz (Zea mays)’’.
Cultivos Tropicales, vol. 20, no. 3, 1999, pp. 49–53, ISSN 1819-4087.
33. Ambrosano, E. J.; Trivelin, P. C. O.; Cantarella, H.; Ambrosano, G. M. B.;
Schammass, E. A.; Guirado, N.; Rossi, F.; Mendes, P. C. D. y Muraoka, T. ‘‘Utilization
of nitrogen from green manure and mineral fertilizer by sugarcane’’. Scientia
Agricola, vol. 62, no. 6, 2005, pp. 534-542, ISSN 0103-9016, DOI 10.1590/S0103-90162005000600004.
34. Hasegawa, H. y Denison, R. F. ‘‘Model predictions of winter rainfall effects
on N dynamics of winter wheat rotation following legume cover crop or fallow’’.
Field Crops Research, vol. 91, no. 2–3, 2005, pp. 251-261, ISSN 0378-4290,
DOI 10.1016/j.fcr.2004.07.019.
35. Ugarte, O. M.; Martínez, R. C.; Quesada, M. S.; Montoya, A. N. y
Vega, G. D. ‘‘La Sesbania Rostrata como fuente alternativa de nutrientes
en el cultivo del arroz’’. Spanish Journal of Soil Science, vol. 2,
no. 3, 2012, pp. 57–62, ISSN 2253-6574, DOI 10.3232/SJSS.2012.V2.N3.06.
36. Crozier, C. R.; King, L. D. y Volk, R. J. ‘‘Tracing Nitrogen Movement in
Corn Production Systems in the North Carolina Piedmont: A Nitrogen-15 Study’’.
Agronomy Journal, vol. 90, no. 2, 1998, p. 171, ISSN 0002-1962, DOI
10.2134/agronj1998.00021962009000020009x.
37. Martín, G. M. y Rivera, R. ‘‘Participación del nitrógeno
de los abonos verdes en la nutrición nitrogenada del maíz (Zea
mays L.) cultivado sobre suelo Ferralítico Rojo’’. Cultivos
Tropicales, vol. 23, no. 3, 2002, pp. 91–96, ISSN 0258-5936.
38. Treto, E.; García, M.; Martínez, R.; Febles, J. M.; Funes,
F.; García, L.; Bourque, M.; Pérez, N. y Rosset, P. ‘‘Avances
en el manejo de los suelos y la nutrición orgánica’’. En: Transformando
el campo Cubano: avances de la agricultura sostenible, edit. Asociación
Cubana de Técnicos Agrícolas y Forestales, Cuba, 2001, pp. 167–190,
ISBN 978-959-246-032-4.
39. Samasundaram, E.; Srinivasan, G. y Manoharan, M. L. ‘‘Effect of green manuring
Sesbania rostrata and fertilizers application on chemical properties
of soil and grain yield in rice–rice crop sequences’’. Agricultural Journal,
vol. 83, no. 12, 1996, pp. 758–760, ISSN 0024-9602.
40. Mandal, U. K.; Singh, G.; Victor, U. S. y Sharma, K. L. ‘‘Green manuring:
its effect on soil properties and crop growth under rice–wheat cropping system’’.
European Journal of Agronomy, vol. 19, no. 2, 2003, pp. 225-237, ISSN 1161-0301,
DOI 10.1016/S1161-0301(02)00037-0.
41. Aulakh, M. S.; Singh, D. y Sadana, U. S. ‘‘Direct and Residual Effects of
Green Manure and Fertilizer Nitrogen in a Rice-Rapeseed Production System in
the Semiarid Subtropics’’. Journal of Sustainable Agriculture, vol.
25, no. 1, 2005, pp. 97-115, ISSN 1044-0046, DOI 0.1300/J064v25n01_08.
42. Mandimba, G. R. ‘‘Contribution of nodulated legumes of the growth of Zea
mays L. under various cropping systems’’. Symbiosis, vol. 19,
no. 2-3, 1995, pp. 213–222, ISSN 0334-5114, 1878-7665.
43. Astier, M.; Maass, J. M.; Etchevers-Barra, J. D.; Peña, J. J. y González,
F. de L. ‘‘Short-term green manure and tillage management effects on maize yield
and soil quality in an Andisol’’. Soil and Tillage Research, vol. 88,
no. 1–2, 2006, pp. 153-159, ISSN 0167-1987, DOI 10.1016/j.still.2005.05.003.
44. Martín, A. G. M.; Rivera, E. R. y Pérez, D. A. ‘‘Efecto de
canavalia, inoculación micorrízica y dosis de fertilizante nitrogenado
en el cultivo del maíz’’. Cultivos Tropicales, vol. 34, no.
4, diciembre de 2013, pp. 60-67, ISSN 0258-5936.
45. Tian, Y.; Zhang, X.; Liu, J. y Gao, L. ‘‘Effects of summer cover crop and
residue management on cucumber growth in intensive Chinese production systems:
soil nutrients, microbial properties and nematodes’’. Plant and Soil,
vol. 339, no. 1-2, 2010, pp. 299-315, ISSN 0032-079X, 1573-5036, DOI 10.1007/s11104-010-0579-8.
46. Ovalle, C.; Pozo, A. del; Peoples, M. B. y Lavín, A. ‘‘Estimating
the contribution of nitrogen from legume cover crops to the nitrogen nutrition
of grapevines using a 15N dilution technique’’. Plant and Soil,
vol. 334, no. 1-2, 2010, pp. 247-259, ISSN 0032-079X, 1573-5036, DOI 10.1007/s11104-010-0379-1.
47. Sieverding, E.; Friedrichsen, J. y Suden, W. ‘‘Vesicular-arbuscular mycorrhiza
management in tropical agrosystems’’. Sonderpublikation der GTZ, no.
224, 1991, p. 371, ISSN 0930-1070.
48. Arias, N. M. M.; García, V. Q. y Cruz, F. G. ‘‘Colonización
micorrízica arbuscular y fertilización mineral de genotipos de
maíz y trigo cultivados en un Andisol’’. Terra Latinoamericana,
vol. 19, no. 4, 2001, pp. 337–344, ISSN 2395-8030.
49. Kabir, Z. y Koide, R. T. ‘‘The effect of dandelion or a cover crop on mycorrhiza
inoculum potential, soil aggregation and yield of maize’’. Agriculture,
Ecosystems & Environment, vol. 78, no. 2, 2000, pp. 167-174, ISSN 0167-8809,
DOI 10.1016/S0167-8809(99)00121-8.
50. Souza, F. A. de; Trufem, S. F. B.; Almeida, D. L. de; Silva, E. M. R. da
y Guerra, J. G. M. ‘‘Efeito de pré-cultivos sobre o potencial de inóculo
de fungos micorrízicos arbusculares e produção da mandioca’’.
Pesquisa Agropecuária Brasileira, vol. 34, no. 10, 1999, pp.
1913-1923, ISSN 0100-204X, DOI 10.1590/S0100-204X1999001000019.
51. Peña, C. P.; Vanegas, G. I. C.; Valderrama, A. M.; Cárdenas,
J. H. A. y Dorado, A. L. A. Micorrizas arbusculares de la Amazonia Colombiana.
Catalogo Ilustrado. edit. Instituto Amazónico de Investigaciones Científicas
«SINCHI», 14 de junio de 2006, 90 p., ISBN 978-958-97597-6-9.
52. Fernández, F. ‘‘La simbiosis micorrízica arbuscular’’. En:
Rivera R. y Fernández K., Manejo efectivo de la simbiosis micorrízica,
una vía hacia la agricultura sostenible. Estudio de caso: el Caribe,
edit. Ediciones INCA, La Habana, Cuba, 2003, p. 166, ISBN 959-7023-24-5.
53. Siqueira, J. O. y Franco, A. A. Biotecnologia do solo: fundamentos e perspectivas
[en línea]. edit. Ministerio da Educacao e Cultura, Brasilia, Brasil,
1988, 235 p., [Consultado: 29 de noviembre de 2015], Disponible en:
<http://www.sidalc.net/cgi-bin/wxis.exe/?IsisScript=AGB.tidad=1&expresion=mfn=118141>.
54. Entry, J. A.; Rygiewicz, P. T.; Watrud, L. S. y Donnelly, P. K. ‘‘Influence
of adverse soil conditions on the formation and function of Arbuscular mycorrhizas’’.
Advances in Environmental Research, vol. 7, no. 1, 2002, pp. 123-138,
ISSN 1093-0191, DOI 10.1016/S1093-0191(01)00109-5.
55. Bucher, M. ‘‘Functional biology of plant phosphate uptake at root and mycorrhiza
interfaces’’. New Phytologist, vol. 173, no. 1, 1 de enero de 2007,
pp. 11-26, ISSN 1469-8137, DOI 10.1111/j.1469-8137.2006.01935.x.
56. Matos, R. M. B.; Silva, E. M. R. y Lima, E. ‘‘Fungos micorrízicos
e nutrição de plantas’’. Embrapa Agrobiologia, no. 98,
1999, p. 36, ISSN 0104-6187.
57. Azcón, R.; Ambrosano, E. y Charest, C. ‘‘Nutrient acquisition in
mycorrhizal lettuce plants under different phosphorus and nitrogen concentration’’.
Plant Science, vol. 165, no. 5, 2003, pp. 1137-1145, ISSN 0168-9452,
DOI 10.1016/S0168-9452(03)00322-4.
58. Alvarado, A.; Chavarría, M.; Guerrero, R.; Boniche, J. y Navarro,
J. R. ‘‘Características edáficas y presencia de micorrizas en
plantaciones de teca (Tectona grandis Lf) en Costa Rica’’. Agronomía
Costarricense, vol. 28, no. 1, 2004, pp. 89–100, ISSN 0377-9424.
59. Lugo, M. A. y Cabello, M. N. ‘‘Native Arbuscular Mycorrhizal Fungi (AMF)
from Mountain Grassland (Córdoba, Argentina) I. Seasonal Variation of
Fungal Spore Diversity’’. Mycologia, vol. 94, no. 4, 2002, pp. 579-586,
ISSN 0027-5514, DOI 10.2307/3761709.
60. Adriano, A. M. L.; Solis, D. F.; Gavito, P. M. E. y Salvador, F. M. ‘‘Agronomical
and Environmental Factors Influence Root Colonization, Sporulation and Diversity
of Arbuscular Mycorrhizal Fungi at a Specific Phenological Stage of Banana Trees’’.
Journal of Agronomy, vol. 5, no. 1, 1 de enero de 2006, pp. 11-15,
ISSN 18125379, 18125417, DOI 10.3923/ja.2006.11.15.
61. Apple, M. E.; Thee, C. I.; Smith-Longozo, V. L.; Cogar, C. R.; Wells, C.
E. y Nowak, R. S. ‘‘Arbuscular mycorrhizal colonization of Larrea tridentata
and Ambrosia dumosa roots varies with precipitation and season in the Mojave
Desert’’. Symbiosis, vol. 39, no. 3, 2005, pp. 131–135.
62. Oliveira, A. N. de y Oliveira, L. A. de. ‘‘Seasonal dynamics of Arbuscular
mycorrhizal fungi in plants of Theobroma grandiflorum Schum and Paullinia cupana
Mart. of aN agroforestry system in Central Amazonia, Amazonas State, Brazil’’.
Brazilian Journal of Microbiology, vol. 36, no. 3, 2005, pp. 262-270,
ISSN 1517-8382, DOI 10.1590/S1517-83822005000300011.
63. Becerra, A. G.; Arrigo, N. M.; Bartoloni, N.; Domínguez, L. S. y
Cofré, M. N. ‘‘Arbuscular mycorrhizal colonization of Alnus acuminate
Kunth in Northwestern Argentina in relation to season and soil parameters’’.
Ciencia del Suelo, vol. 25, no. 1, 2007, pp. 7-13, ISSN 1850-2067.
64. Duponnois, R.; Plenchette, C.; Thioulouse, J. y Cadet, P. ‘‘The mycorrhizal
soil infectivity and Arbuscular mycorrhizal fungal spore communities in soils
of different aged fallows in Senegal’’. Applied Soil Ecology, vol.
17, no. 3, 2001, pp. 239-251, ISSN 0929-1393, DOI 10.1016/S0929-1393(01)00132-9.
65. Chen, X.; Tang, J.; Fang, Z. y Shimizu, K. ‘‘Effects of weed communities
with various species numbers on soil features in a subtropical orchard ecosystem’’.
Agriculture, Ecosystems & Environment, vol. 102, no. 3, 2004, pp.
377-388, ISSN 0167-8809, DOI 10.1016/j.agee.2003.08.006.
66. Peña, V. C. P.; Cardona, G. I.; Arguelles, J. H. y Arcos, A. L. ‘‘Micorrizas
arbusculares del sur de la Amazonia colombiana y su relación con algunos
factores fisicoquímicos y biológicos del suelo’’. Acta Amazonica,
vol. 37, no. 3, 2007, pp. 327-336, ISSN 0044-5967, DOI 10.1590/S0044-59672007000300003.
67. Fernández, K. y Rivera, R. ‘‘Bases científico–técnicas
para el manejo de los sistemas agrícolas micorrizados eficientemente’’.
En: Rivera R. y Fernández K., Manejo efectivo de la simbiosis micorrízica,
una vía hacia la agricultura sostenible. Estudio de caso: el Caribe,
edit. Ediciones INCA, La Habana, Cuba, 2003, p. 166, ISBN 959-7023-24-5.
68. Cruz, A. F.; Ishii, T.; Matsumoto, I. y Kadoya, K. ‘‘Network Establishment
of Vesicular-Arbuscular Mycorrhizal Hyphae in the Rhizospheres between Trifoliate
Orange and Some Plants.’’. Journal Japanese Society for Horticultural Science,
vol. 71, no. 1, 2002, pp. 19–25, ISSN 1880-358X, 0013-7626, DOI http://dx.doi.org/10.2503/jjshs.71.19.
69. González, P. J.; Arzola, J.; Morgan, O.; Rivera, R.; Plana, R. y
Fernández, F. ‘‘Manejo de las asociaciones micorrízicas en pastos
del género Brachiaria cultivados en suelos Ferralítico Rojo y
Pardo Mullido’’. En: XVI Congreso Científico del INCA, edit. Ediciones
INCA, La Habana, Cuba, 2008, ISBN 978-959-16-0953-3.
70. González, M. E. ‘‘Respuesta de plantas de Coffea canephora a la inoculación
con hongos micorrizógenos arbusculares durante la fase de aclimatización’’.
Cultivos Tropicales, vol. 25, no. 1, 2013, pp. 13–16, ISSN 0258-5936.
71. Herrera, P. R. A.; Hamel, C.; Fernández, F.; Ferrer, R. L. y Furrazola,
E. ‘‘Soil–strain compatibility: the key to effective use of Arbuscular mycorrhizal
inoculants?’’. Mycorrhiza, vol. 21, no. 3, 16 de junio de 2010, pp.
183-193, ISSN 0940-6360, 1432-1890, DOI 10.1007/s00572-010-0322-6.
72. Mohammad, A.; Mitra, B. y Khan, A. G. ‘‘Effects of sheared-root inoculum
of Glomus intraradices on wheat grown at different phosphorus levels in the
field’’. Agriculture, Ecosystems & Environment, vol. 103, no. 1,
2004, pp. 245-249, ISSN 0167-8809, DOI 10.1016/j.agee.2003.09.017.
73. Gamper, H.; Hartwig, U. A. y Leuchtmann, A. ‘‘Mycorrhizas improve nitrogen
nutrition of Trifolium repens after 8 yr of selection under elevated atmospheric
CO2 partial pressure’’. New Phytologist, vol. 167, no. 2, 1 de agosto
de 2005, pp. 531-542, ISSN 1469-8137, DOI 10.1111/j.1469-8137.2005.01440.x.
74. Bittman, S.; Kowalenko, C. G.; Hunt, D. E.; Forge, T. A. y Wu, X. ‘‘Starter
Phosphorus and Broadcast Nutrients on Corn with Contrasting Colonization by
Mycorrhizae’’. Agronomy Journal, vol. 98, no. 2, 2006, p. 394, ISSN
1435-0645, DOI 10.2134/agronj2005.0093.
75. Xoconostle, C. B. y Ruiz, M. R. ‘‘Impacto de la biotecnología agrícola
en cultivos: el caso de las micorrizas’’. Avance y perspectiva, vol.
21, 2002, pp. 263-266, ISSN 0185-1411.
76. Karasawa, T.; Kasahara, Y. y Takebe, M. ‘‘Differences in growth responses
of maize to preceding cropping caused by fluctuation in the population of indigenous
Arbuscular mycorrhizal fungi’’. Soil Biology and Biochemistry, vol.
34, no. 6, 2002, pp. 851-857, ISSN 0038-0717, DOI 10.1016/S0038-0717(02)00017-2.
77. Bajwa, R.; Aslam, N. y Javaid, A. ‘‘Comparison of Three Green Manures for
Growth and VA Mycorrhizal Colonization in Maize (Zea mays L.)’’. Journal
of Biological Sciences, vol. 2, no. 8, 2002, pp. 512-517, ISSN 17273048,
18125719, DOI 10.3923/jbs.2002.512.517.
78. Trannin, W. S.; Urquiaga, S.; Guerra, G.; Ibijbijen, J. y Cadisch, G. ‘‘Interspecies
competition and N transfer in a tropical grass-legume mixture’’. Biology
and Fertility of Soils, vol. 32, no. 6, 2000, pp. 441-448, ISSN 0178-2762,
1432-0789, DOI 10.1007/s003740000271.
79. Blanco, F. y Salas, E. ‘‘Micorrizas en la agricultura: contexto mundial
e investigación realizada en Costa Rica’’. Agronomía Costarricense,
vol. 21, no. 1, 1997, pp. 55-67, ISSN 0377-9424.
80. Franke, S. M.; Douds, D. D.; Galvez, L.; Phillips, J. G.; Wagoner, P.; Drinkwater,
L. y Morton, J. B. ‘‘Diversity of communities of Arbuscular mycorrhizal (AM)
fungi present in conventional versus low-input agricultural sites in eastern
Pennsylvania, USA’’. Applied Soil Ecology, vol. 16, no. 1, 2001, pp.
35-48, ISSN 0929-1393, DOI 10.1016/S0929-1393(00)00100-1.
81. Gosling, P.; Hodge, A.; Goodlass, G. y Bending, G. D. ‘‘Arbuscular mycorrhizal
fungi and organic farming’’. Agriculture, Ecosystems & Environment,
vol. 113, no. 1–4, 2006, pp. 17-35, ISSN 0167-8809, DOI 10.1016/j.agee.2005.09.009.
82. Kaizzi, C. K.; Ssali, H. y Vlek, P. L. G. ‘‘Differential use and benefits
of Velvet bean (Mucuna pruriens var. utilis) and N fertilizers in maize
production in contrasting agro-ecological zones of E. Uganda’’. Agricultural
Systems, vol. 88, no. 1, 2006, pp. 44-60, ISSN 0308-521X, DOI 10.1016/j.agsy.2005.06.003.
83. Caudle, N. ‘‘Legume green manures: a potential substitute for fertilizers
in maize’’. International Ag-Sieve, vol. 3, no. 3, 2006, Disponible en:
<1048-2962>.
84. Horst, W. J.; Kamh, M.; Jibrin, J. M. y Chude, V. O. ‘‘Agronomic measures
for increasing P availability to crops’’. Plant and Soil, vol. 237,
no. 2, 2001, pp. 211-223, ISSN 0032-079X, 1573-5036, DOI 10.1023/A:1013353610570.
85. Baijukya, F. P.; Ridder, N. de y Giller, K. E. ‘‘Nitrogen Release from Decomposing
Residues of Leguminous Cover Crops and their Effect on Maize Yield on Depleted
Soils of Bukoba District, Tanzania’’. Plant and Soil, vol. 279, no.
1-2, 2006, pp. 77-93, ISSN 0032-079X, 1573-5036, DOI 10.1007/s11104-005-2504-0.
86. Paré, T.; Gregorich, E. G. y Nelson, S. D. ‘‘Mineralization of nitrogen
from crop residues and N recovery by maize inoculated with vesicular-Arbuscular
mycorrhizal fungi’’. Plant and Soil, vol. 218, no. 1-2, 2000, pp. 11-20,
ISSN 0032-079X, 1573-5036, DOI 10.1023/A:1014958321933.
87. Rivera, R. ‘‘Resultados de las campañas de validación’’. En:
Rivera R. y Fernández K., Manejo efectivo de la simbiosis micorrízica,
una vía hacia la agricultura sostenible. Estudio de caso: el Caribe,
edit. Ediciones INCA, La Habana, Cuba, 2003, p. 166, ISBN 959-7023-24-5.
88. Álvarez, S. J. D. y Anzueto, M. M. de J. ‘‘Actividad microbiana del
suelo bajo diferentes sistemas de producción de maíz en los altos
de Chiapas, México’’. Agrociencia, vol. 38, no. 1, 2004, pp.
13-22, ISSN 1405-3195.
89. Boswell, E. P.; Koide, R. T.; Shumway, D. L. y Addy, H. D. ‘‘Winter wheat
cover cropping, VA mycorrhizal fungi and maize growth and yield’’. Agriculture,
Ecosystems & Environment, vol. 67, no. 1, 1998, pp. 55-65, ISSN 0167-8809,
DOI 10.1016/S0167-8809(97)00094-7.
90. Araújo, A. P. de y Almeida, D. L. de. ‘‘Adubação verde
associada a fosfato de rocha na cultura do milho’’. Pesquisa Agropecuária
Brasileira, vol. 28, no. 2, 1993, pp. 245-251, ISSN 1678-3921.
Recibido: 5 de
diciembre de 2014
Aceptado: 26 de agosto de 2015
Dra.C. Gloria
M. Martín, Instituto Nacional de Ciencias Agrícolas (INCA),
gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700. Email:
gloriam@inca.edu.cu


