RESEÑA BIBLIOGRÁFICA
Óxido Nítrico y su papel en las respuestas de las plantas al estrés hídrico
Nitric oxide and its role in plant responses to water stress
Yamile Vidal Aguiar,I Akira Pérez Márquez,I Dr.C. Loiret Fernández GarcíaII
IInstituto
Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José
de las Lajas, Mayabeque, Cuba, CP 32700.
IIFacultad Biología, Universidad de La Habana.
RESUMEN
El déficit hídrico constituye en la actualidad el estrés abiótico de mayor incidencia en el crecimiento y productividad de los cultivos. Numerosos reportes afirman que el óxido nítrico (NO) es una molécula señal involucrada en los mecanismos de respuestas ante esta condición de estrés. Mediante la aplicación de compuestos donadores de NO se han obtenido evidencias experimentales que apoyan estas funciones para el NO, pero poco se sabe acerca de la producción natural de NO en respuesta al estrés por sequía y su implicación para la planta. Asímismo, el mecanismo por el cual dicha molécula ejerce sus efectos y las dianas moleculares del NO en plantas sometidas a déficit hídrico aún no han sido descritas. Adicionalmente varios datos indican que el cierre de los estomas se efectúa a través de la señalización intracelular, en cual el NO es un componente. Por lo tanto, estos datos sugieren un nuevo modelo en la respuesta de la planta al estrés hídrico en la cual el NO debe ser incluido.
Palabras clave: crecimiento, estoma, estrés, productividad.
ABSTRACT
Water deficit is currently the abiotic stress with highest incidence on growth and crop productivity. Numerous reports affirm that nitric oxide (NO) is a signaling molecule involved in mechanisms of response to this stress condition. Through the application of NO donor compounds have been obtained experimental evidence in support these functions for NO, but it´s little known about the natural production of NO in response to drought stress and its implication for the plant. Likewise, the mechanism by which this molecule exerts its effects and the molecular targets of NO in plants under water stress have not yet been described. Additionally various data indicate that stomatal closure is effected through intracellular signaling in which NO is a component too. Thus, these data suggest an emerging model of drought stress response in which NO has been included.
Key words: growth, stoma, stress, productivity.
INTRODUCCIÓN
El déficit
hídrico es el estrés abiótico de mayor incidencia en el
crecimiento de las plantas (1, 2). Durante los últimos años, los
cambios globales en las condiciones climáticas han propiciado la intensificación
y la prolongación de la sequía (1, 3).
Este tipo de estrés ocurre en las plantas cuando la pérdida de
agua por transpiración excede la capacidad de absorción por las
raíces, resultando en deshidratación celular, con el consecuente
daño en las células, lo que puede desencadenar la muerte celular.
A nivel celular el déficit hídrico induce una sobreproducción
de especies reactivas del oxígeno (ROS, por sus siglas en inglés
Reactive Oxygen Species), las cuales son las responsables del daño
oxidativo a biomoléculas asociado con este tipo de estrés. Normalmente
las plantas responden a esta condición modificando la expresión
génica, relacionada con la producción de enzimas claves en síntesis
de osmólitos, proteínas con función protectora, enzimas
antioxidantes, factores de transcripción y otras proteínas involucradas
en las respuestas al estrés hídrico (4). La mayoría de
estas respuestas están reguladas por el ácido abscísico
(ABA), aunque también se han descrito vías de regulación
independientes de esta hormona (5).
Bajo estas condiciones, uno de los mecanismos de defensa más importantes
es el cierre estomático inducido por la redistribución y síntesis
de ABA. Entre las moléculas que participan en la señalización
mediada por ABA, el óxido nítrico (NO) es un importante intermediario.
El requerimiento de NO endógeno durante el cierre estomático inducido
por esta hormona ha sido demostrado mediante el empleo de herramientas genéticas
y bioquímicas (6).
Reportes recientes implican, además, la participación del NO y
otras especies reactivas del nitrógeno como mecanismos de respuestas
sistémicas de las plantas al déficit hídrico. Sin embargo,
la información disponible del metabolismo de NO en plantas sometidas
a déficit hídrico es limitada y aún cuando las investigaciones
sobre el papel de esta molécula en numerosas respuestas fisiológicas
ha aumentado en los últimos años, las fuentes de producción
así como los mecanismos moleculares mediante los cuales el NO ejerce
su respuesta, son todavía poco conocidos, por lo que es objeto de estudio
de numerosos laboratorios en todo el mundo.
El objetivo de este artículo es mostrar información actualizada
sobre los mecanismos de acción del NO así como las vías
involucradas en su producción y el papel de esta molécula en la
respuesta al déficit hídrico. Este es un tópico con importancia
para esclarecer las bases moleculares, bioquímicas y fisiológicas,
donde el NO constituye un intermediario que pudiera actuar de manera concertada
con ROS en el mecanismo de respuesta de la planta ante esta condición
y también para un uso práctico en la agricultura.
ESPECIES REACTIVAS DEL NITRÓGENO
El término
de especies reactivas del nitrógeno (RNS, por sus siglas en inglés
Reactive Nitrogen Species) se introdujo en la literatura para designar
al NO y otras moléculas relacionadas con el NO, como por ejemplo los
S-nitrosotioles (SNOs), S-nitrosoglutatión (GSNO), peroxinitrito y otros
compuestos que poseen un rol relevante en múltiples procesos fisiológicos
en células vegetales (7).
Evidencias experimentales en animales, demuestran la interacción del
NO con diferentes biomoléculas como los lípidos (8), ácidos
nucleicos (9) y proteínas, modificando sus funciones. Sin embargo, es
esta última la más estudiada.
En plantas, numerosos reportes afirman que las RNS ejercen su señalización
a través de modificaciones postraduccionales de proteínas específicas.
En ese sentido el NO puede reaccionar con las proteínas de distintas
formas; metales de transición presentes en la proteína dando complejos
llamados metales nitrosilados (10), grupos sulfidrilos de residuos de cisteína
mediante un proceso de S-nitrosilación (11) y por adición de un
grupo nitro en residuos de tirosina mediado por un proceso de nitración
(12, 13).
Una especial atención se ha dado al proceso de S-nitrosilación
del tripéptido glutatión (GSH) para formar el S-nitrosoglutatión
(GSNO) ya que esta molécula puede funcionar como reserva móvil
del NO (14, 15) y puede regular el equilibrio entre GSNO y las proteínas
nitrosiladas por un proceso de trasnitrosilación. En ese sentido la enzima
GSNO reductasa parece ser un elemento clave porque cataliza la reducción
de GSNO dependiente de nicotinamida adenina dinucleótido reducido (NADH)
a glutatión oxidado (GSSG) y NH3. Por consiguiente, esta enzima
controla el nivel de GSNO intracelular y como resultado los efectos de NO en
las células (16, 17). En plantas la información disponible respecto
al metabolismo de SNOs y RNS es todavía limitada comparada con los modelos
animales.
SÍNTESIS DE NIO EN PLANTAS
En la pasada década
el NO ha emergido como una importante molécula señal en plantas.
La síntesis de este compuesto es un mecanismo bien establecido en animales,
catalizado enzimáticamente por tres óxido nítrico sintasa
(NOS), las cuales presentan diferentes localizaciones y funciones. Esta enzima
convierte la L-Arginina a L-Citrulina y NO que requiere para su catálisis
diversos cofactores enzimáticos (18).
Sin embargo, en plantas, la generación de NO es más controversial.
Hasta la actualidad diversos sistemas generadores de NO, tanto enzimáticos
como no-enzimáticos, han sido descritos.
En 1996 se reportó por primera vez la presencia de actividad NOS en raíces
y nódulos de Lupinus albus mediante el empleo de Arginina marcada
radioactivamente, así como de un inhibidor de la actividad NOS en animales
NG-monometil-L-Arginina (NMMA) (19).
Adicionalmente dicha actividad ha sido descrita en otras especies como Nicotiana
tabacum (20) y Zea mays (21), así como en diferentes compartimentos
celulares como cloroplastos de Glycine max (22) y peroxisomas de
Pisum sativum (23).
En el 2003 se identificó el gen AtNOS1 en Arabidopsis, el cual codificaba
para una proteína que poseía actividad NOS y dicha actividad requería
los mismos cofactores descritos en animales, pero el gen no presentaba homología
de secuencia con ninguna de las isoformas descritas en mamíferos. De
acuerdo con estos datos, los autores reportaron el descubrimiento de una NOS
diferente a las descritas hasta el momento en la literatura, capaz de regular
el crecimiento y la señalización hormonal en plantas (24). Sin
embargo, estudios posteriores demostraron que la proteína recombinante
AtNOS1 no exhibía actividad NOS (25) y que dicha proteína era
en realidad una GTPasa que pudiera ser necesaria para la producción de
NO in vivo (26).
A pesar de que varios autores plantean la presencia de dicha actividad en plantas,
el gen que codifica para esta enzima aún no ha sido caracterizado y esto
constituye uno de los puntos más controversiales en lo referente a esta
enzima en plantas (25, 27).
Por su parte, la nitrato reductasa (NR) constituye una de las enzimas reportadas,
capaz de producir NO en plantas, y a su vez reduce el nitrito a NO en una reacción
dependiente de NAD(P)H (28, 29). En el 2002 se demostró que la generación
de NO mediada por esta enzima es estimulada en condiciones de hipoxia y puede
ser modulada por el estatus de fosforilación de la enzima (30). Estos
datos sugieren que un potencial mecanismo regulatorio puede existir in vivo.
Una proteína unida a membrana plasmática, específica de
raíces: nitrito-NO reductasa (NI-NOR) ha sido descrita como fuente de
NO. Dicha enzima usa Citocromo c como un donador de electrones in vivo
y cataliza la producción de NO a partir de nitrito. Sin embargo, ni su
rol fisiológico ni el gen que codifica para esta enzima ha sido reportado
hasta el momento (31).
La formación de NO a partir de reacciones no enzimáticas han sido
referidas en plantas de Nicotiana tabacum a partir de la reducción
mitocondrial de nitrito a NO (32) y dicha reacción es favorecida a pH
ácido, donde el nitrito puede dismutar a NO (33). Por su parte la generación
de NO in vivo por reacción de H2O2 y L-Arginina
se reportó en el año 1997(34). Adicionalmente una reacción
mediada por la luz, donde el nitrito es reducido por carotenoides ha sido también
demostrado como fuente de producción de NO (35).
Estudios recientes demostraron que células vegetales libres de nitrato
reductasa son capaces de formar NO a partir del suplemento exógeno de
Hidroxilamina (36), una vía que ha sido caracterizada en bacterias y
animales (37). Así mismo las poliaminas pueden inducir la producción
de NO, pero el mecanismo bajo el cual ocurre esto todavía no ha sido
descrito (38). Análisis futuros en este sentido podrían definir
nuevas vías de señalización, teniendo en cuenta que las
poliaminas están involucradas en los mecanismos de respuesta frente a
condiciones de estrés (39).
PAPEL DEL NO EN EL ESTRÉS HÍDRICO
Muchos autores
plantean que las plantas producen determinados niveles de NO en su ambiente
natural (40) como una respuesta generalizada frente al estrés ambiental
(41). Asimismo el rol protector de NO en plantas sometidas a estrés hídrico
ha sido reportado por varios investigadores. Dos mecanismos interrelacionados
por el cual el NO puede mitigar los efectos del estrés han sido descritos.
El NO puede funcionar como antioxidante, mediante la eliminación directa
de ROS que son generadas en estas condiciones, con la consecuente formación
de peroxinitrito o mediante la expresión de enzimas antioxidantes (42).
Además, el NO puede actuar como molécula señalizadora permitiendo
la expresión de genes involucrados en la respuesta de la planta al déficit
hídrico y modificar la actividad de proteínas mediante modificaciones
postraduccionales (43). Las propiedades químicas del NO (molécula
pequeña, tiempo de vida medio corto, ausencia de carga y alta difusibilidad)
sugieren que el NO pudiera funcionar como molécula señal en respuesta
al estrés celular (44).
La mayoría de las investigaciones previas que estudian el efecto del
NO y su papel en el estrés hídrico utilizan donadores químicos
de NO, además compuestos que eliminan esta molécula o inhibidores
de las enzimas envueltas en la producción de NO. Sin embargo, pocas son
las publicaciones que han monitoreado la velocidad de producción de NO
de forma natural y como respuesta al estrés hídrico.
Estudios anteriores han demostrado que el NO reduce la pérdida de agua
en hojas de trigo y que dichos resultados están en correspondencia con
una disminución en un 20 % de la tasa transpiratoria. Además,
la exposición de la planta a SNP (Nitroprusiato de sodio, donador de
NO) disminuye en un 25 % la pérdida de iones así como el daño
celular y estos resultados son atribuidos a esta molécula porque incubación
previa de SNP con compuestos eliminadores de NO revierten dichos efectos (45).
Estos resultados sugieren que la aplicación exógena de NO puede
conferir a las plantas un incremento en la tolerancia a las condiciones de estrés
hídrico.
Publicaciones recientes han demostrado que el NO exógeno incrementa la
tolerancia a la sequía en plantas de trigo (46). Dicho tratamiento aumenta
el crecimiento de la plántula, manteniendo un elevado contenido de agua
y disminuyendo el daño oxidativo por la producción de enzimas
antioxidantes (47). Sin embargo, altas dosis de NO (2 mM SNP) aumentan el efecto
del estrés como resultado de una sobreproducción de ROS
y una ineficiencia en la capacidad de controlar las especies reactivas del oxígeno
mediante la expresión de sistemas antioxidantes. Estos datos indican
que la habilidad potencial del NO de eliminar el peróxido de hidrógeno
es, en parte, debido a la inducción del mecanismo de defensa antioxidante
(46).
Otros estudios en plantas de maíz sometidas a estrés hídrico
mediante la aplicación del 10 % de polietilenglicol mostraron un rápido
incremento de NO en células del mesófilo. La actividad NOS fue
inducida bajo estas condiciones en fracciones citosólicas y microsomal,
siendo en esta última más elevada. Pre-tratamientos con inhibidores
de la actividad NOS y NR disminuyen la producción de NO sugiriendo que
dicha molécula es producida por la acción sinérgica de
estas dos enzimas en plantas de maíz expuestas a déficit hídrico.
Junto con la expresión de NO se induce adicionalmente la actividad enzimática
de la superóxido dismutasa, ascorbato peroxidasa y glutatión reductasa
(48).
Por su parte, en plántulas de Cucumis sativus, ha sido descrito
un ligero incremento en las síntesis de NO en la punta de las raíces
y en la región próxima a la zona de elongación. Esta producción
fue reducida por pre-tratamiento con inhibidores de NOS y NR. Aplicación
exógena de NO (SNP y GSNO) indica una respuesta adaptativa de las raíces
al estrés hídrico, encontrándose una correlación
positiva entre los niveles de NO y el estatus hídrico de la planta (49).
Estos resultados evidencian que el aumento de NO está estrechamente vinculado
a los mecanismos por los cuales la planta logra disminuir los efectos provocados
por el déficit hídrico.
A pesar de este efecto protector que representa la aplicación exógena
de NO a concentraciones específicas de este compuesto, estudios recientes
demuestran, que una sobreproducción de dicha molécula producida
como respuesta fisiológica de las plantas al estrés hídrico
en conjunto con un incremento en las ROS, puede mediar el daño a biomoléculas,
siendo las modificaciones de proteínas las más estudiadas.
Estudios recientes demostraron que plantas de Lotus japonicus expuestas
a estrés hídrico presentaron cambios significativos en los niveles
de especies reactivas del oxígeno y nitrógeno. Dichos cambios
se acompañaron de aumentos en la peroxidación lipídica
y nitración de proteínas respectivamente, indicando que bajo estas
condiciones el estrés hídrico provocó un estrés
oxidativo y nitrosativo (50). Estos resultados sugieren que el aumento de los
niveles de NO pueden tener múltiples funciones en el mecanismo de adaptación
al estrés hídrico y las modificaciones de proteínas pudieran
estar envueltas en mecanismos de señalización específicas
mediadas por estas moléculas.
Estas dos familias de moléculas (ROS y RNS) pueden considerarse como
moléculas señales endógenas envueltas en el mecanismo de
respuesta de las plantas a condiciones de sequía, pero una sobreproducción
de ambas pueden provocar un estrés nitro-oxidativo con consecuencias
tóxicas para la planta.
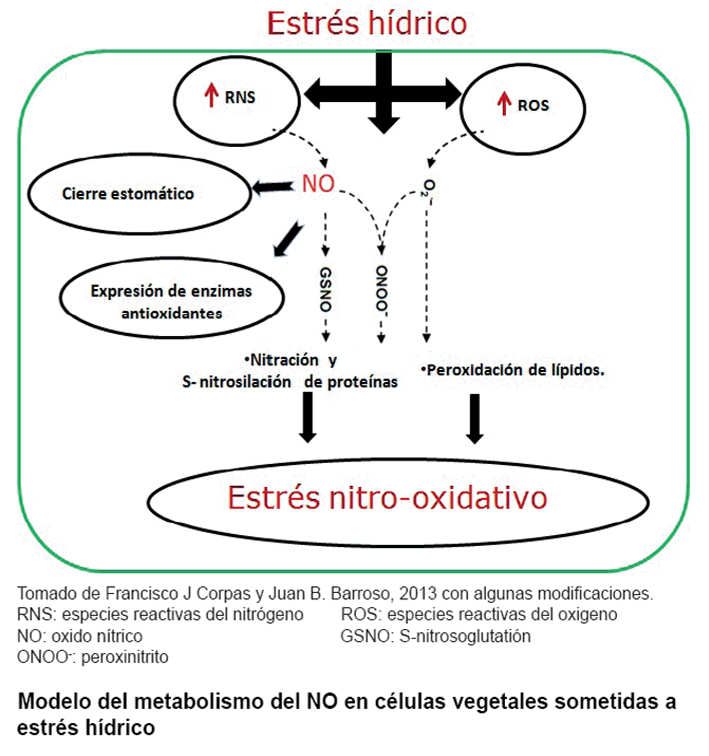
La figura muestra un
modelo del metabolismo del NO en células vegetales bajo estrés
hídrico y su interacción con ROS. Bajo estas condiciones y en
dependencia de su concentración el NO puede funcionar como antioxidante
mediante la eliminación directa de ROS o por la expresión de enzimas
antioxidantes, o puede estar involucrado en el cierre estomático por
vías de señalización dependientes de ABA. Una sobreproducción
de RNS y ROS pueden provocar la modificación de proteínas y peroxidación
de lípidos respectivamente provocando, a su vez, un estrés nitro-oxidativo
en plantas sometidas a estrés por sequía (51).

CIERRE ESTOMÁTICO DURANTE ESTRÉS HÍDRICO. PAPEL DE NO
El cierre estomático
en respuesta al ABA es mediado por una red de señalización que
envuelve vías dependientes e inactivadas por una serie de intermediarios
que incluye el peróxido de hidrógeno (54, 55) y el NO (56).
El descubrimiento de que el NO es una molécula clave que media la respuesta
por ABA en células oclusivas en plantas de guisante (57), ha sido confirmada
en Vicia faba (58) y Arabidopsis (28). Se conoce que esta respuesta
es dependiente del tiempo y de la concentración de NO y es mediada por
un proceso completamente reversible (57). El empleo de sondas fluorescentes
tal como el 4,5- diacetato de diaminofluoresceína (DAF-2DA) ha sido ampliamente
reportada en la literatura para la detección de la producción
de NO en tiempo real.
Incrementos en la fluorescencia de DAF-2DA fue observada en el citoplasma y
alrededor de los cloroplastos de células oclusivas tratadas con ABA.
Esta fluorescencia es específica para el NO, y cuando se empleó
la sonda inactiva 4-diacetato de diaminofluoresceína (4AF-DA) no se observó
incrementos en esta señal.
La aplicación exógena de 2-fenil-5,5-tetrametilimidazolina-1-oxil-3-óxido
(PTIO) o 2-(4-carboxifenil)-4,4,5,5-tretametilimidazolina-1-oxil-3-óxido
(cPTIO), compuestos que eliminan el NO, inhiben el cierre estomático
inducido por esta hormona, demostrando el papel endógeno de dicha molécula
en esta respuesta (45, 57, 58). Estos estudios demostraron que la síntesis
de NO es esencial para el cierre estomático inducido por ABA en varias
especies (28, 45, 57).
Para corroborar el papel de NO en el cierre estomático, varios estudios
han empleado donadores exógenos de NO, como por ejemplo el uso de SNP.
Mediante el uso de este compuesto se observó que el mismo induce el cierre
estomático y reduce la transpiración en tres especies diferentes
de plantas: Tradescantia sp. (monocotiledóneas) y dos dicotiledóneas
(Vicia faba y Salpichroa organifolia) (45). Estos resultados
han sido corroborados por otros autores en guisante y plantas de Arabidopsis
(28, 57).
En el 2002 se demostró que el cierre de los estomas es dependiente de
la síntesis de NO mediada por la NR en células oclusivas y que
el tratamiento de estas células de Arabidopsis con nitrito induce la
síntesis de NO y consecuentemente el cierre estomático (28). El
empleo de tungstato, un inhibidor de la actividad de la NR inhibe la síntesis
de NO inducida por nitrito y ABA (59). Adicionalmente el empleo de NG-nitro-L-Arginina
metil éster(L-NAME, inhibidor de la actividad de NOS) no inhibe la síntesis
de NO inducido por ABA o el cierre estomático en la epidermis de Arabidopsis
(28). Todos estos datos sugieren que la NR actúa como fuente de NO inducida
por ABA en células oclusivas de Arabidopsis.
En células epidérmicas del doble mutante nia1 nia2 (el cual exhibe
menos del 0,5 % de la actividad de NR), ni ABA ni nitrito inducen el cierre
estomático ni la síntesis de NO (28).
Curiosamente fue encontrado que las células oclusivas del mutante nia1/nia2
no responden a otros estímulos de cierre estomático como oscuridad,
peróxido de hidrógeno y empleo de donadores de NO, demostrando
un rol importante en la funcionalidad de este tipo de células (28). Estos
resultados brindan evidencias genéticas del papel de la NR como fuente
de NO durante el cierre estomático mediado por ABA en Arabidopsis.
Específicamente, de las dos isoformas de NR codificadas por los genes
nia1 y nia2, el cierre estomático es altamente dependiente de la isoforma
codificada por el gen nia1 (28).
Esta regulación mediada por NO puede ser por modulación del Ca
2+ en células oclusivas. Esta reportado que el NO activa selectivamente
los canales de Ca2+ intracelular en Vicia faba a través de vías
de señalización dependientes de cGMP/cADPR, sugiriendo el papel
del NO como molécula señal en el cierre estomático inducido
por ABA (57, 60).
CONCLUSIONES
A pesar de los
avances significativos en el metabolismo celular del NO en las plantas, se debe
reconocer que es muy limitado el conocimiento sobre la función de esta
molécula y otras RNS, que pudieran estar involucrados en el estrés
hídrico. Un factor limitante es la necesidad de identificar las fuentes
de producción de NO en cada órgano de la planta y cuáles
son determinantes para esta condición de estrés.
Investigaciones futuras deben ir dirigidas a estudiar los mecanismos de transducción
de señales involucradas en el mecanismo de respuesta del NO, así
como a la identificación y caracterización de sus dianas moleculares.
Una interpretación completa de los fenómenos de estrés
hídrico requiere el estudio no sólo del papel de las ROS, sino
también de las RNS y dilucidar como estas dos clases de moléculas
pueden interactuar durante el estrés hídrico.
BIBLIOGRAFÍA
1. Chaves, M. M.;
Maroco, J. P. y Pereira, J. S. ‘‘Understanding plant responses to drought-from
genes to the whole plant’’. Functional Plant Biology, vol. 30, no.
3, 2003, pp. 239-264, ISSN 1445-4408, DOI http://dx.doi.org/10.1071/FP02076.
2. Shao, H. B.; Chu, L. Y.; Jaleel, C. A.; Manivannan, P.; Panneerselvam, R.
y Shao, M. A. ‘‘Understanding water deficit stress-induced changes in the basic
metabolism of higher plants – biotechnologically and sustainably improving agriculture
and the ecoenvironment in arid regions of the globe’’. Critical Reviews
in Biotechnology, vol. 29, no. 2, 2009, pp. 131-151, ISSN 0738-8551, DOI
10.1080/07388550902869792.
3. Chaves, M. M. y Oliveira, M. M. ‘‘Mechanisms underlying plant resilience
to water deficits: prospects for water-saving agriculture’’. Journal of
Experimental Botany, vol. 55, no. 407, 11 de enero de 2004, pp. 2365-2384,
ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/erh269.
4. Bray, E. A. ‘‘Plant responses to water deficit’’. Trends in Plant Science,
vol. 2, no. 2, 1 de febrero de 1997, pp. 48-54, ISSN 1360-1385, DOI 10.1016/S1360-1385(97)82562-9.
5. Roychoudhury, A.; Paul, S. y Basu, S. ‘‘Cross-talk between abscisic acid-dependent
and abscisic acid-independent pathways during abiotic stress’’. Plant Cell
Reports, vol. 32, no. 7, 2013, pp. 985-1006, ISSN 0721-7714, 1432-203X,
DOI 10.1007/s00299-013-1414-5.
6. Neill, S.; Barros, R.; Bright, J.; Desikan, R.; Hancock, J.; Harrison, J.;
Morris, P.; Ribeiro, D. y Wilson, I. ‘‘Nitric oxide, stomatal closure, and abiotic
stress’’. Journal of Experimental Botany, vol. 59, no. 2, 2008, pp.
165-176, ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/erm293.
7. Durzan, D. J. y Pedroso, M. C. ‘‘Nitric Oxide and Reactive Nitrogen Oxide
Species in Plants’’. Biotechnology and Genetic Engineering Reviews,
vol. 19, no. 1, 2002, pp. 293-338, ISSN 0264-8725, DOI10.1080/02648725.2002.10648032.
8. Desel, C. y Krupinska, K. ‘‘The impact of tocochromanols on early seedling
development and NO release’’. Journal of Plant Physiology, vol. 162,
no. 7, 2005, pp. 771-776, ISSN 0176-1617, DOI 10.1016/j.jplph.2005.04.008.
9. Akuta, T.; Zaki, M. H.; Yoshitake, J.; Okamoto, T. y Akaike, T. ‘‘Nitrative
stress through formation of 8-nitroguanosine: Insights into microbial pathogenesis’’.
Nitric Oxide, vol. 14, no. 2, 2006, pp. 101-108, ISSN 1089-8603, DOI 10.1016/j.niox.2005.10.004.
10. Gupta, K. J.; Hebelstrup, K. H.; Mur, L. A. J. y Igamberdiev, A. U. ‘‘Plant
hemoglobins: Important players at the crossroads between oxygen and nitric oxide’’.
FEBS Letters, vol. 585, no. 24, 2011, pp. 3843-3849, ISSN 0014-5793,
DOI 10.1016/j.febslet.2011.10.036.
11. Astier, J.; Rasul, S.; Koen, E.; Manzoor, H.; Besson-Bard, A.; Lamotte,
O.; Jeandroz, S.; Durner, J.; Lindermayr, C. y Wendehenne, D. ‘‘S-nitrosylation:
An emerging post-translational protein modification in plants’’. Plant Science,
vol. 181, no. 5, 2011, pp. 527-533, ISSN 0168-9452, DOI 10.1016/j.plantsci.2011.02.011.
12. Besson, B. A.; Pugin, A. y Wendehenne, D. ‘‘New Insights into Nitric Oxide
Signaling in Plants’’. Annual Review of Plant Biology, vol. 59, no.
1, 2008, pp. 21-39, ISSN 1543-5008, 1545-2123, DOI 10.1146/annurev.arplant.59.032607.092830.
13. Cecconi, D.; Orzetti, S.; Vandelle, E.; Rinalducci, S.; Zolla, L. y Delledonne,
M. ‘‘Protein nitration during defense response in Arabidopsis thaliana’’.
Electrophoresis, vol. 30, no. 14, 1 de julio de 2009, pp. 2460-2468,
ISSN 1522-2683, DOI 10.1002/elps.200800826.
14. Durner, J. y Klessig, D. F. ‘‘Nitric oxide as a signal in plants’’. Current
Opinion in Plant Biology, vol. 2, no. 5, 1999, pp. 369-374, ISSN 1369-5266,
DOI 10.1016/S1369-5266(99)00007-2.
15. Barroso, J. B.; Corpas, F. J.; Carreras, A.; Rodríguez, S. M.; Esteban,
F. J.; Fernández, O. A.; Chaki, M.; Romero, P. M. C.; Valderrama, R.;
Sandalio, L. M. y Río, L. A. del. ‘‘Localization of S-nitrosoglutathione
and expression of S-nitrosoglutathione reductase in pea plants under cadmium
stress’’. Journal of Experimental Botany, vol. 57, no. 8, 2006, pp.
1785-1793, ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/erj175.
16. Leterrier, M.; Chaki, M.; Airaki, M.; Valderrama, R.; Palma, J. M.; Barroso,
J. B. y Corpas, F. J. ‘‘Function of S-nitrosoglutathione reductase (GSNOR) in
plant development and under biotic/abiotic stress’’. Plant Signaling &
Behavior, vol. 6, no. 6, 2011, pp. 789-793, ISSN 1559-2316, 1559-2324,
DOI 10.4161/psb.6.6.15161.
17. Corpas, F. J.; Alché, J. de D. y Barroso, J. B. ‘‘Current overview
of S-nitrosoglutathione (GSNO) in higher plants’’. Plant Physiology,
vol. 4, 2013, p. 126, ISSN 0032-0889, 1532-2548, DOI 10.3389/fpls.2013.00126.
18. Mayer, B. y Hemmens, B. ‘‘Biosynthesis and action of nitric oxide in mammalian
cells’’. Trends in Biochemical Sciences, vol. 22, no. 12, 1997, pp.
477-481, ISSN 0968-0004, DOI 10.1016/S0968-0004(97)01147-X.
19. Cueto, M.; Hernández, P. O.; Martín, R.; Bentura, M. L.; Rodrigo,
J.; Lamas, S. y Golvano, M. P. ‘‘Presence of nitric oxide synthase activity
in roots and nodules of Lupinus albus’’. FEBS Letters, vol.
398, no. 2, 1996, pp. 159-164, ISSN 0014-5793, DOI 10.1016/S0014-5793(96)01232-X.
20. Durner, J.; Wendehenne, D. y Klessig, D. F. ‘‘Defense gene induction in
tobacco by nitric oxide, cyclic GMP, and cyclic ADP-ribose’’. Proceedings
of the National Academy of Sciences, vol. 95, no. 17, 18 de agosto de 1998,
pp. 10328-10333, ISSN 0027-8424, 1091-6490, DOI 10.1073/pnas.95.17.10328.
21. Ribeiro, E. A.; Cunha, F. Q.; Tamashiro, W. M. S. C. y Martins, I. S. ‘‘Growth
phase-dependent subcellular localization of nitric oxide synthase in maize cells’’.
FEBS Letters, vol. 445, no. 2, 1999, pp. 283-286, ISSN 0014-5793, DOI 10.1016/S0014-5793(99)00138-6.
22. Jasid, S.; Simontacchi, M.; Bartoli, C. G. y Puntarulo, S. ‘‘Chloroplasts
as a Nitric Oxide Cellular Source. Effect of Reactive Nitrogen Species on Chloroplastic
Lipids and Proteins’’. Plant Physiology, vol. 142, no. 3, 11 de enero
de 2006, pp. 1246-1255, ISSN , 1532-2548, DOI 10.1104/pp.106.086918.
23. Barroso, J. B.; Corpas, F. J.; Carreras, A.; Sandalio, L. M.; Valderrama,
R.; Palma, J.; Lupiáñez, J. A. y Ri´o, L. A. del. ‘‘Localization
of Nitric-oxide Synthase in Plant Peroxisomes’’. Journal of Biological Chemistry,
vol. 274, no. 51, 1999, pp. 36729-36733, ISSN 0021-9258, 1083-351X, DOI 10.1074/jbc.274.51.36729.
24. Guo, F. Q.; Okamoto, M. y Crawford, N. M. ‘‘Identification of a Plant Nitric
Oxide Synthase Gene Involved in Hormonal Signaling’’. Science, vol.
302, no. 5642, 2003, pp. 100-103, ISSN 0036-8075, 1095-9203, DOI 10.1126/science.1086770.
25. Zemojtel, T.; Fröhlich, A.; Palmieri, M. C.; Kolanczyk, M.; Mikula,
I.; Wyrwicz, L. S.; Wanker, E. E.; Mundlos, S.; Vingron, M.; Martasek, P. y
Durner, J. ‘‘Plant nitric oxide synthase: a never-ending story?’’. Trends
in Plant Science, vol. 11, no. 11, 2006, pp. 524-525, ISSN 1360-1385, DOI
10.1016/j.tplants.2006.09.008.
26. Moreau, M.; Lee, G. I.; Wang, Y.; Crane, B. R. y Klessig, D. F. ‘‘AtNOS/AtNOA1
Is a Functional Arabidopsis thaliana cGTPase and Not a Nitric-oxide
Synthase’’. Journal of Biological Chemistry, vol. 283, no. 47, 2008,
pp. 32957-32967, ISSN 0021-9258, 1083-351X, DOI 10.1074/jbc.M804838200.
27. Gupta, K. J.; Fernie, A. R.; Kaiser, W. M. y van Dongen, J. T. ‘‘On the
origins of nitric oxide’’. Trends in Plant Science, vol. 16, no. 3,
2011, pp. 160-168, ISSN 1360-1385, DOI 10.1016/j.tplants.2010.11.007.
28. Desikan, R.; Griffiths, R.; Hancock, J. y Neill, S. ‘‘A new role for an
old enzyme: Nitrate reductase-mediated nitric oxide generation is required for
abscisic acid-induced stomatal closure in Arabidopsis thaliana’’. Proceedings
of the National Academy of Sciences, vol. 99, no. 25, 12 de octubre de
2002, pp. 16314-16318, ISSN 0027-8424, 1091-6490, DOI 10.1073/pnas.252461999.
29. Kaiser, W. M.; Weiner, H.; Kandlbinder, A.; Tsai, C.-B.; Rockel, P.; Sonoda,
M. y Planchet, E. ‘‘Modulation of nitrate reductase: some new insights, an unusual
case and a potentially important side reaction’’. Journal of Experimental
Botany, vol. 53, no. 370, 2002, pp. 875-882, ISSN 0022-0957, 1460-2431,
DOI 10.1093/jexbot/53.370.875.
30. Rockel, P.; Strube, F.; Rockel, A.; Wildt, J. y Kaiser, W. M. ‘‘Regulation
of nitric oxide (NO) production by plant nitrate reductase in vivo
and in vitro’’. Journal of Experimental Botany, vol. 53, no. 366, 1
de enero de 2002, pp. 103-110, ISSN 0022-0957, 1460-2431, DOI 10.1093/jexbot/53.366.103.
31. Stöhr, C. y Stremlau, S. ‘‘Formation and possible roles of nitric oxide
in plant roots’’. Journal of Experimental Botany, vol. 57, no. 3, 2006,
pp. 463-470, ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/erj058.
32. Planchet, E.; Jagadis, G. K.; Sonoda, M. y Kaiser, W. M. ‘‘Nitric oxide
emission from tobacco leaves and cell suspensions: rate limiting factors and
evidence for the involvement of mitochondrial electron transport’’. The
Plant Journal, vol. 41, no. 5, 2005, pp. 732-743, ISSN 1365-313X, DOI 10.1111/j.1365-313X.2005.02335.x.
33. Bethke, P. C.; Badger, M. R. y Jones, R. L. ‘‘Apoplastic Synthesis of Nitric
Oxide by Plant Tissues’’. The Plant Cell, vol. 16, no. 2, 2004, pp.
332-341, ISSN 1532-298X, DOI 10.1105/tpc.017822.
34. Nagase, S.; Takemura, K.; Ueda, A.; Hirayama, A.; Aoyagi, K.; Kondoh, M.
y Koyama, A. ‘‘A Novel Nonenzymatic Pathway for the Generation of Nitric Oxide
by the Reaction of Hydrogen Peroxide and D- or L-Arginine’’. Biochemical
and Biophysical Research Communications, vol. 233, no. 1, 1997, pp. 150-153,
ISSN 0006-291X, DOI 10.1006/bbrc.1997.6428.
35. Cooney, R. V.; Harwood, P. J.; Custer, L. J. y Franke, A. A. ‘‘Light-mediated
conversion of nitrogen dioxide to nitric oxide by carotenoids’’. Environmental
Health Perspectives, vol. 102, no. 5, 1994, pp. 460-462, ISSN 0091-6765.
36. Rümer, S.; Kapuganti, J. G. y Kaiser, W. M. ‘‘Oxidation of hydroxylamines
to NO by plant cells’’. Plant Signaling & Behavior, vol. 4, no.
9, 2009, pp. 853-855, ISSN 1559-2316, 1559-2324, DOI 10.4161/psb.4.9.9378.
37. Vetrovsky, P.; Stoclet, J. C. y Entlicher, G. ‘‘Possible mechanism of nitric
oxide production from NG-hydroxy-l-arginine or hydroxylamine by superoxide ion’’.
The International Journal of Biochemistry & Cell Biology, vol.
28, no. 12, 1996, pp. 1311-1318, ISSN 1357-2725, DOI 10.1016/S1357-2725(96)00089-1.
38. Tun, N. N.; Santa, C.; Begum, T.; Silveira, V.; Handro, W.; Floh, E. I.
S. y Scherer, G. F. E. ‘‘Polyamines Induce Rapid Biosynthesis of Nitric Oxide
(NO) in Arabidopsis thaliana Seedlings’’. Plant and Cell Physiology,
vol. 47, no. 3, 2006, pp. 346-354, ISSN 0032-0781, 1471-9053, DOI 10.1093/pcp/pci252.
39. Groppa, M. D. y Benavides, M. P. ‘‘Polyamines and abiotic stress: recent
advances’’. Amino Acids, vol. 34, no. 1, 2007, pp. 35-45, ISSN 0939-4451,
1438-2199, DOI 10.1007/s00726-007-0501-8.
40. Wildt, J.; Kley, D.; Rockel, A.; Rockel, P. y Segschneider, H. J. ‘‘Emission
of NO from several higher plant species’’. Journal of Geophysical Research:
Atmospheres, vol. 102, no. D5, 1997, pp. 5919-5927, ISSN 2156-2202, DOI
10.1029/96JD02968.
41. Magalhaes, J. R.; Pedroso, M. C. y Durzan, D. ‘‘Nitric Oxide Apoptosis and
Plant Stresses’’. Physiology and Molecular Biology of Plants, vol.
5, 1999, pp. 115–125, ISSN 0971-5894.
42. Radi, R.; Beckman, J. S.; Bush, K. M. y Freeman, B. A. ‘‘Peroxynitrite-induced
membrane lipid peroxidation: The cytotoxic potential of superoxide and nitric
oxide’’. Archives of Biochemistry and Biophysics, vol. 288, no. 2,
1991, pp. 481-487, ISSN 0003-9861, DOI 10.1016/0003-9861(91)90224-7.
43. Wendehenne, D.; Pugin, A.; Klessig, D. F. y Durner, J. ‘‘Nitric oxide: comparative
synthesis and signaling in animal and plant cells’’. Trends in Plant Science,
vol. 6, no. 4, 2001, pp. 177-183, ISSN 1360-1385, DOI 10.1016/S1360-1385(01)01893-3.
44. Foissner, I.; Wendehenne, D.; Langebartels, C. y Durner, J. ‘‘In vivo
imaging of an elicitor-induced nitric oxide burst in tobacco’’. The Plant
Journal, vol. 23, no. 6, 2000, pp. 817-824, ISSN 1365-313X, DOI 10.1046/j.1365-313X.2000.00835.x.
45. Garci´a, M. C. y Lamattina, L. ‘‘Nitric Oxide Induces Stomatal Closure
and Enhances the Adaptive Plant Responses against Drought Stress’’. Plant
Physiology, vol. 126, no. 3, 2001, pp. 1196-1204, ISSN 1532-2548, DOI 10.1104/pp.126.3.1196.
46. Tian, X. y Lei, Y. ‘‘Nitric oxide treatment alleviates drought stress in
wheat seedlings’’. Biologia Plantarum, vol. 50, no. 4, 2006, pp. 775-778,
ISSN 0006-3134, 1573-8264, DOI 10.1007/s10535-006-0129-7.
47. Hao, G. P. y Zhang, J. H. ‘‘The Role of Nitric Oxide as a Bioactive Signaling
Molecule in Plants under Abiotic Stress’’ [en línea]. En: eds. Hayat
S., Mori saki, Pichtel J., y Ahmad A., Nitric Oxide in Plant Physiology, edit.
Wiley-VCH Verlag GmbH & Co. KGaA, 2009, pp. 115-138, ISBN 978-3-527-62913-8,
[Consultado: 29 de noviembre de 2015], Disponible en: <http://onlinelibrary.wiley.com/doi/10.1002/9783527629138.ch9/summary>.
48. Sang, J.; Jiang, M.; Lin, F.; Xu, S.; Zhang, A. y Tan, M. ‘‘Nitric Oxide
Reduces Hydrogen Peroxide Accumulation Involved in Water Stress-induced Subcellular
Anti-oxidant Defense in Maize Plants’’. Journal of Integrative Plant Biology,
vol. 50, no. 2, 2008, pp. 231-243, ISSN 1744-7909, DOI 10.1111/j.1744-7909.2007.00594.x.
49. Arasimowicz, J. M.; Floryszak, W. J. y Kubis, J. ‘‘Involvement of nitric
oxide in water stress-induced responses of cucumber roots’’. Plant Science,
vol. 177, no. 6, 2009, pp. 682-690, ISSN 0168-9452, DOI 10.1016/j.plantsci.2009.09.007.
50. Signorelli, S.; Corpas, F. J.; Borsani, O.; Barroso, J. B. y Monza, J. ‘‘Water
stress induces a differential and spatially distributed nitro-oxidative stress
response in roots and leaves of Lotus japonicus’’. Plant Science, vol.
201-202, marzo de 2013, pp. 137-146, ISSN 0168-9452, DOI 10.1016/j.plantsci.2012.12.004.
51. Corpas, F. J. y Barroso, J. B. ‘‘Nitro-oxidative stress vs oxidative or
nitrosative stress in higher plants’’. New Phytologist, vol. 199, no.
3, 2013, pp. 633-635, ISSN 1469-8137, DOI 10.1111/nph.12380.
52. Webb, A. A. R.; Larman, M. G.; Montgomery, L. T.; Taylor, J. E. y Hetherington,
A. M. ‘‘The role of calcium in ABA-induced gene expression and stomatal movements’’.
The Plant Journal, vol. 26, no. 3, 2001, pp. 351-362, ISSN 1365-313X,
DOI 10.1046/j.1365-313X.2001.01032.x.
53. Kim, T. H.; Böhmer, M.; Hu, H.; Nishimura, N. y Schroeder, J. I. ‘‘Guard
Cell Signal Transduction Network: Advances in Understanding Abscisic Acid, CO2,
and Ca2+ Signaling’’. Annual Review of Plant Biology, vol. 61, no.
1, 2010, pp. 561-591, ISSN 1543-5008, 1545-2123, DOI 10.1146/annurev-arplant-042809-112226.
54. Yuchen, M.; Chunpeng, S.; Facai, D. y Xuechen, W. ‘‘ABA-induced hydrogen
peroxide generation in guard cells of Vicia faba’’. Acta phytophysiologica
Sinica / Zhongguo zhi wu sheng li xue hui zhu bian, vol. 26, no. 1, 1999,
pp. 53-58, ISSN 0257-4829.
55. Wang, P. y Song, C. P. ‘‘Guard-cell signalling for hydrogen peroxide and
abscisic acid’’. New Phytologist, vol. 178, no. 4, 2008, pp. 703-718,
ISSN 1469-8137, DOI 10.1111/j.1469-8137.2008.02431.x.
56. Desikan, R.; Cheung, M. K.; Bright, J.; Henson, D.; Hancock, J. T. y Neill,
S. J. ‘‘ABA, hydrogen peroxide and nitric oxide signalling in stomatal guard
cells’’. Journal of Experimental Botany, vol. 55, no. 395, 2004, pp.
205-212, ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/erh033.
57. Neill, S. J.; Desikan, R.; Clarke, A. y Hancock, J. T. ‘‘Nitric Oxide Is
a Novel Component of Abscisic Acid Signaling in Stomatal Guard Cells’’. Plant
Physiology, vol. 128, no. 1, 2002, pp. 13-16, ISSN 1532-2548, DOI 10.1104/pp.010707.
58. Garci´a, M. C. y Lamattina, L. ‘‘Nitric Oxide and Abscisic Acid Cross
Talk in Guard Cells’’. Plant Physiology, vol. 128, no. 3, 2002, pp. 790-792,
ISSN 1532-2548, DOI 10.1104/pp.011020.
59. Bright, J.; Desikan, R.; Hancock, J. T.; Weir, I. S. y Neill, S. J. ‘‘ABA-induced
NO generation and stomatal closure in Arabidopsis are dependent on H2O2
synthesis’’. The Plant Journal, vol. 45, no. 1, 2006, pp. 113-122,
ISSN 1365-313X, DOI 10.1111/j.1365-313X.2005.02615.x.
60. Garci´a, M. C. y Lamattina, L. ‘‘Abscisic acid, nitric oxide and stomatal
closure – is nitrate reductase one of the missing links?’’. Trends in Plant
Science, vol. 8, no. 1, 2003, pp. 20-26, ISSN 1360-1385, DOI 10.1016/S1360-1385(02)00009-2.
Recibido:
7 de octubre de 2014
Aceptado: 18 de marzo de 2015
Yamile Vidal Aguiar, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700. Email: yvidalaguiar@gmail.com