RESEÑA
BIBLIOGRÁFICA
Aspectos
relacionados con el estrés de calor en tomate (Solanum lycopersicum
L.)
Some aspect
related to heat tolerance in tomato (Solanum lycopersicum L.)
Dra.C.
Marilyn Florido Bacallao, Dra.C. Marta Álvarez Gil
Instituto Nacional
de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las
Lajas, Mayabeque, Cuba. CP 32 700.
RESUMEN
Aunque el tomate
puede crecer en un amplio rango de condiciones climáticas, su crecimiento
vegetativo y reproductivo se ve seriamente afectado en condiciones de temperaturas
altas, resultando en una reducción del rendimiento y de la calidad del
fruto. Estas condiciones son importantes, fundamentalmente, en ambientes tropicales
y subtropicales, donde el estrés es un factor limitante en la producción
de tomate. En este trabajo se exponen los principales aspectos relacionados
con la tolerancia al calor en el cultivo a nivel celular, morfoagronómico
y de planta completa; las dificultades en la cuantificación de la tolerancia
a este estrés, así como la necesidad de conocer los mecanismos
fisiológicos y las bases genéticas de la termotolerancia con vistas
a lograr progresos en el mejoramiento genético del cultivo.
Palabras
clave: estrés, fructificación, mejora genética,
tolerancia al calor, tomate.
ABSTRACT
Although tomato
plants can grow in a wide range of climatic conditions, their vegetative and
reproductive growth is severely impaired at high temperatures, resulting in
reduced yield and fruit quality. This high-temperature sensitivity is particularly
important in areas with tropical or subtropical climates. In such environments,
heat stress may become a major limiting factor for tomatoe production. This
work was focused in explain different aspect related to heat stress tolerance
at cellular and whole plant levels, difficulties on the quantification of stress
tolerance, as well as the necessity on an understanding of the physiological
mechanisms and genetic basis for thermotolerance in order to achievement progress
in tomato plant breeding.
Key words:
stress, fruit set, plant breeding, heat tolerance, tomato.
INTRODUCCIÓN
El tomate (Solanum
lycopersicum L.), después de la papa (Solanum tuberosum
L.), es el vegetal más consumido debido al alto valor de sus frutos en
términos de versatilidad, tanto para consumo fresco, como la diversidad
de sus frutos procesados (1).
Aunque las plantas de tomate pueden crecer en una amplia gama de condiciones
climáticas, su crecimiento vegetativo y reproductivo se afectan seriamente
en condiciones de temperaturas altas. Estas causan daños serios en las
estructuras reproductivas, lo que trae como consecuencia la deficiencia en el
cuajado de los frutos y la disminución de la producción (2, 3,
4), de ahí que este constituya uno de los factores más importantes
que inciden en la baja producción de tomate en ambientes tropicales (5,
6, 7, 8).
Por lo general, esta afectación es mayor cuando la temperatura ambiente
supera los 35 oC (2, 3, 9, 10). Esta sensibilidad a temperaturas
altas es particularmente importante en zonas con climas tropicales o subtropicales,
donde el estrés por calor puede convertirse en un factor limitante para
la producción de campo de tomates (11).
Cada año las temperaturas altas y el aumento de la frecuencia, magnitud
e intensidad de las olas de calor causan considerables pérdidas económicas
(12, 13, 14). Producto del calentamiento global se estima que el promedio de
temperatura puede incrementarse entre 3-6 oC para el año 2100,
lo cual causaría serios daños económicos en el cultivo
si se tiene en cuenta que la fructificación en el tomate disminuye significativamente
con pequeños incrementos de la temperatura (2). Este efecto se agrava
si las elevaciones de temperaturas coinciden con períodos lluviosos,
incrementándose la incidencia de plagas, fundamentalmente cuando la explotación
del cultivo se realiza a cielo abierto (15, 16).
Uno de los indicadores más importantes de la tolerancia al calor en el
tomate, a nivel de planta, es la capacidad de fructificación o cuajado
de los frutos en ambientes estresantes, de manera que aquellos cultivares con
mayor capacidad para la fructificación bajo altas temperaturas y humedad,
resultan los más adecuados para la producción del tomate en los
trópicos (15, 17, 18, 19, 20), por lo que cualquier método empleado
para el tamizaje de las accesiones de tomate deberá estar asociado al
mismo.
En general, el mejoramiento genético puede ser una solución económicamente
viable para la producción del tomate en condiciones de temperaturas altas;
sin embargo, los progresos en estos programas dependen del conocimiento de los
mecanismos fisiológicos y las bases genéticas de la tolerancia
a este estrés a nivel celular y de la planta completa. Actualmente existe
información disponible sobre el conocimiento de aspectos fisiológicos
y metabólicos sobre la tolerancia a estrés de calor en plantas
(4); sin embargo, las investigaciones en la caracterización genética
y el mejoramiento para condiciones de estrés han sido algo limitadas,
aunque recientemente se han realizado esfuerzos en esta dirección (6,
9, 11, 20, 21, 22).
La cuantificación de la tolerancia al calor en tomate posee serias dificultades,
la selección directa en condiciones de campo es, generalmente, difícil
por la presencia de otros factores ambientales adversos que afectan la precisión
y repetibilidad de estos ensayos (21, 23, 24, 25, 26). En ocasiones, la tolerancia
a estrés en una etapa específica de desarrollo de las plantas
no se correlaciona con la tolerancia en otras etapas de desarrollo (9, 11, 25,
27), de ahí que en la medida que se comprendan mejor los aspectos fisiológicos
y de desarrollo en condiciones de estrés, permitirán un mejor
entendimiento de las bases genéticas de la tolerancia a estrés
en plantas.
Los avances recientes en las técnicas moleculares, incluyendo transformación
genética, análisis de expresión y análisis de loci
cuantitativos (QTLs), han contribuido en entender las bases bioquímicas
y moleculares de la tolerancia a estrés en plantas (19, 28, 29, 30, 31).
Se espera que estos avances contribuyan significativamente al desarrollo de
plantas con tolerancia al calor en un futuro cercano (7, 11, 21).
Se conoce que el tomate (Solanum lycopersicum L.) es moderadamente
susceptible a diversos factores abióticos incluido el de las temperaturas
altas. Sin embargo, dentro de las especies afines existen algunas silvestres
que presentan una fuente de variación genética útil, que
ha sido ampliamente utilizada en los programas de mejoramiento genético
para obtener cultivares con características agronómicamente deseables
y para caracterizar las bases genético-fisiológicas de la tolerancia
al calor y desarrollar plantas tolerantes al estrés.
En esta revisión se discuten aspectos agronómicos, fisiológicos
y moleculares, relacionados con la tolerancia al calor en el cultivo, asimismo
se exponen los avances recientes en aspectos genéticos y relacionados
con el mejoramiento para estas condiciones.
ASPECTOS
GENERALES
De las principales
formas de estrés abiótico a los cuales las plantas están
expuestas a en la naturaleza, el estrés por calor tiene un modo independiente
de la acción sobre la fisiología y el metabolismo de las células
vegetales. Aunque con frecuencia, este se ve agravado por estreses abióticos
adicionales, tales como la sequía y estrés salino. Es importante
desentrañar la acción independiente y las consecuencias biológicas
de las temperaturas altas, con el fin de aliviar los efectos del estrés
abiótico combinado.
La susceptibilidad a altas temperaturas afecta el desarrollo vegetativo y reproductivo,
variando con la etapa de desarrollo de la planta. Los efectos observados dependen
de especies y genotipos con abundantes variaciones inter e intraespecíficas
(32, 33).
En respuesta al estrés por calor, las plantas manifiestan diferentes
adaptaciones morfológicas, incluyendo mecanismos de corto plazo de evitación
o aclimatación que implican la orientación de las hojas, la refrigeración,
la transpiración o la alteración de composiciones de lípidos
de la membrana (9).
La exposición inicial a una temperatura moderadamente alta en plantas
le proporciona tolerancia a una temperatura que normalmente habría sido
letal. Este fenómeno se conoce como termotolerancia adquirida (34). Incluso
cuando las plantas crecen en su área de distribución natural,
pueden experimentar temperaturas altas o fluctuaciones diurnas que serían
letales en ausencia de esta aclimatación rápida. Por lo tanto,
la adquisición de la termotolerancia puede reflejar un mecanismo más
general que contribuye a la homeostasis metabólica (35). Sin embargo,
solamente se ha definido un limitado número de factores responsables
del desarrollo de la termotolerancia de las plantas debido a la complejidad
de este carácter (35).
La termotolerancia es un componente esencial de aclimatación en diferentes
organismos, incluida las plantas. Generalmente se divide en termotolerancia
adquirida (capacidad de adquirir tolerancia a temperaturas letales) y termotolerancia
basal (capacidad de sobrevivir a temperaturas por encima de la temperatura óptima
de crecimiento) (36). La capacidad de adquirir termotolerancia por incrementos
en la expresión de genes protectores, previo a una exposición
al estrés. Un período prolongado a una temperatura moderadamente
alta es tan dañino como la exposición breve a las temperaturas
extremas (37, 38).
En condiciones de estrés por temperatura alta se señalan cuatro
efectos fundamentales (39), estos son:
• La respuesta diferenciada de las velocidades de reacción, debido a
las diferencias en la energía de activación de las mismas.
• La desnaturalización y la agregación de las proteínas.
• La hiperfluidez de los lípidos de las membranas.
• La descomposición química directa.
Se plantea que el desarrollo de la termotolerancia debe moderar los diferentes
tipos de daños y efectos tóxicos que provocan las temperaturas
altas, a través de la inducción de factores protectores que limitan
la magnitud del daño o por medio de la activación de procesos
de recuperación de la planta ante el daño, aunque no necesariamente
son mecanismos mutuamente excluyentes (23, 40).
RESPUESTA
MORFOAGRONÓMICA DEL TOMATE A TEMPERATURAS ALTAS
La primera respuesta
de las plantas al impacto del estrés por temperatura alta se traduce
en una reducción en la duración de todas las etapas de desarrollo,
además de causar reducciones en el tamaño de sus órganos
y finalmente disminuir el rendimiento (11).
Las plantas sólo pueden desarrollarse entre sus umbrales térmicos
o temperaturas mínimas y máximas, variando según la especie
y se maximiza cuando se presentan temperaturas óptimas (17, 41, 42, 43).
Se ha demostrado que incrementos de temperatura están asociados con pre
y postcosecha como quemaduras y abscisión de las hojas, ramas y tallos,
la senescencia foliar, disminuyendo el crecimiento radicular, abortos florales
y caída de frutos, decoloración y reducciones del rendimiento
(9).
Las temperaturas altas afectan el desarrollo de las plantas de tomate, causando
serios daños en las estructuras reproductivas, lo que trae como consecuencia
excersiones estigmáticas que dificultan el cuajado de los frutos y la
disminución de la producción (2, 44) de ahí que éste
constituya uno de los factores más importantes que inciden en la baja
producción de tomate en ambientes tropicales (15, 41, 45).
La temperatura promedio óptima para el cultivo se encuentra entre 21-24
oC (9), en dependencia de la etapa de desarrollo de la planta y las
temperaturas sólo unos pocos grados por encima del rango óptimo
pueden reducir la producción de frutos y la formación de semillas
(10, 17, 41). De modo que, temperaturas diurnas promedio superiores a 32 oC
y temperaturas nocturnas promedio mayores de 21 oC disminuyen la
producción de tomate (8, 9). Al igual que en otros cultivos, en el tomate
los órganos reproductivos son generalmente más sensibles al calor
que los órganos vegetativos (4, 46, 47, 48).
El incremento de las temperaturas en tomate afecta casi todos las etapas de
desarrollo del polen, tanto en órganos femeninos como masculinos, pero
sin dudas la mayor afectación se produce en la fase de meiosis, donde
se dificultan, tanto la viabilidad como la cantidad de polen producido (2, 4,
41, 43, 49), aspecto que se ha señalado en numerosos trabajos (42, 43,
49), en los que se ha informado que cuando el polen se produce a temperaturas
superiores a 35 oC, se reduce su viabilidad, respuesta que varía
de un cultivar a otro (4, 11, 17).
Ahora bien, el período crítico de desarrollo de las plantas de
tomate en presencia de temperaturas altas se encuentra entre 8-13 días
anteriores a la antesis, lo cual se asocia a cambios en el desarrollo de las
anteras, irregularidades en la epidermis y endotecio, además de la pobre
formación del polen (41, 43), existiendo mayor afectación en la
microsporogénesis que en la megasporogénesis (50). Durante el
desarrollo del polen, los carbohidratos solubles presentes en las esporas pueden
consumirse inmediatamente o ser polimerizados y transformados en otras moléculas,
por lo que en presencia de estrés de calor, una disminución de
la concentración de almidón tres días antes de la antesis,
provoca disminuciones en la concentración de azúcares en los granos
de polen maduros, lo que puede contribuir a una disminución de la viabilidad
del polen (43, 49, 50, 51).
A las temperaturas altas también se le atribuye un efecto adverso sobre
el crecimiento del tubo polínico, viabilidad del óvulo, las posiciones
de los estigmas, la germinación y la fertilidad del polen, la formación
del endospermo y el desarrollo del embrión, lo que provoca un menor número
de frutos por planta (43). De igual modo estas pueden afectar la receptividad
del estigma y son causa de fallos en la fructificación (5, 18) y del
incremento de la partenocarpia en los frutos de tomate (2, 8).
No todas las accesiones presentan fallos en la fructificación o cuajado
de los frutos por disturbios en la formación de los gametofitos, algunas
plantas alcanzan gran desarrollo vegetativo, pero se reduce el número
de racimos y el número de flores por racimo e inclusive estas no aparecen;
asimismo ,disminuye el número máximo de frutos que puede producir
la planta, aumentando también el riesgo de malformaciones (19, 52).
Diversos autores han señalado la presencia de malformaciones en flores
formadas, que pueden provocar la ruptura del cono anteridal, ocasionando que
las anteras se separen del estilo y se dificulte con ello la llegada del polen
al estigma, provocando abortos florales (8, 43, 50).
Otro fenómeno manifestado por el incremento de las temperaturas es la
exsersión estigmática, provocado por el crecimiento de los estambres,
pues se ha demostrado que el pistilo responde poco a las variaciones ambientales
(44). Este fenómeno se asocia a fallos del cuajado del fruto por dificultad
del polen para alcanzar el estigma y se agrava cuando a las temperaturas altas
se le une una baja iluminación (44). Asimismo, se incrementan las abscisiones
florales y muchas flores producen frutos partenocárpicos (10, 42), hecho
que se correlaciona fuertemente con la exsersión del estilo, de manera
que no se producen frutos cuando el estilo se pronuncia más de 1 mm fuera
del cono anteridal (10, 17). En este ambiente se reducen además, el porcentaje
de fructificación, el número, la masa de los frutos y el contenido
de semillas (17, 18, 45, 49, 53).
Uno de los indicadores más importantes de tolerancia al calor en el cultivo,
lo constituye la capacidad de fructificación en las temperaturas nocturnas
altas, de manera que se ha señalado que aquellos cultivares que muestren
mayor capacidad para la fructificación bajo temperaturas y humedad altas,
resultan las más adecuadas para la producción del tomate en los
trópicos (15, 17, 42, 49).
El número de frutos por planta constituye uno de los principales componentes
del rendimiento y se encuentra correlacionado con el mismo y con la capacidad
de cuajado, de ahí que se ha destacado la importancia de este indicador
en la selección para incrementar los rendimientos del tomate en las siembras
de verano, siendo de gran ayuda en la identificación de cultivares tolerantes
al calor (45).
Dentro de este contexto, los cultivares de tomate mejorados en áreas
templadas presentan con frecuencia fallos en el cuajado de los frutos cuando
se siembran en zonas tropicales, fundamentalmente en el período de verano
(45). Se hace necesario contar con programas de mejoramiento encaminados a obtener
cultivares que se desarrollen en estas condiciones y que presenten, en lo posible,
una serie de características favorables como la mayor dehiscencia del
polen o la mayor apertura del estambre y el saco polínico; la ausencia
de exsersión del estigma, endotecio bien organizado y normal; la ausencia
de rajadura del cono de la antera; el gran número de semillas por fruto,
como medida de la viabilidad de los gamentos; la alta viabilidad del polen y
del óvulo; la alta tasa de crecimiento del tubo polínico, lo que
sin dudas aliviará los efectos nocivos de las temperaturas altas en la
producción fuera de época de tomate en los trópicos (6,
15, 17, 43).
Aunque la mayor afectación del tomate a temperaturas altas es el pobre
cuajado de los frutos, no menos importante resultan los daños producidos
en los frutos maduros, los cuales están más propensos a infecciones
y rajaduras, son frutos blandos y con poco valor comercial (44, 45).
ASPECTOS
FISIOLÓGICOS Y BIOQUÍMICOS RELACIONADOS CON LA TOLERANCIA AL CALOR
La mayor parte
de los organismos, incluidas las plantas, están constantemente expuestos
a cambios bruscos de temperatura que causan estreses, los que pueden ser, a
corto plazo o crónicos. Se considera que el estrés por calor se
produce cuando hay incrementos de la temperatura por encima del óptimo
fisiológico y pueden causar varias lesiones en la planta, dependiendo
de la intensidad (temperatura en grados), duración y velocidad de aumento
de la temperatura. A temperaturas muy altas puede ocurrir lesiones celulares
graves dentro de minutos, e incluso provocar la muerte celular de las plantas,
debido al colapso de la organización celular. En temperaturas moderadamente
altas las lesiones y la muerte celular son, en su mayoría, a causa de
la exposición a largo plazo.
Por lo general, las temperaturas altas interfieren con la homeostasis normal
de las células, mediante la producción de los cambios en la fluidez
y permeabilidad de la membrana (54), en el plegamiento de las proteínas
de las vías metabólicas (40, 55, 56, 57, 58, 59) el período
de actividad fotosintética (57, 60). A nivel de planta completa, hay
una tendencia general a reducir el tamaño de la célula, cerrar
los estomas y disminuir la pérdida de agua, mientras que alteraciones
subcelulares en los cloroplastos conducen a un deterioro significativo de la
fotosíntesis (61).
En general, la pérdida de la actividad de las enzimas se debe al debilitamiento
de las interacciones electrostáticas e hidrofóbicas que estabilizan
su configuración nativa, de manera tal, que las especies tolerantes al
calor poseen mayor cantidad de enzimas resistentes a temperaturas elevadas y
viceversa (2, 4, 48).
El calor produce efectos desfavorables en las reacciones fotoquímicas
primarias; hay pruebas de que la Rubisco y otras enzimas del metabolismo del
carbono se afectan ante el estrés, siendo la luz y otros factores ambientales
capaces de incrementar la tolerancia al calor en plantas (31, 32, 58, 61). En
estas condiciones se puede inhibir la actividad del fotosistema II (PSII), el
cual es el más termolábil de la cadena de transporte electrónico,
por lo que la fotosíntesis puede ser completamente inhibida por las temperaturas
altas antes de que otro síntoma sea detectado (54, 59, 62).
Es por ello que diversos estudios sugieren que es la fotosíntesis el
proceso fisiológico más afectado por la temperatura alta y que
su afectación depende de la estabilidad de los cloroplastos para mantener
las reacciones fotosintéticas activas y de la velocidad de síntesis
de la clorofila (59, 63, 64).
Las altas temperaturas también afectan el metabolismo de los carbohidratos,
considerado este carácter como una de las estrategias de las plantas
para tolerar el estrés ambiental (65, 66). Estas condiciones además,
disminuyen la fluorescencia de clorofila y ocasionan cambios en el citoplasma,
afectando la estructura de las proteínas u otros polímeros como
el ADN (ácido desoxiribonucleico) o ARN (ácido ribonucleico) (57,
61).
Los estreses medioambientales, en general, pueden distorsionar el metabolismo
celular normal y afectar el balance de la producción de radicales libres,
disminuyendo la capacidad fotosintética de las plantas (32, 58), existiendo
evidencias de que plantas aclimatadas a temperaturas altas se asocian con el
estrés oxidativo por incrementos en la expresión del sistema antioxidante
(38, 61), de manera tal, que en estas condiciones aparecen modificaciones en
la actividad de enzimas como peroxidasas (Prx), catalasas (CAT), superóxido
dismutasas (SOD) y ascorbato oxidasas (AO) (19, 50, 67).
De hecho, se ha señalado que estas enzimas son vitales para la supervivencia
de organismos aeróbicos, pues pueden prevenir la peroxidación
de la membrana y otros tipos de daños, siendo necesarias en el mecanismo
de defensa de las plantas, de ahí la importancia de utilizarlas como
indicadoras de tolerancia a temperaturas altas (67, 68).
El sistema antioxidante no es el único que se afecta por incrementos
de temperaturas, de hecho, en estas condiciones se alteran también los
sistemas anhidrasa carbónica (AC), esterasa (Est), fosfatasas ácidas
(Aps), amilasa (Amy), aspartato amino transferasa (Got), fenil amino liasa (PAL),
formiato deshidrogenasa (Fdh), poligalacturonasas y las deshidrogenasas en general
(69, 70). Diversos estudios han señalado la utilidad de evaluar estas
enzimas como indicadores de la tolerancia al calor en plantas (69, 70, 71),
pero sin dudas, el método más utilizado como un estimado de la
termotolerancia celular en plantas es el de viabilidad celular, el cual evalúa
la cadena de transporte electrónico mitocondrial, basado en el principio
de la reducción de la sal de tetrazolio a formazán por acción
de las enzimas deshidrogenasas (71).
Se ha identificado, además, una amplia gama de metabolitos capaces de
mitigar los efectos deletéreos del estrés oxidativo que acompañan
a muchas situaciones ambientales hostiles como el estrés por calor. En
este grupo se incluyen osmoprotectores como prolina, glicina-betaína,
poliaminas, malondialdehído, trehalosa, manitol, etileno, ácidos
salicílico y jasmónico y antioxidantes como glutation, ascorbato
y tocoferoles, los que actúan como solutos osmóticos, incrementando
el potencial osmótico de la célula (36, 57, 72, 73). Igualmente,
se plantea que varios reguladores del crecimiento vegetal, tales como ácido
abscísico (ABA), ácido salicílico (SA), etileno, citoquininas,
auxinas y los brasinoesteroides desempeñan un papel importante en la
termotolerancia de las plantas (40, 74, 75, 76).
A nivel génico, los estreses abióticos pueden causar rearreglos
genéticos, pues las células expuestas al estrés afectan
los patrones de metilación que alteran la heterocromatina, resultando
en cambios en la expresión génica. Además, la desmetilación
de los transposones puede activar la expresión de tramposazas activas
y conllevar a la transposición de elementos genéticos móviles
y no móviles que tienen una variedad de efectos, entre los que se encuentran
la activación o desactivación de genes; la captura de una porción
de un gen; la co-supresión de actividad génica y la disminución
de la trascripción, por lo que los rearreglos génicos resultado
del estrés, pueden ser la principal fuente de variación genética
(23, 50). Asimismo, ocurre una disminución en la concentración
de determinados azúcares neutros como la galactosa, cambios en el color
de la piel de los frutos, afectaciones en la degradación de la clorofila
interna, inactivación de muchos tipos de proteínas, resultando
en daños, seguidos por el ataque de las proteasas, lesiones y mutaciones
de ácidos nucleicos (50, 51, 61, 77), aí como la síntesis
de licopeno (7).
En tomate se ha informado que la temperatura se manifestaba con un cambio en
la toma de oxígeno y del coeficiente respiratorio, así como por
un incremento en la actividad de las deshidrogenasas, de modo que, temperaturas
subletales producen serios daños en la actividad funcional del sistema
respiratorio. De hecho, según estos autores, la reorganización
del proceso respiratorio parece ser un elemento necesario, porque para lograr
una mayor tolerancia al calor se requiere de ciertas cantidades de energía,
existiendo, por lo tanto, una estrecha relación entre el nivel de termotolerancia
y el intercambio gaseoso por respiración en plantas (9, 61).
A su vez, en el desarrollo del grano de polen y las anteras, se han observado
desbalances en los contenidos de prolina, poliaminas y carbohidratos en condiciones
de estrés de calor a 32-36 oC de corta y prolongada duración
asociados a fallos en la fructificación (49, 78); mientras que temperaturas
de 38 oC provocan reducciones de la germinación del polen
y crecimiento del tubo polínico, debido a reducciones en los contenidos
de espermidina y espermina y azúcares solubles, una pobre asimilación
del almidón en la formación de los granos de polen y en su maduración
(25, 43, 49). Por lo tanto, las diferencias entre los cultivares pudieran, además,
estar asociada a la diferente capacidad de regular estas vías metabólicas
y fisiológicas. Se ha demostrado que las líneas de tomate tolerantes
al calor son capaces de mantener invariable el contenido de carbohidratos y
un adecuado desarrollo de los granos de polen, inclusive cuando se exponen a
los regímenes prolongados de temperaturas altas (59, 79).
Otros resultados han indicado que a 35 oC en el cultivo ocurren incrementos
en la concentración de fenoles en las plantas, por activación
de su biosíntesis e inhibición de la oxidación, así
como disminuciones de las actividades Prx, Cat, Guayacol peroxidasa, ascorbato
peroxidasa (APrx), dehidroascorbato reductasa, gluatation reductasa (GR) y polifenol
oxidasa (PPO) (27, 67, 70).
Se ha encontrado, además, mayor acumulación de peróxido
de hidrogeno e incrementos en la actividad PAL, SOD y en compuestos antioxidantes
(ascorbato, dehidroascorbato, glutatión reducido y oxidado), inhibición
del ciclo ascorbato/glutatión y la rotura oxidativa (67).
Al respecto, se debe señalar que estudios de sequía en el cultivo
sugieren que se considere a la actividad SOD como herramienta de tamizaje para
el desarrollo de cultivares de tomate tolerantes a la sequía y a otros
estreses medioambientales (80).
En resumen, las plantas están sometidas frecuentemente a situaciones
desfavorables para su funcionamiento óptimo ocasionados por el medio
ambiente, estos estreses han ejercido una gran presión selectiva sobre
las plantas a lo largo de la evolución, lo cual ha provocado, mediante
mecanismos de selección natural, la adaptación de las plantas
al medio.
LA MEMBRANA
CELULAR Y SU PAPEL EN LA TERMOTOLERANCIA
Los mecanismos
fisiológicos relacionados con los daños por las temperaturas altas,
aparecen al nivel de la organización estructural, por lo que sus síntomas
están asociados, fundamentalmente, con la pérdida de integridad
de las membranas, lo cual causa daños en el proceso fotosintético
primario, cambios en la fosforilación, estructura de los tilacoides,
composición de la fase bicapa de los lípidos y desnaturalización
de proteínas, siendo por tanto, las membranas las más afectadas
por este estrés, considerándoseles como el sitio primario de daños
por el calor (2, 13, 60).
Las membranas muestran un fino ordenamiento molecular capaz de captar selectivamente
unas sustancias respecto a otras, de recibir, traducir y amplificar señales,
de regular vectorialmente el flujo y la concentración de diversas sustancias
por medio de sistemas de bombas y transportadores, de disponer de canales iónicos
específicos con puertas de regulación fisiológica del flujo
y de poseer un orden complejo de potenciales de membrana (81), por lo que la
pérdida de la integridad de las mismas resulta en la ruptura de la membrana
celular, daños en su estructura, un incremento de la permeabilidad y
eflujo de electrolitos, por lo que se reduce la actividad fotosintética
y mitocondrial (37, 68).
La capacidad de tolerancia de las plantas a la temperatura alta, involucra una
serie de reacciones y mecanismos complejos, siendo la membrana celular uno de
los componentes principales de la termotolerancia y, por tanto, un buen indicador
de tolerancia al calor (68). Los efectos ocasionados por la temperatura alta
pueden llegar a determinarse mediante la técnica de termoestabilidad
de la membrana celular (TMC), la cual se ha utilizado ampliamente para evaluar
la conducta de las plantas sometidas a estos estreses en diversos cultivos y
cuantificar el nivel de termotolerancia adquirida en plantas (68, 82, 83, 84,
85).
El método de la termoestabilidad de la membrana celular (TMC) se fundamenta
en la difusión de electrolitos, desde la célula del tejido foliar
al medio acuoso. En presencia de estrés por temperaturas altas se incrementa
la permeabilidad de la membrana, de esta forma la cantidad de electrolitos que
efluyen producto de daños celulares, puede ser medida por la conductividad
eléctrica de la solución y expresada en pocentajes, lo cual facilita
su interpretación (82, 83). Varios estudios han sugerido la efectividad
de esta técnica en la detección de variabilidad genética
para tolerancia al calor en tomate (6, 86).
Algunos autores sugieren que la capacidad de algunas plantas para tolerar a
una temperatura alta, está estrechamente correlacionado con el potencial
genético que posean para esta característica (68, 82). Diversas
investigaciones informan que la TMC en condiciones de temperatura alta está
controlada por un grupo reducido de genes y además, se ha encontrado
variabilidad genética en diferentes cultivos, lo cual sugiere que este
carácter podría ser utilizado como un criterio de selección
en la búsqueda de materiales tolerantes a este estrés (68, 81).
Esta idea corrobora que la eficacia de la selección para un rasgo determinado
y en específico para la TMC, depende de la magnitud relativa de las diferencias
fenotípicas y genotípicas de una misma población haciendo
mención, asimismo, de que existen muy pocos estudios y, por ende, avances
en la selección sobre la base de este criterio (87).
Se determinó que existe una correlación alta entre mediciones
de termoestabilidad de la membrana celular durante la etapa vegetativa y la
etapa reproductiva temprana bajo condiciones controladas. Esto sugiere que el
uso apropiado del método de la TMC en la fase vegetativa, puede ser de
gran utilidad para identificar genotipos tolerantes a temperatura alta durante
etapas tempranas del crecimiento, por lo que podría ser un buen criterio
de selección para genotipos tolerantes al calor, ya que contempla la
variabilidad genética existente en las plantas (68, 81).
PROTEÍNAS
DE CHOQUE TÉRMICO (HSP) Y SU PAPEL EN LA TERMOTOLERANCIA
La respuesta al
choque térmico está asociada a la síntesis de un grupo
particular de proteínas denominadas Proteínas de Choque Térmico
o Heat Shock Proteins (HSP), que resultan de la transcripción de los
genes hs. Estas proteínas son sintetizadas cuando la síntesis
de la mayor parte de las proteínas normales se reprime (88, 89, 90).
La inducción de estas proteínas incrementa la termotolerancia
de las plantas, permitiendo que los tejidos puedan soportar las exposiciones
a las temperaturas que previamente resultaban letales; sin embargo, el papel
preciso de muchas de las HSPs en la termotolerancia permanece incierto (91).
Las HSPs se involucran en el plegamiento de proteínas; por ejemplo, la
recuperación de proteínas agregadas o plegadas incorrectamente,
actividad que explica su papel en el estrés térmico. Las HSPs
también pueden jugar un papel en el crecimiento y el desarrollo en las
condiciones ambientales normales (92). La acumulación rápida de
HSP en órganos susceptibles puede jugar un papel importante en la protección
del aparato metabólico de las células, por tanto, actúa
como un factor clave en la adaptación y supervivencia de las plantas
en condiciones de estrés por calor (9, 91).
La respuesta al estrés de calor en plantas se caracteriza por la síntesis
de seis clases de proteínas conservadas, las que se nombran según
su masa molecular HSP100, HSP90, HSP70, HSP60, proteínas de masa molecular
baja (sHSP) y HSP8.5 del grupo de las ubiquitinas (93). Las sHSP presentan una
masa molecular que oscila entre 15-30 kDa, aproximadamente y pueden ser divididas
en, al menos seis familias que codifican para varias proteínas localizadas
en el citosol, núcleo o diferentes organelos (cloroplastos, retículo
endoplasmático y mitocondrias (40, 91, 94).
En plantas superiores, las HSPs son generalmente inducidas a 38-40 oC
(70) y parece dispararse a una temperatura que, por lo regular, se encuentra
entre 10-15 oC por encima de la temperatura normal de crecimiento
del organismo. Por encima de esa temperatura, la síntesis de proteínas
totales disminuye precipitadamente y sólo se sintetizan las proteínas
HSP (61, 95).
En general, las HSPs tienen funciones importantes como proteínas “chaperonas”,
además de sus funciones en el plegamiento de proteínas después
de la traducción y en la transformación de las proteínas
a estructuras transportadoras en la membrana, están profundamente involucradas
en la resistencia a temperaturas altas y a otros tipos de estrés (51,
70, 89, 90, 96, 97). Se ha demostrado que las HSPs producidas durante el estrés
permanecen en la célula varias horas después de este y que los
tejidos a los que previamente se les aplica un choque térmico y sintetizan
HSPs, pueden sobrevivir a un posterior tratamiento con calor mientras que en
otros casos puede ser letal (61, 90, 97), lo cual indica que la presencia de
HSPs es esencial para la termotolerancia (51, 56, 89).
Algunas de las HSPs no son únicas del estrés por temperaturas
altas, ellas se han inducido ante otros estímulos, entre los que se destacan
el estrés hídrico, de salinidad y por temperaturas bajas, el etanol,
etileno, dinitrofenol, compuestos de arsenito y otros agentes químicos,
así como en presencia de los ácidos abscísico, jasmónico
y salicílico (27, 70, 98).
Las HSPs pueden jugar un papel específico en la alteración o mantenimiento
de las proteínas, la prevención de la desnaturalización
y su función reparadora, como parte de su respuesta fisiológica
a diversos estreses medioambientales.
Es por ello que las HSPs juegan un papel fundamental en la protección
de las proteínas y membranas celulares contra daños irreversibles
causados por el estrés. Se ha demostrado que las mismas participan en
la generación de la tolerancia al calor, lo cual probablemente se lleve
a cabo protegiendo a las enzimas esenciales y los ácidos nucleicos de
la desnaturalización provocada por el calor. Sin esta protección,
los ácidos nucleicos podrían ser fragmentados por los iones metálicos
específicos, que desde el exterior (o desde la vacuola) entran al citoplasma
a medida que las membranas se hacen más permeables (91). Las HSPs están
altamente conservadas en todos los organismos y tienen un papel esencial en
la función celular (23, 40, 50).
En muchas especies de plantas se ha encontrado una relación positiva
entre las HSPs y con la estabilidad térmica de la membrana celular, el
uso eficiente de agua y la fotosíntesis, así como con la tolerancia
al calor en la planta completa (9, 51, 90, 99). Además estas proteínas
se han relacionado con las especies reactivas de oxígeno (ROS), lo que
corrobora la hipótesis de que durante la evolución, las plantas
son capaces de suprimir las ROS o pueden utilizarlas como señales moleculares
para inducir HSP (96).
Al respecto se ha señalado que la mejor aclimatación ocurre cuando
el estrés por temperatura alta ocurre gradualmente en lugar de un cambio
repentino en la temperatura (38). De hecho existen evidencias que demuestran
que las HSPs incrementan la sobrevivencia al estrés oxidativo (9, 50,
91), lo que sugiere la existencia de una comunicación entre la expresión
de HPSs y el estímulo oxidativo, lo cual puede constituir la base de
la tolerancia cruzada entre estos tipos de estrés. Por otro lado, los
genes de las proteínas de choque térmico (hsp17, hsp83, hsp101,
entre otras) pueden inducirse por la ROS, H2O2 (100).
En tomate diferentes proteínas se inducen por tratamientos térmicos
a hojas, flores y frutos, dentro de las que se encuentran las hsp21, también
denominada TOM111 y Lehsp23.8 (101). Estas se localizan en el cloroplasto y
mitocondrias, respectivamente. Asimismo se han identificado proteínas
chaperonas de las clases HSP70 y HSP90 (90).
Se ha estudiado la función de HSP100 en respuesta al estrés por
calor, demostrándose que un amplio rango de especies sintetiza proteínas
de alrededor de 100 kDa de manera constitutiva en presencia de estrés
de calor, las cuales están involucradas en la termotolerancia de los
organismos (102). Estas proteínas desempeñan funciones celulares
importantes como proteínas “chaperonas”, incluyendo la supervivencia
en condiciones de estrés (49, 102).
Se sugiere que las HSP100 son requeridas para la sobrevivencia durante períodos
cortos de tiempo a temperaturas extremas, ayudando a prevenir la agregación
y la desnaturalización de proteínas a temperaturas altas y, por
lo tanto, a limitar los daños inducidos en las células por el
calor (49, 50, 70). En el cultivo se ha demostrado que los niveles de transcriptos
de HSP101 se incrementan en granos de polen maduros, en respuesta al estrés
térmico, incrementando la termotolerancia de los granos (49).
FACTORES
DE TRANSCRIPCIÓN INVOLUCRADOS EN LA TOLERANCIA AL CALOR
La transcripción
de los genes HSP y otros genes relacionados con las adaptaciones de las plantas
al estrés es controlada por proteínas reguladoras llamadas factores
de choque térmico (HSF), las que en estado inactivo se localizan en el
citoplasma (91, 103, 104). En ocasiones, la expresión constitutiva de
HSFs incrementa la termotolerancia basal sin afectar la termotolerancia adquirida
o inducida, por lo que se consideran los activadores transcripcionales del choque
térmico (43, 90, 91, 94, 103). Los HSF se clasifican en tres clases de
acuerdo a sus diferencias estructurales y sus sitios de unión (HsfA,
tales como HsfA1 y HsfA2; HsfB, la que incluye HsfB1 en tomate y HsfC) (56,
105).
Generalmente, la primera etapa de la respuesta al estrés abiótico
es la percepción de las señales de estrés por los receptores
de la pared celular, seguido por el evento de transducción que involucra
segundos mensajeros como el Ca2+ citosólico, el ABA y las kinasas que
conllevan a la activación de factores de transcripción específicos
y elementos que actúan en cis (25, 75).
Los factores de transcripción (FTs) juegan un papel central en la elaboración
de la respuesta ambiental y el programa morfogenético de la planta. Se
trata de proteínas que actúan en trans, capaces de reconocer blancos
de secuencias específicas de ADN (elementos cis) localizadas en las regiones
promotoras de determinados genes. La regulación de la expresión
génica está gobernada en gran medida por la interacción
de los FTs con esta clase de elementos cis, induciendo o reprimiendo distintas
vías de transducción de señales, a través de un
efecto dominó (23, 25).
En plantas, se han identificado y caracterizado numerosos genes que codifican
FTs. Los FTs vegetales se clasifican en familias y subfamilias, de acuerdo al
grado de conservación de la secuencia de aminoácidos, al tamaño
y a la composición estructural de los genes codificantes. Sin embargo,
en plantas, no más de un 10 % de estas secuencias han sido aisladas y
estudiadas fehacientemente, asignándoles la función de FT a las
proteínas codificadas. Además se debe tener en cuenta que la similitud
entre proteínas de organismos que pertenecen a distintos reinos, no necesariamente
implica que se encuentren involucradas en la regulación de los mismos
eventos (23, 25, 40).
En las estrategias donde los FTs se sobreexpresan o se silencian; se ha observado
que las plantas transformadas presentan respuestas modificadas por las condiciones
medioambientales, tanto por la acción de factores bióticos como
abióticos (105, 106). En algunos casos la duplicación o triplicación
de genes que codifican proteínas de tipo WRKY, provoca la falta de respuesta
en mutantes silenciados. En otros, se obtuvieron plantas con respuestas mejoradas
a distintos tipos de estrés, corroborando la hipótesis de que
los factores de transcripción actúan simultáneamente en
diferentes vías de señalización (23, 94).
La utilización de promotores inducibles en reemplazo de los constitutivos
presenta una alternativa viable. Cuando se modifican los factores adecuados,
la morfología y el proceso de desarrollo se tornan indistinguibles de
las plantas controles sin transformarse, alcanzando buenos niveles de tolerancia
(107).
En tomate se demostró que HsfA1a actúa como regulador de la respuesta
al estrés por calor. La supresión de HsfA1a reduce fuertemente
la capacidad de estas plantas de sobrevivir a temperaturas altas (4, 90, 108).
Tanto en Arabidopsis como en tomate los HsfA2 se acumulan a niveles bastante
altos después de múltiples ciclos de PCR y recuperación
(43, 109).
Se ha demostrado que la sobreexpresión del gen LeFAD3 (ácido omega-3
desaturado) incrementa la tolerancia al frío en plantas transgénicas
de tomate (110). De manera similar ocurre con la sobreexpresión del ácido
omega-3 saturado (FAD3, FAD7) (111). Por el contrario la represión de
LeFAD3 incrementa la saturación de los ácidos grasos, alivia la
fotoinhibición del fotosistema II e incrementa la tolerancia al estrés
de calor (57). Asimismo, se ha demostrado que la expresión de Spodoptera
frugiperda (J.E. Smith) SfIAP, un inhibidor de la familia de proteínas
relacionadas con la apoptosis en plantas transgénicas de tomate, confieren
tolerancia a estreses abióticos como calor y salinidad (112).
Otro grupo de proteínas involucradas en la tolerancia de las plantas
a estrés abióticos son las MAPKs kinasas (proteínas kinasas
activadas por mitógenos, del inglés Mitogen-activated protein
kinase). Se plantea que en diversas condiciones de estrés la cascada
MAPK se activa en plantas (113), por lo que manipulando la expresión
de esas kinasas en plantas transgénicas de tomate se podría incrementar
la tolerancia a diversos estreses abióticos (25).
GENÉTICA
DE LA TOLERANCIA AL CALOR EN TOMATE
El desarrollo
de cultivares de tomate tolerantes al calor es deseable para la producción
de tomate en las regiones tropicales donde las temperaturas alcancen los 35
oC.
Sin embargo, el mejoramiento para estrés de calor en el tomate es una
tarea difícil, en parte debido a la complejidad de las características
relacionadas con la tolerancia al calor y, por otra parte, debido a la heredabilidad
de baja a moderada de estos caracteres (9, 11).
Otro inconveniente que se presenta es que las líneas tolerantes al calor
tienden a producir frutos más pequeños que los que son comercialmente
aceptables y con pobre cubierta foliar (9, 11, 43). Es por ello que para superar
estos obstáculos se recomienda utilizar en los diferentes programas de
mejoramiento genético aquellos genotipos capaces de fructificar a temperaturas
altas, los cuales deben ser cruzados con genotipos de frutos grandes y vigorosos
(7, 11).
Se han realizado varios estudios de herencia del cuajado de los frutos, por
ser este carácter uno de los más afectados en condiciones de temperatura
alta. Se informó que la herencia de este carácter en esas condiciones
es dominante, con efectos aditivos y heredabilidad moderada (h2) (11, 15, 19).
Los resultados de heredabilidad indican que se necesita un alto grado de homocigosis
para predecir el progreso por selección en cruces de tomate, con vistas
a obtener cultivares tolerantes a este estrés abiótico, mediante
cruzamientos; de manera tal, que la selección será efectiva si
se realiza en generaciones más avanzadasA
(>F5) (15).
En un análisis dialélico utilizando varios genotipos de tomate
tolerantes y susceptibles al calor, se determinó que la fertilidad del
polen y la producción de frutos a temperaturas altas presentaban, fundamentalmente,
un control genético aditivo (11, 114).
Altos valores de heredabilidad se obtuvieron en estudios de termoestablidad
de la membana celular y viabilidad celular por reducción del TTC en el
cultivoA, lo cual indican que estos caracteres tienen poca influencia ambiental.
Se detectó la presencia de efectos de dominancia y epistasis, aunque
no dejó de ser apreciable la porción de la varianza fenotípica,
debido a la varianza aditiva que podrá ser explotada en los programas
de mejoramiento de la especie.
La existencia de efectos aditivos y de dominancia sobre la expresión
de estos caracteres sugiere que una parte de la variación genotípica
es heredable y otra no, por lo que estos métodos pueden ser efectivos
en el tamizaje de accesiones en un banco de germoplasma, en la selección
de líneas para la obtención de híbridos con tolerancia
al calor y en los programas para la obtención de nuevos cultivares en
la selección de los progenitores para los cruces y en generaciones avanzadas
(F5-F7), cuando las líneas tengan un alto grado de homocigosis.
La inclusión de estos caracteres en la mejora genética pueden
complementar los métodos empíricos y así incrementar la
eficiencia en la selección, asegurando genes de tolerancia al calor que
pudieran perderse por los procedimientos tradicionales, los que involucran un
gran número de plantas en la selección de caracteres, que generalmente
tienen heredabilidades bajas (13, 21, 115).
La ventaja de la naturaleza dominante de la capacidad de cuajado del fruto es
que se pueden obtener híbridos F1 entre los padres tolerantes y susceptibles
al calor. En este enfoque, los defectos de los padres tolerantes al calor, tales
como la susceptibilidad a plagas, frutos pequeños y pobre cobertura del
follaje, podría ser al menos parcialmente mejorado con los cultivares
susceptibles al calor que se utilicen para la producción de híbridos
(2, 21, 116).
A pesar de las dificultades presentadas en la transferencia de las características
de tolerancia al calor en el tomate, se han desarrollado y liberado varias líneas
mejoradas, así como cultivares híbridos con tolerancia al calor
y características hortícolas aceptables (9, 11, 53, 117). El problema
del tamaño de los frutos pequeños se ha superado con la producción
de híbridos F1 obtenidos mediante el cruce de cultivares tolerantes al
calor con fruto pequeño, con líneas susceptibles de frutos muy
grandes. El uso de esos cultivares híbridos ha incrementado la producción
de tomate en zonas tropicales y subtropicales (2, 11, 53). Sin embargo, hay
muy pocos informes de cultivares de tomate tolerantes al calor desarrollados
a través de protocolos tradicionales.
En general, la información sobre la base genética de la tolerancia
al calor es escasa, debido a su naturaleza multigénica, aunque se piensa
que el uso de los protocolos tradicionales en el cultivo, de conjunto con las
técnicas de biología molecular, incluyendo la tecnología
de marcadores moleculares y transformación genética, conlleven
a la caracterización y desarrollo de plantas mejoradas, con tolerancia
al calor.
MEJORA
PARA LA TOLERANCIA AL CALOR
El mejoramiento
genético del tomate para la tolerancia al calor puede ser una solución
económicamente viable para la producción en condiciones de estrés
(9, 43). Los progresos para la mejora en este sentido dependen del entendimiento
de los mecanismos fisiológicos y las bases genéticas de la tolerancia
al estrés en el cultivo a nivel celular, molecular y de planta completa.
Las investigaciones realizadas indican que la mayoría de los ensayos
realizados para evaluar la tolerancia de los cultivos a estrés por temperatura
alta son complejos, controlados por más de un gen y altamente influenciados
por las variaciones ambientales (2, 9, 11, 15). Es por ello, que la cuantificación
de la tolerancia con frecuencia posee serias dificultades.
La selección directa en condiciones de campo se dificulta porque los
factores ambientales son difícilmente controlables, lo cual afecta la
precisión y la repetitividad de esos ensayos. En ocasiones no se pueden
garantizar condiciones de temperatura alta en el campo. La tolerancia al estrés
está regulada, además, por el desarrollo, es específico
de cada etapa, por lo tanto, la tolerancia en una etapa específica de
desarrollo de la planta pudiera no estar correlacionada con la tolerancia en
otra etapa de desarrollo (118). Se ha demostrado que en tomate las etapas más
sensibles al calor son la floración y el cuajado de los frutos, siendo
muy poco afectados cuando las temperaturas diurnas/nocturnas se encuentran por
encima de 26/20 oC y severamente afectadas cuando estas alcanzan
valores superiores a 35/26 oC (119).
Un estudio separado de los componentes genético-fisiológicos y
de desarrollo pudiera proveer un mejor entendimiento de la respuesta de las
plantas al estrés de calor y facilitar el desarrollo de plantas con tolerancia
al estrés a lo largo de su ciclo de vida (9, 118).
Un método comúnmente utilizado para seleccionar plantas con tolerancia
al calor ha sido sembrar materiales mejorados en ambientes de producción
e identificar individuos o líneas con gran rendimiento potencial. En
tales condiciones, la presencia de otros estreses como plagas, ha hecho que
el proceso de selección sea muy difícil, fundamentalmente durante
la etapa reproductiva.
Lo ideal sería identificar un criterio de selección durante las
etapas tempranas de desarrollo de las plantas, el cual pudiera estar correlacionado
con la tolerancia durante la etapa reproductiva. Desafortunadamente, estos no
son criterios fáciles de identificar (9).
Un reto importante en la mejora tradicional de la tolerancia al calor es la
identificación de los métodos de detección fiables y criterios
de selección eficaces para facilitar la detección de plantas tolerantes
al calor. En algunas especies vegetales, como el tomate, se ha observado una
fuerte correlación positiva entre el cuajado y el rendimiento en condiciones
de temperatura alta. Por lo tanto, la evaluación del germoplasma para
identificar fuentes de tolerancia al calor, regularmente se ha llevado a cabo
mediante la detección del cuajado del fruto en condiciones de temperatura
alta (9, 11, 119).
Existen dos herramientas biotecnológicas muy útiles en el estudio
y el mejoramiento de la tolerancia al calor en plantas: La selección
asistida por marcadores moleculares (MAS, del inglés Marker Assisted
Selection) y la transformación genética (Figura).
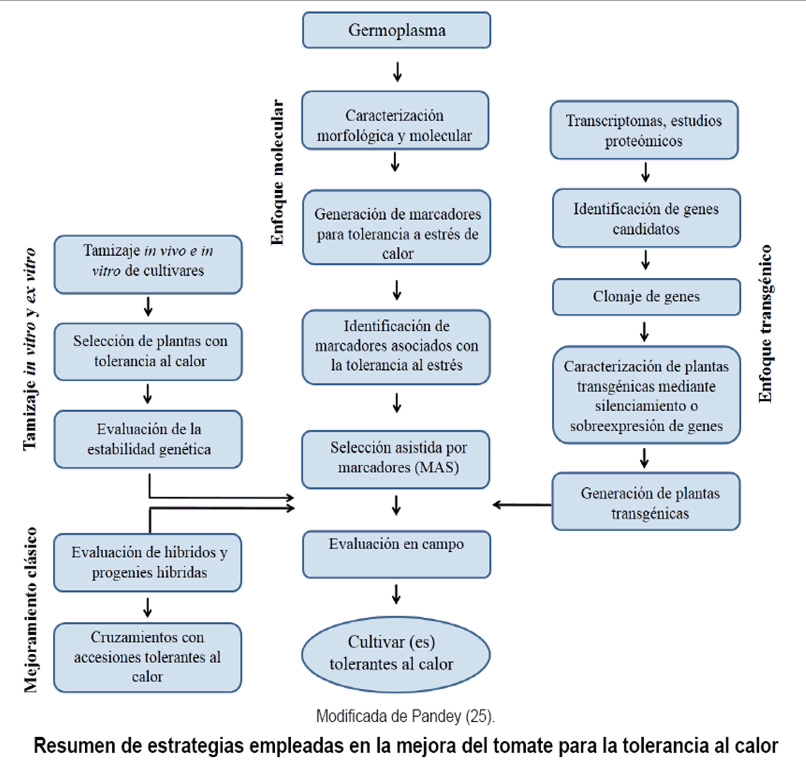
La utilización de estas herramientas ha contribuido, grandemente, a un
mejor entendimiento de las bases genéticas y bioquímicas de la
tolerancia al estrés en plantas y, en algunos casos, han conllevado al
desarrollo de plantas con incrementos en la tolerancia al estrés. Debido
a la complejidad de la tolerancia a estrés abiótico y lo difícil
que resulta la selección por el fenotipo, la MAS se ha considerado como
una herramienta efectiva en este sentido (1, 9).
El uso de estas herramientas requiere de marcadores genéticos que estén
asociados con genes o QTLs que afecten la tolerancia de las plantas al estrés
o de componentes individuales que contribuyan a esto (59, 120, 121).
Muchos son los esfuerzos de diferentes investigadores en varios cultivos con
vistas a identificar marcadores genéticos asociados a estreses medioambientales,
fundamentalmente temperaturas extremas, salinidad y sequia (9); no obstante,
pocas son las investigaciones conducidas para identificar marcadores genéticos
asociados con la tolerancia al calor.
Es por ello que la comprensión de los mecanismos de tolerancia al calor
es importante para diseñar estrategias de mejoramiento en diversos cultivos,
incluido el tomate (25, 103, 122, 123). Sin embargo, pocas herramientas han
sido informadas en tomate para mejorar la tolerancia a estreses ambientales.
En la figura se presenta un esquema que puede ser utilizado con este fin, combinando
herramientas clásicas y biotecnológicas (25).
Se debe destacar que la sobreexpresión y el silenciamiento de genes por
ingeniería genética que codifican para osmoprotectores, transportadores
de iones o enzimas antioxidantes en tomate, constituyen un paso de avance para
incrementar la tolerancia al calor en el cultivo.
Desafortunadamente, los progresos en esta dirección dependen de futuros
genes que se descubrirán por estudios proteómicos y de transcriptomas,
los cuales podrán conducir a un entendimiento más completo de
los procesos fisiológicos involucrados en esa respuesta, así como
determinar cuáles promotores o factores de transcripción serán
los más adecuados en las técnicas de transformación genética.
El conocimiento de las bases genético-fisiológicas de la tolerancia
al calor, de conjunto con las técnicas de transformación genética,
permitirán incrementar la tolerancia al calor en los cultivares de tomate
(9, 25).
En resumen, el mejoramiento genético encaminado a la obtención
de líneas, híbridos o cultivares, con adaptabilidad a las temperaturas
altas, se encuentra todavía en su fase inicial. A pesar de toda la complejidad
de la tolerancia al calor y las dificultades encontradas durante la transferencia
de tolerancia, algunas líneas endogámicas y cultivares híbridos
con aceptación comercial se han desarrollado y liberado en tomate (117).
Para acelerar tales avances, las áreas de atención prioritaria
en el futuro deben ser el diseño y el desarrollo de procedimientos de
selección precisos; la identificación y caracterización
de los recursos genéticos en condiciones de temperaturas altas; el discernimiento
de la base genética de la tolerancia al calor en cada etapa del desarrollo
de la planta; el desarrollo y el cribado de grandes poblaciones de mejora, para
facilitar la transferencia de genes a los cultivares comerciales (9, 11, 85).
El uso de técnicas avanzadas de biología molecular pudiera facilitar
el desarrollo de plantas con mayor tolerancia al calor.
CONSIDERACIONES
FINALES
Los recursos genéticos
disponibles para las tolerancia al calor se han identificado dentro de las especies
de Solanum, sección lycopersicon. Sus componentes fisiológicas
y morfológicas se han resuelto y se determinó su base genética
a nivel de toda la planta.
Durante los últimos años, muchas líneas de mejora y cultivares
se han desarrollado con la capacidad alta de cuajado en condiciones de tolerancia
al calor. Muchas de estas líneas también muestran características
hortícolas indeseables, en particular, el tamaño pequeño
del fruto, bajo rendimiento, pobre cobertura del follaje y pedicelo articulado.
Años de investigación en tomate han dado como resultado el desarrollo
de nuevas líneas de mejora con altos rendimientos y cultivares híbridos
con tamaño medio, alta capacidad de cuajado y otros atributos agronómicamente
deseables, relacionados con este estrés abiótico. Sin embargo,
pocas investigaciones se han realizado sobre la base de la genética molecular
de la HTA en el tomate. Esta línea de investigación, así
como la investigación sobre la relación entre la tolerancia a
las temperaturas altas, durante las diferentes etapas de desarrollo de la planta,
deben ser fortalecidas.
Es por ello, que el mejorador de tomate de éxito del futuro será
aquel que sea capaz de combinar tres componentes de la mejora moderna, el arte
del mejoramiento tradicional de plantas; identificar e introgresar genes de
especies silvestres y el acceso y empleo de genes de otras especies, utilizando
las técnicas de ADN recombinante, lo cual conllevará a la búsqueda
de resultados más desafiantes y excitantes de los que han sido logrados
hasta ahora.
Notas al
pie
A
Florido, M. Bases genéticas de la tolerancia del tomate a estrés
abióticos. Informe final de proyecto PNCT, no. 0800129, Inst. INCA, MES,
2012, p. 62.
BIBLIOGRAFÍA
1. Foolad, M.
R. y Panthee, D. R. ‘‘Marker-Assisted Selection in Tomato Breeding’’. Critical
Reviews in Plant Sciences, vol. 31, no. 2, 1 de marzo de 2012, pp. 93-123,
ISSN 0735-2689, DOI 10.1080/07352689.2011.616057.
2. Comlekcioglu, N.; Simsek, O.; Boncuk, M. y Aka, K. Y. ‘‘Genetic characterization
of heat tolerant tomato (Solanum lycopersicon) genotypes by SRAP and
RAPD markers’’. Genetics and molecular research: GMR, vol. 9, no. 4,
2010, pp. 2263-2274, ISSN 1676-5680, DOI 10.4238/vol9-4gmr876.
3. Kamel, M. A.; Soliman, S. S.; Mandour, A. E. y Ahmed, M. S. ‘‘Genetic evaluation
and molecular markers for heat tolerance in tomato (Lycopersicon esculentum
Mill.)’’. Journal of American Science, vol. 6, no. 12, 2010, pp. 364–374,
ISSN 1545-1003.
4. Bita, C. E.; Zenoni, S.; Vriezen, W. H.; Mariani, C.; Pezzotti, M. y Gerats,
T. ‘‘Temperature stress differentially modulates transcription in meiotic anthers
of heat-tolerant and heat-sensitive tomato plants’’. BMC Genomics,
vol. 12, no. 1, 31 de julio de 2011, p. 384, ISSN 1471-2164, DOI 10.1186/1471-2164-12-384.
5. Sharma, K. C. y Verma, S. ‘‘Path coefficient analysis in tomato (Lycopersicon
esculentum)’’. Indian Journal of Agricultural Sciences, vol. 70,
no. 10, 2000, pp. 700-702, ISSN 0019-5022, CABDirect2.
6. Saeed, A.; Hayat, K.; Khan, A. A. y Iqbal, S. ‘‘Heat tolerance studies in
tomato (Lycopersicon esculentum Mill.)’’. International Journal
of Agriculture and Biology, vol. 9, no. 4, 2007, pp. 649–652, ISSN 1560-8530.
7. Prohens, J. y Nuez, F. Vegetables II Fabaceae, Liliaceae, Solanaceae, and
Umbelliferae [en línea]. edit. Springer New York, New York, NY, 2008,
ISBN 978-0-387-74108-6, [Consultado: 29 de noviembre de 2015], Disponible en:
<http://link.springer.com/10.1007/978-0-387-74110-9>.
8. Çömlekçioglu, N. y Soylu, K. M. ‘‘Determination of high
temperature tolerance via screening of flower and fruit formation in tomato’’.
Yüzüncü Yil University Journal of Agricultural Sciences,
vol. 20, no. 2, 2010, pp. 123 - 130, ISSN 1308-7584.
9. Wahid, A.; Gelani, S.; Ashraf, M. y Foolad, M. R. ‘‘Heat tolerance in plants:
An overview’’. Environmental and Experimental Botany, vol. 61, no.
3, diciembre de 2007, pp. 199-223, ISSN 0098-8472, DOI 10.1016/j.envexpbot.2007.05.011.
10. Peet, M. M. ‘‘Physiological disorders in tomato fruit development’’. Acta
Horticulturae, no. 821, marzo de 2009, pp. 151-160, ISSN 0567-7572, 2406-6168,
DOI 10.17660/ActaHortic.2009.821.16.
11. Foolad, M. R. ‘‘Tolerance to abiotic stresses’’ [en línea]. En: eds.
Razdan M. K. y Mattoo A. K., Genetic Improvement of Solanaceous Crops, edit.
Science Publishers, Enfield, USA, 2002, pp. 521–590, ISBN 978-1-57808-179-0.
12. Long, S. P. y Ort, D. R. ‘‘More than taking the heat: crops and global change’’.
Current Opinion in Plant Biology, vol. 13, no. 3, junio de 2010, pp.
240-247, ISSN 1369-5266, DOI 10.1016/j.pbi.2010.04.008.
13. Saidi, Y.; Finka, A. y Goloubinoff, P. ‘‘Heat perception and signalling
in plants: a tortuous path to thermotolerance’’. New Phytologist, vol.
190, no. 3, 1 de mayo de 2011, pp. 556-565, ISSN 1469-8137, DOI 10.1111/j.1469-8137.2010.03571.x.
14. Proveniers, M. C. G. y van Zanten, M. ‘‘High temperature acclimation through
PIF4 signaling’’. Trends in Plant Science, vol. 18, no. 2, 1 de febrero
de 2013, pp. 59-64, ISSN 1360-1385, DOI 10.1016/j.tplants.2012.09.002.
15. Hanson, P. M.; Chen, J. y Kuo, G. ‘‘Gene Action and Heritability of High-temperature
Fruit Set in Tomato Line CL5915’’. HortScience, vol. 37, no. 1, 2 de
enero de 2002, pp. 172-175, ISSN 0018-5345, 2327-9834.
16. Morales, F. J. ‘‘Distribution and Dissemination of Begomoviruses in Latin
America and the Caribbean’’ [en línea]. En: eds. Stansly P. A. y Naranjo
S. E., Bemisia: Bionomics and Management of a Global Pest, edit. Springer Netherlands,
2009, pp. 283-318, ISBN 978-90-481-2459-6, [Consultado: 29 de noviembre
de 2015], Disponible en: <http://link.springer.com/pter/10.1007/978-90-481-2460-2_9>.
17. Peet, M. M.; Willits, D. H. y Gardner, R. ‘‘Response of ovule development
and post-pollen production processes in male-sterile tomatoes to chronic, sub-acute
high temperature stress’’. Journal of Experimental Botany, vol. 48,
no. 1, 1 de enero de 1997, pp. 101-111, ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/48.1.101.
18. Peet, M.; Sato, S.; Clément, C. y Pressman, E. ‘‘Heat stress increases
sensitivity of pollen, fruit and seed production in tomatoes (Lycopersicon
esculentum Mill) to non-optimal vapor pressure deficits’’. Acta Horticulturae,
no. 618, noviembre de 2003, pp. 209-215, ISSN 0567-7572, 2406-6168, DOI 10.17660/ActaHortic.2003.618.23.
19. Grilli, G. V. G.; Braz, L. T. y Lemos, E. G. M. ‘‘QTL identification for
tolerance to fruit set in tomato by AFLP markers’’. Cropp Breeding and Applied
Biotechnology, vol. 7, no. 3, 30 de septiembre de 2007, pp. 234-241, ISSN
1984-7033, DOI 10.12702/1984-7033.v07n03a02.
20. Hazra, P.; Ansary, S. H.; Dutta, A. K.; Balacheva, E. y Atanassova, B. ‘‘Breeding
tomato tolerant to high temperature stress’’. Acta Horticulturae, no.
830, junio de 2009, pp. 241-248, ISSN 0567-7572, 2406-6168, DOI 10.17660/ActaHortic.2009.830.33.
21. Foolad, M. R. ‘‘Genome Mapping and Molecular Breeding of Tomato’’. International
Journal of Plant Genomics, vol. 2007, 22 de agosto de 2007, p. 52, ISSN
1687-5370, DOI 10.1155/2007/64358.
22. Pineda, B.; García, A. J. O.; Antón, T.; Pérez, F.;
Moyano, E.; García, S. B.; Campos, J. F.; Angosto, T. y Morales, B. ‘‘Tomato:
Genomic Approaches for Salt and Drought Stress Tolerance’’ [en línea].
En: eds. Tuteja N., Gill S. S., Tiburcio A. F., y Tuteja R., Improving Crop
Resistance to Abiotic Stress, edit. Wiley-VCH Verlag GmbH & Co. KGaA, 2012,
pp. 1085-1120, ISBN 978-3-527-63293-0, [Consultado: 29 de noviembre de
2015], Disponible en: <http://onlinelibrary.wiley.com/doi/10.1002/9783527632930.ch43/summary>.
23. Shinozaki, K. y Yamaguchi, S. K. ‘‘Gene networks involved in drought stress
response and tolerance’’. Journal of Experimental Botany, vol. 58,
no. 2, 1 de enero de 2007, pp. 221-227, ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/erl164.
24. Schwarz, D.; Rouphael, Y.; Colla, G. y Venema, J. H. ‘‘Grafting as a tool
to improve tolerance of vegetables to abiotic stresses: Thermal stress, water
stress and organic pollutants’’. Scientia Horticulturae, vol. 127,
no. 2, 8 de diciembre de 2010, pp. 162-171, ISSN 0304-4238, DOI 10.1016/j.scienta.2010.09.016.
25. Pandey, S. K.; Nookaraju, A.; Upadhyaya, C. P.; Gururani, M. A.; Venkatesh,
J.; Kim, D.-H. y Park, S. W. ‘‘An Update on Biotechnological Approaches for
Improving Abiotic Stress Tolerance in Tomato’’. Crop Science, vol.
51, no. 6, 2011, p. 2303, ISSN 0011-183X, DOI 10.2135/cropsci2010.10.0579.
26. Peleg, Z.; Apse, M. P. y Blumwald, E. ‘‘Engineering Salinity and Water-Stress
Tolerance in Crop Plants: Getting Closer to the Field’’ [en línea]. En:
ed. Turkan I., Advances in Botanical Research, edit. Academic Press, 2011, pp.
405-443, [Consultado: 29 de noviembre de 2015], Disponible en: <http://dx.doi.org/10.1016/B978-0-12-387692-8.00012-6>.
27. Jafari, A.; Paknejad, F. y Al-Ahmadi, M. J. ‘‘Evaluation of selection indices
for drought tolerance of corn (Zea mays L.) hybrids’’. International Journal
of Plant Production, vol. 3, no. 4, 2009, pp. 33–38, ISSN 1735-6814, 1735-8043.
28. Collins, N. C.; Tardieu, F. y Tuberosa, R. ‘‘Quantitative Trait Loci and
Crop Performance under Abiotic Stress: Where Do We Stand?’’. Plant Physiology,
vol. 147, no. 2, 6 de enero de 2008, pp. 469-486, ISSN 1532-2548, DOI 10.1104/pp.108.118117.
29. Sanjari, P. A. y Yazdansepas, A. ‘‘Evaluation of Wheat (Triticum aestivum
L.) Genotypes under Pre- and Post-anthesis Drought Stress Conditions’’. Journal
of Agricultural Science and Technology, vol. 10, no. 0, 27 de enero de
2010, pp. 109-121, ISSN 1680-7073.
30. Zou, J.; Liu, C. y Chen, X. ‘‘Proteomics of rice in response to heat stress
and advances in genetic engineering for heat tolerance in rice’’. Plant
Cell Reports, vol. 30, no. 12, 17 de julio de 2011, pp. 2155-2165, ISSN
0721-7714, 1432-203X, DOI 10.1007/s00299-011-1122-y.
31. Grover, A.; Mittal, D.; Negi, M. y Lavania, D. ‘‘Generating high temperature
tolerant transgenic plants: Achievements and challenges’’. Plant Science,
vol. 205-206, mayo de 2013, pp. 38-47, ISSN 0168-9452, DOI 10.1016/j.plantsci.2013.01.005.
32. Barnabás, B.; Jäger, K. y Fehér, A. ‘‘The effect of drought
and heat stress on reproductive processes in cereals’’. Plant, Cell &
Environment, vol. 31, no. 1, 1 de enero de 2008, pp. 11-38, ISSN 1365-3040,
DOI 10.1111/j.1365-3040.2007.01727.x.
33. Sakata, T. y Higashitani, A. ‘‘Male sterility accompanied with abnormal
anther development in plants–genes and environmental stresses with special reference
to high temperature injury’’. The International Journal of Developmental
Biology, vol. 2, 2008, pp. 42–51, ISSN 0214- 6282.
34. Senthil, K. M.; Kumar, G.; Srikanthbabu, V. y Udayakumar, M. ‘‘Assessment
of variability in acquired thermotolerance: Potential option to study genotypic
response and the relevance of stress genes’’. Journal of Plant Physiology,
vol. 164, no. 2, 23 de febrero de 2007, pp. 111-125, ISSN 0176-1617, DOI 10.1016/j.jplph.2006.09.009.
35. Hong, S. W.; Lee, U. y Vierling, E. ‘‘Arabidopsis hot Mutants Define Multiple
Functions Required for Acclimation to High Temperatures’’. Plant Physiology,
vol. 132, no. 2, 6 de enero de 2003, pp. 757-767, ISSN , 1532-2548, DOI 10.1104/pp.102.017145.
36. Suzuki, N.; Bajad, S.; Shuman, J.; Shulaev, V. y Mittler, R. ‘‘The Transcriptional
Co-activator MBF1c Is a Key Regulator of Thermotolerance in Arabidopsis thaliana’’.
Journal of Biological Chemistry, vol. 283, no. 14, 4 de abril de 2008,
pp. 9269-9275, ISSN 0021-9258, 1083-351X, DOI 10.1074/jbc.M709187200.
37. Georgieva, K. ‘‘Some mechanisms of damage and acclimation of the photosynthetic
apparatus due to high temperature’’. Bulgarian Journal of Plant Physiology,
vol. 25, no. 3-4, 1999, pp. 89–99, ISSN 1310-4586, 1312-8213.
38. Larkindale, J. y Vierling, E. ‘‘Core Genome Responses Involved in Acclimation
to High Temperature’’. Plant Physiology, vol. 146, no. 2, 2 de enero
de 2008, pp. 748-761, ISSN 1532-2548, DOI 10.1104/pp.107.112060.
39. Levitt, J. Responses of Plants to Environmental Stresses (Physiological
Ecology): Chilling, freezing, and high temperature stresses. 2.a ed., edit.
Academic Pres, New York, octubre de 1980, 497 p., ISBN 978-0-12-445501-6.
40. Kotak, S.; Larkindale, J.; Lee, U.; von Koskull, D. P.; Vierling, E. y Scharf,
K. D. ‘‘Complexity of the heat stress response in plants’’. Current Opinion
in Plant Biology, vol. 10, no. 3, junio de 2007, pp. 310-316, ISSN 1369-5266,
DOI 10.1016/j.pbi.2007.04.011.
41. Sato, S.; Peet, M. M. y Thomas, J. F. ‘‘Determining critical pre and post-anthesis
periods and physiological processes in Lycopersicon esculentum Mill.
exposed to moderately elevated temperatures’’. Journal of Experimental Botany,
vol. 53, no. 371, 5 de enero de 2002, pp. 1187-1195, ISSN 0022-0957, 1460-2431,
DOI 10.1093/jexbot/53.371.1187.
42. Sato, S. y Peet, M. M. ‘‘Effects of moderately elevated temperature stress
on the timing of pollen release and its germination in tomato (Lycopersicon
esculentum Mill.)’’. Journal of horticultural science & Biotechnology,
vol. 80, no. 1, 2005, pp. 23-28, ISSN 1462-0316.
43. Giorno, F.; Wolters, A. M.; Grillo, S.; Scharf, K.-D.; Vriezen, W. H. y
Mariani, C. ‘‘Developmental and heat stress-regulated expression of HsfA2 and
small heat shock proteins in tomato anthers’’. Journal of Experimental Botany,
vol. 61, no. 2, 1 de enero de 2010, pp. 453-462, ISSN 0022-0957, 1460-2431,
DOI 10.1093/jxb/erp316.
44. Nuez, F. El cultivo del tomate [en línea]. edit. Mundi-Prensa, España,
1995, 793 p., ISBN 84-7114-549-9, [Consultado: 29 de noviembre de 2015],
Disponible en: <http://www.sidalc.net/cgi-bin/wxis.exe/?IsisScript=INIA.dad=1&expresion=mfn=030995>.
45. Abdelmageed, A. H. A. y Gruda, N. ‘‘Influence of heat shock pretreatment
on growth and development of tomatoes under controlled heat stress conditions’’.
Journal of Applied Botany and Food Quality, vol. 81, no. 1, 29 de noviembre
de 2012, pp. 26-28, ISSN 1439-040X.
46. Ruan, Y. L.; Jin, Y.; Yang, Y. J.; Li, G. J. y Boyer, J. S. ‘‘Sugar Input,
Metabolism, and Signaling Mediated by Invertase: Roles in Development, Yield
Potential, and Response to Drought and Heat’’. Molecular Plant, vol.
3, no. 6, noviembre de 2010, pp. 942-955, ISSN 1674-2052, DOI 10.1093/mp/ssq044.
47. Zinn, K. E.; Tunc, M. y Harper, J. F. ‘‘Temperature stress and plant sexual
reproduction: uncovering the weakest links’’. Journal of Experimental Botany,
vol. 61, no. 7, 4 de enero de 2010, pp. 1959-1968, ISSN 0022-0957, 1460-2431,
DOI 10.1093/jxb/erq053.
48. Li, Z.; Palmer, W. M.; Martin, A. P.; Wang, R.; Rainsford, F.; Jin, Y.;
Patrick, J. W.; Yang, Y. y Ruan, Y. L. ‘‘High invertase activity in tomato reproductive
organs correlates with enhanced sucrose import into, and heat tolerance of,
young fruit’’. Journal of Experimental Botany, vol. 63, no. 3, 2 de
enero de 2012, pp. 1155-1166, ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/err329.
49. Pressman, E.; Shaked, R. y Firon, N. ‘‘Tomato response to heat stress: focus
on pollen grains’’. Plant Stress, vol. 1, no. 2, 2007, pp. 216–227,
ISSN 1749-0359.
50. Frank, G.; Pressman, E.; Ophir, R.; Althan, L.; Shaked, R.; Freedman, M.;
Shen, S. y Firon, N. ‘‘Transcriptional profiling of maturing tomato (Solanum
lycopersicum L.) microspores reveals the involvement of heat shock proteins,
ROS scavengers, hormones, and sugars in the heat stress response’’. Journal
of Experimental Botany, vol. 60, no. 13, 2009, pp. 3891-3908, ISSN 1460-2431,
DOI 10.1093/jxb/erp234.
51. Shah, F.; Huang, J.; Cui, K.; Nie, L.; Shah, T.; Chen, C. y Wang, K. ‘‘Impact
of high-temperature stress on rice plant and its traits related to tolerance’’.
The Journal of Agricultural Science, vol. 149, no. 05, octubre de 2011,
pp. 545–556, ISSN 1469-5146, DOI 10.1017/S0021859611000360.
52. Abdul, B. A. A. y Stommel, J. R. ‘‘Pollen Viability and Fruit Set of Tomato
Genotypes under Optimumand High-temperature Regimes’’. HortScience,
vol. 30, no. 1, 2 de enero de 1995, pp. 115-117, ISSN 0018-5345, 2327-9834.
53. Alam, M.; Sultana, N.; Ahmad, S.; Hossain, M. y Islam, A. ‘‘Performance
of heat tolerant tomato hybrid lines under hot, humid conditions’’. Bangladesh
Journal of Agricultural Research, vol. 35, no. 3, 17 de noviembre de 2010,
ISSN 0258-7122, 0258-7122, DOI 10.3329/bjar.v35i3.6442, [Consultado: 29
de noviembre de 2015], Disponible en: <http://www.banglajol.info/index.php/BJAR/article/view/6442>.
54. Scafaro, A. P.; Haynes, P. A. y Atwell, B. J. ‘‘Physiological and molecular
changes in Oryza meridionalis Ng., a heat-tolerant species of wild rice’’. Journal
of Experimental Botany, vol. 61, no. 1, 1 de enero de 2010, pp. 191-202,
ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/erp294.
55. Guy, C.; Kaplan, F.; Kopka, J.; Selbig, J. y Hincha, D. K. ‘‘Metabolomics
of temperature stress’’. Physiologia Plantarum, vol. 132, no. 2, 2008,
pp. 220-235, ISSN 1399-3054, DOI 10.1111/j.1399-3054.2007.00999.x.
56. Tripp, J.; Mishra, S. K. y Scharf, K.-D. ‘‘Functional dissection of the
cytosolic chaperone network in tomato mesophyll protoplasts’’. Plant, Cell
& Environment, vol. 32, no. 2, 1 de febrero de 2009, pp. 123-133, ISSN
1365-3040, DOI 10.1111/j.1365-3040.2008.01902.x.
57. Wang, G. P.; Li, F.; Zhang, J.; Zhao, M. R.; Hui, Z. y Wang, W. ‘‘Overaccumulation
of glycine betaine enhances tolerance of the photosynthetic apparatus to drought
and heat stress in wheat’’. Photosynthetica, vol. 48, no. 1, 29 de
mayo de 2010, pp. 30-41, ISSN 0300-3604, 1573-9058, DOI 10.1007/s11099-010-0006-7.
58. Almeselmani, M.; Deshmukh, P. S. y Chinnusamy, V. ‘‘Effects of prolonged
high temperature stress on respiration, photosynthesis and gene expression in
wheat (Triticum aestivum L.) varieties differing in their thermotolerance’’.
Plant stress, vol. 6, no. 1, 2012, pp. 25–32, ISSN 1749-0359.
59. Jie, Z.; Xiaodong, J.; Tianlai, L. y Zaiqiang, Y. ‘‘Effect of moderately-high
temperature stress on photosynthesis and carbohydrate metabolism in tomato (Lycopersicum
esculentum L.) leaves’’. African Journal of Agricultural Research,
vol. 7, no. 3, 2012, pp. 487–492, ISSN 1991-637X, DOI 10.5897/AJAR11.2062.
60. Kreslavski, V.; Tatarinzev, N.; Shabnova, N.; Semenova, G. y Kosobryukhov,
A. ‘‘Characterization of the nature of photosynthetic recovery of wheat seedlings
from short-term dark heat exposures and analysis of the mode of acclimation
to different light intensities’’. Journal of Plant Physiology, vol.
165, no. 15, 9 de octubre de 2008, pp. 1592-1600, ISSN 0176-1617, DOI 10.1016/j.jplph.2007.12.011.
61. Allakhverdiev, S. I.; Kreslavski, V. D.; Klimov, V. V.; Los, D. A.; Carpentier,
R. y Mohanty, P. ‘‘Heat stress: an overview of molecular responses in photosynthesis’’.
Photosynthesis Research, vol. 98, no. 1-3, 22 de julio de 2008, pp.
541-550, ISSN 0166-8595, 1573-5079, DOI 10.1007/s11120-008-9331-0.
62. Li, W. D.; Duan, W.; Fan, P. G.; Yan, S. T. y Li, S. H. ‘‘Photosynthesis
in response to sink-source activity and in relation to end products and activities
of metabolic enzymes in peach trees’’. Tree Physiology, vol. 27, no.
9, 9 de enero de 2007, pp. 1307-1318, ISSN 0829-318X, 1758-4469, DOI 10.1093/treephys/27.9.1307.
63. Crafts, B. S. J. y Salvucci, M. E. ‘‘Analyzing the impact of high temperature
and CO2 on net photosynthesis: biochemical mechanisms, models and genomics’’.
Field Crops Research, vol. 90, no. 1, 8 de noviembre de 2004, pp. 75-85,
ISSN 0378-4290, DOI 10.1016/j.fcr.2004.07.006.
64. Ainsworth, E. A.; Beier, C.; Calfapietra, C.; Ceulemans, R.; Durand, M.;
Farquhar, G. D.; Godbold, D. L.; Hendrey, G. R.; Hickler, T.; Soussana, J.-F.;
Stitt, M.; Weigel, H.-J. y White, J. W. ‘‘Next generation of elevated [CO2]
experiments with crops: a critical investment for feeding the future world’’.
Plant, Cell & Environment, vol. 31, no. 9, 1 de septiembre de 2008,
pp. 1317-1324, ISSN 1365-3040, DOI 10.1111/j.1365-3040.2008.01841.x.
65. Stobrawa, K. y Lorenc, P. G. ‘‘Changes in carbohydrate metabolism in fine
roots of the native European black poplar (Populus nigra L.) in a heavy-metal-polluted
environment’’. Science of The Total Environment, vol. 373, no. 1, 1
de febrero de 2007, pp. 157-165, ISSN 0048-9697, DOI 10.1016/j.scitotenv.2006.11.019.
66. Petkova, V.; Rodeva, V.; Grozeva, S. y Topalova, E. Response of tomato lines
(Solanum lycopersicum x Solanum pennellii) and their parental
genotypes toward high temperatures and drought [en línea]. no. 59, Inst.
Tomato Genetics Cooperative-University of Florida, Florida, USA, 2009, pp. 48-53,
[Consultado: 12 de mayo de 2015], Disponible en: <http://tgc.ifas.ufl.edu/vol59/tgcvol59web.pdf>.
67. Rivero, R. M.; Ruiz, J. M. y Romero, L. ‘‘Oxidative metabolism in tomato
plants subjected to heat stress’’. The Journal of Horticultural Science
and Biotechnology, vol. 79, no. 4, 2004, pp. 560-564, ISSN 1462-0316.
68. Ibrahim, A. M. H. y Quick, J. S. ‘‘Genetic Control of High Temperature Tolerance
in Wheat as Measured by Membrane Thermal Stability’’. Crop Science,
vol. 41, no. 5, 2001, p. 1405, ISSN 1435-0653, DOI 10.2135/cropsci2001.4151405x.
69. Iglesias, L. ‘‘Utilización de marcadores bioquímicos y moleculares
en el mejoramiento genético de la papa’’. Cultivos Tropicales,
vol. 15, no. 2, 1994, pp. 108–121, ISSN 1819-4087.
70. Iba, K. ‘‘Acclimative response to temperature stress in higher plants. Approaches
of Gene Engineering for temperature tolerance’’. Annual Review of Plant
Biology, vol. 53, no. 1, 2002, pp. 225-245, ISSN 1543-5008, 1545-2123,
DOI 10.1146/annurev.arplant.53.100201.160729.
71. Amutha, R.; Muthulaksmi, S.; Baby, R. W.; Indira, K. y Mareeswari, P. ‘‘Physiological
Studies on Evaluation of Sunflower (Helianthus annus L.) Genotypes for High
Temperature Stress’’. Research Journal of Agriculture and Biological Sciences,
vol. 3, no. 4, 2007, pp. 245-251, ISSN 1816-1561.
72. Yang, X.; Wen, X.; Gong, H.; Lu, Q.; Yang, Z.; Tang, Y.; Liang, Z. y Lu,
C. ‘‘Genetic engineering of the biosynthesis of glycinebetaine enhances thermotolerance
of photosystem II in tobacco plants’’. Planta, vol. 225, no. 3, 5 de
septiembre de 2006, pp. 719-733, ISSN 0032-0935, 1432-2048, DOI 10.1007/s00425-006-0380-3.
73. Meiri, D.; Tazat, K.; Cohen, P. R.; Farchi, P. O.; Aviezer, H. K.; Avni,
A. y Breiman, A. ‘‘Involvement of Arabidopsis ROF2 (FKBP65) in thermotolerance’’.
Plant Molecular Biology, vol. 72, no. 1-2, 29 de octubre de 2009, pp.
191-203, ISSN 0167-4412, 1573-5028, DOI 10.1007/s11103-009-9561-3.
74. Bajguz, A. y Hayat, S. ‘‘Effects of brassinosteroids on the plant responses
to environmental stresses’’. Plant Physiology and Biochemistry, vol.
47, no. 1, enero de 2009, pp. 1-8, ISSN 0981-9428, DOI 10.1016/j.plaphy.2008.10.002.
75. Ding, W.; Song, L.; Wang, X. y Bi, Y. ‘‘Effect of abscisic acid on heat
stress tolerance in the calli from two ecotypes of Phragmites communis’’. Biologia
Plantarum, vol. 54, no. 4, 23 de septiembre de 2010, pp. 607-613, ISSN
0006-3134, 1573-8264, DOI 10.1007/s10535-010-0110-3.
76. Hsu, S. F.; Lai, H. C. y Jinn, T. L. ‘‘Cytosol-Localized Heat Shock Factor-Binding
Protein, AtHSBP, Functions as a Negative Regulator of Heat Shock Response by
Translocation to the Nucleus and Is Required for Seed Development in Arabidopsis’’.
Plant Physiology, vol. 153, no. 2, 1 de junio de 2010, pp. 773-784,
ISSN , 1532-2548, DOI 10.1104/pp.109.151225.
77. Lang, M. C.; Popova, O.; Kiok, K.; Berlinger, M.; Rakic, B.; Aufsatz, W.;
Jonak, C.; Hauser, M. T. y Luschnig, C. ‘‘Transgenerational Inheritance and
Resetting of Stress-Induced Loss of Epigenetic Gene Silencing in Arabidopsis’’.
Molecular Plant, vol. 3, no. 3, mayo de 2010, pp. 594-602, ISSN 1674-2052,
DOI 10.1093/mp/ssq014.
78. Sato, S.; Kamiyama, M.; Iwata, T.; Makita, N.; Furukawa, H. y Ikeda, H.
‘‘Moderate Increase of Mean Daily Temperature Adversely Affects Fruit Set of
Lycopersicon esculentum by Disrupting Specific Physiological Processes
in Male Reproductive Development’’. Annals of Botany, vol. 97, no.
5, 5 de enero de 2006, pp. 731-738, ISSN 0305-7364, 1095-8290, DOI 10.1093/aob/mcl037.
79. Firon, N.; Shaked, R.; Peet, M. M.; Pharr, D. M.; Zamski, E.; Rosenfeld,
K.; Althan, L. y Pressman, E. ‘‘Pollen grains of heat tolerant tomato cultivars
retain higher carbohydrate concentration under heat stress conditions’’. Scientia
Horticulturae, vol. 109, no. 3, 21 de julio de 2006, pp. 212-217, ISSN
0304-4238, DOI 10.1016/j.scienta.2006.03.007.
80. Lutfor, R. R. S. M.; Mackay, W. A.; Nawata, E.; Sakuratani, T.; Mesbah,
A. S. M. y Quebedeaux, B. ‘‘Superoxide dismutase, ribulose1, 5-bisphosphate
carboxylase (rubisco) and photosynthetic rates of drought-tolerant and drought-sensitive
tomato cultivars’’. Acta Horticulturae, no. 618, noviembre de 2003,
pp. 337-345, ISSN 0567-7572, 2406-6168, DOI 10.17660/ActaHortic.2003.618.39.
81. Fokar, M.; Nguyen, H. T. y Blum, A. ‘‘Heat tolerance in spring wheat. I.
Estimating cellular thermotolerance and its heritability’’. Euphytica,
vol. 104, no. 1, noviembre de 1998, pp. 1-8, ISSN 0014-2336, 1573-5060, DOI
10.1023/A:1018346901363.
82. Arvin, M. J. y Donnelly, D. J. ‘‘Screening Potato Cultivars and Wild Species
to Abiotic Stresses Using an Electrolyte Leakage Bioassay’’. Journal of
Agricultural Science and Technology, vol. 10, no. 0, 26 de enero de 2010,
pp. 33-42, ISSN 1680-7073.
83. Khan, A. I.; Khan, I. A. y Sadaqat, H. A. ‘‘Heat tolerance is variable in
cotton (Gossypium hirsutum L.) and can be exploited for breeding of better yielding
cultivars under high temperature regimes’’. Pakistan Journal of Botany,
vol. 40, no. 5, 2008, pp. 2053–2058, ISSN 0556-3321, 2070-3368.
84. Mohammed, A. R. y Tarpley, L. ‘‘Impact of High Nighttime Temperature on
Respiration, Membrane Stability, Antioxidant Capacity, and Yield of Rice Plants’’.
Crop Science, vol. 49, no. 1, 2009, p. 313, ISSN 1435-0653, DOI 10.2135/cropsci2008.03.0161.
85. Farooq, M.; Bramley, H.; Palta, J. A. y Siddique, K. H. M. ‘‘Heat Stress
in Wheat during Reproductive and Grain-Filling Phases’’. Critical Reviews
in Plant Sciences, vol. 30, no. 6, 1 de noviembre de 2011, pp. 491-507,
ISSN 0735-2689, DOI 10.1080/07352689.2011.615687.
86. Chen, H. H.; Shen, Z. Y. y Li, P. H. ‘‘Adaptability of Crop Plants to High
Temperatures Stress1’’. Crop Science, vol. 22, no. 4, 1982, p. 719,
ISSN 0011-183X, DOI 10.2135/i1982.0011183X002200040006x.
87. Thiaw, S. y Hall, A. E. ‘‘Comparison of selection for either leaf-electrolyte-leakage
or pod set in enhancing heat tolerance and grain yield of cowpea’’. Field
Crops Research, vol. 86, no. 2-3, 10 de marzo de 2004, pp. 239-253, ISSN
0378-4290, DOI 10.1016/j.fcr.2003.08.011.
88. Chang, P. F. L.; Jinn, T. L.; Huang, W. K.; Chen, Y.; Chang, H.-M. y Wang,
C. W. ‘‘Induction of a cDNA clone from rice encoding a class II small heat shock
protein by heat stress, mechanical injury, and salicylic acid’’. Plant Science,
vol. 172, no. 1, enero de 2007, pp. 64-75, ISSN 0168-9452, DOI 10.1016/j.plantsci.2006.07.017.
89. Pavli, O. I.; Ghikas, D. V.; Katsiotis, A. y Skaracis, G. N. ‘‘Differential
expression of heat shock protein genes in sorghum (Sorghum bicolor L.) genotypes
under heat stress’’. Australian Journal of Crop Science, vol. 5, no.
5, 2011, pp. 511-515, ISSN 1835-2707, 1835-2693.
90. Hahn, A.; Bublak, D.; Schleiff, E. y Scharf, K.-D. ‘‘Crosstalk between Hsp90
and Hsp70 Chaperones and Heat Stress Transcription Factors in Tomato’’. The
Plant Cell, vol. 23, no. 2, 1 de febrero de 2011, pp. 741-755, ISSN 1532-298X,
DOI 10.1105/tpc.110.076018.
91. Al-Whaibi, M. H. ‘‘Plant heat-shock proteins: A mini review’’. Journal
of King Saud University, vol. 23, no. 2, abril de 2011, pp. 139-150, ISSN
1018-3647, DOI 10.1016/j.jksus.2010.06.022.
92. Vierling, E. ‘‘The Roles of Heat Shock Proteins in Plants’’. Annual
Review of Plant Physiology and Plant Molecular Biology, vol. 42, no. 1,
1991, pp. 579-620, ISSN 1040-2519?; 1040-2519, DOI 10.1146/annurev.pp.42.060191.003051.
93. Efeoglu, B. ‘‘Heat Shock Proteins and Heat Shock Response in Plants’’. Gazi
University Journal of Science, vol. 22, no. 2, 2009, pp. 67-75, ISSN 2147-1762.
94. Kotak, S.; Vierling, E.; Bäumlein, H. y Koskull, D. P. von. ‘‘A Novel
Transcriptional Cascade Regulating Expression of Heat Stress Proteins during
Seed Development of Arabidopsis’’. The Plant Cell, vol. 19, no. 1,
1 de enero de 2007, pp. 182-195, ISSN 1532-298X, DOI 10.1105/tpc.106.048165.
95. Snyman, M. y Cronjé, M. J. ‘‘Modulation of heat shock factors accompanies
salicylic acid-mediated potentiation of Hsp70 in tomato seedlings’’. Journal
of Experimental Botany, vol. 59, no. 8, 1 de mayo de 2008, pp. 2125-2132,
ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/ern075.
96. Timperio, A. M.; Egidi, M. G. y Zolla, L. ‘‘Proteomics applied on plant
abiotic stresses: Role of heat shock proteins (HSP)’’. Journal of Proteomics,
vol. 71, no. 4, 7 de octubre de 2008, pp. 391-411, ISSN 1874-3919, DOI 10.1016/j.jprot.2008.07.005.
97. Gupta, S. C.; Sharma, A.; Mishra, M.; Mishra, R. K. y Chowdhuri, D. K. ‘‘Heat
shock proteins in toxicology: How close and how far?’’. Life Sciences,
vol. 86, no. 11–12, 13 de marzo de 2010, pp. 377-384, ISSN 0024-3205, DOI 10.1016/j.lfs.2009.12.015.
98. Zhang, J. H.; Wang, L. J.; Pan, Q. H.; Wang, Y. Z.; Zhan, J. C. y Huang,
W. D. ‘‘Accumulation and subcellular localization of heat shock proteins in
young grape leaves during cross-adaptation to temperature stresses’’. Scientia
Horticulturae, vol. 117, no. 3, 23 de julio de 2008, pp. 231-240, ISSN
0304-4238, DOI 10.1016/j.scienta.2008.04.012.
99. Huang, B. y Xu, C. ‘‘Identification and Characterization of Proteins Associated
with Plant Tolerance to Heat Stress’’. Journal of Integrative Plant Biology,
vol. 50, no. 10, 1 de octubre de 2008, pp. 1230-1237, ISSN 1744-7909, DOI 10.1111/j.1744-7909.2008.00735.x.
100. Desikan, R.; Mackerness, S.; Hancock, J. T. y Neill, S. J. ‘‘Regulation
of the Arabidopsis Transcriptome by Oxidative Stress’’. Plant Physiology,
vol. 127, no. 1, 9 de enero de 2001, pp. 159-172, ISSN 1532-2548, DOI 10.1104/pp.127.1.159.
101. Sun, W.; Van Montagu, M. y Verbruggen, N. ‘‘Small heat shock proteins and
stress tolerance in plants’’. Biochimica et Biophysica Acta (BBA)-Gene Structure
and Expression, vol. 1577, no. 1, 19 de agosto de 2002, pp. 1-9, ISSN 0167-4781,
DOI 10.1016/S0167-4781(02)00417-7.
102. Hong, S. W. y Vierling, E. ‘‘Hsp101 is necessary for heat tolerance but
dispensable for development and germination in the absence of stress’’. The
Plant Journal, vol. 27, no. 1, 1 de julio de 2001, pp. 25-35, ISSN 1365-313X,
DOI 10.1046/j.1365-313x.2001.01066.x.
103. Hu, W.; Hu, G. y Han, B. ‘‘Genome-wide survey and expression profiling
of heat shock proteins and heat shock factors revealed overlapped and stress
specific response under abiotic stresses in rice’’. Plant Science,
vol. 176, no. 4, abril de 2009, pp. 583-590, ISSN 0168-9452, DOI 10.1016/j.plantsci.2009.01.016.
104. Scharf, K. D.; Berberich, T.; Ebersberger, I. y Nover, L. ‘‘The plant heat
stress transcription factor (Hsf) family: Structure, function and evolution’’.
Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms, vol.
1819, no. 2, febrero de 2012, pp. 104-119, ISSN 1874-9399, DOI 10.1016/j.bbagrm.2011.10.002.
105. Sung, D. Y.; Kaplan, F.; Lee, K. J. y Guy, C. L. ‘‘Acquired tolerance to
temperature extremes’’. Trends in Plant Science, vol. 8, no. 4, abril
de 2003, pp. 179-187, ISSN 1360-1385, DOI 10.1016/S1360-1385(03)00047-5.
106. Krasensky, J. y Jonak, C. ‘‘Drought, salt, and temperature stress-induced
metabolic rearrangements and regulatory networks’’. Journal of Experimental
Botany, vol. 63, no. 4, 2 de enero de 2012, pp. 1593-1608, ISSN 0022-0957,
1460-2431, DOI 10.1093/jxb/err460.
107. Varshney, R. K.; Bansal, K. C.; Aggarwal, P. K.; Datta, S. K. y Craufurd,
P. Q. ‘‘Agricultural biotechnology for crop improvement in a variable climate:
hope or hype?’’. Trends in Plant Science, vol. 16, no. 7, julio de
2011, pp. 363-371, ISSN 1360-1385, DOI 10.1016/j.tplants.2011.03.004.
108. Mishra, S. K.; Tripp, J.; Winkelhaus, S.; Tschiersch, B.; Theres, K.; Nover,
L. y Scharf, K. D. ‘‘In the complex family of heat stress transcription factors,
HsfA1 has a unique role as master regulator of thermotolerance in tomato’’.
Genes & Development, vol. 16, no. 12, 15 de junio de 2002, pp. 1555-1567,
ISSN 0890-9369, 1549-5477, DOI 10.1101/gad.228802.
109. Port, M.; Tripp, J.; Zielinski, D.; Weber, C.; Heerklotz, D.; Winkelhaus,
S.; Bublak, D. y Scharf, K.-D. ‘‘Role of Hsp17.4-CII as Coregulator and Cytoplasmic
Retention Factor of Tomato Heat Stress Transcription Factor HsfA2’’. Plant
Physiology, vol. 135, no. 3, 7 de enero de 2004, pp. 1457-1470, ISSN 1532-2548,
DOI 10.1104/pp.104.042820.
110. Yu, C.; Wang, H. S.; Yang, S.; Tang, X. F.; Duan, M. y Meng, Q. W. ‘‘Overexpression
of endoplasmic reticulum omega-3 fatty acid desaturase gene improves chilling
tolerance in tomato’’. Plant Physiology and Biochemistry, vol. 47,
no. 11–12, noviembre de 2009, pp. 1102-1112, ISSN 0981-9428, DOI 10.1016/j.plaphy.2009.07.008.
111. Domínguez, T.; Hernández, M. L.; Pennycooke, J. C.; Jiménez,
P.; Martínez, R. J. M.; Sanz, C.; Stockinger, E. J.; Sánchez,
J. J. y Sanmartín, M. ‘‘Increasing ?-3 Desaturase Expression in Tomato
Results in Altered Aroma Profile and Enhanced Resistance to Cold Stress’’. Plant
Physiology, vol. 153, no. 2, 1 de junio de 2010, pp. 655-665, ISSN 1532-2548,
DOI 10.1104/pp.110.154815.
112. Li, W.; Kabbage, M. y Dickman, M. B. ‘‘Transgenic expression of an insect
inhibitor of apoptosis gene, SfIAP, confers abiotic and biotic stress tolerance
and delays tomato fruit ripening’’. Physiological and Molecular Plant Pathology,
vol. 74, no. 5–6, septiembre de 2010, pp. 363-375, ISSN 0885-5765, DOI 10.1016/j.pmpp.2010.06.001.
113. Zhu, J. K. ‘‘Salt and Drought Stress Signal Transduction in Plants’’. Annual
Review of Plant Biology, vol. 53, no. 1, 2002, pp. 247-273, ISSN 1543-5008,
1545-2123, DOI 10.1146/annurev.arplant.53.091401.143329.
114. Alvarez, M.; Hong, L. M.; Martín, J. V. y Varela, M. ‘‘Herencia
de la germinación del polen in vitro y la fructificación del tomate
en condiciones tropicales’’. Cultivos Tropicales, vol. 15, no. 1, 1994,
pp. 57–60, ISSN 1819-4087.
115. EI-Ahmadi, A. B. y Stevens, M. A. ‘‘Genetics of high temperature, fruit
set in the tomato’’. Journal of the American Society for Horticultural Science,
vol. 104, no. 5, 1979, pp. 686-691, ISSN 0003-1062, 2327-9788.
116. Scott, J. W. ‘‘Fla. 7771, a medium-large, heat-tolerant, jointless-pedicel
tomato’’. HortScience, vol. 35, no. 5, 2000, pp. 968–969, ISSN 0018-5345,
2327-9834.
117. Scott, J. W.; Olson, S. M.; Howe, T. K.; Stoffella, P. J.; Bartz, J. A.
y Bryan, H. H. ‘‘Equinox’Heat-tolerant Hybrid Tomato’’. HortScience,
vol. 30, no. 3, 1995, pp. 647–648, ISSN 0018-5345, 2327-9834.
118. Souza, M. A. de; Pimentel, A. J. B. y Ribeiro, G. ‘‘Breeding for Heat-Stress
Tolerance’’ [en línea]. En: eds. Fritsche N. R. y Borém A., Plant
Breeding for Abiotic Stress Tolerance, edit. Springer Berlin Heidelberg, 2012,
pp. 137-156, ISBN 978-3-642-30552-8, [Consultado: 30 de noviembre de 2015],
Disponible en: <http://link.springer.com/pter/10.1007/978-3-642-30553-5_9>.
119. Berry, S. Z. y Uddin, M. R. ‘‘Breeding Tomato for Quality and Processing
Attributes’’ [en línea]. En: ed. Kalloo P. D. G., Genetic Improvement
of Tomato, edit. Springer Berlin Heidelberg, 1991, pp. 197-206, ISBN 978-3-642-84277-1,
[Consultado: 30 de noviembre de 2015], Disponible en: <http://link.springer.com/pter/10.1007/978-3-642-84275-7_15>.
120. Duran, C.; Eales, D.; Marshall, D.; Imelfort, M.; Stiller, J.; Berkman,
P. J.; Clark, T.; McKenzie, M.; Appleby, N.; Batley, J.; Basford, K. y Edwards,
D. ‘‘Future tools for association mapping in crop plants’’. Genome / National
Research Council Canada = Génome / Conseil National De Recherches Canada,
vol. 53, no. 11, noviembre de 2010, pp. 1017-1023, ISSN 1480-3321, DOI 10.1139/G10-057.
121. Argyris, J.; Truco, M. J.; Ochoa, O.; McHale, L.; Dahal, P.; Deynze, A.
V.; Michelmore, R. W. y Bradford, K. J. ‘‘A gene encoding an abscisic acid biosynthetic
enzyme (LsNCED4) collocates with the high temperature germination locus Htg6.1
in lettuce (Lactuca sp.)’’. Theoretical and Applied Genetics, vol.
122, no. 1, 12 de agosto de 2010, pp. 95-108, ISSN 0040-5752, 1432-2242, DOI
10.1007/s00122-010-1425-3.
122. Lin, K. H.; Lo, H. F.; Lee, S. P.; George, K. C.; Chen, J. T. y Yeh, W.
L. ‘‘RAPD markers for the identification of yield traits in tomatoes under heat
stress via bulked segregant analysis’’. Hereditas, vol. 143, no. 2006,
1 de diciembre de 2006, pp. 142-154, ISSN 1601-5223, DOI 10.1111/j.2006.0018-0661.01938.x.
123. Ahuja, I.; de Vos, R. C. H.; Bones, A. M. y Hall, R. D. ‘‘Plant molecular
stress responses face climate change’’. Trends in Plant Science, vol.
15, no. 12, diciembre de 2010, pp. 664-674, ISSN 1878-4372, DOI 10.1016/j.tplants.2010.08.002.
Recibido: 20 de
febrero de 2014
Aceptado: 17 de mayo de 2015
Dr.C. Francisco
Guevara Hernández, Profesor-Investigador. Universidad Autónoma
de Chiapas, Villaflores, Chiapas, México. Email: francisco.guevara@unach.mx
