RESEÑA BIBLIOGRÁFICA
Nuevos productos naturales para la agricultura: las oligosacarinas
New natural products for agriculture: the oligosaccharins
Dr.C. Alejandro B. Falcón Rodríguez, Dra.C. Daimy Costales Menéndez, Dianevys González-Peña Fundora, Dra.C. María C. Nápoles García
Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba. CP 32 700.
RESUMEN
Las oligosacarinas son polisacáridos y oligosacáridos naturales que forman parte de las paredes celulares de las plantas y microorganismos como los hongos; sin embargo, las principales fuentes de materia prima para su preparación a gran escala lo constituyen subproductos agrícolas y el exoesqueleto de los crustáceos que se desechan de la industria pesquera. Poseen potenciales aplicaciones agrícolas, ya que promueven la germinación, el crecimiento de las plantas, el incremento de los rendimientos y el beneficio de la simbiosis de las leguminosas. Numerosos estudios demuestran la protección de los cultivos con oligosacarinas ante diferentes manifestaciones del estrés biótico y abiótico. Algunas como las quitosanas ejercen acción antimicrobiana directa, lo que eleva sus aplicaciones como agente protector de la calidad de las producciones agrícolas. Existen varios productos internacionales basados en estas macromoléculas que ostentan además, como valor agregado, la inocuidad y biodegradabilidad característica de estos compuestos. El Grupo de Productos Bioactivos (GPB) del Instituto Nacional de Ciencias Agrícolas (INCA) ha desarrollado varios productos a base de oligosacarinas que constituyen alternativas nacionales a productos agrícolas, como reguladores del crecimiento y los rendimientos, protectores de los cultivos contra el estrés biótico y abiótico y biofertilizantes de nuevo tipo para la fijación biológica del nitrógeno en las leguminosas.
Palabras clave: estrés, hongos, microorganismos, oligogalacturónido, productos, quitosano.
ABSTRACT
Oligosaccharins are natural polysaccharides and oligosaccharides occurring as part of cell walls of plants and microorganisms such as fungi; however, main sources of raw materials for its large scale preparation are by products from agriculture and wasted crustacean exoskeletons from fishing industry. They have potential agricultural applications since they promote germination and plant growth, enhance crop yields and benefit symbiosis in leguminous. A great number of studies demonstrate crop protection by oligosaccharins against biotic and abiotic stress. Some oligosaccharins, such as chitosans, perform direct antimicrobial activity, this fact reinforce their application as protective agent of agricultural commodities quality. There are several international commercial products based on these macromolecules that bearing also, as an additional valor, the innocuous and biodegradable features of these compounds. The Group of Bioactive Products (GPB) from INCA has developed several oligosaccharins based products that constitute national alternatives to agro-products as plant growth regulators, enhancers of crop yields, plant protecting agents against biotic and abiotic stress and new type of biofertilizers for biological nitrogen fixation in leguminous.
Key words: stress, fungus, microorganisms, oligogalacturonide, products, chitosan.
INTRODUCCIÓN
En la actualidad
existe una creciente necesidad mundial de producción de alimentos, debido
a su escasez en determinadas zonas geográficas y a los incrementos de
los precios y costos de producción que resultan prohibitivos para muchos
países del tercer mundo. Una gran parte de los agroquímicos que
se utilizan actualmente tienen altos precios en el mercado mundial, lo que contribuye
a los altos costos de producción agrícola. En adición,
todavía la mayor parte de los químicos que se utilizan para la
protección de los cultivos contra sus enfermedades y algunos que incrementan
la eficiencia productiva, son considerados agentes contaminantes del suelo,
de los propios cultivos, de la biodiversidad y causantes de enfermedades en
animales y humanos.
La ciencia moderna en los últimos 20 años se ha proyectado a la
búsqueda de soluciones y alternativas para dichos problemas que mantengan
la eficiencia de la producción agrícola. Para esto, el desarrollo
de las distintas ramas de la biología vegetal ha permitido profundizar
en los mecanismos que las plantas tienen y desarrollan frente a los diferentes
retos que la naturaleza y el hombre les impone, como son los diferentes estreses
bióticos y abióticos a que están sometidos los cultivos
en la actualidad. Los resultados de estas últimas dos décadas
permiten vislumbrar el desarrollo de una nueva generación de compuestos
inocuos o menos agresivos al ambiente y al hombre que basan su utilidad en la
manipulación de las respuestas naturales de los vegetales, contra los
diferentes estreses y en maximizar las potencialidades intrínsecas de
los cultivos para elevar sus rendimientos.
La siguiente revisión versa sobre las características y potencialidades
de un grupo de compuestos (las Oligosacarinas), inocuos y de origen natural,
con grandes perspectivas en la agricultura orgánica y sostenible e incluso
en la agricultura de gran escala o intensiva.
LAS OLIGOSACARINAS
Las oligosacarinas fueron descubiertas como resultado de los estudios realizados
durante las décadas de los años 70 y los 80, vinculados a dos
temas de gran importancia en biología vegetal. Por una parte, múltiples
grupos del primer mundo estudiaban la interacción planta-microorganismos,
especialmente las respuestas de la planta a patógenos y predadores, así
como las señales vinculadas con estas respuestas; y por otra parte, un
número menor de investigadores liderados por el Dr. Peter Albersheim
en Georgia, EUA, estudiaban la estructura y los componentes de la pared celular
de las plantas, bajo la sospecha de que debido a la complejidad de la misma,
era muy probable que sus funciones en la planta no solo fueran las de sostén,
forma y protección del contenido celular.
Ambas líneas confluyeron en resultados de gran importancia que revolucionaron
conceptos y puntos de vista en ambos temas. De esta forma se conoce hoy que
la pared celular de las plantas es, además de reservorio o sostén
celular, un depósito de hormonas que actúan en una variada gama
de funciones en la planta, posiblemente mediante acción directa o indirecta
sobre las llamadas hormonas tradicionales de la misma y, especialmente, en la
activación de respuestas defensivas y de la resistencia de la planta
contra patógenos y predadores.
CONCEPTOS: ELICITORES Y OLIGOSACARINAS
Las plantas tienen la capacidad de defenderse de la mayoría de los microorganismos,
potencialmente patógenos, que habitan en su entorno. De forma general,
los cultivos presentan barreras estructurales y compuestos químicos que
impiden el avance de infecciones; además de estos mecanismos defensivos
preestablecidos, las plantas pueden inducir la expresión de numerosos
genes defensivos, tanto local como sistémicamente en todos los tejidos,
cuya acción coordinada logra detener el establecimiento de una enfermedad
(1, 2).
La respuesta defensiva en las plantas es el resultado del reconocimiento por
parte de estas de diversos compuestos liberados de los patógenos y de
las propias plantas durante el proceso de patogénesis, cuando enzimas
excretadas por ambos contendientes degradan las paredes celulares del otro organismo
(3, 4, 5). Las estructuras liberadas y reconocidas por la planta se denominan
elicitores.
Los elicitores son sustancias que pueden inducir respuestas defensivas cuando
se adicionan en tejidos o en células de plantas. Son compuestos de diversa
estructura y origen -oligosacáridos, glicoproteínas, péptidos,
lípidos, entre otros-. Se ha demostrado que los elicitores de tipo oligosacárido
tienen importantes funciones en las interacciones planta-patógeno (3).
Los componentes polisacáridos y glicoprotéicos de las paredes
celulares constituyen una fuente de oligosacáridos, que además
de ser elicitores de respuestas defensivas en la planta, algunos ejercen efectos
en el crecimiento y desarrollo de la misma a bajas concentraciones. El término
Oligosacarinas se refiere, por tanto, a oligosacáridos de diferente origen
con efectos biológicos en las plantas. Están constituidos por
una cadena de residuos glicósidos, unidos por enlaces glicosídicos
(6, 7).
Tipos, clasificación, localización y estructura
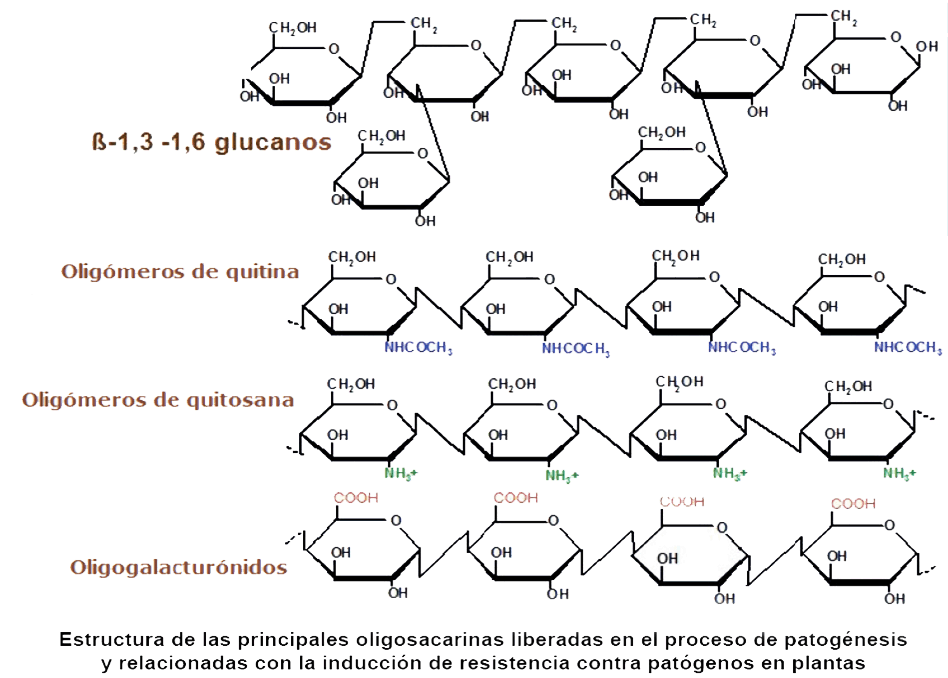
Las Oligosacarinas se denominan de tipo endógena o exógena, de acuerdo a si son obtenidas o liberadas de las paredes celulares de la planta o del patógeno, respectivamente. De acuerdo a su origen existen diferentes tipos (Figura).

Oligosacarinas endógenas
Entre
las endógenas las más conocidas y estudiadas son los Oligogalacturónidos
(Oligosacáridos pécticos) y los Xiloglucanos (Figura).
Los Oligogalacturónidos consisten en una cadena lineal de moléculas
de ácido galacturónico unida por enlaces α-1-4. El número
de restos de D-galacturonatos que contiene el oligosacárido define su
grado de polimerización (5). Se localizan en la porción péctica
que constituye la pared celular de las plantas y en condiciones naturales se
liberan de la pectina mediante hidrólisis enzimática por acción
de la planta o como resultado del ataque de patógenos (4, 5).
Por su parte, los polímeros de Xiloglucanos son los principales polisacáridos
hemicelulósicos que componen la estructura de la pared celular primaria
de las plantas dicotiledóneas y monocotiledóneas no poáceas.
También forman parte de los polisacáridos de reserva en semillas
de dicotiledóneas. Consisten en un esqueleto de residuos de glucosa,
unidos por enlaces ß-1-4, algunos de estos residuos pueden estar sustituidos
por α-Xilosa, ß-Galactosa y α-Fucosa (8). La fragmentación de estos
polímeros por hidrólisis química o enzimática libera
oligosacáridos de xyloglucanos con actividad biológica en plantas
(9, 10). Específicamente, el fenómeno de crecimiento y extensión
a nivel celular está estrechamente relacionado con el metabolismo de
los polímeros de Xiloglucanos y su degradación enzimática,
además de liberar los fragmentos mencionados, provoca el debilitamiento
de la pared celular de la planta (11, 12).
Oligosacarinas exógenas
Entre las exógenas
se conocen los Oligoglucanos, Oligoquitinas, Poli y Oligoquitosanas y Lipo-quitin-oligosacáridos
(Figura).
Entre las oligosacarinas de tipo exógeno, los derivados de quitina y
los oligoglucanos son liberados de la pared celular de diversos patógenos
que los contienen, mediante degradación enzimática por enzimas
glucanasas y quitinasas que se excretan por la planta como respuesta al ataque
del patógeno en el proceso de patogénesis (4, 7). A su vez, los
conocidos como factores Nod (Lipo-oligo-quitinas) son sintetizados de novo y
excretados por bacterias de la familia Rizobiaceae, como respuesta a señales
químicas liberadas por la planta y percibidas por el microorganismo (13).
Otras fuentes de obtención
No obstante, el
origen mencionado, las oligosacarinas pueden ser extraídas de otras fuentes
más ricas en los polisacáridos que las contienen; así la
pectina cítrica comercial es la fuente principal para obtener oligogalacturónidos,
mientras que las semillas de tamarindo son ricas en xiloglucanos. El exoesqueleto
de los crustáceos es muy rico en quitina y la presencia permanente de
esta estructura química de manera natural en la biosfera es de 10 gigatoneladas
(1013 kg) (14). Debido a la versatilidad de aplicaciones de sus derivados, principalmente
la quitosana y la glucosamina, la quitina es producida a escala industrial,
fundamentalmente, a partir de cangrejo, camarón, langosta y langostinos,en
cantidades de alrededor de 10 000 toneladas anuales (14, 15).
Varios grupos de investigación y empresas agrícolas a escala mundial
han comenzado a desarrollar agroquímicos alternativos a base de oligosacarinas,
siendo la elección de la fuente apropiada de obtención de los
polímeros y oligosacáridos uno de los factores fundamentales en
la reducción de costos de obtención y de precios de venta para
los distintos sistemas agrícolas. De esta forma, los productos a base
de quitina y quitosana se obtienen en un 90 %, a partir del exoesqueleto de
los crustáceos que se pescan por millones de toneladas a escala mundial
y que constituyen desechos de esta industria (15).
Otro ejemplo es el de un producto de ß-glucanos que se vende comercialmente.
Una importante empresa francesa (GOEMAR) en colaboración con el Centro
Nacional para las Investigaciones Científicas de Francia desarrollaron
un producto a base de laminarina, el Iodus 40®; (Vacciplant),
extraído de algas marinas, que activa la protección intrínseca
de la planta contra patógenos potenciales cuando se aplica preventivamente
en diversos cultivos de importancia agrícola.
En Cuba, el Grupo de Productos Bioactivos (GPB) del Instituto Nacional de Ciencias
Agrícolas (INCA) desarrolló una metodología de obtención
de una mezcla de oligogalacturónidos activos biológicamente en
plantas, a partir de pectina cítrica comercial, nombrado “Pectimorf”
y se trabaja actualmente en el desarrollo de una metodología para la
preparación de un producto a base de quitosana, derivado de la quitina
de exoesqueleto de langosta cubana, a partir de desechos contaminantes de la
industria pesquera. Ambos productos han demostrado diferentes efectos biológicos
en cultivos de interés económicoA
(16).
EFECTOS BIOLÓGICOS DE LAS OLIGOSACARINAS
Las Oligosacarinas fueron primeramente reconocidas como polisacáridos y oligosacáridos que inducían respuestas defensivas y resistencia en plantas. Sin embargo, estudios posteriores desarrollados en la década de los 90 las implicaron, además, en varias respuestas relacionadas con el crecimiento y el desarrollo del vegetal (6, 17). El descubrimiento de la estructura del principal esqueleto carbonado de los factores de nodulación excretados por las bacterias de la familia Rizobiaceae y su efecto en la morfogénesis de las raíces de las leguminosas, contribuyó a establecer a las oligosacarinas como una nueva jerarquía de hormonas en las plantas, cuya acción precede la síntesis y acumulación de las conocidas hormonas tradicionales (6, 18, 19).
Regulación del crecimiento y desarrollo en las plantas
La aplicación exógena de oligosacarinas influye en el crecimiento y desarrollo de los tejidos de las plantas, estas evidencias han sido fundamentalmente obtenidas con oligosacáridos derivados de los polímeros de la pared celular de plantas y también con derivados de quitina y quitosanaA (20, 21). En la Tabla I se presentan algunos ejemplos de efectos de oligosacarinas endógenas y exógenas en cultivos de importancia comercialB (22, 23, 24, 25, 26, 27).
Dentro de las oligosacarinas endógenas o derivadas de paredes celulares
de plantas, los oligogalacturónidos u oligopectatos han sido los más
ampliamente estudiados, en cuanto a su efecto en el crecimiento y el desarrollo
vegetal. En muchos de los casos estudiados, el efecto provocado en la planta
parece ser el contrario a la acción auxínica.
Se demostró el efecto negativo de los oligogalacturónidos de diferente
grado de polimerización (GP) en el alargamiento de tallos del guisante
inducido por ácido indol acético (AIA), la inhibición de
la formación de raíces en capas celulares delgadas que crecían
en medio de cultivo de enraizamiento, la reducción de la acumulación
de una proteína en medio de cultivo que se induce con ciertos niveles
de AIA en presencia de oligopectatos en el medio y la inhibición de la
división celular, inducida por auxinas en las células parenquimatosas
del floema (5, 28). Sin embargo, resultados posteriores obtenidos con una mezcla
de oligopectatos, comercialmente conocida como Pectimorf (Pm), incluida en el
medio de cultivo in vitro de diferentes especies, con determinado balance
fitohormonal, indican un efecto auxínico basado en la estimulación
del enraizamiento, el incremento de brotes y del crecimiento vegetativo (21,
22, 29).
En adición, se han obtenido con la misma mezcla resultados ex vitro
relacionados con la formación de raíces en niveles similares a
las inducidas con AIAA
(30).
Una aplicación potencial de los oligopectatos (y quizás de otras
oligosacarinas) es la de provocar el incremento de color en algunos frutos.
Recientemente, un grupo de investigación estudió la respuesta
de color de la vid a la aplicación de una mezcla de oligogalacturónidos
con grado de polimerización menor de 20, a escala productiva. Los resultados
mostraron incrementos de color significativamente por encima del control y del
producto comercial (Ethephon) que se utiliza para este propósito. El
incremento estuvo directamente relacionado con aumentos del contenido de antocianinas
(responsables del color en la vid) y además, con la expresión
génica de la fenilalanina amonio liasa (PAL, en inglés) en los
primeros días de la aplicación, enzima que abre varias rutas enzimáticas,
algunas que conllevan a la formación de antocianinas (24). Esta correlación
justifica la posibilidad de que otros inductores de PAL puedan causar incrementos
de color en las uvas.
Fragmentos específicos de Xiloglucanos muestran actividad antiauxínica
o auxínica, en dependencia del tipo de residuos de monosacáridos,
unido a la cadena oligomérica de xiloglucano y de la concentración
utilizada (31, 32). Sus efectos a concentraciones nanomolares los convierten
en señales primarias a las hormonas que regulan.
Estudios más recientes realizados con xiloglucanos, obtenidos de semillas
de tamarindo, mostraron efectos en la promoción del crecimiento primario
de la raíz en interacción con la reducción de la formación
de raíces laterales (33, 34), así como el acortamiento del ciclo
celular, en particular en la fase G1 de la mitosis y la reversión de
la ocurrencia de tamaños mayores o menores de fenotipos celulares, obtenidos
con genotipos particulares de Arabidopsis thaliana (34, 35).
Por su parte, tanto el polímero de quitosana como sus derivados de menor
tamaño se consideran reguladores del crecimiento y del desarrollo de
las plantas, al estimular el crecimiento radical y vegetativo de varias especies
(20, 36), acortar el período de floración y mejorar la floración
y fructificación (37, 38). Incluso se han demostrado incrementos de los
rendimientos y en la calidad en varios cultivos con estos derivados, lo que
ha permitido que sean patentados para estos fines (36, 39). En general, en dependencia
del órgano de la planta que se trate, se han obtenido los resultados
benéficos antes mencionados cuando se hacen tratamientos a las semillas,
a las raíces de las plantas o por aspersión foliar en los momentos
adecuados para cada cultivoB
(36, 39, 40).
A su vez, las aplicaciones exógenas en plantas, principalmente con oligogalacturónidos
y quitosanas (Tabla I),
a escala de casas de cultivo y de campo, han demostrado influencias de estas
oligosacarinas que favorecen el crecimiento y los rendimientos de especies de
importancia económica dentro de las familias Solanáceae, Cucurbitáceae,
Poáceae y Fabáceae, entre otrasA,
B, C
(25, 26, 27, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50). Algunos autores plantean
que la influencia positiva sobre el crecimiento está relacionada con
un efecto antitranspirante en la planta, inducido por el cierre de los estomas
(51, 52).
De acuerdo a un estudio realizado, la reducción del riego de plantas
de pimiento aplicadas con quitosana permitió una mejor adaptación
y consumo del agua por la planta, ya que la aplicación foliar del polímero
redujo el uso del agua por las plantas entre un 26 y un 46 %, mientras que la
producción de biomasa y el rendimiento se mantuvo similar al de las plantas
controles no sometidas al déficit hídrico (53). Esto ocurrió
por disminución de la pérdida de agua a través de los estomas,
debido a un cierre estomático provocado por la quitosana. Este cierre
estomático fue estudiado posteriormente, demostrándose un incremento
del ácido abscísico en las células de las hojas aplicadas
con quitosana, lo que provocó la reducción de la conductancia
estomática (52). Lo anterior justifica el empleo de la quitosana como
antitranspirante para conservar el uso del agua en la agricultura.
Adicionalmente, las oligosacarinas sintetizadas y excretadas por rizobacterias
fijadoras de nitrógeno de la familia Rhizobiaceae, provocan la germinación
de diversas semillas de plantas y están involucradas en los eventos primarios
de las raíces, que conllevan al establecimiento de la simbiosis entre
las leguminosas y las bacterias mencionadas (18, 54, 55). Las estructuras de
estas oligosacarinas consisten en oligosacáridos de quitina de cuatro
o cinco restos de N-acetyl glucosamina unidas a otros grupos complejos que varían
con la especie de Rhizobium. Estas oligoquitinas son las responsables
de inducir las divisiones en las células corticales de la raíz
que inician y conllevan a la formación posterior del nódulo (56).
El GPB del INCA estudió la aplicación de quitosanas en experimentos
in vitro de soya en combinación con el microsimbionte Bradyrhizobium
elkanii. Se demostró que la inclusión de quitosanas de diferente
masa molecular en el medio de crecimiento de la planta, causó el aumento
del número y de la masa seca de los nódulos que se forman en la
raíz, en dependencia de las concentraciones utilizadas. También
se observó un efecto dependiente de la concentración, en el crecimiento
de las plántulas y en el volumen de las raíces producidas. Concentraciones
por encima de 500 mg L-1 no beneficiaron el crecimiento de las raíces
y el sistema aéreo de las plantasD
(57, 58).
INDUCCIÓN DE RESISTENCIA EN PLANTAS CONTRAN PASTÓGENOS
Oligosacáridos de ß-Glucanos
Los oligosacáridos
derivados de los polímeros de ß-glucanos, que conforman la pared
celular de patógenos del género Phytophthora, han sido bien documentados
como inductores de respuestas defensivas en plantas. Así, un hepta-ß-glucósido
ramificado, obtenido del glucano de la pared de Phytophthora sojae
por hidrólisis ácida, demostró ser un elicitor muy activo
de la síntesis de la fitoalexina gliceolina en células cotiledonales
de soya (59), demostrándose, además, que la hidrólisis
parcial del glucano de P. sojae liberaba fragmentos con actividad elicitora
en diferentes plantas de la familia Fabaceae (60), lo que indica un sistema
similar de percepción en esta familia de plantas.
En células de tabaco, el hepta-ß-glucósido no actuó
como elicitor; sin embargo, una cadena linear de ß 1-3 glucano (laminarina),
extraída del alga Laminaria digitata mostró ser un elicitor activo
de respuestas defensivas (61) e incluso causó la reducción de
la infección fungosa en hojas de vid (62). A partir de resultados como
los citados anteriormente (Tabla
II), la empresa francesa GOEMAR en colaboración con el Centro Nacional
para las Investigaciones Científicas, desarrollaron un producto a base
de laminarina, el Iodus 40® (Vacciplant), extraído de algas
marinas que activa la protección intrínseca de la planta contra
patógenos potenciales cuando se aplica preventivamente.

Oligosacáridos pécticos u Oligogalacturónidos
Los oligogalacturónidos
derivados de los polisacáridos pécticos de las paredes celulares
de las plantas han sido descritos como inductores de una gran variedad de respuestas
defensivas en células, órganos y plantas completas de numerosas
especies, entre las que se encuentran la inducción de fitoalexinas, inhibidores
de proteinasas, proteínas PR y el proceso de lignificación (5,
7).
Los oligogalacturónidos se pueden generar de las sustancias pécticas
de la pared celular primaria de la planta por hidrólisis ácida
parcial o por acción de enzimas pectinasas o pectatoliasas de patógenos.
Es conocido además que, sin importar el método de generación,
son dependientes del grado de polimerización (GP) para la inducción
de respuestas defensivas, siendo los GP entre 10 y 12 los más activos
(5, 7).
En la última década se informó la protección de
dos especies de importancia económica (Tabla
II), contra sus principales patógenos, por inducción de resistencia
con oligogalacturónidosA
(63). Es importante destacar que, a diferencia de las quitosanas, los oligogalacturónidos
y los ß-glucanos no tienen acción directa antimicrobiana sobre
los microorganismos, por lo que la protección que puedan ejercer en los
cultivos es debida a la activación de resistencia inducida en las plantas.
Polímeros y oligosacáridos de quitosana
La quitina, un
polímero de N-acetil-glucosamina unido por enlaces ß 1-4, es un
componente común de las paredes celulares de varias familias de hongos
(64). Sus fragmentos (N-acetil quitooligosacáridos) han estado implicados
en la inducción de una gran variedad de respuestas vinculadas a la defensa
de la planta, como son la inducción de fitoalexinas, lignificación,
proteínas PR, la expresión de genes defensivos y otros; fundamentalmente,
en especies del grupo de las monocotiledóneas y, especialmente, en suspensiones
celulares de arroz (65).
También se ha estudiado la activación de respuestas secundarias
vinculadas a la transducción de la señal defensiva por fragmentos
de quitina, entre las que se destacan cambios en el flujo iónico y fosforilación
de proteínas, despolarización de la membrana plasmática
y eflujo de iones Cl- y K+, acidificación citoplasmática, generación
de especies reactivas de oxígeno y biosíntesis de ácido
jasmónico (7, 65, 66).
La quitosana es un polímero de ß 1-4 glucosamina, componente natural
de las paredes celulares de los hongos Zygomycetos (64). Tanto el polímero
como sus oligómeros son potentes inductores de respuestas defensivas
y de resistencia en la planta contra patógenos. Sin embargo, las concentraciones
requeridas para la activación de las respuestas defensivas son superiores
a aquellas necesarias para inducir dichas actividades con los oligómeros
de quitina (7, 65).
Como en el caso de los oligogalacturónidos, los fragmentos de quitina
(y también los de quitosana) son dependientes del grado de polimerización
(GP) de la molécula en la activación de las respuestas defensivas
antes mencionadas, siendo los tamaños por encima de GP 4 y principalmente
el heptámero y el octámero los que inducen las respuestas a las
menores concentraciones (7, 66).
La quitosana es, entre las oligosacarinas, la más estudiada y de mayores
aplicaciones en el campo de la agricultura de pre y pos-cosecha. Posee tres
características esenciales en su actividad biológica que la hacen
deseable en este campo, benefician el aumento del crecimiento y los rendimientos
de muchos cultivos probados; causan la inducción defensiva y de resistencia
contra patógenos en plantas aplicadas y, a diferencia de las otras oligosacarinas
estudiadas; provoca la inhibición del crecimiento y desarrollo de micro-organismos
en general (16, 67, 68, 69, 70). Es reconocido que su actividad biológica
está relacionada con las cargas positivas libres, presentes en el grupo
amino en condiciones de acidez, que interactúan con cargas contrarias
de componentes de la pared celular y las membranas de microorganismos y plantas.
Actividad antimicrobiana de las quitosanas
La actividad antimicrobiana de la quitosana ha sido documentada tanto en experimentos in vitro como in situ (14, 67). La literatura informa que la inhibición del desarrollo de muchos patógenos, que incluyen hongos, bacterias y oomycetes, está altamente correlacionada con el incremento de la concentración de quitosana en el medio de crecimiento, indicando que en la medida en que aumenta la concentración se incrementa la inhibición, existiendo diferencias entre acción fungistático y fungicida, de acuerdo a las concentraciones probadas (Tabla III).
Desde hace más de dos décadas se han evaluado estos compuestos
sobre todos los estadios del ciclo de vida de los hongos, siendo las estructuras
reproductivas las más afectadas (14, 67).
El estudio del efecto de la quitosana en el grupo de los oomycetes es más
reciente. Algunos autores han demostrado que polímeros de quitosana afectan
el desarrollo vegetativo de aislados del género Phytophthora. El aumento
de la concentración en dependencia de la especie causa una disminución
significativa del crecimiento de las colonias, lo cual se ha podido observar
en especies como P. nicotianae, P. capsici y P. palmivora,
todos ellos patógenos importantes de numerosas especies de plantasE
(71, 72, 73, 74). Algunas de estas especies son más sensibles que otras,
por ejemplo, P. nicotianae y P. capsici redujeron su crecimiento
vegetativo más de un 50 % con alrededor de 0,5 g L-1 (71,
73, 74), mientras que P. palmivora necesitó más de 2
g L-1 E.
Entre oomycetes y hongos verdaderos, los resultados muestran, en general, una
aparente mayor sensibilidad en los primeros, como se ha observado al comparar
experimentos entre Phytophthora y Pythium contra especies
de diferentes grupos de hongos; siendo incluso, mucho menos sensibles algunos
hongos nematófagos y entomopatógenos (71, 74, 75).
Otros estadios de los microorganismos, como son las estructuras reproductivas
y de dispersión asexual, pueden ser más sensibles que las de crecimiento
vegetativo. La inhibición de la germinación de esporas por quitosana
se ha observado en numerosos hongos, tales como Aspergillus niger, Alternaria
alternata, Rhizopus stolonifer, Mucor sp. y Pochonia
chlamydosporia (74, 75, 76, 77, 78, 79, 80).
Dentro de los oomycetes, el género Phytophthora ha sido de los más
estudiados. Polímeros y oligómeros de quitosana causan la inhibición
de la formación y germinación de zoosporas y zoosporangios en
P. capsici, P. nicotianae y P. palmivoraE
(16, 71, 72, 73).
Las propiedades físico-químicas de estos compuestos también
influyen en la inhibición del crecimiento de los microorganismos. Por
ejemplo, la reducción de la masa molecular del polímero y del
grado de acetilación aumenta la inhibición del crecimiento micelial
y la germinación de esporas de Phytophthora nicotianae (16,
73). De manera similar, en Rhizopus stolonifer, variaciones desde 1,0
hasta 2,0 g L-1 no alteraron la formación o germinación
de esporas; sin embargo, se observó inhibición de estos procesos
al emplear quitosanas de diferente masa molecular (76).
Se sugiere que la acción antimicrobiana de la quitosana se deba principalmente,
al carácter policatiónico de la molécula cuando se encuentra
en soluciones a pH por debajo de 6,0, ya que los grupos aminos, cargados positivamente,
pueden interactuar con los fosfolípidos de las membranas celulares de
los microorganismos y alterar su permeabilidad. Esto puede provocar desbalances
osmóticos que conllevan a desorganizaciones estructurales y finalmente
puede culminar con la lisis celular (67, 81). Para el caso de las oligoquitosanas
se ha demostrado la internalización de estas moléculas en la célula
microbiana y se especula su posible interacción con el ADN de la misma
(72). La magnitud de las afectaciones encontradas puede variar, fundamentalmente,
en dependencia de las propiedades físico-químicas del polímero
y las concentraciones que se empleen (14, 67).
A pesar de las numerosas bondades de la quitosana demostradas en decenas de
trabajos y del incremento en el número de patentes de aplicación
en los últimos 15 años, puede considerarse este polímero
todavía no muy explotado en el contexto agrícola mundial. De hecho,
la mayoría de los productos agrícolas con base quitosana (Elexa®,
Chitogel®, Aminogro®, Chito-Plant®,
Chito-Care®, etc) comenzaron a aparecer aproximadamente hace una
década y no tienen todavía una demanda o producción elevada
(41, 82). Sin embargo, recientemente se ha notado un impulso de las evaluaciones
de quitosana en condiciones controladas, no controladas y de invernaderoA
(16, 41, 82, 83) e incluso su extensión y evaluación como resultado
de decisiones gubernamentales. En la actualidad este polímero es reconocido
dentro de los biopesticidas como un “derivado de crustáceos activador
de la defensa de las plantas” (84).
Protección de las plantas por quitosanas ante el estrés biótico
La protección de los cultivos contra sus principales enfermedades, mediante aplicaciones de quitosanas, se ha estudiado por más de 20 años en diferentes interacciones planta-patógeno por numerosos grupos de investigación a escala mundial. Varios ejemplos de protección informadas en diferentes especies y distintos momentos del cultivo se referencian en la Tabla II (70, 73, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100). La protección encontrada contra el ataque de patógenos puede deberse a la actividad antimicrobiana que estos polímeros y oligómeros ejercen sobre los microorganismos o puede ser el resultado de la elevación de la resistencia basal de la planta, causada por la activación de resistencia inducida que ejercen estos compuestos en el vegetal. En muchos casos pueden ocurrir simultáneamente ambos efectos (16, 67, 69, 70).
Protección de las plantas por oligosacarinas ante el estrés abiótico
Estudios más
recientes han demostrado las potencialidades de las oligosacarinas en la protección
de algunas especies contra diferentes manifestaciones del estrés abiótico.
La mayoría de los estudios divulgados se refieren a evaluaciones y resultados
de la última década con oligosacarinas exógenas; sin embargo,
resultados con oligosacarinas endógenas han resultado incluso en la publicación
de patentes.
En este sentido, fue patentado un proceso para la adaptación de plantas
a diferentes estreses abióticos, que incluye la aspersión foliar
de un derivado de xiloglucano en condiciones particulares de aplicación.
De acuerdo a los autores, el proceso beneficia el crecimiento de las plantas,
bajo diferentes tipos de estrés, que incluyen bajas temperaturas, sequía,
humedad o salinidad, mediante la estimulación de enzimas y compuestos
que reducen los niveles de las especies reactivas de oxígeno que se liberan
durante el estrés y amplifican, además, algunas señales
que conllevan a la formación y activación de las hormonas tradicionales
que actúan en la célula vegetal (101).
Un creciente número de resultados de protección contra el estrés
abiótico se han informado en plantas con diferentes tipos de tratamiento
con quitosanas. Los estudios abarcan desde ensayos controlados hasta experimentos
en mayor escala, así como en diferentes cultivos. Por su parte, las aplicaciones
pueden ser por recubrimiento o imbibición de semillas, durante un corto
tiempo con altas concentraciones o lo inverso, concentraciones menores y mayores
tiempos de contacto, en dependencia del tipo de semilla. También se han
obtenido buenos resultados con tratamientos por aspersión foliar, aplicación
al sustrato de crecimiento o por inclusión de estacas o raíces
en soluciones de quitosana.
Las diferentes manifestaciones del estrés abiótico han sido ensayadas
con mayor o menor éxito, en dependencia de las condiciones de experimentación.
Algunos ejemplos de protección de especies contra diferentes manifestaciones
del estrés abiótico se resumen en la Tabla
IV (102, 103, 104, 105, 106).

BONDADES ECOLÓGICAS DE LAS OLIGOSACARINAS
El propio origen
y estructura química oligosacárida de las oligosacarinas habla
ya de sus posibles características no tóxicas. Los oligogalacturónidos
que forman parte del Pectimorf se extraen mediante hidrólisis enzimática
de pectina cítrica, materia prima utilizada ampliamente en la industria
alimenticia y el producto final es biodegradable por microorganismos del suelo,
una vez aplicado, no quedando trazas del producto en la planta o sustratoF.
Algo similar sucede con los productos basados en quitina y quitosana ya que
aunque esta puede ser tóxica para muchos fitopatógenos del suelo,
resulta una fuente de carbono excelente para otros. Por otra parte, los productos
de quitina y quitosana son ampliamente utilizados para la medicina humana y
animal, la cosmética, así como en la industria ,debido a su inocuidad
para el hombre (15, 107).
Otro aporte ecológico importante de ambos productos lo constituye el
hecho de que las materias primas (pectina y quitina industrial) de donde se
obtienen cada uno, constituyen el valor agregado que se obtiene de subproductos
potencialmente contaminantes de las industrias alimentaria y pesquera respectivamente,
ya que constituyen los desechos de la producción de jugos y del exoesqueleto
de los crustáceos que se pescan para el consumo humano. Por tanto, la
preparación de ambos productos ofrece una salida económica y ecológica
a subproductos de ambas industrias.
RESULTADOS Y PERSPECTIVAS DE PRODUCTOS CUBANOS A BASE DE OLIGOSACARINAS
El GPB del INCA
tiene una experiencia de 20 años en el estudio de las oligosacarinas,
su preparación y efectos en plantas. El grupo desarrolla productos a
base de oligogalacturónidos (Pectimorf®) y quitosanas -QuitoMax®-,
como principales agentes activos, a partir de metodologías propias. Ambos
ejercen diferentes efectos biológicos en plantas y permiten diversas
aplicaciones como productos alternativos para diferentes agroquímicos.
El Pectimorf (Pm) promueve el desarrollo de raíces en plantas a concentraciones
entre 5 y 20 mg L-1, lo que se ha demostrado en experimentos de tratamiento
de semillas, esquejes y mediante aspersión foliar y en combinación
de las formas de aplicación mencionadas en cultivos como hortalizas,
frutales y plantas ornamentales (25, 26, 27). Este producto se introduce y extiende
como enraizador en la agricultura cubana por todo el país y se están
probando nuevas presentaciones del producto para facilitar su utilización
por los agricultores.
Los incrementos en el desarrollo foliar y del crecimiento de la planta, también
han sido observados en solanáceas y leguminosas, así como de los
rendimientos en soya y frijoles (26, 27, 108). Igualmente, se ha demostrado
un efecto positivo en la activación del crecimiento en plantas ornamentales
de crecimiento lento como la Areca, el Anturium y las orquídeas, mediante
la aspersión foliar del Pm en diferentes concentraciones y momentos de
aplicación (25, 109, 110).
En el cultivo in vitro, el Pectimorf ha sido ampliamente estudiado,
demostrándose su capacidad como sustituto de hormonas tradicionales,
auxinas y citoquininas, en diferentes estadios y en diversos cultivos como la
caña de azúcar, el café, los cítricos, la papa,
el tomate, el tabaco, el banano, el arroz, el ajo, entre otrosF
(21, 22, 23, 29). En este caso también se han observado beneficios al
cultivo como la promoción del enraizamiento, el incremento de brotes,
así como resultados beneficiosos en el estadio de adaptación ex
vitro. Otros resultados encontrados con el Pm son el retraso en la apertura
de flores recién cortadas, específicamente en rosas y el incremento
de brotes en violetas tratadas por aspersión del productoF.
Con el Pectimorf también se han realizado estudios relacionados con la
protección de las plantas contra diferentes tipos de estrés. Por
ejemplo, se evaluó la inducción de respuestas defensivas y protección
contra oomycetes (Phytophthora) en tomate y tabaco, mediante tratamiento de
semillas y aspersión foliarA.
En relación con el estrés abiótico, se ha evaluado el potencial
de esta mezcla de oligogalacturónidos en la protección de plantas
de tomate contra el estrés por metales pesados, encontrándose
que la imbibición previa de semillas de tomate con Pm permitió
reducir la afectación de las plántulas que crecían en un
sustrato envenenado con cobre, obteniéndose valores en las variables
de crecimiento semejantes al control cultivado en sustrato carente del metal
(111).
El GPB ha desarrollado metodologías para la preparación de compuestos
de quitosana con diferentes características químico-físicas.
De esta forma se estudiaron las potencialidades biológicas de quitosana
en polímero, parcialmente hidrolizada y de oligosacáridos de quitosana,
encontrándose diferencias en su accionar biológico en dependencia
de la masa molecular y el grado de acetilación en el grupo amino. Estos
compuestos han sido investigados como inductores de resistencia contra patógenos
en cultivos como tabaco, tomate, soya y arroz y, además, como inhibidores
de los patógenos fundamentales de estos cultivosD,
E (16, 73, 74, 112, 113,
114). Igualmente fueron demostradas sus potencialidades para aumentar el crecimiento
y los rendimientos en cultivos de interés como tabaco, tomate, maíz
y pepinoB (16, 115,
116).
A partir de los resultadosen los cultivos mencionados, el GPB desarrolló
un formulado de quitosana conocido como QuitoMax® que se encuentra
en fase de registro como bioestimulante en presentación líquida
y se continúan sus validaciones en campo mediante extensiones y campos
controles en diferentes provincias de Cuba. En este sentido, durante tres campañas
agrícolas (2012-2015) el QuitoMax® se ha extendido de cientos
a miles de hectáreas en el país fundamentalmente en los cultivos
de papa, frijol y maíz. En la campaña 2014-2015 se generalizó
en las 1700 ha de papa plantadas en la provincia de Mayabeque y se extendió
en cientos de hectáreas de Matanzas y Ciego de Ávila obteniéndose
incrementos de más de tres toneladas por hectárea como promedio.
En frijol se generalizó en más de 2000 ha en la misma provincia
y en más de 1000 ha a nivel nacional en el cultivo del maíz. Adicionalmente,
se ha extendido en decenas de hectáreas en el cultivo del tomate y el
tabaco en la provincia de Granma.
Los estudios realizados en las pruebas de validación del QuitoMax®
sustentan la preparación de polímeros de quitina y quitosana a
partir del exoesqueleto de la langosta cubana, que constituye actualmente un
desecho contaminante de la industria pesquera, con el fin de ser aplicados en
la agricultura a mayor escala. Entre las ventajas de su utilización para
este fin se puede agregar que son compuestos no tóxicos y biodegradables
una vez liberados al ambiente y se pueden obtener, a través de metodologías
no contaminantes, de materias primas nacionales que constituyen desechos (16).
A lo anterior debe añadirse su acción antimicrobiana contra patógenos
y su compatibilidad, e incluso, acción sinérgica con varios controles
biológicos; la activación de resistencia inducida contra posteriores
ataques de patógenos, cuando se aplican previamente en los cultivos y
el demostrado efecto de promover el crecimiento, desarrollo vegetativo y el
rendimientoB (16, 70,
73).
Los resultados del GPB demuestran el incremento del crecimiento y los rendimientos
que van desde el 10 al 60 % por encima de los controles, en dependencia del
producto evaluado (Pectimorf o QuitoMax®), las diferentes formas
de aplicación experimentadas en el cultivo y la localidad de que se trateB,
B, C.
Estos resultados promisorios, algunos en fase de extensión, se han demostrado
en cultivos como tabaco, tomate, papa, maíz, arroz, pepino, soya y frijol.
En estos dos últimos se ha demostrado un efecto sinérgico de ambos
productos por separado con los microorganismos fijadores biológicos de
nitrógeno que se utilizan como biofertilizantes de dichos cultivosC
(108).
El grupo ha diseñado y desarrollado además, un nuevo concepto
dentro de los biofertilizantes para la fijación biológica del
nitrógeno, basado en la obtención de biopreparados a base de rizobios
y enriquecidos en factores de nodulación, oligosacarinas sintetizadas
y excretadas por estos microorganismos simbiontes de las leguminosas (117, 118).
Al explotar una mayor presencia de estas macromoléculas en dichos biopreparados,
se logra un valor agregado que va más allá del simple aumento
de la biomasa bacteriana para proponer además, un mayor número
de las estructuras que inducen los primeros eventos en la formación de
los nódulos donde se fijará posteriormente el nitrógeno
atmosférico.
La comparación de biofertilizantes tradicionales para soya con aquel
enriquecido en factores de nodulación (conocido comercialmente como Azofert),
demostró las ventajas del segundo en la formación de nódulos
en las raíces y el aumento del crecimiento y los rendimientos del cultivo
(119). Resultados adicionales demuestran que la presencia de estas oligosacarinas
en los biopreparados provoca una mayor protección en cultivos de soya
contra el estrés biótico y abiótico (120, 121).
Las más recientes investigaciones y validaciones del GPB que se ejecutan
a escala de campo, vislumbran en promisorios resultados en los cultivos del
frijol y la soya, un efecto sinérgico entre oligosacarinas exógenas
y endógenas con inóculos microbianos, lo que permite considerar
la utilización de oligogalacturónidos y quitosanas para la potenciación
sinérgica o aditiva del biofertilizante respectivo, en el proceso simbiótico
y de crecimiento de las leguminosas.
CONCLUSIONES
Las oligosacarinas
constituyen compuestos naturales, no tóxicos y biodegradables, con diversos
efectos biológicos en plantas y microorganismos que le confieren atractivos
para su aplicación en la agricultura sostenible e intensiva, en la sustitución
de agroquímicos para la protección de las plantas contra enfermedades
y como sustitutos de reguladores del crecimiento.
Aunque son estructuras que forman parte de las paredes celulares de plantas
y microorganismos, existen otras fuentes, comerciales o de desechos industriales,
que permiten abaratar su obtención, la cual, puede realizarse mediante
métodos químicos, físicos y enzimáticos, que no
resultan de alto costo.
Resultados del GPB, tanto en el desarrollo de productos a base de oligosacarinas
como en su aplicación y extensión a escala productiva, demuestran
la potencial introducción de algunos de estos productos en el beneficio
de la agricultura cubana e internacional, como sustitutos de hormonas en el
cultivo in vitro, alternativas de protección contra el estrés
y reguladores del crecimiento y los rendimientos de los cultivos.
AGRADECIMIENTOS
Los autores quieren agradecer a la International Foundation for Science (IFS) y a la Organisation for the Prohibition of Chemical Weapons (OPCW) por su contribución a las investigaciones que conllevaron a los resultados del Grupo de Productos Bioactivos del INCA que se recogen en esta revisión. El apoyo de esta organización se realizó a través de los proyectos F-4446-1 y F-4446-2F mediante financiamiento para equipamiento, reactivos, material informático e información científica.
Notas al pie
A Falcón, A. B.; Cabrera, J. C.; Reinaldo, I. M. y Nuñez, M. N. Desarrollo de activadores de las plantas de amplio espectro de acción. Informe Final del PNCT, no. 00100191, Inst. CITMA, Cuba, 2005.
B Falcón, A. B. Evaluación de Oligosacarinas nacionales de quitosana en la estimulación del crecimiento, la nodulación y la protección de cultivos de interés económico. Informe Final del PNCT, no. 00300277, Inst. CITMA, 2009, p. 77.
C Falcón, A. B. Compuestos de quitosana como activadores del metabolismo, el crecimiento y la resistencia contra el estrés biótico en cultivos de interés económico. Informe Final del PNCT, no. 00300330, Inst. CITMA, 2012, 70 p.
D Costales, D. Quitosacáridos en la nodulación y el crecimiento de soya (Glycine max (L) Merril) inoculada con Bradyrhizobium elkanii. Tesis de Maestría, Instituto Nacional de Ciencias Agrícolas, Mayabeque, Cuba, 2010, 56 p.
E González, P. D. Efecto de un polímero de quitosana en el desarrollo de Phytophthora nicotianae y Phytophthora palmivora. Tesis de Maestría, Facultad de Biología, Universidad de la Habana, La Habana, Cuba, 2011, 50 p.
F Cabrera, J. C. Obtención y purificación de oligogalacturónidos bioactivos a partir de la pectina cítrica. Informe Final del PNCT, no. 002, Inst. CITMA, La Habana, Cuba, 2000, p. 150.
BIBLIOGRAFÍA
1. Agrios, G.
N. ‘‘How pathogens attack plants’’. En: Plant Pathology, edit. Academic Press,
25 de enero de 2005, pp. 37-82, ISBN 978-0-08-047378-9.
2. Agrios, G. N. ‘‘How plants defend themselves against pathogens’’. En: Plant
Pathology, edit. Academic Press, 25 de enero de 2005, pp. 107-161, ISBN 978-0-08-047378-9.
3. Ebel, J. y Mithöfer, A. ‘‘Early events in the elicitation of plant defence’’.
Planta, vol. 206, no. 3, agosto de 1998, pp. 335-348, ISSN 0032-0935,
1432-2048, DOI 10.1007/s004250050409.
4. Esquerré, T. M. T.; Boudart, G. y Dumas, B. ‘‘Cell wall degrading
enzymes, inhibitory proteins, and oligosaccharides participate in the molecular
dialogue between plants and pathogens’’. Plant Physiology and Biochemistry,
vol. 38, no. 1-2, enero de 2000, pp. 157-163, ISSN 0981-9428, DOI 10.1016/S0981-9428(00)00161-3.
5. Ridley, B. L.; O’Neill, M. A. y Mohnen, D. ‘‘Pectins: structure, biosynthesis,
and oligogalacturonide-related signaling’’. Phytochemistry, vol. 57,
no. 6, julio de 2001, pp. 929-967, ISSN 0031-9422, DOI 10.1016/S0031-9422(01)00113-3.
6. Côté, F.; Ham, K. S.; Hahn, M. G. y Bergmann, C. W. ‘‘Oligosaccharide
Elicitors in Host-Pathogen Interactions’’ [en línea]. En: Plant-Microbe
Interactions, edit. Springer US, 1998, pp. 385-432, ISBN 978-1-4899-1709-6,
[Consultado: 1 de diciembre de 2015], Disponible en: <http://link.springer.com/pter/10.1007/978-1-4899-1707-2_13>.
7. Shibuya, N. y Minami, E. ‘‘Oligosaccharide signalling for defence responses
in plant’’. Physiological and Molecular Plant Pathology, vol. 59, no.
5, noviembre de 2001, pp. 223-233, ISSN 0885-5765, DOI 10.1006/pmpp.2001.0364.
8. Hayashi, T. ‘‘Xyloglucans in the Primary Cell Wall’’. Annual Review of
Plant Physiology and Plant Molecular Biology, vol. 40, no. 1, 1989, pp.
139-168, ISSN 0066-4294, DOI 10.1146/annurev.pp.40.060189.001035.
9. Cutillas, I. A.; Fulton, D. C.; Fry, S. C. y Lorences, E. P. ‘‘Xyloglucan-derived
oligosaccharides induce ethylene synthesis in persimmon (Diospyros kaki
L.) fruit’’. Journal of Experimental Botany, vol. 49, no. 321, 4 de
enero de 1998, pp. 701-706, ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/49.321.701.
10. Marry, M.; Cavalier, D. M.; Schnurr, J. K.; Netland, J.; Yang, Z.; Pezeshk,
V.; York, W. S.; Pauly, M. y White, A. R. ‘‘Structural characterization of chemically
and enzymatically derived standard oligosaccharides isolated from partially
purified tamarind xyloglucan’’. Carbohydrate Polymers, vol. 51, no.
3, 15 de febrero de 2003, pp. 347-356, ISSN 0144-8617, DOI 10.1016/S0144-8617(02)00189-3.
11. Cutillas, I. A. y Lorences, E. P. ‘‘Effect of Xyloglucan Oligosaccharides
on Growth, Viscoelastic Properties, and Long-Term Extension of Pea Shoots’’.
Plant Physiology, vol. 113, no. 1, 1 de enero de 1997, pp. 103-109,
ISSN 1532-2548, DOI 10.1104/pp.113.1.103.
12. Kaku, T.; Tabuchi, A.; Wakabayashi, K.; Kamisaka, S. y Hoson, T. ‘‘Action
of Xyloglucan Hydrolase within the Native Cell Wall Architecture and Its Effect
on Cell Wall Extensibility in Azuki Bean Epicotyls’’. Plant and Cell Physiology,
vol. 43, no. 1, 15 de enero de 2002, pp. 21-26, ISSN 0032-0781, 1471-9053, DOI
10.1093/pcp/pcf004.
13. Spaink, H. P. ‘‘Root Nodulation and Infection Factors Produced by Rhizobial
Bacteria’’. Annual Review of Microbiology, vol. 54, no. 1, 2000, pp.
257-288, ISSN 0066-4227, 1545-3251, DOI 10.1146/annurev.micro.54.1.257.
14. Badawy, M. E. I. y Rabea, E. I. ‘‘A Biopolymer Chitosan and Its Derivatives
as Promising Antimicrobial Agents against Plant Pathogens and Their Applications
in Crop Protection’’. International Journal of Carbohydrate Chemistry,
vol. 2011, 19 de junio de 2011, p. 29, ISSN 1687-9341, DOI 10.1155/2011/460381.
15. Harish, P. K. V. y Tharanathan, R. N. ‘‘Chitin/chitosan: modifications and
their unlimited application potential-an overview’’. Trends in Food Science
& Technology, vol. 18, no. 3, marzo de 2007, pp. 117-131, ISSN 0924-2244,
DOI 10.1016/j.tifs.2006.10.022.
16. Falcón, R. A.; Rodríguez, A. T.; Ramírez, M. A.; Rivero,
D.; Martínez, B.; Cabrera, J. C.; Costales, D.; Cruz, A.; González,
L. G.; Jiménez, M. C.; Jiménez, L.; Hernández, I.; Gonzáles,
P. D. y Márquez, R. ‘‘Chitosans as bioactive macromolecules to protect
conomically relevant crops from their main pathogens’’. Biotecnología
Aplicada, vol. 27, no. 4, diciembre de 2010, pp. 305-309, ISSN 1027-2852.
17. Marfà, V.; Gollin, D. J.; Eberhard, S.; Mohnen, D.; Albersheim, P.
‘‘Oligogalacturonides are able to induce flowers to form on tobacco explants’’.
The Plant Journal, vol. 1, no. 2, 1991, pp. 217–225, ISSN 1365-313X,
0960-7412, DOI http://dx.doi.org/10.1111/j.1365-313X.1991.00217.x.
18. Prithiviraj, B.; Souleimanov, A.; Zhou, X. y Smith, D. L. ‘‘Differential
response of soybean (Glycine max (L.) Merr.) genotypes to lipo-chito-oligosaccharide
Nod Bj V (C(18:1) MeFuc)’’. Journal of Experimental Botany, vol. 51,
no. 353, diciembre de 2000, pp. 2045-2051, ISSN 0022-0957, DOI http://dx.doi.org/10.1093/jexbot/51.353.2045.
19. Gage, D. J. ‘‘Infection and invasion of roots by symbiotic, nitrogen-fixing
rhizobia during nodulation of temperate legumes’’. Microbiology and molecular
biology reviews: MMBR, vol. 68, no. 2, junio de 2004, pp. 280-300,
ISSN 1092-2172, DOI 10.1128/MMBR.68.2.280-300.2004.
20. Chibu, H.; Shibayama, H. y Arima, S. ‘‘Effects of Chitosan Application on
the Shoot Growth of Rice and Soybean’’. Japanese Journal of Crop Science,
vol. 71, no. 2, 2002, pp. 206-211, ISSN 1349-0990, 0011-1848, DOI 10.1626/jcs.71.206.
21. Cid, M.; González, O. J. L.; Lezcano, Y. y Nieves, N. ‘‘Influencia
del Pectimorf sobre la calidad de la semilla artificial de caña de azúcar
(Saccharum spp)’’. Cultivos Tropicales, vol. 27, no. 1, 2006,
pp. 31–34, ISSN 0258-5936.
22. Nieves, N. ‘‘Evaluación del Pectimorf como complemento del 2,4-D
en el proceso de embriogénesis somática de caña de azúcar
(Saccharum sp.)’’. Cultivos Tropicales, vol. 27, no. 1, 2013,
pp. 25–30, ISSN 0258-5936.
23. Izquierdo, H.; Núñez, M.; González, M. C.; Proenza,
R. y Cabrera, J. C. ‘‘Influencia de un oligogalacturónido en la aclimatización
de vitroplantas de banano (Musa spp.) del clon FHIA-18 (AAAB)’’. Cultivos
Tropicales, vol. 30, no. 1, marzo de 2009, pp. 00-00, ISSN 0258-5936.
24. Ochoa, V. M.; Vargas, A. I.; Islas, M. A.; González, A. G. y Martínez,
T. M. Á. ‘‘Pectin-derived oligosaccharides increase color and anthocyanin
content in Flame Seedless grapes’’. Journal of the Science of Food and Agriculture,
vol. 91, no. 10, 15 de agosto de 2011, pp. 1928-1930, ISSN 1097-0010, DOI 10.1002/jsfa.4412.
25. Benítez, B.; Soto, F.; Yong, A. y Núñez, M. ‘‘Crecimiento
de plantas de palma areca (Dypsis lutescens, H. Wendel) con aspersiones
foliares de una mezcla de oligogalacturónidos’’. Cultivos Tropicales,
vol. 29, no. 3, septiembre de 2008, pp. 81-85, ISSN 0258-5936.
26. Alvarez, B. I.; Reynaldo, E. I.; Cartaya, R. O. y Teheran, Z. ‘‘Efectos
de una mezcla de oligogalacturónidos en la morfología de hortalizas
de importancia económica’’. Cultivos Tropicales, vol. 32, no.
3, septiembre de 2011, pp. 52-57, ISSN 0258-5936.
27. Terry, A. E.; Ruiz, P. J.; Tejeda, P. T.; Reynaldo, E. I. y Díaz,
de A. M. M. ‘‘Respuesta del cultivo de la lechuga (Lactuca sativa L.)
a la aplicación de diferentes productos bioactivos’’. Cultivos Tropicales,
vol. 32, no. 1, 2011, pp. 28-37, ISSN 0258-5936.
28. Spiro, M. D.; Bowers, J. F. y Cosgrove, D. J. ‘‘A Comparison of Oligogalacturonide-
and Auxin-Induced Extracellular Alkalinization and Growth Responses in Roots
of Intact Cucumber Seedlings’’. Plant Physiology, vol. 130, no. 2,
10 de enero de 2002, pp. 895-903, ISSN 1532-2548, DOI 10.1104/pp.006064.
29. Plana, D. ‘‘Actividad biológica del Pectimorf en la morfogénesis
in vitro del tomate (Lycopersicon esculentum, Mill) var. Amalia’’.
Cultivos Tropicales, vol. 24, no. 1, 2003, pp. 29–33, ISSN 0258-5936.
30. Falcón, A. B. ‘‘Actividad enraizadora de una mezcla de oligogalacturónidos
en pecíolos de violeta africana’’. Cultivos Tropicales, vol.
28, no. 2, 2012, pp. 87–90, ISSN 0258-5936.
31. McDougall, G. J. y Fry, S. C. ‘‘Xyloglucan Oligosaccharides Promote Growth
and Activate Cellulase: Evidence for a Role of Cellulase in Cell Expansion’’.
Plant Physiology, vol. 93, no. 3, 7 de enero de 1990, pp. 1042-1048, ISSN
1532-2548, DOI 10.1104/pp.93.3.1042.
32. Vargas, R. C.; Reicher, F.; Sierakowski, M. R.; Heyraud, A.; Driguez, H.
y Liénart, Y. ‘‘Xyloglucan Octasaccharide XXLGol Derived from the Seeds
of Hymenaea courbaril Acts as a Signaling Molecule’’. Plant Physiology,
vol. 116, no. 3, 3 de enero de 1998, pp. 1013-1021, ISSN 1532-2548, DOI 10.1104/pp.116.3.1013.
33. Acosta, A.; Rocha, M. y González, P. L. ‘‘Molecular and morphological
evidences of the effect of xyloglucans on stress-response in Arabidopsis
thaliana’’. En: Memorias del IV Simposio Internacional en Bioquímica
y Biología Molecular, edit. Centro internacional de conferencias de La
Habana, La Habana, Cuba, 2009.
34. Cabrera, J. C.; Wégria, G.; Onderwater, R. C. A.; González,
G.; Nápoles, M. C.; Falcón, R. A. B.; Costales, D.; Rogers, H.
J.; Diosdado, E.; González, S.; Cabrera, G.; González, L. y Wattiez,
R. ‘‘Practical use of oligosaccharins in agriculture’’. Acta Horticulturae,
no. 1009, octubre de 2013, pp. 195-212, ISSN 0567-7572, 2406-6168, DOI 10.17660/ActaHortic.2013.1009.24.
35. González, P. L.; Vázquez, G. A.; Perrotta, L.; Acosta, A.;
Scriven, S. A.; Herbert, R.; Cabrera, J. C.; Francis, D. y Rogers, H. J. ‘‘Oligosaccharins
and Pectimorf® stimulate root elongation and shorten the cell
cycle in higher plants’’. Plant Growth Regulation, vol. 68, no. 2,
3 de mayo de 2012, pp. 211-221, ISSN 0167-6903, 1573-5087, DOI 10.1007/s10725-012-9709-z.
36. Hadwiger, L. A. Method for treating cereal crop seed with chitosan to enhance
yield, root growth and stem strength [en línea]. no. US 4886541 A, Inst.
Washington State University Research Foundation, 12 de diciembre de 1989, [Consultado: 1
de diciembre de 2015], Disponible en: <http://www.google.com/patents/US4886541>.
37. Utsunomiya, N.; Kinai, H.; Matsui, Y. y Takebayashi, T. ‘‘The Effects of
Chitosan Oligosaccharides Soil Conditioner and Nitrogen Fertilizer on the Flowering
and Fruit Growth of Purple Passionfruit (Passiflora edulis Sims var.
edulis)’’. Journal of the Japanese Society for Horticultural Science,
vol. 67, no. 4, 1998, pp. 567-571, ISSN 1882-336X, 1882-3351, DOI 10.2503/jjshs.67.567.
38. Ohta, K.; Morishita, S.; Suda, K.; Kobayashi, N. y Hosoki, T. ‘‘Effects
of Chitosan Soil Mixture Treatment in the Seedling Stage on the Growth and Flowering
of Several Ornamental Plants’’. Journal of the Japanese Society for Horticultural
Science, vol. 73, no. 1, 2004, pp. 66-68, ISSN 1882-336X, 1882-3351, DOI
10.2503/jjshs.73.66.
39. Freepons, D. E. Plant growth regulators derived from chitin [en línea].
no. US4964894 A, 23 de octubre de 1990, [Consultado: 1 de diciembre de
2015], Disponible en: <http://www.google.com.cu/patents/US4964894>.
40. Cho, M. H.; No, H. K. y Prinyawiwatkul, W. ‘‘Chitosan Treatments Affect
Growth and Selected Quality of Sunflower Sprouts’’. Journal of Food Science,
vol. 73, no. 1, 1 de enero de 2008, pp. S70-S77, ISSN 1750-3841, DOI 10.1111/j.1750-3841.2007.00607.x.
41. Sharathchandra, R. G.; Raj, S. N.; Shetty, N. P.; Amruthesh, K. N. y Shetty,
H. S. ‘‘A Chitosan formulation ElexaTM induces downy mildew disease resistance
and growth promotion in pearl millet’’. Crop Protection, vol. 23, no.
10, octubre de 2004, pp. 881-888, ISSN 0261-2194, DOI 10.1016/j.cropro.2003.12.008.
42. Bhaskara, R. M. V.; Arul, J.; Angers, P. y Couture, L. ‘‘Chitosan treatment
of wheat seeds induces resistance to Fusarium graminearum and improves
seed quality’’. Journal of Agricultural and Food Chemistry, vol. 47,
no. 3, 1999, pp. 1208–1216, ISSN 0021-8561, DOI http://dx.doi.org/10.1021/jf981225k.
43. Shao, C. X.; Hu, J.; Song, W. J. y Hu, W. M. ‘‘Effects of seed priming with
chitosan solutions of different acidity on seed germination and physiological
characteristics of maize seedling’’. Journal of Zhejiang University (Agriculture
and Life Science), vol. 31, no. 6, 2005, pp. 705–708, ISSN 1008-9209.
44. Zhou, Y. G.; Yang, Y. D.; Qi, Y. G.; Zhang, Z. M.; Wang, X. J. y Hu, X.
J. ‘‘Effects of chitosan on some physiological activity in germinating seed
of peanut’’. Journal of Peanut Science, vol. 31, no. 1, 2002, pp. 22–25,
ISSN 0095-3679.
45. Boonlertnirun, S.; Boonraung, C. y Suvanasara, R. ‘‘Application of chitosan
in rice production’’. Journal of Metals, Materials and Minerals, vol.
18, no. 2, 2008, pp. 47–52, ISSN 0857-6149.
46. Dzung, N. ‘‘Enhancing Crop Production with Chitosan and Its Derivatives’’
[en línea]. En: Chitin, Chitosan, Oligosaccharides and Their Derivatives,
edit. CRC Press, 14 de julio de 2010, pp. 619-631, ISBN 978-1-4398-1603-5, [Consultado: 1
de diciembre de 2015], Disponible en: <http://www.crcnetbase.com/doi/abs/10.1201/EBK1439816035-c42>.
47. Khan, W. M.; Prithiviraj, B. y Smith, D. L. ‘‘Effect of Foliar Application
of Chitin and Chitosan Oligosaccharides on Photosynthesis of Maize and Soybean’’.
Photosynthetica, vol. 40, no. 4, diciembre de 2002, pp. 621-624, ISSN
0300-3604, 1573-9058, DOI 10.1023/A:1024320606812.
48. Abdel, M. A. M. R.; Tantawy, A. S.; El-Nemr, M. A. y Sassine, Y. N. ‘‘Growth
and yield responses of strawberry plants to chitosan application’’. European
Journal of Scientific Research, vol. 39, no. 1, 2010, pp. 161-168, ISSN
1450-216X, 1450-202X.
49. Chibu, H. y Shibayama, H. ‘‘Effects of chitosan application on the growth
of several crops’’. En: Uragami T., Chitin and Chitosan in Life Science: Proceedings
of the Eighth International Chitin and Chitosan Conference and Fourth Asia Pacific
Chitin and Chitosan Symposium, Yamaguchi, Japan, September 21-23, 2000, edit.
Kodansha Scientific, 2001, pp. 235–239, ISBN 978-4-906464-13-5.
50. Kowalski, B.; Terry, F. J.; Herrera, L. y Peñalver, D. A. ‘‘Application
of Soluble Chitosan in vitro and in the Greenhouse to Increase Yield
and Seed Quality of Potato Minitubers’’. Potato Research, vol. 49,
no. 3, 13 de febrero de 2007, pp. 167-176, ISSN 0014-3065, 1871-4528, DOI 10.1007/s11540-006-9015-0.
51. Lee, S.; Choi, H.; Suh, S.; Doo, I. S.; Oh, K. Y.; Choi, E. J.; Taylor,
A. T. S.; Low, P. S. y Lee, Y. ‘‘Oligogalacturonic Acid and Chitosan Reduce
Stomatal Aperture by Inducing the Evolution of Reactive Oxygen Species from
Guard Cells of Tomato and Commelina communis’’. Plant Physiology,
vol. 121, no. 1, 9 de enero de 1999, pp. 147-152, ISSN 1532-2548, DOI 10.1104/pp.121.1.147.
52. Iriti, M.; Picchi, V.; Rossoni, M.; Gomarasca, S.; Ludwig, N.; Gargano,
M. y Faoro, F. ‘‘Chitosan antitranspirant activity is due to abscisic acid-dependent
stomatal closure’’. Environmental and Experimental Botany, vol. 66,
no. 3, septiembre de 2009, pp. 493-500, ISSN 0098-8472, DOI 10.1016/j.envexpbot.2009.01.004.
53. Bittelli, M.; Flury, M.; Campbell, G. S. y Nichols, E. J. ‘‘Reduction of
transpiration through foliar application of chitosan’’. Agricultural and
Forest Meteorology, vol. 107, no. 3, 2 de abril de 2001, pp. 167-175, ISSN
0168-1923, DOI 10.1016/S0168-1923(00)00242-2.
54. Lhuissier, F. G. P.; Ruijter, N. C. A. D.; Sieberer, B. J.; Esseling, J.
J. y Emons, A. M. C. ‘‘Time Course of Cell Biological Events Evoked in Legume
Root Hairs by Rhizobium Nod Factors: State of the Art’’. Annals
of Botany, vol. 87, no. 3, 3 de enero de 2001, pp. 289-302, ISSN 0305-7364,
1095-8290, DOI 10.1006/anbo.2000.1333.
55. Prithiviraj, B.; Zhou, X.; Souleimanov, A.; Khan, W. M.; Smith, D. L. y
Kahn, W. M. ‘‘A host-specific bacteria-to-plant signal molecule (Nod factor)
enhances germination and early growth of diverse crop plants’’. Planta,
vol. 216, no. 3, enero de 2003, pp. 437-445, ISSN 0032-0935, DOI 10.1007/s00425-002-0928-9.
56. D’Haeze, W. y Holsters, M. ‘‘Nod factor structures, responses, and perception
during initiation of nodule development’’. Glycobiology, vol. 12, no.
6, 6 de enero de 2002, p. 79R-105R, ISSN 0959-6658, 1460-2423, DOI 10.1093/glycob/12.6.79R.
57. Costales, D. ‘‘Efecto de derivados de quitosana en la simbiosis Bradyrhizobium-soya’’.
Cultivos Tropicales, vol. 26, no. 1, 2013, pp. 83-87, ISSN 0258-5936.
58. Costales, D.; Nápoles, M. y Falcón, A. ‘‘Influencia de oligosacáridos
de quitosana y pectina en la interacción simbiótica Soya-Bradyrhizobium’’.
Revista Cubana de Ciencia Agrícola, vol. 41, no. 2, 2007, pp.
175–181, ISSN 0034-7485, 2079-3472.
59. Sharp, J. K.; McNeil, M. y Albersheim, P. ‘‘The primary structures of one
elicitor-active and seven elicitor-inactive hexa(beta-D-glucopyranosyl)-D-glucitols
isolated from the mycelial walls of Phytophthora megasperma f. sp.
glycinea’’. The Journal of Biological Chemistry, vol. 259, no. 18,
25 de septiembre de 1984, pp. 11321-11336, ISSN 0021-9258.
60. Cosio, E. G.; Feger, M.; Miller, C. J.; Antelo, L. y Ebel, J. ‘‘High-affinity
binding of fungal ß-glucan elicitors to cell membranes of species of the
plant family Fabaceae’’. Planta, vol. 200, no. 1, septiembre de 1996,
pp. 92-99, ISSN 0032-0935, 1432-2048, DOI 10.1007/BF00196654.
61. Klarzynski, O.; Plesse, B.; Joubert, J.-M.; Yvin, J.-C.; Kopp, M.; Kloareg,
B. y Fritig, B. ‘‘Linear ß-1,3 Glucans Are Elicitors of Defense Responses
in Tobacco’’. Plant Physiology, vol. 124, no. 3, 11 de enero de 2000,
pp. 1027-1038, ISSN 1532-2548, DOI 10.1104/pp.124.3.1027.
62. Aziz, A.; Poinssot, B.; Daire, X.; Adrian, M.; Bézier, A.; Lambert,
B.; Joubert, J. M. y Pugin, A. ‘‘Laminarin elicits defense responses in grapevine
and induces protection against Botrytis cinerea and Plasmopara
viticola’’. Molecular plant-microbe interactions: MPMI, vol. 16,
no. 12, diciembre de 2003, pp. 1118-1128, ISSN 0894-0282, DOI 10.1094/MPMI.2003.16.12.1118.
63. Aziz, A.; Heyraud, A. y Lambert, B. ‘‘Oligogalacturonide signal transduction,
induction of defense-related responses and protection of grapevine against Botrytis
cinerea’’. Planta, vol. 218, no. 5, 14 de noviembre de 2003, pp. 767-774,
ISSN 0032-0935, 1432-2048, DOI 10.1007/s00425-003-1153-x.
64. Bartnicki, G. S. y Wang, M. C. ‘‘Biochemical aspects of morphogenesis in
Phytophthora’’. En: Erwin D. C., Bartnicki G. S., Tsao P. H., y Society A. P.,
Phytophthora: its biology, taxonomy, ecology, and pathology, edit. American
Phytopathological Society, 1983, pp. 121-138, ISBN 978-0-89054-050-3.
65. Nishizawa, Y.; Kawakami, A.; Hibi, T.; He, D. Y.; Shibuya, N. y Minami,
E. ‘‘Regulation of the chitinase gene expression in suspension-cultured rice
cells by N-acetylchitooligosaccharides: differences in the signal transduction
pathways leading to the activation of elicitor-responsive genes’’. Plant
Molecular Biology, vol. 39, no. 5, marzo de 1999, pp. 907-914, ISSN 0167-4412,
1573-5028, DOI 10.1023/A:1006161802334.
66. Zhao, J.; Davis, L. C. y Verpoorte, R. ‘‘Elicitor signal transduction leading
to production of plant secondary metabolites’’. Biotechnology Advances,
vol. 23, no. 4, junio de 2005, pp. 283-333, ISSN 0734-9750, DOI 10.1016/j.biotechadv.2005.01.003.
67. Bautista, B. S.; Hernández, L. A. N.; Velázquez, del V. M.
G.; Hernández, L. M.; Ait Barka, E.; Bosquez, M. E. y Wilson, C. L. ‘‘Chitosan
as a potential natural compound to control pre and postharvest diseases of horticultural
commodities’’. Crop Protection, vol. 25, no. 2, febrero de 2006, pp.
108-118, ISSN 0261-2194, DOI 10.1016/j.cropro.2005.03.010.
68. Khan, W.; Prithiviraj, B. y Smith, D. L. ‘‘Chitosan and chitin oligomers
increase phenylalanine ammonia-lyase and tyrosine ammonia-lyase activities in
soybean leaves’’. Journal of Plant Physiology, vol. 160, no. 8, 2003,
pp. 859-863, ISSN 0176-1617, DOI 10.1078/0176-1617-00905.
69. El Hadrami, A.; Adam, L. R.; El Hadrami, I. y Daayf, F. ‘‘Chitosan in Plant
Protection’’. Marine Drugs, vol. 8, no. 4, 30 de marzo de 2010, pp.
968-987, ISSN 1660-3397, DOI 10.3390/md8040968.
70. Falcón, R. A. B.; Costales, D.; Cabrera, J. C. y Martínez,
T. M. Á. ‘‘Chitosan physico–chemical properties modulate defense responses
and resistance in tobacco plants against the oomycete Phytophthora nicotianae’’.
Pesticide Biochemistry and Physiology, vol. 100, no. 3, julio de 2011,
pp. 221-228, ISSN 0048-3575, DOI 10.1016/j.pestbp.2011.04.005.
71. Xu, J.; Zhao, X.; Han, X. y Du, Y. ‘‘Antifungal activity of oligochitosan
against Phytophthora capsici and other plant pathogenic fungi in
vitro’’. Pesticide Biochemistry and Physiology, vol. 87, no. 3,
marzo de 2007, pp. 220-228, ISSN 0048-3575, DOI 10.1016/j.pestbp.2006.07.013.
72. Xu, J.; Zhao, X.; Wang, X.; Zhao, Z. y Du, Y. ‘‘Oligochitosan inhibits Phytophthora
capsici by penetrating the cell membrane and putative binding to intracellular
targets’’. Pesticide Biochemistry and Physiology, vol. 88, no. 2, junio
de 2007, pp. 167-175, ISSN 0048-3575, DOI 10.1016/j.pestbp.2006.10.010.
73. Falcón, A. B.; Cabrera, J. C.; Costales, D.; Ramírez, M. A.;
Cabrera, G.; Toledo, V. y Martínez, T. M. A. ‘‘The effect of size and
acetylation degree of chitosan derivatives on tobacco plant protection against
Phytophthora parasitica nicotianae’’. World Journal of Microbiology
and Biotechnology, vol. 24, no. 1, 23 de junio de 2007, pp. 103-112, ISSN
0959-3993, 1573-0972, DOI 10.1007/s11274-007-9445-0.
74. Rodríguez, A. B. F.; Menéndez, D. C.; Delgado, E. O.; Díaz,
O. L. y Pino, J. C. C. ‘‘Evaluation of chitosan as an inhibitor of soil-borne
pathogens and as an elicitor of defence markers and resistance in tobacco plants’’.
Spanish Journal of Agricultural Research, vol. 5, no. 4, 1 de diciembre
de 2007, pp. 533-541, ISSN 2171-9292, DOI 10.5424/sjar/2007054-274.
75. Palma, G. J.; Jansson, H.-B.; Salinas, J. y Lopez, L. L. V. ‘‘Effect of
chitosan on hyphal growth and spore germination of plant pathogenic and biocontrol
fungi’’. Journal of Applied Microbiology, vol. 104, no. 2, febrero
de 2008, pp. 541-553, ISSN 1365-2672, DOI 10.1111/j.1365-2672.2007.03567.x.
76. Hernández, L. A. N.; Hernández, M. M.; Velázquez, del
V. M. G.; Guerra, S. M. G. y Melo, G. G. E. ‘‘Actividad antifúngica del
quitosano en el control de Rhizopus stolonifer (Ehrenb.: Fr.) Vuill.
y Mucor spp’’. Revista Mexicana de Fitopatología, vol.
25, no. 2, 2007, pp. 109–113, ISSN 0185-3309, 2007-8080.
77. Liu, J.; Tian, S.; Meng, X. y Xu, Y. ‘‘Effects of chitosan on control of
postharvest diseases and physiological responses of tomato fruit’’. Postharvest
Biology and Technology, vol. 44, no. 3, junio de 2007, pp. 300-306, ISSN
0925-5214, DOI 10.1016/j.postharvbio.2006.12.019.
78. Bhaskara, R. M.; Arul, J.; Ait-Barka, E.; Angers, P.; Richard, C. y Castaigne,
F. ‘‘EVect of Chitosan on Growth and Toxin Production by Alternaria alternata
f. sp. lycopersici’’. Biocontrol Science and Technology, vol. 8, no.
1, 1 de marzo de 1998, pp. 33-43, ISSN 0958-3157, DOI 10.1080/09583159830414.
79. Plascencia, J. M.; Viniegra, G.; Olayo, R.; Castillo, O. M. M. y Shirai,
K. ‘‘Effect of Chitosan and Temperature on Spore Germination of Aspergillus
niger’’. Macromolecular Bioscience, vol. 3, no. 10, 1 de octubre de
2003, pp. 582-586, ISSN 1616-5195, DOI 10.1002/mabi.200350024.
80. Sánchez, D. D.; Bautista, B. S. y Castillo, P. ‘‘Efecto del quitosano
en el desarrollo y morfología de Alternaria alternata (Fr.)
Keissl’’. Anales de Biología, vol. 29, 2007, pp. 23–32, ISSN
1138-3399. 1989-2128.
81. Ghaouth, A. E. ‘‘Effect of Chitosan on Cucumber Plants: Suppression of Pythium
aphanidermatum and Induction of Defense Reactions’’. Phytopathology,
vol. 84, no. 3, 1994, p. 313, ISSN 0031949X, DOI 10.1094/Phyto-84-313.
82. Barka, E. A.; Eullaffroy, P.; Clément, C. y Vernet, G. ‘‘Chitosan
improves development, and protects Vitis vinifera L. against Botrytis
cinerea’’. Plant Cell Reports, vol. 22, no. 8, 1 de noviembre
de 2003, pp. 608-614, ISSN 0721-7714, 1432-203X, DOI 10.1007/s00299-003-0733-3.
83. Agostini, J. P.; Bushong, P. M. y Timmer, L. W. ‘‘Greenhouse Evaluation
of Products That Induce Host Resistance for Control of Scab, Melanose, and Alternaria
Brown Spot of Citrus’’. Plant Disease, vol. 87, no. 1, 1 de enero de
2003, pp. 69-74, ISSN 0191-2917, DOI 10.1094/PDIS.2003.87.1.69.
84. Copping, L. G. The biopesticide manual: world compendium. edit. British
crop protection council, 1998, 333 p., ISBN 1-901396-26-6, CABDirect2.
85. Bautista, B. S.; Hernández, L. M.; Bosquez, M. E. y Wilson, C. L.
‘‘Effects of chitosan and plant extracts on growth of Colletotrichum gloeosporioides,
anthracnose levels and quality of papaya fruit’’. Crop Protection,
vol. 22, no. 9, noviembre de 2003, pp. 1087-1092, ISSN 0261-2194, DOI 10.1016/S0261-2194(03)00117-0.
86. Jitareerat, P.; Paumchai, S.; Kanlayanarat, S. y Sangchote, S. ‘‘Effect
of chitosan on ripening, enzymatic activity, and disease development in mango
(Mangifera indica) fruit’’. New Zealand journal of crop and horticultural
science, vol. 35, no. 2, 2007, pp. 211–218, ISSN 0114-0671, 1175-8783,
DOI http://dx.doi.org/10.1080/01140670709510187.
87. Chien, P. J. y Chou, C. C. ‘‘Antifungal activity of chitosan and its application
to control post-harvest quality and fungal rotting of Tankan citrus fruit (Citrus
tankan Hayata)’’. Journal of the Science of Food and Agriculture,
vol. 86, no. 12, 1 de septiembre de 2006, pp. 1964-1969, ISSN 1097-0010, DOI
10.1002/jsfa.2570.
88. Hernández, M. P.; Almenar, E.; Valle, V. D.; Velez, D. y Gavara,
R. ‘‘Effect of chitosan coating combined with postharvest calcium treatment
on strawberry (Fragaria × ananassa) quality during refrigerated
storage’’. Food Chemistry, vol. 110, no. 2, 15 de septiembre de 2008,
pp. 428-435, ISSN 0308-8146, DOI 10.1016/j.foodchem.2008.02.020.
89. Lin, W.; Hu, X.; Zhang, W.; John Rogers, W. y Cai, W. ‘‘Hydrogen peroxide
mediates defence responses induced by chitosans of different molecular weights
in rice’’. Journal of Plant Physiology, vol. 162, no. 8, 23 de agosto
de 2005, pp. 937-944, ISSN 0176-1617, DOI 10.1016/j.jplph.2004.10.003.
90. Rodríguez, A. T.; Ramírez, M. A.; Cárdenas, R. M.;
Hernández, A. N.; Velázquez, M. G. y Bautista, S. ‘‘Induction
of defense response of Oryza sativa L. against Pyricularia grisea
(Cooke) Sacc. by treating seeds with chitosan and hydrolyzed chitosan’’. Pesticide
Biochemistry and Physiology, vol. 89, no. 3, noviembre de 2007, pp. 206-215,
ISSN 0048-3575, DOI 10.1016/j.pestbp.2007.06.007.
91. Romanazzi, G.; Nigro, F.; Ippolito, A.; DiVenere, D. y Salerno, M. ‘‘Effects
of Pre- and Postharvest Chitosan Treatments to Control Storage Grey Mold of
Table Grapes’’. Journal of Food Science, vol. 67, no. 5, 1 de junio
de 2002, pp. 1862-1867, ISSN 1750-3841, DOI 10.1111/j.1365-2621.2002.tb08737.x.
92. Trotel, A. P.; Couderchet, M.; Vernet, G. y Aziz, A. ‘‘Chitosan Stimulates
Defense Reactions in Grapevine Leaves and Inhibits Development of Botrytis
Cinerea’’. European Journal of Plant Pathology, vol. 114, no.
4, abril de 2006, pp. 405-413, ISSN 0929-1873, 1573-8469, DOI 10.1007/s10658-006-0005-5.
93. Ben, S. N.; Ardi, R.; Pinto, R.; Aki, C. y Fallik, E. ‘‘Controlling gray
mould caused by Botrytis cinerea in cucumber plants by means of chitosan’’.
Crop Protection, vol. 22, no. 2, marzo de 2003, pp. 285-290, ISSN 0261-2194,
DOI 10.1016/S0261-2194(02)00149-7.
94. Molloy, C.; Cheah, L. H. y Koolaard, J. P. ‘‘Induced resistance against
Sclerotinia sclerotiorum in carrots treated with enzymatically hydrolysed
chitosan’’. Postharvest Biology and Technology, vol. 33, no. 1, julio
de 2004, pp. 61-65, ISSN 0925-5214, DOI 10.1016/j.postharvbio.2004.01.009.
95. Benhamou, N. ‘‘Induction of Systemic Resistance to Fusarium Crown and Root
Rot in Tomato Plants by Seed Treatment with Chitosan’’. Phytopathology,
vol. 84, no. 12, 1994, p. 1432, ISSN 0031949X, DOI 10.1094/Phyto-84-1432.
96. Baños, S. B. y Luna, L. B. ‘‘Evaluación del quitosano en el
desarrollo de la pudrición blanda del tomate durante el almacenamiento’’.
Revista Iberoamericana de Tecnología Postcosecha, vol. 6, no.
1, 2004, pp. 63–67, ISSN 1665-0204.
97. Coqueiro, D. S. O.; Maraschin, M. y Piero, R. M. D. ‘‘Chitosan Reduces Bacterial
Spot Severity and Acts in Phenylpropanoid Metabolism in Tomato Plants’’.
Journal of Phytopathology, vol. 159, no. 7-8, 1 de agosto de 2011, pp.
488-494, ISSN 1439-0434, DOI 10.1111/j.1439-0434.2011.01791.x.
98. Du, J.; Gemma, H. y Iwahori, S. ‘‘Effects of Chitosan Coating on the Storage
of Peach, Japanese Pear, and Kiwifruit.’’. Journal of the Japanese Society
for Horticultural Science, vol. 66, no. 1, 1997, pp. 15–22, ISSN 1880-358X,
DOI http://dx.doi.org/10.2503/jjshs.66.15.
99. Zhao, X.; She, X.; Du, Y. y Liang, X. ‘‘Induction of antiviral resistance
and stimulary effect by oligochitosan in tobacco’’. Pesticide Biochemistry
and Physiology, vol. 87, no. 1, enero de 2007, pp. 78-84, ISSN 0048-3575,
DOI 10.1016/j.pestbp.2006.06.006.
100. Iriti, M. y Faoro, F. ‘‘Abscisic acid is involved in chitosan-induced resistance
to tobacco necrosis virus (TNV)’’. Plant Physiology and Biochemistry,
vol. 46, no. 12, diciembre de 2008, pp. 1106-1111, ISSN 0981-9428, DOI 10.1016/j.plaphy.2008.08.002.
101. Salvador, P. y Lasserre, T. Process for increasing plants resistance to
an abiotic stress [en línea]. no. US20100304975 A1, Inst. Elicityl, 2
de diciembre de 2010, [Consultado: 1 de diciembre de 2015], Disponible en:
<http://www.google.com.cu/patents/US20100304975>.
102. Xuan, T. L.; Nagasawa, N.; Matsuhashi, S.; Ishioka, N. S.; Ito, T. y Kume,
T. ‘‘Effect of radiation-degraded chitosan on plants stressed with vanadium’’.
Radiation Physics and Chemistry, vol. 61, no. 2, mayo de 2001, pp.
171-175, ISSN 0969-806X, DOI 10.1016/S0969-806X(00)00388-1.
103. Ortega, O.; Benavides, M. A.; Flores, O. A. y Ledezma, P. A. ‘‘Use of the
Interpolyelectrolyte Complexes of Poly (acrylic acid)-Chitosan as Inductors
of Tolerance Against Pathogenic Fungi in Tomato (Lycopersicon esculentum
Mill. var. Floradade)’’. Macromolecular Bioscience, vol. 3, no. 10,
1 de octubre de 2003, pp. 566-570, ISSN 1616-5195, DOI 10.1002/mabi.200300021.
104. Boonlertnirun, S.; Sarobol, E. D.; Meechoui, S. y Sooksathan, I. ‘‘Drought
recovery and grain yield potential of rice after chitosan application’’. Kasetsart
Journal: Natural Science, vol. 41, 2007, pp. 1-6, ISSN 0075-5192.
105. Górnik, K.; Grzesik, M. y Romanowska, D. B. ‘‘The effect of chitosan
on rooting of grapevine cuttings and on subsequent plant growth under drought
and temperature stress’’. Journal of Fruit and Ornamental Plant Research,
vol. 16, 2008, pp. 333–343, ISSN 1231-0948.
106. Lizárraga, P. E. G.; Torres, P. I.; Moreno, M. E. y Miranda, C.
S. P. ‘‘Chitosan application in maize (Zea mays) to counteract the
effects of abiotic stress at seedling level’’. African Journal of Biotechnology,
vol. 10, no. 34, 2013, pp. 6439-6446, ISSN 1684-5315, DOI 10.4314/ajb.v10i34.
107. Kim, S. K. Chitin, Chitosan, Oligosaccharides and Their Derivatives: Biological
Activities and Applications. edit. CRC Press, 14 de julio de 2010, 668 p., ISBN
978-1-4398-1604-2.
108. Corbera, G. J. y Nápoles, G. M. C. ‘‘Efecto de la inoculación
conjunta Bradyrhizobium elkanii-hongos MA y la aplicación de
un bioestimulador del crecimiento vegetal en soya (Glycine max (L.)
Merrill), cultivar INCASOY-27’’. Cultivos Tropicales, vol. 34, no.
2, junio de 2013, pp. 05-11, ISSN 0258-5936.
109. Hernández, L. ‘‘Efecto de una mezcla de oligogalacturónidos
en el crecimiento y desarrollo del cultivo de Anthurium andreanum’’.
Cultivos Tropicales, vol. 28, no. 4, 2012, pp. 83–86, ISSN 0258-5936.
110. Suárez, L. ‘‘Efecto que ejercen las aspersiones foliares de una
mezcla de oligogalacturónidos (Pectimorf) y la formulación a base
de un análogo de brasinoesteroides (Biobras-16) en dos especies de orquídeas
(Cattleya leuddemanniana y Guarianthe skinneri)’’. Cultivos
Tropicales, vol. 28, no. 4, 2007, pp. 87–91, ISSN 0258-5936.
111. Cartaya, O. E.; Reynaldo, I.; Peniche, C. y Garrido, M. L. ‘‘Empleo de
polímeros naturales como alternativa para la remediación de suelos
contaminados por metales pesados’’. Revista internacional de contaminación
ambiental, vol. 27, no. 1, febrero de 2011, pp. 41-46, ISSN 0188-4999.
112. Rivero, D.; Cruz, A.; Martínez, B.; Rodríguez, A. T. y Ramírez,
M. A. ‘‘Actividad antifúngica in vitro de dos quitosanas frente
a Fusarium subglutinans (Wollenweber and Reinking), patógeno
de arroz (Oryza sativa L.)’’. Revista de Protección Vegetal,
vol. 21, no. 2, 2006, ISSN 1010-2752, 2224-4697, [Consultado: 1 de diciembre
de 2015], Disponible en: <http://agris.fao.org/agris-search/search.do?recordID=CU2009100417>.
113. Deyanira, R.; Cruz, A.; Martínez, B.; Rodríguez, A. T. y
Ramírez, M. A. ‘‘Actividad antifúngica in vitro de las
quitosanas K1 y Sigma frente a Bipolaris oryzae (B. de Haan) Shoem’’. Revista
de Protección Vegetal, vol. 23, no. 1, abril de 2008, pp. 43-47,
ISSN 1010-2752.
114. Rodríguez, P. A. T.; Ramírez, A. M. Á.; Cárdenas,
T. R. M.; Falcón, R. A. y Bautista, B. S. ‘‘Efecto de la Quitosana en
la Inducción de la Actividad de Enzimas Relacionadas con la Defensa y
Protección de Plántulas de Arroz (Oryza sativa L.) contra
Pyricularia grisea Sacc’’. Revista Mexicana de Fitopatología,
vol. 24, no. 1, 2006, pp. 1-7, ISSN 0185-3309, 2007-8080.
115. González, L.; Falcan, A.; Jiménez, M. C.; Jiménez,
L.; Silvente, J. y Terrero, J. C. ‘‘Evaluación de tres dosis de quitosana
en el cultivo de pepino en un periodo tardío’’. Revista amazónica:
Ciencia y tecnología, vol. 1, no. 2, 2012, pp. 134-139, ISSN 1390-5600.
116. Arteaga, M. C. J.; Gómez, G. G.; Rodríguez, A. F. y Quintana,
O. ‘‘Evaluación de tres bioestimulantes sobre la incidencia de plagas
en el maíz (Zea mays L.) en la provincia de Santiago de Cuba’’.
Centro Agrícola, vol. 37, no. 2, 2010, pp. 45–48, ISSN 2072-2001.
117. Nápoles, M. C. Medio de cultivo para Bradyrhizobium japonicum.
Biopreparado resultante. no. 22 797, Inst. OCPI, Cuba, 2002.
118. Nápoles, M. C.; Luyten, E.; Dombrecht, B.; Laeremans, T.; Vanderleyden,
J.; Costales, D.; Gutiérrez, A. y Corbera, J. ‘‘Growth media modulating
the symbiotic efficiency of Bradyrhizobium elkanii’’. Symbiosis,
vol. 38, no. 1, 2005, pp. 87-98, ISSN 0334-5114, 1878-7665.
119. Nápoles, M. C.; Cabrera, J. C.; Varela, M.; González, A.
G.; Nogueras, F.; Cricco, J.; Guevara, E. y Meira, S. ‘‘Influencia de inoculantes
y factores edáficos en el rendimiento de la soya’’. Cultivos Tropicales,
vol. 30, no. 3, septiembre de 2009, pp. 18-22, ISSN 0258-5936.
120. Nápoles, M. C.; Guevara, E.; Montero, F.; Rossi, A. y Ferreira,
A. ‘‘Role of Bradyrhizobium japonicum induced by genistein on soybean
stressed by water deficit’’. Spanish Journal of Agricultural Research,
vol. 7, no. 3, 1 de septiembre de 2009, pp. 665-671, ISSN 2171-9292, DOI 10.5424/sjar/2009073-451.
121. Duzan, H. M.; Mabood, F.; Zhou, X.; Souleimanov, A. y Smith, D. L. ‘‘Nod
factor induces soybean resistance to powdery mildew’’. Plant Physiology
and Biochemistry, vol. 43, no. 10-11, octubre de 2005, pp. 1022-1030, ISSN
0981-9428, DOI 10.1016/j.plaphy.2005.08.004.
Recibido: 26 de
diciembre de 2014
Aceptado: 20 de marzo de 2015
Dr.C. Alejandro B. Falcón Rodríguez, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba. CP 32 700. Email: alfalcon@inca.edu.cu