Fuentes de fosfato asociadas a la cachaza y el biofertilizante sobre los microorganismos solubilizadores de fósforo y su contenido en el suelo
Phosphate sources associated with filter cake and biofertilizer on phosphorus solubilizing microorganisms and its content in the soil
M.Cs. Cid N. Silva Campos,I Dr.C. Renato de Mello Prado,I Dr.C. Leónides Castellanos González,II M.Cs. Maikel Abreu Jiménez,II M.Cs. Leandro Rosatto ModaI
IUniversidad
Estadual Paulista “Júlio de Mesquita Filho”, Facultad de Ciencias Agrarias
y Veterinarias, Vía de Acceso Prof. Paulo Donato Castellane s/n, CEP:
14884-900-9, Jaboticabal, SP-Brasil.
II Centro de Estudios para la Transformación Agraria Sostenible
(CETAS), Facultad de Ciencias Agrarias, Universidad de Cienfuegos, carretera
a Rodas km 4, Cuatro Caminos, CP 59430, Cuba.
RESUMEN
Los suelos de regiones tropicales presentan una elevada adsorción del fósforo, el cual se encuentra poco disponible para las plantas y limita la producción de los cultivos. Este estudio tuvo como objetivo evaluar el efecto de las fuentes de fosfato acidulado y fosfato natural asociadas a la cachaza, no enriquecida y enriquecida con biofertilizante, sobre la población de microorganismos solubilizadores de fosfatos y los tenores de P en el suelo. El experimento se realizó en condiciones controladas a nivel de laboratorio en la Universidad “Carlos Rafael Rodríguez” de Cienfuegos, Cuba. Las unidades experimentales fueron macetas de 0,5 dm3 conteniendo suelo Ferralítico Calcítico. El diseño experimental utilizado fue completamente aleatorizado con arreglo factorial 3x2+1 y tres repeticiones; tres fuentes de fósforo: superfosfato triple, fosfato monoamónico y fosfato natural de Cuba; cachaza no enriquecida y enriquecida con el biofertilizante Azotofos y un tratamiento control (solo suelo). A los 30 y 60 días después de la aplicación de los tratamientos, se evaluaron la cantidad de microorganismos solubilizadores de P, los niveles de P, la materia orgánica y el pH del suelo. La adición de biofertilizante a la cachaza no tuvo ningún efecto en los niveles de P y la materia orgánica del suelo. La aplicación de fósforo en forma de fosfato natural en presencia de cachaza no enriquecida y enriquecida con biofertilizante proporcionó una mayor población de microorganismos e incrementó el nivel de P en el suelo, en relación con las fuentes de fosfato acidulado.
Palabras clave: fertilización orgánica, fósforo, microbiología del suelo, solubilización.
ABSTRACT
Soils from tropical regions have high adsorption of phosphorus, which is hardly available to plants, so limiting crop production. This study was aimed to evaluate the effect of acidulated phosphate and ground rock phosphate sources associated with filter cake, enriched or not with biofertilizer, on the population of phosphate solubilizing microorganisms and P concentration in the soil. The experiment was carried out under laboratory conditions at “Carlos Rafael Rodríguez” University of Cienfuegos, Cuba. Experimental units were pots of 0,5 dm3 containing Luvisol. A completely randomized design with 3x2+1 factorial arrangement and three repetitions was used; also, three phosphorus sources: triple superphosphate, mono-ammonium phosphate and natural phosphate of Cuba; filter cake enriched or not with Azotofos biofertilizer and a control treatment (just soil). The amount of P solubilizing microorganisms, soil P levels, organic matter and soil pH value were assessed at 30 and 60 days after applying treatments. The biofertilizer added to filter cake did not have any effect on P levels and soil organic matter. Phosphorus applied as natural phosphate increased the population of microorganisms and soil P level in presence of filter cake, enriched or not with biofertilizer, in relation to acidulated phosphate sources.
Key words: organic fertilization, phosphorus, soil microbiology, solubilization.
INTRODUCCIÓN
Los suelos de
regiones tropicales, con intensa intemperización, presentan elevada adsorción
del fósforo (P) en los óxidos e hidróxidos de hierro y
aluminio, encontrándose poco disponible para las plantas, lo que implica
que el P sea uno de los nutrientes que más limita la producción
y la longevidad de los cultivos en esas condiciones.
Por lo tanto, una alternativa para aumentar los niveles de P en los suelos sería
añadir residuos orgánicos, tales como cachaza asociada con la
fertilización fosfatada. La cachaza contiene altas cantidades de P, por
lo que puede reducir el uso de fertilizantes minerales (1, 2).
Otro de los beneficios del uso de la cachaza está asociado a la microbiología
del suelo, una vez que provoca un aumento de colonias de microorganismos productores
de enzimas y ácidos orgánicos responsables de la solubilización
de P adsorbido en los suelos (3, 4, 5).
Actualmente, se está difundiendo la aplicación de biofertilizantes
asociados con la fertilización. Algunos autores, utilizando productos
a base de microorganismos, encontraron mayores niveles de P en el suelo, lo
que contribuye a una eficiencia más acentuada de la fertilización
fosfatada (6, 7, 8, 9). Sin embargo, otros informaron que esta asociación
no se refleja en el aumento de la concentración de P en el suelo (10).
Consecuentemente, es necesario realizar más estudios sobre la solubilización
de P asociados a los microorganismos, con el fin de que se establezcan nuevas
posibilidades para su aplicación en la agricultura, lo que podrá
reflejarse en una mejora de la fertilización fosfatada (4). Hay factores
que pueden influir en la eficiencia de la fertilización fosfatada asociada
a los biofertilizantes, como por ejemplo, la fuente de P utilizada (fosfato
acidulado o natural) y la población de microorganismos implicados en
el proceso.
Un aspecto importante sobre el uso eficiente de la fertilización fosfatada
orgánico-mineral, sería verificar la hipótesis de que las
fuentes convencionales de fósforo, como el fosfato monoamónico
(MAP) y el superfosfato triple, comparado con el fosfato natural, asociado a
un compuesto orgánico, puede modificar la población de microorganismos
del suelo, reflejándose sobre el P disponible. Además, verificar
si hay aumento de la actividad de la microbiota del suelo y de la disponibilidad
de P cuando se utiliza la cachaza, comparado con la cachaza enriquecida con
biofertilizantes conteniendo microorganismos.
Por lo tanto, el objetivo del estudio fue evaluar el efecto de las fuentes de
fosfato acidulado y fosfato natural asociadas a la cachaza, con y sin enriquecimiento
con biofertilizante, sobre la población de microorganismos solubilizadores
de fosfatos y los tenores de P en el suelo.
MATERIALES Y MÉTODOS
El experimento se realizó en condiciones controladas, en el laboratorio
de química de la Universidad “Carlos Rafael Rodríguez” de Cienfuegos,
Cuba, en el periodo de septiembre a noviembre de 2013.
Se utilizaron muestras, recolectadas a la profundidad de 0 a 0,40 m, de un suelo
Ferralítico Calcítico (11), que corresponde a un Luvisol (12),
cultivado con caña de azúcar en el central azucarero “Carlos Baliño”,
provincia Villa Clara, Cuba. Inmediatamente después de la recolección,
el suelo se secó al aire, los grumos fueron desmenuzados y tamizados
(malla de 4 mm). Seguidamente, se realizó el análisis químico
para evaluar la fertilidad y se obtuvieron los siguientes resultados: pH (KCl)=
5,5; materia orgánica= 5,4 %; contenido de P en el suelo (Bray-2)= 21
mg 100 g-1 de suelo (13).
El diseño experimental utilizado fue completamente aleatorizado, en disposición
factorial con tres repeticiones, que corresponden a los siguientes tratamientos:
tres fuentes de fósforo (60 mg dm-3 de P soluble en ácido
cítrico a 2 %): superfosfato triple (P2O5 soluble=
41 %), MAP (fosfato monoamónico, P2O5 soluble=
48 %) y fosfato natural de Cuba (P2O5 soluble= 6,5 %;
P2O5 total= 24,1 %); cachaza enriquecida y no enriquecida
con biofertilizante y un tratamiento control (sin tratamiento, solo con suelo).
El fosfato natural de Cuba es proveniente de apatitas de origen magmático
(granulometría en polvo) del yacimiento de Trinidad de Guedes, Matanzas,
Cuba.
Se realizaron evaluaciones en dos momentos: a los 30 y 60 días después
de la aplicación de los tratamientos. Cada unidad experimental estaba
compuesta por recipientes de plástico con 0,5 dm3 de suelo
y los respectivos tratamientos.
Se utilizó la cachaza descompuesta y para su enriquecimiento se adicionó
el biofertilizante Azotofos (480 mL kg-1 de cachaza) conteniendo
los microorganismos Pseudomonas fluorescens y Azotobacter fluorescens
(108 ufc mL-1), de acuerdo con la metodología propuesta
(14). El biofertilizante se obtuvo en el laboratorio del Instituto de Investigaciones
de Suelos y Fertilizantes de Barajagua en Cienfuegos.
Se realizó el análisis químico de la cachaza (15) y se
obtuvieron los siguientes resultados, expresados en g kg-1: N= 18; P= 12,1;
K= 4,3; Ca= 96,4; Mg= 10,2; S= 3,4, mientras que la microbiológicaA
presentó los siguientes resultados: 2,5x102 ufc g-1
de microorganismos solubilizadores de fósforo. La dosis de cachaza fue
de 25 t ha-1 en base seca (12,5 g dm-3 de suelo).
En todos los tratamientos se aplicó, de manera uniforme, el nitrógeno
(200 mg dm-3) en forma de urea (44 % de N) y el potasio (150 mg dm-3)
en forma de cloruro de potasio (60 % de K2O). Durante todo el experimento
se realizaron riegos frecuentes, manteniendo la humedad del suelo próxima
a la capacidad de campo.
A los 30 y 60 días después del inicio del experimento, se recogieron
muestras de suelo de cada recipiente (0,5 dm3), para la determinación
de la materia orgánica, el pH y los niveles de P en el suelo (Bray-2)
(13); además, se cuantificaron los microorganismos solubilizadores de
fosfato. Las muestras recolectadas se colocaron en bolsas de nylon, protegidas
de la luz y mantenidas en cajas térmicas hasta su llegada al laboratorio;
seguidamente, se tamizaron (malla de 2 mm), ajustando la humedad a 60-70 % de
la capacidad de campo, se envasaron en bolsas de plástico con apertura
para la ventilación y después se mantuvieron en cámara
fría (4 ºC).
Para la cuantificación de los microorganismos solubilizadores de fosfato,
se utilizó el medio de cultivo de PykoskaiaA. Las placas fueron
incubadas a temperatura de 30 ºC, por 96 horas y el conteo de los microorganismos
se realizó con un contador de colonias.
Los datos de microorganismos solubilizadores de fosfato fueron transformados
en logaritmo (Log. X).
Para comparar las medias de los tratamientos se utilizó la prueba de
Tukey (P<0,05).
RESULTADOS Y DISCUSIÓN
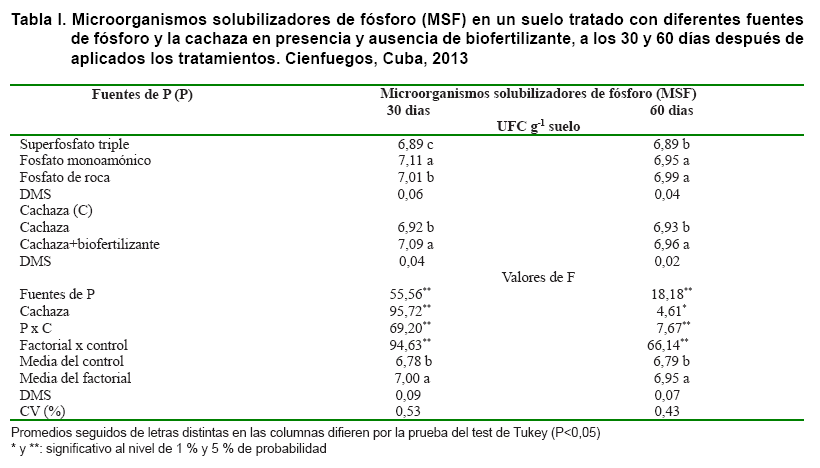
Se encontró interacción entre las fuentes de P y la cachaza para los microorganismos solubilizadores de fósforo (MSF) a los 30 y 60 días (Tabla I). La aplicación de cachaza, independientemente del enriquecimiento o no con biofertilizante, generó colonias más grandes de MSF en comparación con el tratamiento control.
En presencia de la cachaza enriquecida con biofertilizante a los 30 días, el fosfato monoamónico incrementó el número de MSF, en relación a las demás fuentes de P y a los 60 días no se verificaron diferencias entre las fuentes de fosfato monoamónico y fosfato de roca; sin embargo, en ambas fuentes hubo incremento de las MSF con respecto al uso del superfosfato triple (Tabla II). En tanto, cuando solo se aplicó cachaza (sin enriquecimiento con biofertilizante), el mayor número de MSF se obtuvo con la adición de fosfato de roca cubana a los 30 y 60 días.
El uso del biofertilizante
aumentó la población de MSF en el suelo con la aplicación
de la fuente de fosfato monoamónico. Estos resultados pueden estar relacionados
con las características químicas de ese fertilizante, ya que presenta
nitrógeno en su composición, además de su solubilidad y
la interacción con los microorganismos presentes en el biofertilizante,
pues esos son factores que influyen en la eficiencia de la fertilización
fosfatada asociada a la adición de microorganismos (16).
Para las demás fuentes de P no se verificó ningún efecto
sobre la cantidad de MSF entre los tratamientos con o sin enriquecimiento del
biofertilizante. Un resultado semejante ha sido obtenido por otros autores (10).
El hecho de que la adición del biofertilizante en la cachaza no haya
incrementado significativamente el número de MSF en la mayoría
de las fuentes de P, puede atribuirse a la alta cantidad de microorganismos
en la composición de la cachaza (2,5x102 ufc g-1).
Para el tenor de P, la materia orgánica y el valor de pH en el suelo
no se verificaron efectos de la interacción entre las fuentes de P y
la cachaza, a los 30 y 60 días después de la aplicación
de los tratamientos (Tabla III).
Aunque el uso
de la fuente de fosfato monoamónico haya mostrado cantidades más
altas de MSF en relación con otras fuentes de P (Tabla
II), fue la aplicación del fosfato de roca la que proporcionó
un nivel más alto de P en el suelo, correspondiendo a 98 % y 94 % a los
30 días y 99 % y 91 % a los 60 días, en relación con la
aplicación de superfosfato triple y fosfato monoamónico, respectivamente
(Tabla III).
Los resultados pueden ser atribuidos al efecto combinado de dos elementos principales;
primeramente, a la presencia de P insoluble en la roca fosfatada, que con la
adición de los microorganismos contenidos en la cachaza y en el biofertilizante,
se favorece la solubilización, incrementando así los niveles de
P en el suelo. Los mecanismos implicados en la solubilización del fosfato
son la producción de ácidos orgánicos y el aumento de la
acción enzimática, lo cual es atribuido a la actividad de los
microorganismos (3, 4, 5).
Por otra parte, con el extractor (Bray-2) de P utilizado en el trabajo, ya que
por este método (13) se extrae el complejo de cationes combinados con
el fósforo, así puede ser extraído el P de la fuente de
fosfato de roca, que tiene ese elemento unido con AI y Ca (17, 18); por lo tanto,
se supone que el extractor determinó el P disponible y una parte no disponible
de la roca fosfatada.
Los resultados están de acuerdo con otros estudios que verificaron una
mayor recuperación del P aplicado en el suelo con el uso del mismo extractor
(17).
El fosfato de roca presenta una solubilización lenta en el suelo. Sin
embargo, cuando este se aplica asociado a la adición de materia orgánica
y biofertilizantes, puede ser una fuente alternativa a los fertilizantes fosfatados
solubles; varios estudios han comprobado la eficacia de esta fuente en el suministro
del P al vegetal (6, 19).
Para el nivel de materia orgánica del suelo, no hubo efectos significativos
entre las fuentes de P, a los 30 y 60 días (Tabla III).
Sin embargo, el valor de pH del suelo se incrementó con la aplicación
de la roca fosfatada en comparación a las demás fuentes.
Con la adición del biofertilizante a la cachaza no se verificaron efectos
en los niveles de P y materia orgánica del suelo, en ambos periodos evaluados
(30 y 60 días). Estos resultados son semejantes a los encontrados en
otros estudios (10).
El enriquecimiento de la cachaza con biofertilizantes proporcionó disminución
de los valores de pH en el suelo a los 30 y 60 días; similares resultados
han sido encontrados por otros autores, que atribuyeron este hecho a la producción
de ácidos orgánicos por los microorganismos (6).
Se observa que agronómicamente la variación del pH (hasta 0,2)
del suelo en razón de los tratamientos fue relativamente pequeña;
por lo tanto, no es importante para explicar los resultados.
En ambos periodos evaluados, la adición de la cachaza (enriquecida o
no con biofertilizante) promovió el incremento en las colonias de MSF,
los niveles de P, la materia orgánica y el valor de pH del suelo, en
relación al control. Los resultados evidencian los beneficios de la cachaza
para la mejoría de la calidad química y biológica del suelo.
CONCLUSIÓN
La aplicación de fósforo en forma de fosfato natural en presencia de cachaza, con o sin enriquecimiento con biofertilizante, proporcionó una mayor población de microorganismos e incrementó el nivel de P en el suelo en relación con las fuentes de fosfato acidulado.
AGRADECIMIENTOS
Al programa de cooperación internacional de la CAPES/MES, por la concesión de la beca de estudios al primer autor.
Nota al pie
A Martínez, R. V.; López, M.; Brossard, F. M.; Tejeda, G. G.; Pereira, A. H.; Parra, Z. C.; Rodríguez, S. J. y Alba, A. Procedimientos para el estudio y fabricación de Biofertilizantes bacterianos. Instituto Nacional de Investigaciones Agrícolas, Maracay, Venezuela, 2006, p. 88.
BIBLIOGRAFÍA
1. Santos, D.
H.; Tiritan, C. S.; Foloni, J. S. S. y Fabris, L. B. ‘‘Produtividade de cana
de açúcar sob adubação com torta de filtro enriquecida
com fosfato solúvel’’. Pesquisa Agropecuária Tropical (Agricultural
Research in the Tropics), vol. 40, no. 4, 1 de diciembre de 2010, p. DOI:
10.5216/pat.v40i4.7272, ISSN 1983-4063, DOI 10.5216/pat.v40i4.7272.
2. Prado, R. de M.; Caione, G. y Campos, C. N. S. ‘‘Filter Cake and Vinasse
as Fertilizers Contributing to Conservation Agriculture’’. Applied and Environmental
Soil Science, vol. 2013, ISSN 1687-7667, DOI 10.1155/2013/581984, 10.1155/2013/581984,
[Consultado: 2 de diciembre de 2015], Disponible en: <http://www.hindawi.com/journals/aess/2013/581984/abs/>.
3. Lima, C. C. ‘‘Disponibilidade de fósforo para a cana-de-açúcar
em solo tratado com compostos orgânicos ricos em silício’’. Revista
Brasileira de Engenharia Agrícola e Ambiental, vol. 15, no. 12,
diciembre de 2011, pp. 1222-1227, ISSN 1415-4366, DOI 10.1590/S1415-43662011001200002.
4. Mendes, G. de O.; Freitas, A. L. M. de; Pereira, O. L.; Silva, I. R. da;
Vassilev, N. B. y Costa, M. D. ‘‘Mechanisms of phosphate solubilization by fungal
isolates when exposed to different P sources’’. Annals of Microbiology,
vol. 64, no. 1, 19 de mayo de 2013, pp. 239-249, ISSN 1590-4261, 1869-2044,
DOI 10.1007/s13213-013-0656-3.
5. Yang, S.-D.; Liu, J.-X.; Wu, J.; Tan, H.-W. y Li, Y.-R. ‘‘Effects of Vinasse
and Press Mud Application on the Biological Properties of Soils and Productivity
of Sugarcane’’. Sugar Tech, vol. 15, no. 2, 10 de febrero de 2013,
pp. 152-158, ISSN 0972-1525, 0974-0740, DOI 10.1007/s12355-012-0200-y.
6. Pereira, S. N.; Etienne, de R. C. y Stamford, W. P. ‘‘Biofertilizantes de
rocha fosfatada com Acidithiobacillus como adubação alternativa
de caupi em solo com baixo P disponível’’. Revista Analytica,
no. 9, 2004, pp. 48-53, ISSN 2310-6875.
7. Silva, M. de O.; Stamford, N. P.; Amorim, L. B. de; Júnior, A. de
A. B. y Silva, M. de O. ‘‘Diferentes fontes de P no desenvolvimento do meloeiro
e disponibilidade de fósforo no solo’’. Revista Ciência Agronômica,
vol. 42, no. 2, junio de 2011, pp. 268-277, ISSN 1806-6690, DOI 10.1590/S1806-66902011000200003.
8. Yang, P.-X.; Ma, L.; Chen, M.-H.; Xi, J.-Q.; He, F.; Duan, C.-Q.; Mo, M.-H.;
Fang, D.-H.; Duan, Y.-Q. y Yang, F.-X. ‘‘Phosphate Solubilizing Ability and
Phylogenetic Diversity of Bacteria from P-Rich Soils Around Dianchi Lake Drainage
Area of China’’. Pedosphere, vol. 22, no. 5, octubre de 2012, pp. 707-716,
ISSN 1002-0160, DOI 10.1016/S1002-0160(12)60056-3.
9. Yu, X.; Liu, X.; Zhu, T.-H.; Liu, G.-H. y Mao, C. ‘‘Co-inoculation with phosphate-solubilizing
and nitrogen-fixing bacteria on solubilization of rock phosphate and their effect
on growth promotion and nutrient uptake by walnut’’. European Journal of
Soil Biology, vol. 50, mayo de 2012, pp. 112-117, ISSN 1164-5563, DOI 10.1016/j.ejsobi.2012.01.004.
10. González, L. C.; Prado, R. M.; Hernández, A. R.; Assis, L.;
Caione, G.; Moda, L. R.; Selva, E. P. y Almeida, H. J. ‘‘Efecto de la torta
del filtro enriquecida con fosfato natural y microorganismos en el suelo y planta
en un suelo oxisol’’. Centro Agrícola, vol. 40, no. 2, 2013,
pp. 31-37, ISSN 2072-2001.
11. Hernández, A.; Pérez, J.; Bosch, D. y Castro, N. Clasificación
de los suelos de Cuba 2015. edit. Ediciones INCA, Mayabeque, Cuba, 2015,
93 p., ISBN 978-959-7023-77-7.
12. FAO. Guía para la descripción de perfiles de suelo.
[En línea]. edit. FAO, Roma, 1977, 70 p., [Consultado: 2 de diciembre
de 2015], Disponible en: <http://www.sidalc.net/cgi-bin/wxis.exe/?IsisScript=BFHIA.
xis&method=po st&formato=2&cantidad=1&expresion=mfn=003934>.
13. Bray, R. H. y Kurtz, L. T. ‘‘Determination of total, organic, and available
forms of phosphorus in soils.’’. Soil Science, vol. 59, no. 1, 1945,
pp. 39–46, ISSN 0038-075X. 1538-9243, DOI http://dx.doi.org/10.1097/00010694-194501000-00006.
14. Rosatto, M. L.; Mello, P. R. de; Castellanos, G. L.; Reyes, H. A.; Caione,
G. y Silva, C. C. N. ‘‘Solubilización de fuentes de fósforo asociadas
a un compuesto orgánico enriquecido con biofertilizantes’’. Agrociencia,
vol. 48, no. 5, agosto de 2014, pp. 489-500, ISSN 1405-3195.
15. Bataglia, O. C.; Furlani, A. M. C.; Teixeira, J. P. F.; Furlani, P. R. y
Gallo, J. R. Métodos de análise química de plantas.
Vol. 78, edit. Instituto Agronômico, Campinas, 1983, 48 p.
16. Oliveira, C. A.; Alves, V. M. C.; Marriel, I. E.; Gomes, E. A.; Scotti,
M. R.; Carneiro, N. P.; Guimarães, C. T.; Schaffert, R. E. y Sá,
N. M. H. ‘‘Phosphate solubilizing microorganisms isolated from rhizosphere of
maize cultivated in an oxisol of the Brazilian Cerrado Biome’’. Soil Biology
and Biochemistry, vol. 41, no. 9, septiembre de 2009, pp. 1782-1787, ISSN
0038-0717, DOI 10.1016/j.soilbio.2008.01.012.
17. Bonfim, E. M. da S.; Freire, F. J.; Santos, M. V. F. dos; Silva, T. J. A.
da y Freire, M. B. dos S. ‘‘Avaliação de extratores para determinação
de fósforo disponível de solos cultivados com Brachiaria brizantha’’.
Acta Scientiarum. Agronomy, vol. 25, no. 2, 23 de abril de 2003, ISSN
1807-8621, 1679-9275, DOI 10.4025/actasciagron.v25i2.1912, [Consultado: 2 de
diciembre de 2015], Disponible en: <http://periodicos.uem.br/ojs/index.php/ActaSciAgron/article/view/1912>.
18. Van Raij, B. Fertilidade do solo e manejo de nutrientes. 1a ed.,
edit. International Plant Nutrition Institute, Piracicaba, 2011, 420 p., ISBN
978-85-98519-07-4.
19. Basha, A. A. A.-B. ‘‘Improving filter mud cake with rock phosphate and biofertilizers
for exporting organic onion production in newly cultivated land at south valley
area’’. Australian Journal of Basic and Applied Sciences, vol. 5, no.
8, 2011, pp. 1354–1361, ISSN 1991-8178.
Recibido: 30 de
enero de 2015
Aceptado: 18 de abril de 2015
M.Cs. Cid N. Silva Campos, Universidad Estadual Paulista “Júlio de Mesquita Filho”, Facultad de Ciencias Agrarias y Veterinarias, Vía de Acceso Prof. Paulo Donato Castellane s/n, CEP: 14884-900-9, Jaboticabal, SP-Brasil. Email: cidncampos@yahoo.com.br