Efecto de la densidad de inoculación de embriones somáticos en la obtención de plántulas de plátano cv. ‘FHIA-21’ (AAAB)
Effect of inoculation density of somatic embryos for obtaining plantain ‘FHIA-21’ (AAAB) cultivars
Dra.C. Leyanis García-Águila,I Dr.C. Rafael Gómez-Kosky,I Dra.C. Yelenys Alvarado Capó,I M.Cs. Zoe Sarría Hernández,I M.Cs. Nilca Albany,II M.Cs. Jorge Vílchez,II M.Cs. Maritza Reyes Vega,I Blanca Pérez Pérez,I Alexis Rodríguez ConcepciónI
IInstituto
de Biotecnología de las Plantas (IBP), Universidad Central “Marta Abreu”
de Las Villas, carretera a Camajuaní km 5.5, Santa Clara, Villa Clara,
CP 54 830, Cuba.
IIFacultad de Agronomía, Universidad del Zulia, AP 15205,
Maracaibo, Estado de Zulia (4005ZU), República Bolivariana de Venezuela.
RESUMEN
La regeneración de plantas por embriogénesis somática en plátanos y bananos puede convertirse en una tecnología para la propagación a escala comercial, debido al elevado coeficiente de multiplicación de los embriones somáticos. Sin embargo, para lograr tasas superiores de germinación y conversión de plantas, es importante obtener embriones de calidad con un desarrollo morfológico sincrónico. Por tanto, el objetivo del trabajo fue determinar el efecto de la densidad de inoculación de embriones somáticos en la obtención de plántulas de plátano cv. ‘FHIA-21’ (AAAB). Para ello, se estudiaron cuatro tratamientos correspondientes a la inoculación de 0,2; 0,4; 0,6 y 0,8 gramos de masa fresca (gMF) de embriones en medio de cultivo líquido de maduración. A los 30 días, se evaluaron las características morfológicas e histológicas de los embriones y se transfirieron a un medio de cultivo semisólido de germinación. Los resultados mostraron una mejor sincronización en el desarrollo morfológico de los embriones somáticos cuando se cultivaron con 0,6 gMF, aspecto que se evidenció por la uniformidad de su longitud, formación de los meristemos caulinar y radical, así como la acumulación de sustancias de reserva. Estos embriones alcanzaron un mayor porcentaje de germinación y formación de plantas completas, con diferencias estadísticas respecto al resto de los tratamientos. Las plantas se caracterizaron por una mayor longitud del pseudotallo, más de dos hojas abiertas y mayor número de raíces. El presente estudio es fundamental para la propagación masiva de plátano cv. ‘FHIA-21’ por embriogénesis somática.
Palabras clave: embriogénesis somática, histología, maduración, morfología, sincronía.
ABSTRACT
Plant regeneration through somatic embryogenesis in plantain and banana may become a commercial propagation technology, due to the high multiplication coefficient of somatic embryos. However, it is important to get quality embryos with a synchronous morphological development to achieve higher rates of germination and plant conversion. Therefore, the aim of this study was to determine the effect of inoculation density of somatic embryos for obtaining plantain ‘FHIA-21’ (AAAB) cultivars. Then, four inoculation treatments were studied: 0,2; 0,4; 0,6 and 0,8 grams of fresh mass (gMF) of embryos on liquid culture medium of maturation. The morphological and histological characteristics of somatic embryos were evaluated after 30 days and transferred to a semisolid germination culture medium. Results showed a better synchronization in the morphological development of somatic embryos when cultured with 0,6 Gmf, which was evident by their length uniformity, the apical and root meristem formation, as well as the accumulation of reserve substances. Such embryos reached a higher percentage of germination and whole plant formation, with statistical differences compared to other treatments. These plants were characterized by a longer pseudostem, more than two open leaves and greater root number. This study is essential for the mass propagation of plantain cv. ‘FHIA-21’ by somatic embryogenesis.
Key words: somatic embryogenesis, histology, maturation, morphology, synchrony.
INTRODUCCIÓN
La embriogénesis
somática es un proceso mediante el cual las células somáticas
se diferencian en embriones somáticos y conservan íntegramente
el genotipo de la planta donante. Los métodos para la realización
de este tipo de morfogénesis se han descrito en un gran número
de especies de plantas, cada una con sus propias características (1).
En plátanos y bananos, la regeneración de plantas por embriogénesis
somática se ha utilizado como herramienta en programas de mejoramiento
por transformación genética (2), así como para aumentar
la germinación de progenies híbridas utilizadas en las estrategias
de mejoramiento convencional (3). Sin embargo, el mayor interés se centra
en su aplicación práctica para la propagación de plantas
a escala comercial (4), debido al elevado coeficiente de multiplicación
de los embriones somáticos. Aunque para lograr tasas superiores de germinación
y conversión de plantas, es importante obtener embriones de calidad con
un desarrollo morfológico sincrónico.
La asincronía que caracteriza a los cultivos embriogénicos se
considera la principal desventaja del método para su empleo en la propagación
masiva de plantas. A pesar de este fenómeno, sigue siendo un sistema
de propagación más eficiente que la micropropagación convencional
a través del cultivo de ápices meristemáticos (5). Los
altos costos de producción durante la micropropagación de plátano
generalmente limitan su uso comercial (6), debido a la oxidación fenólica,
lento crecimiento y baja proliferación de los explantes (7).
En el proceso de embriogénesis somática la fase de maduración
es crucial, porque favorece el desarrollo del embrión y su conversión
en planta. Evidencias experimentales sugieren que las condiciones de cultivo
pueden modular el desarrollo de los cultivos embriogénicos. Diferentes
autores han hecho referencia al papel de la densidad de inoculación y
su relación con el proceso de diferenciación de los embriones
somáticos, independientemente de la composición del medio de cultivo
(6, 8).
En Musa spp., los estudios relacionados con el efecto de la densidad de inoculación
no describen su influencia sobre el desarrollo morfológico de los embriones
somáticos y su relación con la reducción de la asincronía
y eficacia en la germinación. Esto se debe a que los embriones transitan
rápidamente por las diferentes etapas de desarrollo ontogénico,
sin grandes cambios morfológicos, lo cual requiere de una caracterización
detallada de su morfología e histología (9).
Con base en lo anterior, esta investigación tuvo como objetivo determinar
el efecto de la densidad de inoculación de embriones somáticos
en la obtención de plántulas de plátano cv. ‘FHIA-21’ (AAAB).
MATERIALES Y MÉTODOS
Material
vegetal
Los embriones somáticos se obtuvieron en medio de cultivo líquido,
a partir de suspensiones celulares embriogénicas de plátano cv.
‘FHIA-21’ (AAAB), siguiendo el procedimiento descrito por otros autores (10).
Se utilizó un medio de cultivo compuesto por el 100 % de las sales inorgánicas
de Schenk e Hildebrandt (11), al que se adicionaron vitaminas de Murashige y
Skoog (12) al 100 %, 0,5 mg L-1 de biotina, 100 mg L-1
de extracto de malta, 100 mg L-1 de L-glutamina, 230 mg L-1
de L-prolina, 10 mg L-1 de lactosa, 0,05 mg L-1 de zeatina,
100 mg L-1 de mio-inositol, 0,2 mg L-1 de ácido
naftalenacético (ANA), 0,2 mg L-1 de isopenilaminopurina (2ip),
0,1 mg L-1 de Kinetina y 45 g L-1 de sacarosa. El pH se
ajustó a 5,3 antes de la esterilización. Los embriones se encontraban
en etapa globular y se caracterizaron por presentar una longitud entre 0,20
a 0,50 mm.
Efecto de la densidad de inoculación en la maduración
de los embriones somáticos
Se estudiaron cuatro densidades de inoculación durante la fase de maduración
de los embriones somáticos. Para ello, se adicionaron 0,2; 0,4; 0,6 y
0,8 gramos de masa fresca (gMF) de embriones en Erlenmeyers de 250 mL de capacidad,
que contenían 30 mL de medio de cultivo líquido. El medio de cultivo
estaba compuesto por el 100 % de las sales y vitaminas MS (12), 1,0 mg L-1
de biotina, 0,5 mg L-1 de 6-bencilaminopurina (6-BAP), 1,0 mg L-1
de ácido indol-3-acético (AIA) y 30 g L-1 de sacarosa.
Los Erlenmeyers se colocaron en agitador orbital (INFORS HT) a 90 rpm de velocidad
de rotación, en condiciones de oscuridad total y 27±2,0 ºC.
Se establecieron cinco repeticiones por cada tratamiento con un diseño
experimental completamente aleatorizado. A los 30 días de cultivo, se
evaluaron las características morfológicas e histológicas
de los embriones somáticos en las cuatro densidades de inoculación.
Posteriormente, se transfirieron a medio de cultivo semisólido de germinación
propuesto por otros investigadores (13), el cual estaba compuesto por las sales
y vitaminas MS, 0,5 mg L-1 de 6-BAP, 2,0 mg L-1 de AIA,
100 mg L-1 de mio-inositol, 0,01 mg L-1 de Biobrás-6
(análogo de brasinoesteroide procedente de la Facultad de Química
de la Universidad de La Habana) y 30 g L-1 de sacarosa. En ambos
medios de cultivo el pH fue ajustado a 5,8±0,01.
Morfología e histología de los embriones somáticos
Se realizó una descripción morfológica de los embriones
somáticos, con el objetivo de identificar sus principales características,
durante la fase de maduración. Las observaciones se efectuaron bajo un
microscopio estereoscópico (OLYMPUS) (10x), así como la medición
de su longitud (mm) a través de una escala micrométrica acoplada
al ocular. Para facilitar la observación y medición de los embriones,
se extrajeron, de cada tratamiento, 1,0 mL de medio de cultivo líquido
que contenía los embriones somáticos. Las muestras se depositaron
en vasos de precipitado (50 mL de capacidad) con 30 mL de una solución
de Gelrite® (SIGMA) (2,5 g L-1) y agua desionizada. Posteriormente,
las soluciones de los vasos de precipitado se vertieron en placas de Petri de
70 mm de diámetro y quedaron inmovilizados los embriones después
de solidificada la solución. Los valores de las mediciones se agruparon
en tres rangos de longitudes, de 1,0 a 3,0; de 3,1 a 5,0 y de 5,1 a 7,0 mm,
para determinar su frecuencia de aparición en los diferentes tratamientos
y con ello identificar la densidad de inoculación que aporta mayor sincronía
al cultivo.
El análisis histológico se realizó con el objetivo de identificar
estructuras anatómicas y bioquímicas, que confirmen el desarrollo
de los embriones somáticos y su preparación para la germinación.
Para ello, se extrajeron dos muestras de cada tratamiento y se colocaron los
embriones somáticos en una solución de fijación que contenía
formaldehído al 37 % (v/v), ácido acético al 100 % (v/v)
y etanol al 70 % (v/v), en una proporción 5:5:90 durante 24 horas. Seguidamente,
estos fueron deshidratados en un gradiente ascendente de etanol y embebidos
en parafina. Se efectuaron cortes seriados de 10 µm de grosor con un micrótomo
de rotación (Zeiss, Alemania), se fijaron en portaobjetos, se hidrataron
y se realizó una tinción con safranina al 0,5 %. Las secciones
histológicas de las muestras se examinaron en microscopio óptico
(AXIOSKOP) (40x) y las imágenes fueron captadas con una cámara
digital (OLYMPUS DP70) que se encontraba acoplada al microscopio.
Germinación de los embriones somáticos
Los embriones somáticos maduros, correspondientes a cada densidad de
inoculación, se colocaron en frascos plásticos de cultivo (500
mL de capacidad total) sobre 50 mL de medio de cultivo semisólido de
germinación. Los frascos se colocaron en cámara de crecimiento
de luz artificial (tubos fluorescentes de luz blanca), con un fotoperiodo de
16 horas de luz a una densidad de flujo de fotones fotosintéticos (FFF)
de 62-68 µmol m-2 s-1) y 27±2,0 ºC.
Se establecieron ocho réplicas por cada densidad de inoculación,
con 20 embriones somáticos cada una en un diseño experimental
completamente aleatorizado.
Durante la fase de geminación de los embriones somáticos, se realizaron
observaciones a los 10, 20 y 30 días de cultivo, con la ayuda de un microscopio
estereoscópico (OLYMPUS) (10x); además, a los 30 días se
cuantificó el número de embriones germinados y se expresaron los
valores en porcentaje de germinación. Al mismo tiempo, se evaluaron las
características morfológicas de las plantas, como la longitud
del pseudotallo (cm) desde la base hasta la inserción de la primera hoja,
el número de hojas abiertas y número de raíces. Posteriormente,
las plantas fueron transferidas y mantenidas durante 30 días en medio
de cultivo semisólido de elongación, previo a su traslado a condiciones
ex vitro en casa de cultivo.
Análisis estadístico
Para el análisis estadístico se utilizó el paquete computacional
SPSS (Statistical Package for the Social Sciences) versión 20 sobre Windows
(14). A los datos experimentales se les comprobaron los supuestos de distribución
normal y homogeneidad de varianza. La comparación de los valores medio
se efectuó mediante la prueba de Kruskall Wallis, con un nivel de significación
de 0,05 %.
RESULTADOS Y DISCUSIÓN
Efecto
de la densidad de inoculación en la maduración de los embriones
somáticos
Los resultados mostraron la influencia de la densidad de inoculación
en la morfología, histología y posterior germinación de
los embriones somáticos de plátano cv. ‘FHIA-21’ (AAAB).
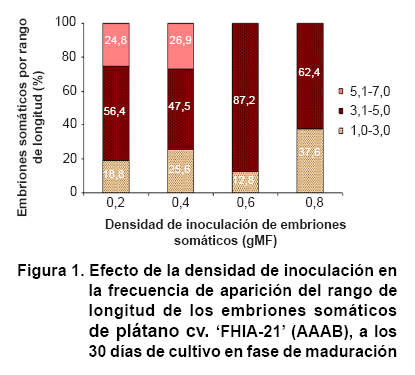
A los 30 días de cultivo en fase de maduración, se observaron
diferencias en la morfología de los embriones somáticos. La principal
diferencia se presentó en su longitud, con variaciones en la frecuencia
de aparición de los rangos establecidos para este estudio (de 1,0 a 3,0;
de 3,1 a 5,0 y de 5,1 a 7,0 mm). Al respecto, se observó que los embriones
somáticos cultivados con las menores densidades (0,2 y 0,4 gMF) mostraron
mayor heterogeneidad en su longitud, con representación en los tres rangos
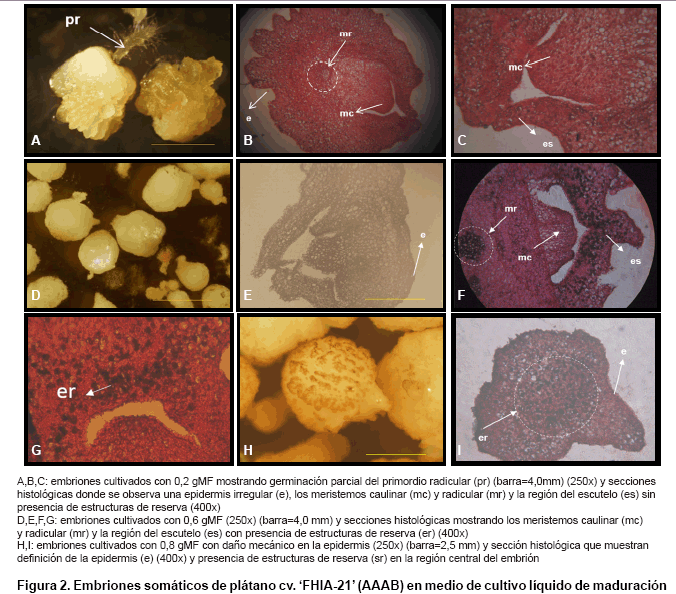
de longitudes (Figura 1). Además, mostraron germinación
parcial con presencia del primordio radicular (Figura 2 A).
En el examen histológico de estos tratamientos, se observó una
epidermis irregular por la formación de estructuras redondeadas en su
periferia y la definición de los meristemos caulinar y radicular en la
región central del embrión. No se observaron estructuras de reserva
en la región del escutelo (Figura 2 B, C).
A pesar del carácter
asincrónico de los cultivos embriogénicos, la densidad de inoculación
de 0,6 gMF proporcionó una mayor sincronía, porque logró
mayor homogeneidad en la longitud de sus embriones somáticos, en relación
con el resto de los tratamientos estudiados. El mayor porcentaje de estos embriones
(87,2 %) se ubicó en uno de los rangos establecidos con una longitud
de 3,1 a 5,0 mm (Figura 1).
Estos embriones se caracterizaron por presentar forma circular con una coloración
amarillo pálido (Figura 2 D). Las secciones histológicas
mostraron una epidermis regular de estos embriones, además de la presencia
de los meristemos caulinar y radicular. También se observó en
la región del escutelo la acumulación de estructuras de reservas
(Figura 2 E, F, G).
Por otra parte, los embriones cultivados con 0,8 gMF de densidad de inoculación
mostraron mayor frecuencia de aparición de embriones pequeños
(37,6 %), entre 1,0 y 3,0 mm de longitud, aunque el 62,4 % de sus embriones
se ubicó en el rango de longitud medio entre 3,1 y 5,0 mm (Figura
1). En este tratamiento se observaron daños sobre la epidermis de
los embriones, dado posiblemente por la fricción entre ellos, debido
a la alta densidad de inoculación (Figura 2 H). Además,
se observó el oscurecimiento del medio de cultivo, lo cual pudo estar
relacionado con la exudación de compuestos fenólicos y su posterior
oxidación.
Las secciones histológicas de los embriones somáticos cultivados
con 0,8 gMF evidenciaron la definición de la epidermis regular y la presencia
de estructuras de reserva en el centro del embrión. Sin embargo, no se
observaron los meristemos caulinar y radicular (Figura 2 I).
Germinación de los embriones somáticos
Durante la germinación de los embriones somáticos se observaron
diferencias en su aspecto morfológico, relacionadas con la densidad de
inoculación utilizada durante la fase de maduración. A los 10
días, los embriones cultivados con 0,6 gMF mostraron la emisión
del ápice caulinar como pequeños brotes de color verde. Estos
se elongaron con el aumento de los días de cultivo hasta la formación
de plantas completas, las cuales se observaron a los 30 días de cultivo
(Figura 3 A, B, C). El mayor porcentaje de germinación
correspondió a estos embriones (62,0 %), con diferencias significativas
con el resto de los tratamientos (Figura 4).
La germinación
de los embriones somáticos cultivados con 0,8 gMF mostró un desarrollo
morfológico, similar a los embriones cultivados con
0,6 gMF; pero su bajo porcentaje de germinación (19,3 %) pudo estar dado
por la fenolización y muerte de los embriones sobre el medio de cultivo
semisólido de germinación. Esta respuesta debió estar relacionada
con el daño mecánico que presentaban en la epidermis y el poco
desarrollo ontogénico que alcanzaron al finalizar la fase de maduración.
Por su parte, los embriones somáticos cultivados con 0,2 y 0,4 gMF presentaron
diferencias morfológicas durante su germinación con respecto al
resto de los tratamientos. A los 10 días de cultivo, se observó
un aumento del tamaño, con un crecimiento irregular de la epidermis,
dando lugar a estructuras redondeadas de color blanco (Figura
3 D). Posteriormente, a los 20 días estas irregularidades se diferenciaron
en pequeños brotes de color verde y a los 30 días se observaron
plantas con crecimiento en forma de roseta (Figura 3 E y F).
Al analizar las características morfológicas de las plantas, se
observó que las procedentes del cultivo con 0,6 gMF tuvieron mejor definición
y longitud del pseudotallo, más de dos hojas abiertas y mayor número
de raíces, con diferencias significativas, respecto a las plantas procedentes
del resto de los tratamientos (Tabla y Figura
3 C). Sin embargo, las plantas originadas de embriones somáticos,
cultivados con 0,2 y 0,4 gMF, mostraron desórdenes en su morfología,
con un crecimiento en forma de roseta por la no definición del pseudotallo
y la presencia de múltiples brotes de apariencia adventicia (Figura
3 F).
En el género
Musa, los estudios relacionados con la densidad de inoculación han estimado
la culminación del desarrollo de los embriones somáticos a través
de su germinación. Por ejemplo, los embriones somáticos del banano
cv. ‘FHIA-18’ (AAAB) mostraron una mejor germinación cuando fueron cultivados
con 0,8 gMF (13).
Por otra parte, en el cultivar de plátano ‘Navolean’ (ABB) se produjo
la maduración de los embriones a una densidad de 0,5 gMF con el 46,8
% de germinación (15). Al respecto, los embriones maduros de plátano
cv. ‘Da Jiao’ (ABB) presentaron de 2,0 a 3,0 mm de diámetro después
de tres meses de cultivo con un porcentaje de germinación del 40,0 %
(2). Como se observa existen diferencias en relación con la densidad
de inoculación y el porcentaje de germinación de los embriones
somáticos, aspectos que han sido relacionados con la influencia del genotipo.
En este estudio, se obtuvo un 62,0 % de embriones germinados cuando los embriones
fueron cultivados a 0,6 gMF, lo cual sugiere la conveniencia de propagar el
cv. de plátano ‘FHIA-21’ por embriogénesis somática.
El éxito en la aplicación de la biotecnología moderna depende
de protocolos eficientes y reproducibles de regeneración de plantas,
a partir de embriones somáticos y suspensiones celulares embriogénicas
(16). Muchos factores restrictivos permanecen en la embriogénesis somática
de plátano como la larga duración, la imprevisibilidad y un alto
grado de dependencia al genotipo (17). Por esta razón, es de gran importancia
realizar estudios que nos permitan establecer las condiciones de cultivos idóneas
para estandarizar los protocolos en función de cada cultivar.
El efecto de la densidad de inoculación y la influencia del genotipo
están entre los factores que determinan la formación de los embriones
somáticos de plátano cv. ‘FHIA-21’ a partir de suspensiones celulares
embriogénicas (10). No obstante, los resultados experimentales de este
trabajo demostraron también la importancia de la densidad de inoculación
en el desarrollo morfológico de estos embriones durante las fases de
maduración, germinación y formación de plantas completas.
Sin embargo, varios investigadores consideran que para la selección adecuada
de la densidad de inoculación, se debe determinar su efecto sobre la
reducción de la asincronía; aspecto fundamental para el avance
de la embriogénesis somática a escala comercial (10). Con ello
se pueden simplificar los protocolos y disminuir sustancialmente los costos
de producción (18). En este sentido, otros autores sugieren que los protocolos
deben ser lo suficientemente amplios como para capturar el rango completo de
posibles diferencias genéticas en el desarrollo de cada genotipo (19).
El efecto de la densidad de inoculación se ha relacionado con la disponibilidad
de nutrientes minerales en el medio de cultivo. Aunque en un estudio previo
se comprobó que no existe relación entre el factor densidad de
inoculación y los requerimientos de nutrientes minerales durante la fase
de maduración de embriones somáticos de plátano cv. ‘FHIA-21’
(20).
De acuerdo con la información existente, durante la fase de maduración
los embriones somáticos sufren cambios morfológicos y bioquímicos,
debido a la expansión celular y acumulación de sustancias de reserva
(1). En este estudio se observó la expansión celular a través
del incremento en la longitud de los embriones somáticos, la cual se
produjo en todos los tratamientos estudiados. Aunque solamente los embriones
que se cultivaron en 0,6 gMF de densidad de inoculación, mostraron estructuras
de reserva y definición de los meristemos caulinar y radicular. Estas
características se consideran evidencias anatómicas de la preparación
de los embriones somáticos para la germinación. Los resultados
de este estudio constituyen el primer informe donde se relacionan las características
morfológicas e histológicas de los embriones somáticos
de plátano cv. ‘FHIA-21’ (AAAB) con la sincronización del cultivo
y su posterior germinación.
CONCLUSIONES
Los resultados mostraron la influencia de la densidad de inoculación en el desarrollo morfológico de los embriones somáticos de plátano cv. ‘FHIA-21’ (AAAB). Los embriones que se cultivaron a 0,6 gMF presentaron una mayor uniformidad de su longitud, formación de los meristemos caulinar y radical, así como la acumulación de sustancias de reserva. Estos embriones alcanzaron mayor porcentaje de germinación y formación de plantas completas. El presente estudio es fundamental para la propagación in vitro de plátano cv. ‘FHIA-21’ a gran escala por embriogénesis somática.
AGRADECIMIENTOS
Los autores agradecen a la Dra.C. Novisel Veitía (IBP, Cuba), por su colaboración en el análisis estadístico de los datos. Esta investigación fue apoyada por el Ministerio de Ciencia, Tecnología y Medio Ambiente de Cuba, en el marco del proyecto “Aplicación de la embriogénesis somática como una vía alternativa para la propagación masiva del cultivar de plátano vianda ‘FHIA-21’ (Musa AAAB)”.
BIBLIOGRAFÍA
1. von Arnold,
S. ‘‘Somatic embryogenesis’’ [en línea]. En: eds. George E. F., Hall
M. A., y Klerk G. J. D., Plant Propagation by Tissue Culture, edit.
Springer Netherlands, Dordrecht, 2007, pp. 335-354, ISBN 978-1-4020-5004-6,
[Consultado: 8 de diciembre de 2015], Disponible en: <http://link.springer.com/10.1007/978-1-4020-5005-3>.
2. Dai, X. M.; Xiao, W.; Huang, X.; Zhao, J. T.; Chen, Y. F. y Huang, X. L.
‘‘Plant regeneration from embryogenic cell suspensions and protoplasts of dessert
banana cv. ‘Da Jiao’ (Musa paradisiacal ABB Linn.) via somatic embryogenesis’’.
In Vitro Cellular & Developmental Biology - Plant, vol. 46, no.
5, 5 de octubre de 2010, pp. 403-410, ISSN 1054-5476, 1475-2689, DOI 10.1007/s11627-010-9314-7.
3. Uma, S.; Lakshmi, S.; Saraswathi, M. S.; Akbar, A. y Mustaffa, M. M. ‘‘Plant
regeneration through somatic embryogenesis from immature and mature zygotic
embryos of Musa acuminata ssp. burmannica’’. In Vitro
Cellular & Developmental Biology - Plant, vol. 48, no. 5, 13 de septiembre
de 2012, pp. 539-545, ISSN 1054-5476, 1475-2689, DOI 10.1007/s11627-012-9462-z.
4. Meenakshi, S.; Shinde, B. N. y Suprasanna, P. ‘‘Somatic embryogenesis from
immature male flowers and molecular analysis of regenerated plants in banana
‘Lal Kela’(AAA)’’. Journal of Fruit and Ornamental Plant Research,
vol. 19, no. 2, 2011, pp. 15–30, ISSN 1231-0948.
5. Deo, P. C.; Tyagi, A. P.; Taylor, M.; Harding, R. y Becker, D. ‘‘Factors
affecting somatic embryogenesis and transformation in modern plant breeding’’.
The South Pacific Journal of Natural and Applied Sciences, vol. 28,
no. 1, 1 de enero de 2010, pp. 27-40, ISSN 1013-9877, 1726-0787, DOI 10.1071/SP10002.
6. Monteiro, T. R.; Luis, Z. G.; Freitas, E. de O.; Matsumoto, K. y Scherwinski,
P. J. E. ‘‘Cell differentiation and plant regulators on banana’’. Revista
Brasileira de Fruticultura, vol. 33, no. SPE1, octubre de 2011, pp. 213-221,
ISSN 0100-2945, DOI 10.1590/S0100-29452011000500025.
7. Korneva, S.; Flores, J.; Santos, E.; Piña, F. y Mendoza, J. ‘‘Plant
regeneration of plantain ‘Barraganete’ from somatic embryos using a temporary
immersion system’’. Biotecnología Aplicada, vol. 30, no. 4,
2013, pp. 267–270, ISSN 0864-4551, 1027-2852.
8. Ducos, J. P.; Lambot, C. y Pétiard, V. ‘‘Bioreactors for coffee mass
propagation by somatic embryogenesis’’. International Journal of Plant Developmental
Biology, vol. 1, no. 1, 2007, pp. 1–12, ISSN 1749-4753.
9. Jalil, M.; Chee, W. W.; Othman, R. Y. y Khalid, N. ‘‘Morphohistological examination
on somatic embryogenesis of Musa acuminata cv. Mas (AA)’’. Scientia
Horticulturae, vol. 117, no. 4, 18 de agosto de 2008, pp. 335-340, ISSN
0304-4238, DOI 10.1016/j.scienta.2008.05.018.
10.García, Á. L.; Gómez, K. R.; Alvarado, C. Y. y Reyes,
Z. S. y M. ‘‘Effect of inoculum density on formation and morphology of plantain
somatic embryos (Musa spp. AAAB, cv. Hybrid ‘FHIA-21’)’’. Revista
Colombiana de Biotecnología, vol. 12, no. 2, diciembre de 2010,
pp. 240-247, ISSN 0123-3475.
11. Schenk, R. U. y Hildebrandt, A. C. ‘‘Medium and techniques for induction
and growth of monocotyledoneous and dicotyledoneous plant cell cultures’’. Canadian
Journal of Botany, vol. 50, no. 1, 1 de enero de 1972, pp. 199-204, ISSN
0008-4026, DOI 10.1139/b72-026.
12. Murashige, T. y Skoog, F. ‘‘A Revised Medium for Rapid Growth and Bio Assays
with Tobacco Tissue Cultures’’. Physiologia Plantarum, vol. 15, no.
3, 1 de julio de 1962, pp. 473-497, ISSN 1399-3054, DOI 10.1111/j.1399-3054.1962.tb08052.x.
13. Kosky, R.; Gilliard, T.; Barranco, L. y Reyes, M. ‘‘Embriogénesis
somática en medios líquidos. Maduración y aumento de la
germinación en el cultivar híbrido «FHIA-18» (AAAB)’’.
InfoMusa, vol. 9, no. 1, 2000, pp. 12-16, ISSN 1023-0076.
14. IBM SPSS Statistics [en línea]. Versión 20, [Windows],
edit. IBM Corporation, U.S, 2011, Disponible en: <http://www.ibm.com>.
15. Cabrera, M.; López, J.; Kosky, R.; Montano, N.; Reyes, M.; Reinaldo,
D.; Ventura, J. C.; Medero, V.; Santos, A.; García, M.; Basail, M. y
Espinosa, E. ‘‘Multiplicación, histo-diferenciación y regeneración
de suspensiones celulares embriogénicas en plátanos vianda «Navolean»
(AAB)’’. Biotecnología Vegetal, vol. 2, no. 2, 2002, pp. 115-117,
ISSN 2074-8647.
16. Ramírez, V. M. y de García, E. ‘‘Características marcadoras
en suspensiones celulares embriogénicas de banano cien bta-03 (AAAA)
y su parental williams (AAA)’’. Bioagro, vol. 24, no. 2, agosto de
2012, pp. 73-82, ISSN 1316-3361.
17. Remakanthan, A.; Menon, T. G. y Soniya, E. V. ‘‘Somatic embryogenesis in
banana (Musa acuminata AAA cv. Grand Naine): effect of explant and
culture conditions’’. In Vitro Cellular & Developmental Biology - Plant,
vol. 50, no. 1, 13 de agosto de 2013, pp. 127-136, ISSN 1054-5476, 1475-2689,
DOI 10.1007/s11627-013-9546-4.
18. Gupta, P. K. y Timmis, R. ‘‘Mass propagation of conifer trees in liquid
cultures — progress towards commercialization’’ [en línea]. En: eds.
Hvoslef E. A. K. y Preil W., Liquid Culture Systems for in vitro Plant Propagation,
edit. Springer Netherlands, 2005, pp. 389-402, ISBN 978-1-4020-3199-1, [Consultado:
10 de diciembre de 2015], Disponible en: <http://link.springer.com/chapter/10.1007/1-4020-3200-5_30>.
19. Youssef, M.; James, A.; Mayo, M. A.; Ku, C. J. R.; Grijalva, A. R. y Escobedo,
G. R. M. ‘‘Influence of genotype and age of explant source on the capacity for
somatic embryogenesis of two Cavendish banana cultivars (Musa acuminata
Colla, AAA)’’. African Journal of Biotechnology, vol. 9, no. 15, 2010,
pp. 2216-2223, ISSN 1684-5315, DOI 10.4314/ajb.v9i15.
20. García, Á. L.; Alvarado, C. Y.; Kosky, R. G.; Sarría,
Z.; Chong, P. B.; Reyes, M.; Pérez, B.; Concepción, A. y Mollineda,
Á. ‘‘Análisis del contenido de nutrientes minerales durante la
formación y maduración de embriones somáticos deFHIA-21
(Musa AAAB)’’. Biotecnología Vegetal, vol. 12, no.
1, 2012, pp. 33-40, ISSN 1609-1841, 2074-8647.
Recibido: 7 de
octubre de 2014
Aceptado: 16 de abril de 2015
Dra.C. Leyanis García-Águila, Instituto de Biotecnología de las Plantas (IBP), Universidad Central “Marta Abreu” de Las Villas, carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, CP 54 830, Cuba. Email: leyanis@ibp.co.cu