Evaluación de la tolerancia de variedades mexicanas de trigo a la salinidad, a través de indicadores fisiológicos, bioquímicos y agronómicos, cultivadas en Cuba en condiciones de campo
Evaluating salinity tolerance through physiological, biochemical and agronomical indicators in Mexican wheat varieties, cultivated under field conditions in Cuba
M.Cs. Leandris Argentel Martínez,I Dr.C. Jaime Garatuza Payán,II Dr.C. Enrico A. Yépez González,II Dr.C. Sergio de los Santos-VillalobosII
IUniversidad
de Granma, carretera a Manzanillo, km 17½, Peralejo. Bayamo, CP 85 100,
Cuba.
IIInstituto Tecnológico de Sonora, 5 de Febrero 818 Sur, Col.
Centro, Cd. Obregón, Sonora, México, CP 85 000.
RESUMEN
Se evaluó la tolerancia a la salinidad de seis variedades mexicanas de trigo, a través de indicadores fisiológicos, bioquímicos y agronómicos, con la finalidad de recomendar las de mejor respuesta para suelos afectados por el estrés salino. La conductividad eléctrica (CEes) del suelo salino empleado en el estudio fue de 7,25 dS m-1; como control se empleó un suelo con una CE de 0,46 dS m-1, ambos son suelos agrupados como Vertisoles. Para diferenciar el grado de tolerancia varietal al estrés salino se evaluaron las variables porcentaje de germinación; altura de la planta; longitud de las raíces y acumulación de materia seca; contenido relativo de agua; transpiración; potenciales hídrico, osmótico saturado y ajuste osmótico; acumulación de prolina y rendimiento agrícola. En todas las variedades se observó una disminución significativa de los indicadores evaluados en el suelo salino, siendo la germinación y transpiración las variables más afectadas. Por efecto de la salinidad, el potencial osmótico y, en consecuencia el hídrico, disminuyeron significativamente en todas las variedades, teniendo lugar el ajuste osmótico. El contenido de prolina se incrementó significativamente en condiciones de estrés salino. El rendimiento agrícola presentó diferencias significativas entre variedades, con valores desde 4,4 a 5,4 t ha-1 en el suelo salino. La evaluación de la tolerancia a la salinidad permitió clasificar como tolerante la variedad Júpare C2001, moderadamente tolerantes las variedades Banámichi C2004 y Samayoa C2004 y susceptibles las variedades Aconchi C89, Rafi C97 y Nácori C97, recomendando tales variedades en el mismo orden cuando la CEes sea igual o menor de 7,25 dS m-1.
Palabras clave: régimen hídrico, rendimiento, tolerancia a salinidad, trigo, variedades.
ABSTRACT
Salinity tolerance was evaluated through physiological, biochemical and agronomical indicators in six Mexican wheat varieties cultivated under field conditions in Cuba, in order to recommend those better responding to salinity stress-affected soils. The electric conductivity (CEes) of salty soils employed in the study was 7,25 dS m-1; a soil with an electric conductivity of CE 0,46 dS m-1 was used as control, both classified as Vertisols. To differentiate varietal tolerance degree to saline stress the following variables were evaluated: germination percentage, plant height, root length and dry matter accumulation; relative water content, transpiration, osmotic adjustment, saturated osmotic and water potentials, proline accumulation and agricultural yield. In all varieties, a significant decrease of the evaluated indicators was observed, germination and transpiration being the most affected variables. Due to salinity stress, osmotic and consequently water potentials diminished in every variable whereas osmotic adjustment took place. Proline content increased significantly under saline conditions. Yield showed significant differences among varieties, with values from 4,4 to 5,4 t ha-1. Salinity tolerance evaluation allowed to classify Júpare C2001 as tolerant variety, Banámichi C2004 and Samayoa C2004 as moderately tolerant varieties, whereas Aconchi C89, Rafi C97 and Nácori C97 as susceptible varieties, recommending them in the same order where CEes= 7,25 dS m-1.
Key words: water regime, yield, salinity tolerance, wheat, varieties.
INTRODUCCIÓN
Entre las condiciones
adversas de los sistemas agrícolas del mundo, la salinidad de los suelos
es uno de los factores abióticos que más influye sobre la productividad
de las plantas cultivadas. Aproximadamente, el 43 % de la superficie terrestre
utilizada para el cultivo en el mundo se encuentra afectada por la salinidad
que, en su mayoría, supera los niveles de tolerancia de las especies
de cultivo tradicionales. El porcentaje de salinidad en el suelo aumenta a una
tasa media de 0,5 % anual, debido fundamentalmente a las bajas precipitaciones,
alta superficie de evaporación, irrigación con aguas de mala calidad
y por prácticas tradicionales de cultivo que favorecen el incremento
de la concentración de sales en el suelo (1). Actualmente, se contabilizan
más de 953 millones de hectáreas de suelos afectados por este
evento estresante en diferentes regiones del mundo, siendo más agravante
la situación en regiones con escasa precipitación pluvial (2).
En la política de recuperación y manejo de suelos salinos, el
uso de especies y variedades tolerantes al estrés se considera de primordial
importancia, recibiendo especial atención por diferentes investigadores
en Cuba y en el extranjero (3). De esta manera, diversos autores sostienen que
incrementar la tolerancia a la salinidad en especies cultivables es un elemento
importante en los sistemas integrados de cultivo en áreas afectadas por
este tipo de estrés y que, a pesar de que esta temática ha sido
objeto de múltiples investigaciones, particularmente en los últimos
30 años, aún no se cumplen todas las expectativas y se tendrá
que seguir trabajando en la mejora genética para este carácter
o en alternativas agro-biotecnológicas que conduzcan a remediar dicho
problema en el suelo o a disminuir sus efectos adversos en la planta (4).
El carácter poligénico de la tolerancia al estrés salino
ha sido el principal obstáculo para la mejora genética (5). Esta
situación impone la necesidad de evaluar la tolerancia de nuevas variedades
de forma precisa y consistente a lo largo de su ciclo biológico (6),
buscando congruencia de tolerancia entre las diferentes fenofases y el rendimiento
agrícola. Se ha observado que múltiples variedades muestran variabilidad
de respuesta, en cuanto a tolerancia o susceptibilidad a la salinidad en diferentes
estadios del desarrollo, siendo algunos de contribución altamente significativa
en la tolerancia final al estrés salino (7). Así, la presente
investigación tuvo como objetivos identificar y evaluar la tolerancia
a la salinidad en variedades mexicanas de trigo introducidas y aclimatadas en
Cuba, las cuales están siendo objeto de evaluación en suelos salinos
de la región oriental, donde algunas variedades de trigo, obtenidas nacionalmente
y otras especies vegetales como el arroz, no expresan su potencial genético
productivo, debido a que no toleran la salinidad existente en los suelos. Por
tanto, el estudio permitirá la selección diferencial de variedades
de alto rendimiento frente al estrés salino y su recomendación
para contribuir al incremento de la biodiversidad de especies en ecosistemas
frágiles y degradados, elevar el coeficiente de utilización de
estos suelos, en los que las producciones no son rentables por consecuencia
del cambio climático global y el uso de variedades susceptibles.
MATERIALES Y MÉTODOS
En la presente investigación se utilizaron seis variedades mexicanas de trigo, que fueron suministradas por el Centro Internacional de Mejoramiento de Maíz y Trigo (CIMMyT) a través del proyecto “Introducción y validación de variedades de trigo con tolerancia a la salinidad y la sequía en la provincia de Granma, Cuba”. Tales variedades se encuentran en la fase de experimentación para su futura extensión en la región oriental, conforme al subprograma nacional de producción de granos, perteneciente al Programa Nacional de Producción de Alimentos de la Agricultura Urbana en Cuba. Las variedades fueron: Júpare C2001; Banámichi C2004; Samayoa C2004; Aconchi C89; Rafi C97; Nácori C97. Todas poseen similitud de procedencia (México) y ciclo biológico (120 días).
Descripción del experimento
Características
de los suelos empleados
El experimento se desarrolló en condiciones de campo, con el objetivo
de evaluar la tolerancia a la salinidad de las seis variedades. Para ello fue
seleccionada como área experimental la granja “San José” de la
Empresa Genética y Cría “Manuel Fajardo” del municipio Jiguaní,
provincia de Granma, situada a los 20°19´ N y los 76°33´
W sobre suelos de un rango de salinidad desde débiles a fuertemente salinos
(833 a 6656 ppm) (1,3 dS m-1 a 10,4 dS m-1, clasificado
como Vértico sálico (VP salino) (8). Tal clasificación
se correlaciona con el grupo Halic Haplustert, perteneciente a la clasificación
desarrollada por la Soil Taxonomy, que a su vez, también tiene
correlación con la clasificación propuesta por World Reference
Base (9, 10).
Los suelos salino y no salino se encuentran separados por un canal magistral
de riego cuyo flujo procede de la presa “Cautillo”. La distancia efectiva de
los campos fue de 38 m, que es el resultado de la separación entre el
borde de cada campo hasta el canal (15 m), más sus dimensiones que son
de 8 m. Los dos campos fueron ajustados a un área total de 4900 m2
(70 x 70 m). Ambos suelos son terrenos maestros de más de 30 años
de cultivo. La preparación de suelos en los dos años de experimentación
(2012 y 2013) se realizó según las normas establecidas en el Instructivo
Técnico para el cultivo del trigoA.
Las siembras se realizaron el 10 de octubre de 2012 y el 14 de octubre de 2013
en cada año de experimentación, en hileras y a chorrillo, respectivamente,
separadas a 0,25 m, con una norma de siembra de 90 kg ha-1 de semillas.
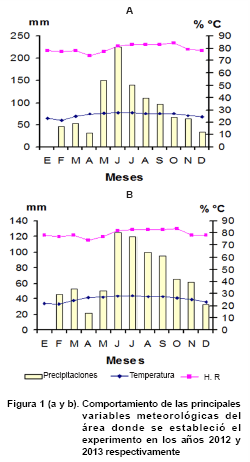
Variables meteorológicas
El primer año de experimentación (2012), en el área de
estudio, se registraron temperaturas medias, que oscilaron entre 22,5 y 27,9
°C (Figura 1a), con máximas entre 29 y 33,4 °C
y mínimas entre 15,4 y 24 °C. Los valores promedio de precipitaciones
estuvieron en el rango de los 600-800 mm anuales. En tanto la humedad relativa
mostró valores entre 72 y 84 %, observándose los mayores en los
meses de junio a noviembre.
En el año
2013 se registró una temperatura media anual entre 23,1 y 26,6 °C
(Figura 1b), con máximas entre 28,3 y 29,7 °C y
mínimas entre 19,3 y 21 °C, mientras que las precipitaciones estuvieron
en el rango de los 570-720 mm anuales.
La humedad relativa mostró valores entre 71 y 85 %, observándose
los mayores en los meses de junio a noviembre. Se pudo constatar que durante
los dos años de estudio, los meses de octubre, noviembre y diciembre
presentaron cierta similitud en el comportamiento de las variables climáticas.
Los datos meteorológicos fueron obtenidos en la Estación Agrometeorológica
“Cautillo”, que se encuentra ubicada a una distancia de 250 m del área
donde se desarrolló el experimento.
Determinación de la conductividad eléctrica de las muestras
de suelo
El análisis de la salinidad de los suelos empleados se llevó a
cabo utilizando 50 muestras en tres transeptos dentro del área de estudio,
a una distancia entre puntos de 1 m (11). La extracción de las muestras
se realizó con una barrena de 1,20 m de longitud. Posteriormente, las
muestras tomadas fueron llevadas al laboratorio, desmenuzadas y colocadas en
bandejas de cartón para ser secadas al aire durante 15 días. Luego
se trituraron, se tamizaron por una malla de 2,0 mm y fueron depositadas en
frascos de vidrio, para su posterior utilización en los análisis
una vez conformada la pasta saturada (11). Para la obtención del extracto
se utilizó la técnica de filtrado con vacío; en los casos
donde este filtrado produjo extractos con gran turbidez se empleó la
técnica de centrifugación (12).
Diseño experimental
Se estableció un diseño experimental de bloques al azar con arreglo
factorial, conformando cuatro bloques orientados de norte a sur por existir
variabilidad espacial de la conductividad eléctrica. El tamaño
de las parcelas fue de 16 m2 (4 x 4 m), separadas a una distancia
de 1,5 m. Se tuvo en cuenta el efecto de borde y de las variantes vecinas en
cada parcela para la toma de muestra, siendo la superficie de cálculo
de 12,25 m2 (13).
Variables evaluadas
Las variables evaluadas se cuantificaron o procesaron en el laboratorio móvil
existente en la Empresa de Genética y Cría.
Germinación de las semillas
El porcentaje de germinación (PG) se evaluó en cada variedad,
en función del total de semillas establecidas en el suelo salino y no
salino y fue expresado en valor relativo al control, mediante la fórmula:
PG (%)= (GS/GC)*100 (3, 14)
donde:
PG representa el porcentaje de germinación GS y GC representan los porcentajes
de germinación de semillas en los suelos salino y no salino, respectivamente,
para cada variedad.
Crecimiento de las plántulas
Transcurridos 15 días posteriores a la germinación, se evaluaron
las variables del desarrollo altura de las plántulas (AP), longitud de
las raíces (LR), ambas variables se expresaron en centímetros
(cm) y la acumulación de masa seca (MS) expresada en gramos (g). A partir
de estos datos se calcularon los índices de tolerancia al estrés
salino (ITS), siguiendo la fórmula:
ITS (%)= [(Yc*Ys)/(Yc)2 ]*100 (3, 14)
donde:
Yc representa el valor del indicador evaluado en el suelo no salino.
Ys el valor del indicador evaluado en el suelo salino.
El tamaño de muestra para estas evaluaciones fue de 12 plántulas
por réplica, las que fueron tomadas al azar en la superficie de cálculo
(2).
Contenido relativo de agua
Se empleó una muestra, tomada al azar a las 10:00 am, de la parte media
del follaje (hojas 3, 4, 5) de 10 plántulas por tratamiento, para determinar
la masa fresca (MF). Posteriormente, se determinó la masa turgente (MT)
después de haber mantenido las muestras en agua durante un tiempo de
12 horas. Cada fragmento tenía una longitud de 1,5 cm. Más tarde,
la muestra fue llevada a una estufa (DK-83) durante 72 horas, manteniendo la
temperatura constante a 80 °C para obtener la masa seca (MS). Se determinó
el contenido relativo de agua (CRA), según el procedimiento de medición
por gravimetría (15).
Transpiración (T)
Se determinó a las 10:30 am en la tercera, cuarta y quinta hojas en su
porción central, por la diferencia de masa fresca y seca, y se expresó
en función del área foliar (AF), determinada mediante un planímetro
digital MK, Delta–T Devices, Cambridge, UK (16).
Se realizó el corte de las hojas y se pesó inmediatamente que
constituyó la masa inicial (MI). Al transcurrir 10 minutos (t), se pesó
nuevamente el órgano de la planta, representando la masa final (MF) y
se calculó la transpiración a través de la ecuación:
T= (MI-MF)/t*AF
Potencial hídrico
Para la determinación del potencial hídrico se tomaron muestras
al azar de cinco plántulas por variedad, en cada tratamiento y se realizaron
las mediciones con la cámara de presión de Schollander (PWP-C04)
(17).
Potencial osmótico saturado
El potencial de solutos en hojas se cuantificó manteniendo la muestra
en condición de peso saturado, congelada en N2 líquido.
Posteriormente, se descongeló y se obtuvo una muestra de savia que fue
colocada en un disco de papel de filtro en la celda de un psicrómetro
(Wescor HR33T), para medir su concentración de solutos (18).
El potencial de solutos se calculó de acuerdo a:
ψs= -CRT
donde:
C es la concentración de solutos expresada como molaridad.
R es la constante de los gases 0,00831kg MPa mol-1 K-1.
T es la temperatura absoluta.
Ajuste osmótico saturado
Con la información obtenida se calculó el ajuste osmótico
(AO) como la diferencia del potencial osmótico saturado entre plantas
del tratamiento control y el salino (Δψs) (18).
Contenido de prolina
Para determinar el contenido de prolina se tomaron muestras de tejidos radicular
y foliar, a razón de 0,50 g respectivamente, replicadas cuatro veces,
congeladas en nitrógeno líquido y homogeneizadas con ácido
sulfosalicílico (3 %). El residuo se eliminó por centrifugación
a 13 000 revoluciones por minuto, durante 10 min. Luego, 500,0 µL del
extracto se hicieron reaccionar con 500,0 µL de ácido acético
glacial y 500,0 µL de ninhidrina a 100 °C por una hora. La reacción
fue detenida en baño con hielo. El complejo cromóforo-prolina
fue extraído con 1,0 mL de tolueno. La prolina se cuantificó en
un espectrofotómetro (Hewlett Packard 8452) a 520 nm, usando L-prolina
para la curva de calibración.
Rendimiento agrícola
El rendimiento agrícola se obtuvo en función de la masa de granos
en la superficie de cálculo de cada parcela de 12,25 m2, que
se promedió y se expresó en t ha-1. El tamaño
de muestra en este caso coincidió con el total de parcelas por cada variedad
(13).
Análisis estadísticos
En todas las evaluaciones fisiológicas y bioquímicas se determinaron
la media y su desviación estándar en las variables evaluadas en
ambas condiciones (suelos salino y no salino) y se establecieron las diferencias
mediante la prueba de t de Student (19) para niveles de significación
del 1 % en cada variedad. A partir de estos datos se calcularon los índices
de tolerancia al estrés por salinidad (ITS), siguiendo la fórmula
antes descrita, para evaluar la tolerancia al estrés durante el crecimiento
de las plantas (14, 20).
Para el cálculo del rendimiento agrícola se siguió un procedimiento
similar. Posteriormente, se realizaron análisis de varianza de clasificación
simple, basados en un modelo lineal de efectos fijos (21) y cuando existieron
diferencias entre las medias de los índices de tolerancia y los atributos
de estrés evaluados, estos se compararon por la prueba de comparación
múltiple de medias de Tukey para niveles de significación del
5 % y 1 % (22).
La intensidad del estrés se calculó según la fórmula:
IS= 1-(YS/YC)*100
donde:
YS y YC representan el rendimiento promedio en los suelos salino y no salino,
respectivamente (20).
Una vez determinados los índices de tolerancia a la salinidad para cada
variable, se procedió a la clasificación de las variedades en
tolerantes, cuando el índice de tolerancia al estrés (ITS) fue
mayor del 95 %; moderadamente tolerantes, cuando 95=ITS= 90 % y susceptibles,
cuando ITS< 90 % (23).
RESULTADOS Y DISCUSIÓN
Germinación
de las semillas y crecimiento en los primeros estadios
Germinación de las semillas
En todas las variedades el índice de germinación de las semillas
de trigo, creciendo bajo estrés salino ,(CE=7,25 dS m-1) fue
mayor al 93 %, excepto en la variedad Nácori C97. Esta respuesta muestra
la tolerancia de este proceso a la salinidad; sin embargo, se observaron diferencias
entre las variedades, excepto entre Aconchi C89 y Rafi C97 (Figura
2).
La
respuesta de la mayoría de las variedades con altos porcentajes de germinación,
demuestra la tolerancia del proceso de germinación a la salinidad, lo
que se debe a la configuración morfológica de la semilla (cubierta
seminal blanda y permeable, que permite la entrada de agua y oxígeno
y la salida de la radícula) (3). En tal sentido, se ha estudiado el proceso
físico de imbibición del epiblasto en algunas variedades y especies
de plantas, incluido el trigo, como condición necesaria para la germinación;
sin embargo, en ocasiones, aún ocurriendo la imbibición no hay
germinación, debido al efecto tóxico de los iones salinos (24).
La obtención de altos índices de germinación del trigo
a conductividades eléctricas superiores a 7,25 dS m-1 tiene
gran significado práctico para la regionalización de variedades
y su establecimiento en suelos con similares o menores valores de salinidad.
Variables del crecimiento
Transcurridos los 15 días posteriores a la germinación, se encontraron
diferencias significativas entre las variedades para los tres indicadores del
desarrollo evaluados, obteniéndose los mayores índices de tolerancia
en las variedades Júpare C2001 y Banámichi C2004 (Tabla
I).
Múltiples
investigaciones se han realizado sobre la evaluación del crecimiento
de las plántulas en condiciones de salinidad en diferentes cereales,
observando que el efecto osmótico es el que se manifiesta durante esta
fenofase como consecuencia del estrés salino (6, 23). Sin embargo, otras
investigaciones sostienen que en la fenofase de plántulas en trigo es
más evidente la toxicidad iónica, debido fundamentalmente al bajo
nivel de especialización del sistema radicular (7).
Todas las variedades presentaron altos índices de longitud de la raíz
(superior al 90 %), aunque también existieron diferencias entre sí.
Los valores elevados de longitud de la raíz han sido reportados como
un importante indicador para la evaluación de la tolerancia a la salinidad
en numerosas especies vegetales incluido el trigo (23).
El incremento de la longitud de las raíces favorece la tolerancia de
las plantas a la salinidad, porque permite una exploración más
eficiente del medio donde se desarrollan (23); sin embargo, existen estudios
que muestran que la capacidad de absorción de agua no depende de la longitud,
ni del volumen total de las raíces sino de su potencial hídrico,
lo que indica que en los primeros estadios del desarrollo radicular, a diferentes
profundidades, el potencial hídrico se mantiene constante (7).
Otro estudio esclarece sobre las variaciones del potencial hídrico radicular
a diferentes profundidades, siendo más alto a mayor profundidad (23),
aspecto que es necesario evaluar en las variedades que se estudian en cuanto
a tolerancia al estrés salino.
Los índices de acumulación de materia seca también presentaron
diferencias significativas entre algunas de las variedades, conformándose
dos grupos homogéneos de respuesta (Tabla I). La acumulación
de materia seca depende en buena medida de las relaciones hídricas de
la planta y la capacidad de regulación de esta variable, mediante la
acumulación activa de osmolitos e iones inorgánicos. Así,
las variedades presentaron índices de tolerancia superiores al 90 %.
Un elemento significativo fue el alto índice de acumulación de
materia seca de la variedad Nácori C97, siendo los valores más
bajos los de las variables GERM, AP y LR.
El mayor grado de tolerancia, desde la germinación hasta los 15 días,
lo presentaron las variedades Júpare C2001 y Banámichi C2004,
seguidas por Samayoa C2004, Aconchi C89 y Rafi C97, mientras que Nácori
C97 clasificó como susceptible.
Régimen hídrico
Contenido relativo de agua y transpiración
Los resultados de las variables del régimen hídrico demostraron
cierta similitud en la economía del agua en las variedades estudiadas,
como respuesta adaptativa al estrés salino. Los valores altos del CRA,
aún superiores a los de la transpiración se deben, fundamentalmente,
a la capacidad de las plantas de mantener volúmenes de agua elevados
en las hojas para evitar la desecación y el daño celular por la
radiación, lo cual ocurre, generalmente, en condiciones de estrés
hídrico (Tabla II). Sin embargo, los factores determinantes
del CRA y la transpiración son el potencial hídrico y la conductividad
hidráulica de las raíces (7, 24).
La mejor respuesta
de estas variables se encontró en las variedades Júpare C2001,
Benámichi C2004 y Nácori C97. En la actualidad, la mejora genética
para las variables hídricas es un tema de especial atención, dado
que el uso eficiente del agua (economía del agua) tiene alta relación
directa con el rendimiento agrícola, aunque existen plantas con una mayor
relación agua-rendimiento (23).
La ineficiente economía del agua en las plantas cultivadas en condiciones
salinas, ocurre debido a la aparición de un estado de sequía fisiológica
y es más pronunciado en especies y variedades de pobre o nulo ajuste
osmótico (24).
Potencial hídrico y osmótico saturado
Los potenciales hídrico (Figura 3a) y osmótico
saturado foliar (Figura 3b), presentaron diferencias significativas
entre las variedades en el suelo salino respecto al control.
En
todas las variedades el potencial hídrico foliar fue inferior a los -0,45
MPa y el potencial osmótico saturado fue inferior a -1MPa; este resultado,
al compararlo con algunos estudios de potenciales de suelo, demuestra que en
aquellos con conductividades eléctricas del extracto de saturación
superior a los 3,5 dS m-1, el rendimiento de los cultivos disminuye
considerablemente, debido a dificultades en los procesos que determinan el ajuste
osmótico (24). Se ha demostrado, además, que en suelos vertisoles
con CE= 4 dS m-1, catalogados como fuertemente salinos, el potencial
hídrico se combina con el coeficiente de dilatación fractal, disminuyendo
la capacidad de absorción del agua capilar y afectando significativamente
la respuesta osmótica de las plantas (25, 26).
Las variedades Júpare C2001, Benámichi C2004 y Nácori C97
presentaron diferencias más marcadas entre el control y el estrés,
por consiguiente, los potenciales hídricos más bajos; sin embargo,
la de menor potencial osmótico respecto al control fue Júpare
C2001, quizás por la acumulación potenciada de compuestos osmóticamente
activos.
Cuando el potencial hídrico de los tejidos disminuye por causa de un
estrés salino, una reducción en el potencial osmótico permite
minimizar los efectos negativos de la sal, cuando se logra un gradiente de potencial
de agua entre el suelo y las raíces, permitiendo la absorción
de agua (24, 27).
Ajuste osmótico
Todas las variedades realizaron el ajuste osmótico y se formaron, según
los resultados de la comparación múltiple de medias, solamente
dos grupos homogéneos de respuesta al estrés salino, pero todos
con valores mayores que 0,15 MPa de presión (Figura 4).
El trigo es una
especie que puede realizar el ajuste osmótico; sin embargo, tiene alta
variación genética para este carácter, aspecto que ha limitado
la estabilidad en la producción cuando las variedades se establecen en
suelos con diferentes CEes (1, 27). Existen trabajos que señalan
que el ajuste osmótico está relacionado positivamente al rendimiento
en condiciones de estrés salino e hídrico en este cereal, por
lo que mejora el rendimiento en grano bajo estrés. Además de extraer
más agua del suelo, los genotipos de trigo con alto ajuste osmótico
pueden producir alta biomasa de raíces, densidad y longitud y tener mayor
transpiración (1, 23).
Las variedades que toleran ciertos niveles de salinidad, al ser sometidas a
condiciones salinas después de la germinación, realizan un rápido
ajuste osmótico generalmente en función de compuestos orgánicos
(prolina, glicina-betaína y proteínas solubles totales) y así
reducen el potencial osmótico y, por consiguiente, el potencial hídrico
celular. Paralelamente modifican la conductividad hidráulica de las raíces
y sus membranas, para evitar la entrada de iones tóxicos; por eso, el
crecimiento inicial se retarda. Una vez lograda la homeostasis, se puede restablecer
el crecimiento (23). Los cambios macroscópicos que se observan en condiciones
de salinidad, como reducción del área foliar y la relación
parte aérea/raíz, entre otros, también reflejan la magnitud
del ajuste necesario para recuperar el balance hídrico.
Contenido de prolina
El contenido de prolina, evaluado a los 15 días después de la
germinación y al inicio de la floración presentó diferencias
significativas entre los tratamientos y entre las variedades, además
de un significativo incremento en más de la mitad de los valores del
indicador durante la floración, resultado importante, pues se ha demostrado
que como respuesta al estrés salino uno de los mejores indicadores bioquímicos
para la selección de variedades con tolerancia, es el contenido de prolina.
En las variedades Nácori C97 y Júpare C2001 se presentaron los
mayores incrementos de prolina en ambos órganos en el medio salino (Tabla
III).
En el tratamiento
control, los valores del contenido de prolina fueron similares, excepto en las
variedades Aconchi C89 (en raíces) y Júpare C2001. Tal resultado
constituye un rasgo de tolerancia en estas variedades. El hecho de haberse obtenido
un incremento del contenido de prolina en todas las variedades en el tratamiento
salino es una señal importante de tolerancia a la condición de
estrés, a la que fueron expuestas (25, 26), ya que se ha demostrado que
la prolina participa en múltiples eventos de tolerancia en las plantas
bajo estrés, actuando como mediador del ajuste osmótico; además,
se ha estudiado su función como estabilizador de proteínas y membranas
(3); como inductor de genes relacionados el ajuste osmótico (5); como
fuente de carbono y nitrógeno, fácilmente disponible en la rehidratación
celular; como fuente de equivalentes de reducción (del catabolismo de
prolina), para sostener la fosforilación oxidativa y la generación
de ATP, durante la recuperación del estrés. Además, ayuda
al control de la acidificación del citosol y puede mantener la relación
NADH/NAD+ a valores compatibles con el metabolismo, ayudando a las
células a superar la tensión oxidativa (captura de especies reactivas
de oxígeno) (26).
La obtención de plantas con mayor capacidad de acumulación de
compuestos orgánicos con función protectora (prolina, glicina
betaína y otros compuestos del amonio cuaternario), como en el presente
estudio, en el caso de la prolina, ha resultado en fenotipos con mayor tolerancia
a salinidad (24, 27). De ahí la importancia del monitoreo del germoplasma
disponible en condiciones de campo, a través de variables fisiológicas
y bioquímicas, para la identificación de variabilidad genética
y selección, asi como la recomendación de variedades tolerantes
(23).
Rendimiento agrícola
Las variedades estudiadas presentaron diferencias significativas en su rendimiento,
en el suelo salino, respecto al control y, por consiguiente, en sus índices
de estrés evaluados. En todas las variedades la disminución media
del rendimiento fue de 0,9 t ha-1, pero en Bernámichi C2004
y Aconchi C89 la disminución media fue superior a 1,1 t ha-1
y la menor intensidad del estrés salino se obtuvo en Nácori C97
(Tabla IV).
En otras especies
de cereales, como la cebada y el centeno, como en algunos cultivares de trigo,
que son evaluados como tolerantes a la salinidad, su rendimiento decrece con
lentitud, por lo que los valores de la intensidad del estrés no son significativos
(intensidad ligera, entre 8 y 14 %) (1). En otro extremo se encuentran especies
que presentan una elevada sensibilidad al estrés salino, en las cuales
su rendimiento decrece de forma muy rápida, mostrando valores elevados
de intensidad del estrés (15-20 %) (5).
Evaluación de la tolerancia media general
Al analizar la tolerancia media general de las variedades, se observó
que todas concentraron sus valores entre el 80 y 100 % de sus índices
de tolerancia, aspecto que demuestra la respuesta fisiológica, bioquímica
y agronómica de las plantas para lograr la adaptación y productividad
en condiciones de estrés (Figura 5).
La mayor respuesta
la obtuvo Júpare C2001; quizás este resultado es función
de las condiciones edafoclimáticas (suelos con salinidad media y régimen
de riego deficitario controlado), en las cuales fue aclimatada en su fase final
de mejora genética. Este es un aspecto importante para la mejora de plantas
y en los últimos años al monitoreo varietal se le ha prestado
especial atención, debido al carácter poligénico de la
tolerancia al estrés salino y su alto grado de relación con las
condiciones naturales donde estas variedades fueron obtenidas.
Se ha demostrado que inmediatamente después de la germinación
de las semillas, tienen lugar diversos mecanismos para asegurar la supervivencia,
adaptación y productividad, como la acumulación activa de iones,
la síntesis de compuestos osmóticamente activos y la síntesis
de hormonas señales de estrés como el ácido abscísico,
siendo el ajuste osmótico uno de los mecanismos más explicados
y, a su vez, más complejos (24). Los estudios de estabilidad del rendimiento,
después de realizar los programas de mejoramiento genético para
la tolerancia al estrés por salinidad y por sequía, tienen como
prueba de validación la capacidad de ajuste osmótico y su grado
de relación con el rendimiento agrícola (24).
En varios trabajos de evaluación de tolerancia a la salinidad en trigo,
se ha demostrado que el rendimiento agrícola disminuye de forma marcada
con el aumento de los niveles de salinidad a partir de los 6 dS m-1,
afectando su fisiología y productividad (5, 27), elemento que tiene considerable
variabilidad genética (28), por lo que es importante la evaluación
del germoplasma en condiciones de campo, donde se tenga la más amplia
interacción genotipo-ambiente, dado su carácter poligénico
(29, 30). Con la evaluación de la tolerancia a través de indicadores
fisiológicos, bioquímicos y agronómicos en condiciones
de campo, se ha logrado identificar variabilidad genética (31), proponer
posibles parentales en programas de mejora, recomendar y regionalizar genotipos
tolerantes para suelos salinos, en los cuales se adicionan los impactados del
cambio climático (32, 33), lo que propicia la entrada de otros factores
estresantes, como la sequía y el estrés térmico (34, 35).
CONCLUSIONES
AGRADECIMIENTOS
A la dirección del CIMM yT por su colaboración con el proyecto “Introducción y validación de variedades de trigo con tolerancia a la salinidad y la sequía en la provincia de Granma, Cuba”.
Nota al pie
AINIFAT. Instructivo Técnico del Trigo. La Habana, Cuba, 2003, p. 23.
BIBLIOGRAFÍA
1. Argentel, L.;
Fonseca, I.; González, L. M. y López, A. R. ‘‘Efectos de la salinidad
en las variables hídricas potenciales hídrico y osmótico
y ajuste osmótico en cultivares cubanos de trigo (Triticum aestivum
L. y T. durum L.)’’. Cultivos Tropicales, vol. 34, no. 4,
diciembre de 2013, pp. 43-48, ISSN 0258-5936.
2. Argentel, L.; López, C.; Gómez, E.; Fonseca, I.; González,
L. M. y López, R. D. ‘‘Evaluación de la tolerancia a la salinidad
en estadios tempranos y finales del desarrollo en triticales (Triticum secale)
’’. Cultivos Tropicales, vol. 31, no. 1, marzo de 2010, pp. 47-52,
ISSN 0258-5936.
3. Argentel, L.; González, L. M. y Fonseca, I. ‘‘Absorción de
agua, germinación y crecimiento del trigo (Triticum aestivum,
variedad Cuba-C-204) en condiciones de salinidad’’. Centro Agrícola,
vol. 37, no. 1, 2010, pp. 43-47, ISSN 0253-5785, 2072-2001.
4. Gutierrez, M.; Reynolds, M. P.; Raun, W. R.; Stone, M. L. y Klatt, A. R.
‘‘Spectral Water Indices for Assessing Yield in Elite Bread Wheat Genotypes
under Well-Irrigated, Water-Stressed, and High-Temperature Conditions’’. Crop
Science, vol. 50, no. 1, 2010, pp. 197-214,
ISSN 1435-0653, DOI 10.2135/cropsci2009.07.0381.
5. Hernández, A. Y. y Soto, P. N. ‘‘Salinidad en la soya (Glycine
max (L.) Merril) y avances en el estudio de los mecanismos de tolerancia’’.
Cultivos Tropicales, vol. 35, no. 2, junio de 2014, pp. 60-71, ISSN
0258-5936.
6. Kadri, K.; Abdellaoui, R.; Mhamed, H. C.; Silva, J. A. T. da y Naceur, M.
B. ‘‘Analysis of Salt-Induced mRNA Transcripts in Tunisian Local Barley (Hordeum
vulgare) Leaves Identified by Differential Display RT-PCR’’. Biochemical
Genetics, vol. 52, no. 1-2, 21 de noviembre de 2013, pp. 106-115, ISSN
0006-2928, 1573-4927, DOI 10.1007/s10528-013-9631-8.
7. Rosenzweig, C.; Elliott, J.; Deryng, D.; Ruane, A. C.; Müller, C.; Arneth,
A.; Boote, K. J.; Folberth, C.; Glotter, M.; Pugh, T. A. M.; Schmid, E.; Stehfest,
E.; Yang, H. y Jones, J. W. ‘‘Assessing agricultural risks of climate change
in the 21st century in a global gridded crop model intercomparison’’. Proceedings
of the National Academy of Sciences, vol. 111, no. 9, 3 de abril de 2014,
pp. 3268-3273, ISSN 0027-8424, 1091-6490, DOI 10.1073/pnas.1222463110.
8. Hernández, A.; Pérez, J.; Bosch, D. y Castro, N. Clasificación
de los suelos de Cuba 2015. edit. Ediciones INCA, Mayabeque, Cuba, 2015,
93 p., ISBN 978-959-7023-77-7.
9. IUSS Working Group WRB. World reference base for soil resources 2006.
A framework for international classification, correlation and communication.
(ser. World Soil Resources Reports, no. ser. 103), 2nd ed., edit. Food and Agriculture
Organization of the United Nations, Rome, Italy, 2006, 128 p., ISBN 92-5-105511-4.
10. Ibáñez, J. J. ‘‘Vertisoles en Latinoamérica y el Caribe’’.
Collection World soil resources reports, no. 3, 2011, p. 21, ISSN 0532-0488.
11. Richards, L. A. ‘‘Diagnosis and improvement of saline and alkali soils.’’.
Soil Science, vol. 78, no. 2, 1954, p. 154, ISSN 0038-075X, 1538-9243.
12. Menzies, N. W. y Bell, L. C. ‘‘Evaluation of the influence of sample preparation
and extraction technique on soil saturation composition’’. Australian Journal
of Soil Research, vol. 26, 1988, pp. 451-464, ISSN 0004-9573.
13. Argentel, M. L. Tolerancia del trigo a la salinidad. Caso de estudio
de Variedades cubanas. edit. Editorial Académica Española,
España, 2012, 96 p., ISBN 978-3-659-02109-1.
14. González, L. M. y Ramírez, R. ‘‘La absorción de agua
por las semillas de arroz a altas concentraciones salinas, como posible indicador
de la tolerancia varietal’’. Cultivos Tropicales, vol. 20, no. 1, 1999,
pp. 31-34, ISSN 0258-5936.
15. Yamasaki, S. y Dillenburg, L. R. ‘‘Measurements of leaf relative water content
in Araucaria angustifolia’’. Revista Brasilleira de Fisiologia
Vegetal, vol. 11, no. 2, 1999, pp. 69-75, ISSN 0103-3131.
16. Kramer, P. J. y Boyer, J. S. Water Relations of Plants and Soils.
edit. Academic Press, 1995, 514 p., ISBN 978-0-12-425060-4.
17. Scholander, P. F.; Bradstreet, E. D.; Hemmingsen, E. A. y Hammel, H. T.
‘‘Sap Pressure in Vascular Plants Negative hydrostatic pressure can be measured
in plants’’. Science, vol. 148, no. 3668, 16 de abril de 1965, pp.
339-346, ISSN 0036-8075, 1095-9203, DOI 10.1126/science.148.3668.339.
18. Babu, R. C.; Pathan, M. S.; Blum, A. y Nguyen, H. T. ‘‘Comparison of Measurement
Methods of Osmotic Adjustment in Rice Cultivars’’. Crop Science, vol.
39, no. 1, 1999, p. 150, ISSN 0011-183X, DOI 10.2135/cropsci1999.0011183X003900010024x.
19. Gosset, E. ‘‘Another difference calculus based on standard deviation and
confidence interval’’. Statistical References, vol. 26, 1917, pp. 66-72,
ISSN 1606-2353.
20. Fernández, G. C. J. ‘‘Effective selection criteria for assessing
plant tolerance’’. En: Adaptation of food crops to temperature and water
stress: Proceedings of an international symposium, edit. Asian Vegetable
Research and Development Center, Taipei, 1993, pp. 257-270, ISBN 978-92-9058-081-2.
21. Fisher, S. R. A.; Genetiker, S.; Fisher, R. A.; Genetician, S.; Fisher,
R. A. y Généticien, S. The design of experiments [en
línea]. (no. ser. 6), vol. 12, edit. Oliver and Boyd Edinburgh, Londres,
1960, [Consultado: 7 de diciembre de 2015], Disponible en: <https://www.etcases.com/media/clnews/1420782013117205015.pdf>.
22. Olkin, I. Contributions to Probability and Statistics: Essays in Honor
of Harold Hotelling [en línea]. edit. Stanford University Press,
1960, 532 p., ISBN 978-0-8047-0596-7, [Consultado: 5 de enero de 2016], Disponible
en: <https://books.google.com.cu/books/about/Contributions_to_Probability_and_Statist.html?id=ZUSsAAAAIAAJ&redir_esc=y>.
23. Nevo, E. y Chen, G. ‘‘Drought and salt tolerances in wild relatives for
wheat and barley improvement’’. Plant, cell & environment, vol.
33, no. 4, 2010, pp. 670–685, ISSN 1365-3040.
24. Schroeder, J. I.; Delhaize, E.; Frommer, W. B.; Guerinot, M. L.; Harrison,
M. J.; Herrera, E. L.; Horie, T.; Kochian, L. V.; Munns, R.; Nishizawa, N. K.;
Tsay, Y.-F. y Sanders, D. ‘‘Using membrane transporters to improve crops for
sustainable food production’’. Nature, vol. 497, no. 7447, 2 de mayo
de 2013, pp. 60-66, ISSN 0028-0836, DOI 10.1038/nature11909.
25. Munns, R.; James, R. A.; Xu, B.; Athman, A.; Conn, S. J.; Jordans, C.; Byrt,
C. S.; Hare, R. A.; Tyerman, S. D.; Tester, M.; Plett, D. y Gilliham, M. ‘‘Wheat
grain yield on saline soils is improved by an ancestral Na+ transporter gene’’.
Nature Biotechnology, vol. 30, no. 4, 1 de abril de 2012, pp. 360-364,
ISSN 1087-0156, DOI 10.1038/nbt.2120.
26. Ramadan, A. M. y Hassanein, S. E. ‘‘Characterization of P5CS gene in Calotropis
procera plant from the de novo assembled transcriptome contigs of the high-throughput
sequencing dataset’’. Comptes Rendus Biologies, vol. 337, no. 12, diciembre
de 2014, pp. 683-690, ISSN 1631-0691, DOI 10.1016/j.crvi.2014.09.002.
27. Khan, M. S. ‘‘Role of sodium and hydrogen (Na+/H+) antiporters in salt tolerance
of plants: present and future challenges’’. African Journal of Biotechnology,
vol. 10, no. 63, 2011, pp. 13693–13704, ISSN 13693–13704, 2278–179X.
28. Brunel, N.; Seguel, O. y Acevedo, E. ‘‘Conservation tillage and water availability
for wheat in the dryland of central Chile’’. Journal of Soil Science and
Plant Nutrition, vol. 13, no. 3, septiembre de 2013, pp. 622-637, ISSN
0718-9516, DOI 10.4067/S0718-951620 13005000050.
29. Lamz, P. A.; Reyes, G. Y. y González, C. M. C. ‘‘Indicadores bioquímicos
para la selección temprana de genotipos de arroz (Oryza sativa
L.) con tolerancia a la salinidad’’. Cultivos Tropicales, vol. 34,
no. 1, marzo de 2013, pp. 11-17, ISSN 0258-5936.
30. Fariduddin, Q.; Varshney, P.; Yusuf, M.; Ali, A. y Ahmad, A. ‘‘Dissecting
the role of glycine betaine in plants under abiotic stress’’. Plant Stress,
vol. 7, no. 1, 2013, pp. 8-18, ISSN 1749-0359.
31. Acuña, J. R. y Campos, E. M. R. ‘‘Relación de la conductividad
eléctrica de los suelos con la reflectancia de imágenes de satélite
en la región de Lambayeque–Perú’’. Revista de Investigación
de Física, vol. 14, no. 02, 2011, ISSN 1728-2977, [Consultado: 7
de diciembre de 2015], Disponible en: <http://revistasinvestigacion.unmsm.edu.pe/index.php/fisica/article/view/8700>.
32. Asseng, S.; Ewert, F.; Rosenzweig, C.; Jones, J. W.; Hatfield, J. L.; Ruane,
A. C.; Boote, K. J.; Thorburn, P. J.; Rötter, R. P. y Wolf, J. ‘‘Uncertainty
in simulating wheat yields under climate change’’. Nature Climate Change,
vol. 3, no. 9, septiembre de 2013, pp. 827-832, ISSN 1758-678X, DOI 10.1038/nclimate1916.
33. Challinor, A. J.; Watson, J.; Lobell, D. B.; Howden, S. M.; Smith, D. R.
y Chhetri, N. ‘‘A meta-analysis of crop yield under climate change and adaptation’’.
Nature Climate Change, vol. 4, no. 4, abril de 2014, pp. 287-291, ISSN
1758-678X, DOI 10.1038/nclimate2153.
34. Gourdji, S. M.; Sibley, A. M. y Lobell, D. B. ‘‘Global crop exposure to
critical high temperatures in the reproductive period: historical trends and
future projections’’. Environmental Research Letters, vol. 8, no. 2,
2013, pp. 24-41, ISSN 1520-0442.
35. Asseng, S.; Ewert, F.; Martre, P.; Rötter, R. P.; Lobell, D. B.; Cammarano,
D.; Kimball, B. A.; Ottman, M. J.; Wall, G. W. y Zhu, Y. ‘‘Rising temperatures
reduce global wheat production’’. Nature Climate Change, vol. 5, no.
2, febrero de 2015, pp. 143-147, ISSN 1758-678X, DOI 10.1038/nclimate2470.
Recibido: 14 de
enero de 2015
Aceptado: 30 de octubre de 2015
Leandris Argentel Martínez, Universidad de Granma, carretera a Manzanillo, km 17½, Peralejo. Bayamo, CP 85 100, Cuba. Email: largentel77@gmail.com