COMUNICACIÓN CORTA
Modificación en el método de tinción de las polifenoloxidasas y anhidrasas carbónica en las plantas
Modification of the staining method of polyphenoloxidases and carbonic anhydrases in plants
M.Sc. Regla M. Lara Rodríguez, Dra.C. Marilyn Florido Bacallaol, Dr.C. Mario Varela Nualles
Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, provincia Mayabeque, Cuba, CP 32700.
RESUMEN
Las isoenzimas han probado ser de gran valor en estudios de diversidad genética de diferentes especies. Por tal motivo se realizó el presente trabajo, con el objetivo de describir una modificación eficiente en la tinción histoquímica de las isoenzimas polifenoloxidasas y anhidrasas carbónica en plantas, la cual consiste en sustituir por agua destilada los tampones de tinción utilizados para revelar estas isoenzimas. La efectividad de estas adaptaciones propuestas se corroboró utilizando la prueba “t” de Student para datos relacionados y realizando estos análisis en diferentes cultivos. Los perfiles electroforéticos observados en las tinciones mostraron igual patrón de bandas y no existieron diferencias significativas entre los tratamientos, lo que demuestra que es posible sustituir los tampones de tinción tradicionalmente empleados en estas técnicas por agua destilada. La alta repetibilidad de estas tinciones permitirá en lo sucesivo emplear las modificaciones propuestas en el revelado de estas isoenzimas.
Palabras clave: marcadores bioquímicos, polimorfismo, tinción histoquímica.
ABSTRACT
Isozymes have proved to be valuable in genetic diversity studies of different species. Therefore, this study was aimed to describe an efficient histochemical staining modification of carbonic anhydrase and polyphenol oxidase isozymes in plants, which consists of replacing the staining buffers used to develop these isozymes by distilled water. The effectiveness of these proposed adjustments was confirmed when using the “t” test of Student for related data and conducting these tests in different crops. The electrophoretic profiles observed in stainings showed the same pattern of bands without significant differences among treatments, demonstrating that it is possible to replace traditionally used staining buffers in these techniques by distilled water. The high repeatability of such stainings will enable to employ the proposed modifications to develop these isozymes.
Key words: biochemical markers, polymorphism, histochemical staining.
INTRODUCCIÓN
Los marcadores
bioquímicos, especialmente las isoenzimas, constituyen herramientas de
gran ayuda en investigaciones genéticas en los últimos 30 años
y tienen un papel destacado en estudios de marcadores genéticos, para
complementar los análisis morfológicos en la identificación
correcta de varios niveles de taxones, accesiones e individuos, siendo la detección
de la homología genética en ocasiones más precisa que la
de algunos marcadores de ADN genómico (1).
Las isoenzimas han probado ser de gran valor en estudios de diversidad genética
de diferentes especies (2, 3, 4, 5, 6), de mapeo y dinámica poblacional,
así como para estimar la estabilidad genética en las técnicas
de cultivo in vitro (7, 8, 9). Además, se han utilizado en la
identificación de loci potencialmente marcadores, que pueden ser empleados
para la selección asistida (10, 11) y en estudios relacionados con la
resistencia a estreses bióticos y abióticos (12, 13, 14).
De hecho, se plantea que existe un amplio espectro de especies isoenzimáticas
en los diferentes tejidos vegetales (7). Dentro de ellas las isoenzimas polifenoloxidasas
(PPO) y las anhidrasas carbónica (AC) han jugado un papel importante
en investigaciones relacionadas con la mejora genética de plantas, debido
a su alta confiabilidad y gran número de bandas polimórficas presentes
en ellas (4, 9).
Es por ello que, teniendo en cuenta lo antes expuesto, se desarrolló
el presente trabajo, con el objetivo de describir una modificación eficiente
en la tinción histoquímica de las isoenzimas polifenoloxidasas
y anhidrasas carbónica en plantas.
MATERIALES Y MÉTODOS
Para el desarrollo
del presente trabajo se tomaron muestras de 1 g de tejido foliar fresco de diez
plántulas de tomate, que se homogeneizaron en frío, con un tampón
de extracción que contenía sacarosa 20 % (m/v) y 0,02 % de ditriotreitol,
empleando una relación masa/volumen de 1/2. El extracto se centrifugó
a
14 000 rpm a 0 °C durante cinco minutos.
El sobrenadante obtenido se sometió a electroforesis sobre gel de poliacrilamida
al 8,5 % en una cámara de electroforesis vertical Mighty Small II
de Pharmacia Biotech y se siguió el protocolo descrito por Laemli
(15). El tiempo de corrida en cada caso estuvo determinado por el desplazamiento
de la banda de Kolrhauch hasta aproximadamente 6 cm del inicio. Se utilizó
una intensidad de corriente constante de 15 mA hasta que la banda migró
al gel separador, donde se incrementó la intensidad de corriente a 25
mA.
Se realizaron las tinciones histoquímicas para las enzimas PPO y AC de
acuerdo a los métodos descritos por Wendel y Weeden (16) y GonzálezA
respectivamente; luego se incubaron en ácido acético al 5 % (v/v).
Los patrones de banda de cada accesión se visualizaron bajo luz blanca
atendiendo al número y la posición de cada banda. Se realizaron
tres repeticiones en cada sistema electroforético analizado.
Los patrones enzimáticos obtenidos en la tinción con los tampones
Tris-HCl 0,1 M, pH 7,2 y Tris–HCl 0,5 M, pH 7,19 para los sistemas PPO y AC,
respectivamente, se utilizaron como testigos en el análisis de los resultados
(T1). Se emplearon diferentes tratamientos que sustituyen estos tampones por
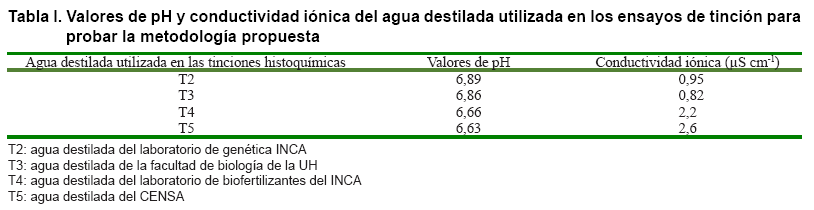
agua destilada con valores de pH entre 6,63 y 6,89, y conductividad iónica
por debajo de los 3 µScm-1, los que se exponen en la Tabla
I.
A partir de los
valores promedio de la posición relativa de las bandas (Rf) presentes
en los zimogramas de cada uno de los tratamientos, se realizó la prueba
“t” de Student para datos relacionados, utilizando el paquete estadístico
SPSS 11,5 sobre Windows.
Se realizaron además estos análisis electroforéticos en
hojas jóvenes de papa (Solanum tuberosum L.) y fresa (Fragaria
ananassa Duch) para corroborar la efectividad de las tinciones propuestas.
RESULTADOS Y DISCUSIÓN
Las múltiples formas de actividad PPO y AC encontradas confirman la presencia de estas isoenzimas en tejido foliar de plántulas de tomate. Estos sistemas isoenzimáticos no presentaron alteraciones en los patrones de bandas, cuando el tejido se reveló con los tampones tradicionales Tris-HCl 0,1 M, pH 7,2 y Tris-HCl 0,5 M, pH 7,19 para PPO y AC, respectivamente, ya que se pudo observar que las 10 plántulas de tomate evaluadas mostraron igual cantidad y posición relativa de bandas, independientemente del tampón o procedencia del agua empleada (Figura).
Estos resultados
se corresponden con lo planteado por otros autores, quienes señalan que
valores de pH entre 6 y 8 son los de mayor estabilidad de la enzima AC (17).
De igual forma, se han realizado investigaciones en PPO para determinar el pH
de mayor estabilidad en pera (Pyrus communis L. Reino) y manzana (Pyrus
malus L.), informándose que esta enzima fue más estable a
pH 6,5 y entre 6,5 y 7,5, respectivamente (18).
Al utilizar estos procedimientos de tinción para papa y fresa, se encontraron
variaciones interespecíficas, ya que se observaron diferencias en las
movilidades electroforéticas en los diferentes cultivos, siendo estas
mayores entre papa y fresa para AC y entre tomate y papa en PPO. Es de señalar
la presencia de tres y cuatro bandas comunes en los dos cultivos del género
Solanum. Sin embargo, igualmente se obtuvieron patrones de banda idénticos
en ambos sistemas isoenzimáticos utilizando agua destilada (T2, T3, T4
y T5) y los sistemas de tampones tradicionales (T1) (Figura,
Tabla II).
Los resultados
demostraron que es posible sustituir los tampones de tinción tradicionalmente
empleados en estas técnicas por agua destilada. La alta repetitividad
de estas tinciones permitirá en lo sucesivo emplear las modificaciones
propuestas en el revelado de estas isoenzimas, lo que contribuirá a disminuir
los costos de estas técnicas por concepto de reactivos.
Cabe destacar la utilidad de estos sistemas enzimáticos, ampliamente
distribuidos en el reino vegetal en estudios genéticos y fisiológicos
en plantas. Al respecto, se ha postulado la participación de PPO en mecanismos
de defensa frente a patógenos, transporte de electrones y oxidación
de auxinas. La enzima ofrece resistencia a infecciones por patógenos
(virus, bacterias, hongos, herbívoros) o por daño mecánico.
Asimismo, se ha indicado que las PPO están involucradas en la formación
y el desarrollo de raíces, en la formación de ligninas y en procesos
biosintéticos en plantas, como la biosíntesis de betalaínas
y de compuestos fenólicos de plantas, particularmente fenilpropanoides
(19, 20, 21).
Igualmente, se señala que la AC tipo ß, que es la que se encuentra
en plantas, ayuda a elevar la concentración de CO2 dentro
del cloroplasto, para incrementar la tasa de carboxilación de la enzima
Rubisco. Esta es la reacción que integra el CO2 en carbohidratos
durante la fotosíntesis, siendo muy utilizada en estudios de resistencia
y tolerancia a estreses bióticos y abióticos (22, 23, 24).
Nota al pie
AGonzález, C. Comportamiento genético bioquímico de la Lima persa SRA-58 (Citrus) sobre diferentes patrones en Cuba. [Tesis de Doctorado], Cuba, 1989.
BIBLIOGRAFÍA
1. Sofy, A. R.;
Mahfouze, S. A. y El-Enany, M. A. M. ‘‘Isozyme Markers for Response of Wild
Potato Species to Potato Spindle Tuber Viroid Egyptian Isolate’’. World
Applied Sciences Journal, vol. 27, no. 8, 2013, pp. 1010–1022, ISSN 1818-4952.
2. Iglesias, A. L. G. y Luna, R. M. ‘‘Polimorfismo isoenzimático en la
población de Pinus hartwegii Lindl. del Cofre de Perote, Ver., México’’.
Revista Ecosistemas, vol. 17, no. 1, 2 de noviembre de 2007, pp. 115-122,
ISSN 1697-2473, DOI 10.7818/re.2014.17-1.00.
3. Arzate, F. A. M.; Hoyos, B. A.; Vázquez, G. L. M. y Gutiérrez,
M. M. ‘‘Caracterización isoenzimática de nueve variedades botánicas
de Tigridia pavonia (L. f.) DC’’. Agrociencia, vol. 42, no.
5, 2008, pp. 519-528, ISSN 1405-3195.
4. Castilla, V. Y.; González, V. M. E. y Lara, R. R. M. ‘‘Determination
of genetic stability in plants of Spanish carnation (Dianthus caryophyllus
L.), micropropagated with Biobras-16’’. Cultivos Tropicales, vol. 35,
no. 1, 2014, pp. 67-74, ISSN 0258-5936, CABDirect2.
5. Kessel, D. A.; Lara, R. R. M.; Hernández, E. M. M.; Coto, R. O.; Díaz,
H. Y.; Caballero, N. A. y Pavón, R. M. I. ‘‘Evaluación morfoagronómica
e isoenzimática de cultivares de Fragaria ananassa Duch., cultivados
en Cuba’’. Cultivos Tropicales, vol. 35, no. 2, junio de 2014, pp.
72-79, ISSN 0258-5936.
6. Ruiz, E.; Caballero, M. W.; Román, M. I.; Rodríguez, S. J.;
Fernández, M. y Jiménez, E. ‘‘Caracterización morfológica
e isoenzimática de nuevos híbridos de papaya’’. Centro Agrícola,
vol. 39, no. 2, 2012, pp. 27-33, ISSN 0253-5785.
7. Cornide, H. M. T. Marcadores moleculares: nuevos horizontes en la genética
y la selección de las plantas [en línea]. edit. Félix
Varela, La Habana, Cuba, 2002, 366 p., ISBN 978-959-258-351-1, [Consultado:
10 de diciembre de 2015], Disponible en: <http://www.sidalc.net/cgi-bin/wxis.exe/?IsisScript=CICY.xis&method=post&formato=2&cantidad=1&expresion
=mfn=004577>.
8. Kotis, M.; Yupsanis, T. A.; Syros, T. D. y Economou, A. S. ‘‘Peroxidase,
acid phosphatase, RNase and DNase activity and isoform patterns during in
vitro rooting of Petunia × hybrida microshoots’’.
Biologia Plantarum, vol. 53, no. 3, 13 de noviembre de 2009, pp. 530-538,
ISSN 0006-3134, 1573-8264, DOI 10.1007/s10535-009-0096-x.
9. Izquierdo, H.; González, M. C. y Núñez, M. de la C.
‘‘Genetic stability of micropropagated banana plants (Musa spp.) with
non-traditional growth regulators’’. Biotecnología Aplicada,
vol. 31, no. 1, marzo de 2014, pp. 23-27, ISSN 1027-2852.
10. Alvarez, G. M. ‘‘La selección asistida por marcadores (MAS, «Marker-assisted
selection») en el mejoramiento genético del tomate (Solanum
lycopersicum L.)’’. Cultivos Tropicales, vol. 32, no. 2, junio
de 2011, pp. 154-171, ISSN 0258-5936.
11. Ibitoye, D. O. y Akin-Idowu, P. E. ‘‘Marker-assisted selection (MAS): A
fast track to increase genetic gain in horticultural crop breeding’’. African
Journal of Biotechnology, vol. 10, no. 55, 2013, pp. 11333-11339, ISSN
1684-5315, DOI 10.4314/ajb.v10i55.
12. Kumar, R. R.; Sharma, S. K.; Gadpayle, K. A.; Singh, K.; Sivaranjani, R.;
Goswami, S. y Rai, R. D. ‘‘Mechanism of action of hydrogen peroxide in wheat
thermotolerance-interaction between antioxidant isoenzymes, proline and cell
membrane’’. African Journal of Biotechnology, vol. 11, no. 78, 2012,
pp. 14368-14379, ISSN 1684-5315, DOI 10.5897/AJB 12 . 2084.
13. Mohamed, H. I. y Abdel-Hamid, A. M. E. ‘‘Molecular and biochemical studies
for heat tolerance on four cotton genotypes’’. Romanian Biotechnological
Letters, vol. 18, no. 6, 2013, pp. 8823-8831, ISSN 1224-5984.
14. Manaa, A.; Mimouni, H.; Terras, A.; Chebil, F.; Wasti, S.; Gharbi, E. y
Ahmed, H. B. ‘‘Superoxide dismutase isozyme activity and antioxidant responses
of hydroponically cultured Lepidium sativum L. to NaCl stress’’. Journal
of Plant Interactions, vol. 9, no. 1, 2 de enero de 2014, pp. 440-449,
ISSN 1742-9145, DOI 10.1080/17429145.2013.850596.
15. Laemmli, U. K. ‘‘Cleavage of structural proteins during the assembly of
the head of bacteriophage T4’’. Nature, vol. 227, 1970, pp. 680-685,
ISSN 0028-0836, 1476-4687.
16. Wendel, J. F. y Weeden, N. F. ‘‘Visualization and interpretation of plant
isozymes’’. En: Soltis D. E., Isozymes in Plant Biology, edit. Springer
Science & Business Media, 6 de diciembre de 2012, pp. 5-34, ISBN 978-94-009-1840-5.
17. Espinosa, M. L. y Sierra, V. M. P. ‘‘Anhidrasa carbónica, nuevas
perspectivas’’. Neumología y Cirugía de Tórax,
vol. 69, no. 4, 2010, pp. 200-209, ISSN 1870-7211.
18. Gasull, E. y Becerra, D. ‘‘Caracterización de Polifenoloxidasa Extraída
de Pera (cv. Packam´s Triumph) y Manzana (cv. Red Delicious)’’. Información
tecnológica, vol. 17, no. 6, 2006, pp. 69-74, ISSN 0718-0764, DOI
10.4067/S0718-07642006000600012.
19. Nokthai, P.; Lee, V. S. y Shank, L. ‘‘Molecular Modeling of Peroxidase and
Polyphenol Oxidase: Substrate Specificity and Active Site Comparison’’. International
Journal of Molecular Sciences, vol. 11, no. 9, 14 de septiembre de 2010,
pp. 3266-3276, ISSN 1422-0067, DOI 10.3390/ijms11093266.
20. Tran, L. T.; Taylor, J. S. y Constabel, C. P. ‘‘The polyphenol oxidase gene
family in land plants: Lineage-specific duplication and expansion’’. BMC
Genomics, vol. 13, no. 1, 16 de agosto de 2012, p. 395, ISSN 1471-2164,
DOI 10.1186/1471-2164-13-395.
21.Othman, O. C. ‘‘Polyphenoloxidase and Peroxidase Activity during Open Air
Ripening Storage of Pineapple (Ananas comosus L.), Mango (Mangifera
indica) and Papaya (Carica papaya) Fruits Grown in Dares Salaam,
Tanzania’’. Tanzania Journal of Science, vol. 38, no. 3, 2014, pp.
84-94, ISSN 0856-1761, DOI 10.4314/tjs.v38i3.
22. Aubry, S.; Brown, N. J. y Hibberd, J. M. ‘‘The role of proteins in C3
plants prior to their recruitment into the C4 pathway’’. Journal
of Experimental Botany, vol. 62, no. 9, 5 de enero de 2011, pp. 3049-3059,
ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/err012.
23. Boone, C. D.; Habibzadegan, A.; Gill, S. y McKenna, R. ‘‘Carbonic Anhydrases
and Their Biotechnological Applications’’. Biomolecules, vol. 3, no.
3, 19 de agosto de 2013, pp. 553-562, ISSN 2218-273X, DOI 10.3390/biom3030553.
24. Hong Sun Wei; You Wu Yan; Zhen Sun Zhen; Xia Wu Qiu y Yu Wen Xin. ‘‘Enzymatic
Characteristics of Higher Plant Carbonic Anhydrase and Its Role in Photosynthesis’’.
Journal of Plant Studies, vol. 3, no. 2, 14 de mayo de 2014, p. 39,
ISSN 1927-047X, DOI 10.5539/jps.v3n2p39.
Recibido: 5 de
diciembre de 2014
Aceptado: 24 de junio de 2015
M.Sc. Regla M. Lara Rodríguez, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, provincia Mayabeque, Cuba, CP 32700. Email: mlara@inca.edu.cu