Micorrización de portainjertos de manzano micropropagados
Mycorrhization of micropropagated apple rootstocks
Dra.C. Alicia Castillo Sallé,I Dra.C. Adriana Montañez Massa,II Dr.C. Roberto Docampo Romero,III Pablo Rodríguez Bruno,IV M.Cs. Danilo Cabrera Bologna,IV Dr.C. Roberto Zoppolo GoldschmidtIV
IUnidad
de Biotecnología INIA “Las Brujas” Ruta 48, km 10, Canelones Uruguay.
IILaboratorio de Microbiología de Suelos, Instituto de Ecología
y Ciencias Ambientales (IECA) Facultad de Ciencias. Mataojo 2055.
IIISuelos y Riego, INIA “Las Brujas” Ruta 48, km 10 Canelones Uruguay.
IVPrograma de Investigación en Producción Frutícola,
INIA “Las Brujas” Ruta 48, km 10, Canelones. Uruguay.
RESUMEN
La micropropagación mediante cultivo in vitro de plantas permite la producción a gran escala de individuos genéticamente idénticos al material de partida. Las especies leñosas tienen dificultades en la etapa de aclimatación por la lentitud que presentan en el desarrollo de respuestas fisiológicas y morfológicas a los cambios de ambiente. El éxito final de la propagación in vitro depende de la capacidad de transferencia de las plantas desde el laboratorio a las condiciones de invernáculo. Una de las herramientas para contrarrestar las pérdidas durante la aclimatación, es la utilización de hongos micorrízicos arbusculares (HMA), que establecen asociaciones simbióticas mutualistas no específicas con el 90 % de las plantas vasculares. Los HMA, por su acción como agentes de biorregulación del crecimiento, biofertilizantes o biocontrol, han tenido especial atención en el manejo y propagación de las plantas frutícolas. En este trabajo se presentan los efectos de la inoculación con HMA en el inicio de la aclimatación. Para la micorrización se empleó un solo tipo de inóculo de HMA sobre dos portainjertos de manzano: un clon de M9 y otro de la serie Cornell-Geneva (RN29 y Geneva®41, respectivamente) en tres sustratos diferentes. Los plantines inoculados con micorrizas presentaron mayor expansión de sus hojas, mayor diámetro y mayor altura, respecto al control, mostrando diferencias significativas. La aclimatación se redujo de 60 a 40 días. La incorporación de este tipo de tecnología, podría generar beneficios orientados a un manejo sustentable de la producción de plantas con menor uso de agroquímicos.
Palabras clave: adaptación, propagación vegetativa, simbiosis.
ABSTRACT
Micropropagation through in vitro plant cultivation allows large-scale production of identical individuals genetically to the starting material. Woody species have difficulties in the acclimatization stage due to their slowness in the development of physiological response to environmental changes. The ultimate success of in vitro propagation depends on the capacity of plants to adapt in the moment of transfering from the laboratory to the greenhouse conditions. One of the tools to offset losses during acclimatization is the use of arbuscular mycorrhizal fungi (AMF), which sets mutualistic symbiotic associations unspecific with 90 % of vascular plants. AMF, because of their action as agents of growth bioregulation as bio-fertilizers or biocontrollers have received special attention in handling and propagation of fruit plants. In this work the effects of inoculation with AMF at the start of acclimatization are presented to mycorrhization. Inoculation with one type of AMF over two rootstocks of apple was done in a clone of M9 and one rootstock of the Cornell-Geneva series (RN29 and Geneva®41 respectively) set in three different substrates. Seedlings inoculated with AMF when compared to the control, presented further expansion of their leaves, bigger diameter and greater height, all significantly different. Acclimatization period was reduced from 60 to 40 days. The incorporation of this type of technologies could generate a more sustainable management of plant production with less use of agrochemicals.
Key words: adaptation, vegetative propagation, simbiosis.
INTRODUCCIÓN
Uruguay
produce fruta de alta calidad que se destina al mercado interno y a la exportación
en volumen variable todos los años, representando alrededor del 5 % del
valor bruto de producción anual (VBPA)A.
Para competir en mercados de exportación con alto nivel de exigencia,
es necesario alcanzar una alta eficiencia en todas las fases del proceso de
producción. Por esta razón, es fundamental instalar montes con
plantas de excelente calidad desde el vivero, ya que la planta es el primer
eslabón en la cadena de producción de frutas (1).
La fruticultura moderna se basa en plantaciones que utilizan portainjertos clonales
enanizantes, que permiten realizar cultivos en alta densidad. A partir del uso
de este tipo de portainjertos, se busca un aumento en la eficiencia de la producción,
incrementando los volúmenes y uniformizando la calidad de la fruta, así
como ofreciendo resistencia a ciertas plagas y enfermedades del suelo (2). Estos
portainjertos se propagan vegetativamente en el campo, mediante el empleo de
encepadas (acodo en cepada) y para ello es necesario contar con bloques de plantas
madres que suministren volúmenes importantes de plantines enraizados.
Las plantas madres de la encepada deben ser controladas anualmente, para conocer
y asegurar que se mantiene el estado sanitario libre de patógenos y enfermedades.
La micropropagación es otra forma de obtener plantas clonales de alta
calidad (3). Con la aplicación de esta técnica es posible la obtención
de un gran número de plantas en pocos meses, conservando la sanidad y
la identidad genética del material (4).
La micropropagación consiste en producir plantas a partir de porciones
de la planta madre, en general se utilizan ápices meristemáticos
vegetativos, cultivados asépticamente en un tubo de ensayo, donde se
puedan controlar estrictamente las condiciones del ambiente y la nutrición
a través del medio de cultivo (5). Esta técnica, que se ha convertido
en una alternativa importante dentro de los métodos de propagación
en una amplia gama de especies (6), se compone de una serie de etapas secuenciales:
establecimiento, proliferación o multiplicación, enraizamiento
y aclimatación (7). Sin embargo, se presentan algunas dificultades ya
que una planta que se ha originado in vitro difiere en muchos aspectos
de las que se forman in vivo (8), debido a que las condiciones, tanto
ambientales como del sustrato en que crecen, son muy diferentes. Asimismo, es
importante señalar que el crecimiento de las plantas in vitro
es heterótrofo en tanto in vivo es autótrofo.
La aclimatación resulta ser el cuello de botella de todo el proceso de
micropropagación, debido a la baja sobrevivencia de plantines que se
da en el pasaje del crecimiento in vitro al crecimiento in vivo. El
éxito final de la propagación in vitro depende de la
capacidad de transferencia de las plantas, desde el ambiente del laboratorio
a las condiciones de invernáculo.
El ambiente in vitro, con una alta humedad relativa, bajo o nulo intercambio
gaseoso, escasez de CO2 durante casi todo el período, producción
de etileno y baja densidad fotosintética, induce cambios morfológicos
y fisiológicos en las plantas desarrolladas bajo esa condición.
La anatomía de la hoja in vitro es influenciada por la luz y
la humedad, diferenciándose anatómicamente de las originadas in
vivo (8, 9). Después de transferir las plantas al ambiente ex vitro,
estas tienen que corregir todas esas anormalidades para aclimatarse al nuevo
ambiente del invernáculo.
Para aumentar la eficiencia de la aclimatación, se evaluó la aplicación
de hongos micorrízicos arbusculares (HMA), como forma de conferir mayor
resistencia a los factores de estrés ambiental y en su establecimiento
en el campo (10). Varios autores han utilizado la inoculación con micorrizas
o bacterias promotoras del crecimiento vegetal, como una herramienta para contrarrestar
las pérdidas durante la aclimatación (11, 12). El objetivo del
presente trabajo fue evaluar el efecto de la inoculación con HMA en plantas
micropropagadas de portainjerto de manzano en la fase de aclimatación.
MATERIALES Y MÉTODOS
Como material
vegetal se seleccionaron dos portainjertos de manzano: un clon del M9, denominado
RN29, de origen belga y un portainjerto de la serie Cornell-Geneva, el Geneva®
41, proveniente de la Universidad de Cornell. Ambos portainjertos se multiplicaron
y enraizaron in vitro. Las plantas enraizadas se sacaron de los frascos
y se lavaron cuidadosamente para remover los restos del medio de cultivo. Al
momento del trasplante, los plantines se inocularon con micorriza HMA Glomus
mossae monoespórico, obtenido por multiplicación en cultivos
trampa de Paspalum dilatatum.
Se colocó 1 g de inóculo en el sustrato, debajo de la planta,
al momento del trasplante. Todos los sustratos utilizados fueron autoclavados
antes de su uso, 1) compost de cama de caballo; 2) mezcla de ¼ de turba
comercial, ¼ de arena, ¼ cáscara de arroz y ¼ de
mantillo de pino; 3) turba comercial. El contenido de P del sustrato fue 1,9
, 15,6 y 49,6 mg L-1, respectivamente (análisis de extracto
de pasta saturada por colorimetría) (13). En los tres casos se evaluó
cada sustrato en dos condiciones: con micorriza y sin inoculación, como
tratamiento control (seis tratamientos). Se evaluaron 150 plantas por tratamiento,
en cada recipiente de aclimatación se utilizaron 20 plantas, repitiéndose
el ensayo dos veces. Se tomaron muestras de raíces para determinar la
presencia de las micorrizas a los 20 días del trasplante. Las raíces
fueron teñidas con azul de tripano a razón de 0,5 g L-1
en solución 1:1 de ácido láctico:glycerol con modificaciones
(14).
A nivel vegetativo se midieron los parámetros de crecimiento: altura
de la planta, número de hojas y diámetro del cuello en distintas
etapas de la aclimatación. Para evitar la deshidratación se cubrieron
las plantas durante los primeros 15 días, luego se fue aumentando paulatinamente
la ventilación hasta dejarlas sin cobertura. En esta etapa no se aplicaron
fungicidas ni fertilizantes.
RESULTADOS Y DISCUSIÓN
En los tratamientos inoculados con HMA se observaron las primeras estructuras en el establecimiento de la simbiosis en las muestras tomadas a los 20 días del trasplante; como muestra la Figura 1, dentro de las células del tejido radicular se observaron apresorios.
La Figura 2 muestra los resultados de la evaluación de los parámetros de crecimiento vegetativo en los seis tratamientos, mostrando en ambos portainjertos el mismo comportamiento. Las plantas inoculadas mostraron diferencia significativa en altura, alcanzando la mayor altura en el sustrato de compost de cama de caballo (T1inoc) y en el sustrato mezcla de turba, arena, cáscara de arroz y mantillo (T2inoc). Entre estos dos tratamientos inoculados con HMA no hubo diferencia significativa. En las plantas trasplantadas en turba comercial se obtuvo la menor altura de las plantas y no hubo diferencia significativa entre las inoculadas y las sin inocular (tratamiento T3inoc y T3).

En el número de hojas se observó diferencia significativa entre
los tratamientos 1A (inoculado), con un valor promedio de nueve y el tratamiento
2B (sustrato mezcla sin inocular), con siete hojas en promedio. El resto de
los tratamientos mostraron un valor intermedio. Si bien el área foliar
no se midió, a simple vista era posible observar una mayor expansión
de las hojas en los tratamientos con plantas inoculadas.
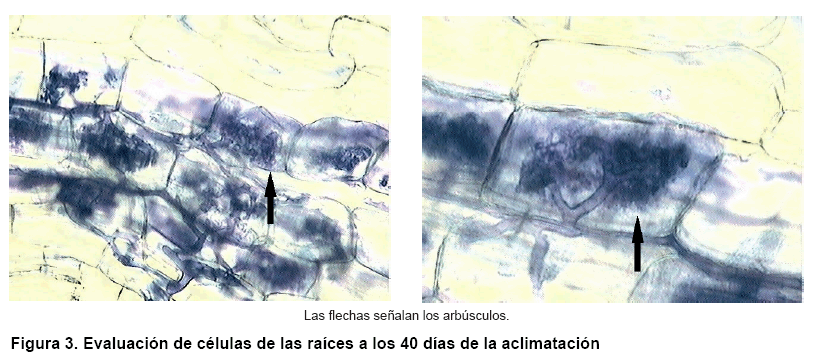
A los 40 días de la aclimatación se realizó una segunda
evaluación al microscopio de las células de la raíz. Se
observó el desarrollo de estructuras denominadas arbúsculos, que
corresponden al micelio de la micorriza en todos los tratamientos con inoculación
(Figura 3).
Las HMA se encuentran asociadas a la mayoría de las especies vegetales
en condiciones naturales (15), colonizan las raíces y desarrollan una
red o cordones de hifas externas que se extienden a partir de las mismas, de
esa forma aumentan la superficie de contacto entre la planta y el suelo. Este
micelio externo actúa como un sistema radical complementario, de extraordinaria
importancia para la absorción de nutrientes y agua por las plantas (16).
Estos microorganismos benéficos han sido ampliamente estudiados y empleados;
sin embargo, su aplicación en plantas micropropagadas es escasa. Los
resultados muestran la colonización por parte de la micorriza en etapas
tempranas de la inoculación del sistema radicular a los 20 días
de la aclimatación y las consecuencias de la simbiosis fueron evidentes
en los parámetros de crecimiento evaluados.
En diversos grados, todas las plantas cultivadas in vitro son susceptibles
a la crisis o estrés del trasplante, fase que resulta el cuello de botella
de todo el proceso de la micropropagación. El éxito final de la
propagación in vitro depende de la capacidad de transferencia
de las plantas fuera del ambiente del laboratorio a las condiciones de invernáculo,
lo cual varía entre las distintas especies; las herbáceas tienen
rápida respuesta, en tanto las especies leñosas requieren mayor
tiempo para su aclimatación. El conocimiento de las características
fisiológicas y morfológicas de las plantas que crecen in vitro
es fundamental para minimizar las pérdidas y asegurar una alta sobrevivencia
en el trasplante. Al llevar a cabo la inoculación se facilitó
el inicio de los cambios fisiológicos que requieren, con el fin de favorecer
la adaptación de las plántulas a la autotrofia y posterior crecimiento
ex vitro (17).
Tanto la nutrición heterotrófica que se da in vitro,
como el escaso mecanismo para controlar la pérdida de agua por poca funcionalidad
estomática, hacen que la planta micropropagada esté desbalanceada
en su capacidad de absorción y reposición del agua transpirada
(18). Debido a la falta de cera en la cutícula respecto de las plantas
que crecen en invernáculo o a campo, la tasa de transpiración
de estas es significativamente más alta cuando están creciendo
in vitro.
En los primeros 25 días del proceso de aclimatación no se observan
cambios a nivel morfológico, pues ocurre una transición lenta
de procesos fisiológicos ante los cambios en las condiciones ambientales.
Sin embargo, en las plantas inoculadas se observó crecimiento y desarrollo
de nuevas hojas en etapas tempranas. En esta asociación simbiótica
el hongo se nutre de los carbohidratos almacenados en las células vegetales
en formas sencillas de fructosa, glucosa y sacarosa, así como de los
exudados radicales de las plantas. Es por esta razón, que la inoculación
de plantas micropropagadas en etapas tempranas confiere mayor resistencia a
los factores de estrés ambiental en la fase de aclimatación (19).
El fósforo es el principal nutriente, con el que se tienen efectos positivos
por la asociación de las plantas con HMA ya que es relativamente inmóvil
en el suelo, pero también hay beneficios en la dinámica de otros
nutrientes como el N, Zn, Mg y Ca (20). En la elección de los sustratos
a evaluar se consideró la sensibilidad de las micorrizas a los niveles
de fósforo, se seleccionaron dos sustratos con bajo contenido en P (<1
ppm). No se utilizó régimen de fertilización en las plántulas
inoculadas por la relación inversa entre la disponibilidad de P y la
colonización de hongos micorrízicos (21, 22). A ello se atribuye
que el sustrato 3, con alto contenido de P, no mostró diferencia significativa
entre las plantas inoculadas y sin inocular. La actividad de la micorriza se
inhibió por la presencia de P.
En los sustratos con bajo contenido en P en los que la inoculación con
HMA se tradujo en mayor crecimiento, permitió acortar la etapa de aclimatación
de 40 a 60 días.
CONCLUSIONES
Mediante la evaluación
de parámetros de desarrollo de las plantas durante la aclimatación
se demostró la acción de los hongos micorrízicos arbusculares
como agentes de biorregulación del crecimiento, biofertilizantes y biocontrol.
Los resultados indican que su aplicación en la fase de aclimatación
y vivero puede representar beneficios para los productores, reducción
de costos de producción, manejo de productos orgánicos y la obtención
de plantas con superior vigor y calidad en menor tiempo.
La incorporación de microorganismos benéficos en la agricultura
intensiva es importante para lograr sistemas de producción sostenibles
y ecosistemas con mayor capacidad de recuperación a condiciones adversas.
Notas al pie
ADurán, F. V. I. ‘‘Situación y perspectivas de las cadenas agroindustriales 2014-2015’’ [en línea]. En: Anuario OPYPA 2014, edit. MGAP, Montevideo, 2014, pp. 15-38, [Consultado: 30 de junio de 2015], Disponible en: <http://www.mgap.gub.uy/OpypaPublicaciones/ANUARIOS/Anuario2014/pdf/Anuario_2014_web.pdf>.
BIBLIOGRAFÍA
1. Robinson, T.
‘‘Advances in apple culture worldwide’’. Revista Brasileira de Fruticultura,
vol. 33, no. SPE1, octubre de 2011, pp. 37-47, ISSN 0100-2945, DOI 10.1590/S0100-29452011000500006.
2. Waman, A. A.; Bohra, P.; Sathyanarayana, B. N.; Umesha, K.; Mukunda, G. K.;
Ashok, T. H. y Gowda, B. ‘‘Optimization of Factors Affecting In vitro
Establishment, Ex vitro Rooting and Hardening for Commercial Scale
Multiplication of Silk Banana (Musa AAB)’’. Erwerbs-Obstbau,
vol. 57, no. 3, 14 de junio de 2015, pp. 153-164, ISSN 0014-0309, 1439-0302,
DOI 10.1007/s10341-015-0244-8.
3. Ahmed, M. R. y Anis, M. ‘‘Changes in activity of antioxidant enzymes and
photosynthetic machinery during acclimatization of micropropagated Cassia
alata L. plantlets’’. In Vitro Cellular & Developmental Biology-Plant,
vol. 50, no. 5, 6 de junio de 2014, pp. 601-609, ISSN 1054-5476, 1475-2689,
DOI 10.1007/s11627-014-9609-1.
4. Lal, M.; Tiwari, A. K.; Gupta, G. N. y Kavita. ‘‘Commercial Scale Micropropagation
of Sugarcane: Constraints and Remedies’’. Sugar Tech, vol. 17, no.
4, 11 de octubre de 2014, pp. 339-347, ISSN 0972-1525, 0974-0740, DOI 10.1007/s12355-014-0345-y.
5. García, G. R.; Quiroz, K.; Carrasco, B. y Caligari, P. ‘‘Plant tissue
culture: Current status, opportunities and challenges’’. Ciencia e Investigación
Agraria, vol. 37, no. 3, 2010, pp. 5–30, ISSN 0718-1620.
6. Sawant, R. A. y Tawar, P. N. ‘‘Use of Sodium Hypochlorite as Media Sterilant
in Sugarcane Micropropagation at Commercial Scale’’. Sugar Tech, vol.
13, no. 1, 17 de mayo de 2011, pp. 27-35, ISSN 0972-1525, 0974-0740, DOI 10.1007/s12355-011-0072-6.
7. Villalobos, V. M. y Thorpe, T. A. ‘‘Micropropagación: conceptos, metodología
y resultados’’. En: Roca W. M. y Mroginski L. A., Cultivo de tejidos en la agricultura:
fundamentos y aplicaciones, edit. CIAT, 1991, pp. 127-141, ISBN 978-958-9183-15-1.
8. Pati, R.; Mishra, M.; Chandra, R. y Muthukumar, M. ‘‘Histological and Biochemical
Changes in Aegle marmelos Corr. before and after Acclimatization’’. Tree
Genetics and Molecular Breeding, vol. 3, no. 1, 2013, pp. 12-18, ISSN 1927-5781.
9. Deccetti, S. F. C.; Soares, A. M.; Paiva, R. y de Castro, E. M. ‘‘Effect
of the culture environment on stomatal features, epidermal cells and water loss
of micropropagated Annona glabra L. plants’’. Scientia Horticulturae,
vol. 117, no. 4, 18 de agosto de 2008, pp. 341-344, ISSN 0304-4238, DOI 10.1016/j.scienta.2008.05.020.
10. Nadeem, S. M.; Ahmad, M.; Zahir, Z. A.; Javaid, A. y Ashraf, M. ‘‘The role
of mycorrhizae and plant growth promoting rhizobacteria (PGPR) in improving
crop productivity under stressful environments’’. Biotechnology Advances,
vol. 32, no. 2, marzo de 2014, pp. 429-448, ISSN 0734-9750, DOI 10.1016/j.biotechadv.2013.12.005.
11. Tauler, M. y Baraza, E. ‘‘Improving the acclimatization and establishment
of Arundo donax L. plantlets, a promising energy crop, using a mycorrhiza-based
biofertilizer’’. Industrial Crops and Products, vol. 66, abril de 2015,
pp. 299-304, ISSN 0926-6690, DOI 10.1016/j.indcrop.2014.12.039.
12. Baum, C.; El-Tohamy, W. y Gruda, N. ‘‘Increasing the productivity and product
quality of vegetable crops using arbuscular mycorrhizal fungi: A review’’. Scientia
Horticulturae, vol. 187, 13 de mayo de 2015, pp. 131-141, ISSN 0304-4238,
DOI 10.1016/j.scienta.2015.03.002.
13. Benton, J. J. Laboratory Guide for Conducting Soil Tests and Plant Analysis.
edit. CRC Press, 28 de junio de 2001, 382 p., ISBN 978-1-4200-2529-3.
14. Brundrett, M. C.; Piché, Y. y Peterson, R. L. ‘‘A new method for
observing the morphology of vesicular–arbuscular mycorrhizae’’. Canadian
Journal of Botany, vol. 62, no. 10, 1 de octubre de 1984, pp. 2128-2134,
ISSN 0008-4026, DOI 10.1139/b84-290.
15. Mello, C. M. A. de; Silva, G. A. da; Assis, D. M. A. de; Pontes, J. S. de;
Ferreira, A. C. de A.; Leão, M. P. C.; Vieira, H. E. E.; Maia, L. C.
y Oehl, F. ‘‘Paraglomus pernambucanum sp. nov. and Paraglomus bolivianum comb.
nov., and biogeographic distribution of Paraglomus and Pacispora’’. Journal
of Applied Botany and Food Quality, vol. 86, no. 1, 24 de septiembre de
2013, ISSN 1439-040X, DOI 10.5073/JABFQ.2013.086.016, [Consultado: 8 de
enero de 2016], Disponible en: <http://pub.jki.bund.de/index.php/JABFQ/article/view/2399>.
16. Barea, J. M.; Pozo, M. J.; Azcón, R. y Azcón-Aguilar, C. ‘‘Microbial
co-operation in the rhizosphere’’. Journal of Experimental Botany,
vol. 56, no. 417, 7 de enero de 2005, pp. 1761-1778, ISSN 0022-0957, 1460-2431,
DOI 10.1093/jxb/eri197, PMID: 15911555.
17. Azcón-Aguilar, C. y Barea, J. M. ‘‘Applying mycorrhiza biotechnology
to horticulture: significance and potentials’’. Scientia Horticulturae,
vol. 68, no. 1-4, 3 de marzo de 1997, pp. 1-24, ISSN 0304-4238, DOI 10.1016/S0304-4238(96)00954-5.
18. Gutiérrez, E. M. A.; Cetina, A. V. M.; Sahagún-Castellanos,
J.; Azpíroz, R. H. S.; Rodríguez, D. la O. J. L. y Martínez,
R. R. ‘‘Micropropagación clonal in vitro en «Eucalyptus
Grandis» y «E. Urophylla»’’. Ra Ximhai: Revista Científica
de Sociedad, Cultura y Desarrollo Sostenible, vol. 1, no. 1, 2005, pp.
111-130, ISSN 1665-0441.
19. Liu, Z.-L.; Li, Y.-J.; Hou, H.-Y.; Zhu, X.-C.; Rai, V.; He, X.-Y. y Tian,
C.-J. ‘‘Differences in the arbuscular mycorrhizal fungi-improved rice resistance
to low temperature at two N levels: Aspects of N and C metabolism on the plant
side’’. Plant Physiology and Biochemistry, vol. 71, octubre de 2013,
pp. 87-95, ISSN 0981-9428, DOI 10.1016/j.plaphy.2013.07.002.
20. Urcoviche, R. C.; Gazim, Z. C.; Dragunski, D. C.; Barcellos, F. G. y Alberton,
O. ‘‘Plant growth and essential oil content of Mentha crispa inoculated with
arbuscular mycorrhizal fungi under different levels of phosphorus’’. Industrial
Crops and Products, vol. 67, mayo de 2015, pp. 103-107, ISSN 0926-6690,
DOI 10.1016/j.indcrop.2015.01.016.
21. Douds, D. D.; Nagahashi, G.; Reider, C. y Hepperly, P. R. ‘‘Choosing a Mixture
Ratio for the On-Farm Production of AM Fungus Inoculum In Mixtures of Compost
and Vermiculite’’. Compost Science & Utilization, vol. 16, no.
1, 1 de enero de 2008, pp. 52-60, ISSN 1065-657X, DOI 10.1080/1065657X.2008.10702355.
22. Birhane, E.; Sterck, F. J.; Fetene, M.; Bongers, F. y Kuyper, T. W. ‘‘Arbuscular
mycorrhizal fungi enhance photosynthesis, water use efficiency, and growth of
frankincense seedlings under pulsed water availability conditions’’. Oecologia,
vol. 169, no. 4, 28 de enero de 2012, pp. 895-904, ISSN 0029-8549, 1432-1939,
DOI 10.1007/s00442-012-2258-3.
Recibido: 15 de
mayo de 2015
Aceptado: 3 de diciembre de 2015
Dra.C. Alicia Castillo Sallé, Unidad de Biotecnología INIA “Las Brujas” Ruta 48, km 10, Canelones Uruguay. Email: acastillo@inia.org.uy