Influencia
de la interacción entre el cultivo del garbanzo (Cicer arietinum
L.) y la inoculación con cepas seleccionadas de Mesorhizobium
spp.
Influence
of chickpea (Cicer arietinum L.) interaction and the inoculation of
selecting strains of Mesorhizobium spp.
Marisel
Ortega García,I M.Cs. Tomás Shagarodsky Scull,I
Dr. C. Bernardo L. Dibut Álvarez,I M.Cs. Yoania Ríos
Rocafull,I M.Cs. Grisel Tejeda González,I Dr. C.
Luis A. Gómez JorrinII
IInstituto
de Investigaciones Fundamentales en Agricultura Tropical “Alejandro de Humboldt”
(INIFAT), La Habana, Cuba.
IIInstituto de Suelos (IS), La Habana, Cuba.
RESUMEN
Contar
con cepas microbianas que permitan la estimulación del crecimiento de
especies vegetales de interés económico, es uno de los aspectos
fundamentales a tener en cuenta para la elaboración de bioproductos que
contribuyan a la sustentabilidad de los sistemas de producción. El objetivo
de este trabajo fue seleccionar cepas de Mesorhizobium sp, efectivas
para el incremento de los rendimientos en el cultivo del garbanzo (Cicer
arietinum L.), debido a la variabilidad que en los últimos años
mostró la cepa INIFAT GR-1, recomendada en el Instructivo Técnico
del mismo. Las cepas que resultaron positivas fueron purificadas y se les realizó
una caracterización morfológica, fisiológica y bioquímica,
mediante veinticuatro pruebas, que permitió la inclusión de dos
de ellos dentro del género Mesorhizobium. La caracterización
metabólica de estas cepas evidenció su superioridad con respecto
a la INIFAT GR-1, teniendo en cuenta que presentan un aumento del halo de solubilización
de fósforo de 0,18 cm y un incremento en la capacidad de producir ácido
indol acético (AIA) entre 7 y 12 µgmL-1. Demostró,
en condiciones in vitro, su compatibilidad con Azotobacter chroococcum,
Bacillus megatherium var phosphaticum, y Bacillus subtilis,
y los plaguicidas Poncho, Celest Top, Gaucho FS-60, Gaucho MT, Yunta, Celest,
TMTD, Cropstar y Apron Star. Respecto a los efectos bajo condiciones de campo
ambas cepas propiciaron el crecimiento, desarrollo y rendimiento del garbanzo
(vainas y granos) con valores estadísticos superior a los patrones empleados.
Las cepas fueron crecidas en zaranda rotatoria a 200 r.p.m. de agitación
a 32 ºC de temperatura de las que se obtuvo una concentración final
de 1011 UFC mL-1, aproximadamente. El empleo de los mejores
aislados provocó un efecto estimulador sobre el rendimiento de la variedad
Nacional-29, superior al 42 %, con relación a las plantas controles.
Palabras
clave: estrategia, estimulación, incremento.
ABSTRACT
The availability
of microorganism strains with growth promoting effect on economically important
species is one of the main aspects for elaborating bio-products, contributing
to the sustainability of the production systems. The aim of this research was
to select effective strains of Mesorhizobium sp to increase the yield
of chickpea (Cicer arietinum. L), due to the variability shown by the
INIFAT GR-1 strain over the last years, which is recommended in the technical
instructions for this cultivar. Positive strains were purified and performed
to conduct a morphological, physiological and biochemical characterization of
the isolates, allowing the inclusion of two of them in the Mesorhizobium
genre. The strain metabolic characterization showed its superiority with respect
to INIFAT GR-1, as indicated by the increase in the phosphorus solubilization
halo of 0,18 cm, and an increase of indol acetic acid (IAA) production ranging
between 7-12 µgmL-1. Its compatibility in vitro with
Azotobacter chroococcum, Bacillus megatherium var phosphaticum,
and Bacillus subtilis, as well as, with pesticides as Poncho, Celest
Top, Gaucho FS-60, Gaucho MT, Yunta, Celest, TMTD, Cropstar and Apron Star was
tested. Regarding the effects under field conditions, both strains promotes
chickpea growth, development and yield (pods and grains), with values statistically
superior to the pattern employed. They were growth in shaker conditions at 200
r.p.m. and 32 ºC of temperature with a final concentration of 1011
UFC.mL-1. The uses of the better strains produce the increase of
Nacional-29 variety yield in 42 %, in comparison with no treated plants.
Key words:
strategy, stimulation, increase.
INTRODUCCIÓN
Conocer las respuestas
fisiológicas y estudiar la planta a nivel básico, permite lograr
una interacción eficiente de acuerdo a sus componentes genéticos
que permitan incrementar los beneficios de los inoculantes microbianos (1).
De ellos los rizobios constituyen un grupo de microorganismos que establecen
interacciones con plantas leguminosas, las que posibilitan procesos como la
adhesión, deformación y curvatura del pelo radical, formación
del cordón de infección, división de las células
corticales, liberación de bacterias en el nódulo en formación,
diferenciación a bacteroide, constitución final del nódulo
y por último el proceso de fijación biológica del dinitrógeno
(2). Los genes Nod son los encargados de la nodulación en diferentes
leguminosas, por lo que están presentes en todas y cada una de las interacciones,
razón que define la alta especificidad de la asociación (3).
El conocimiento acerca de la existencia de las bacterias simbióticas
de este tipo se remonta a 1888. En Cuba, estos estudios comenzaron en los años
60, fundamentalmente en leguminosas forrajeras. En esta década se enriquecieron
las investigaciones y se conformó, por primera vez, un programa de recursos
genéticos microbianos en el país. Entre 1985 y 1990 se inicia
la producción, a escala artesanal, de inoculantes para beneficiar algunos
cultivos (4).
El garbanzo (Cicer arietinum L.) se sitúa en la lista de las
leguminosas más cultivadas después de la soya (Glycine max)
y los frijoles (Phaseolus sp). Fue introducido en Cuba por los españoles
y ha sido sembrado a pequeña escala desde el período colonial.
Numerosos intentos por adaptar este grano han tenido éxito en los últimos
40 años en zonas del Valle de Caujerí, Guantánamo, Banao
y Sancti Spíritus (5), demostrándose que es posible su producción
en el país.
En los últimos años, se han dedicado considerables superficies
a la siembra de este cultivo, aunque la cepa INIFAT GR-1, que ha formado parte
de su paquete tecnológico ha mostrado alta variabilidad en su comportamiento,
y no se han obtenido, los efectos esperados con su aplicación, en cuanto
a la respuesta del cultivo.
MATERIALES
Y MÉTODOS
El trabajo correspondiente
al aislamiento y caracterización de las cepas de Mesorhizobium
sp, se realizó en el Laboratorio de Agrobiotecnología, del Instituto
de Investigaciones Fundamentales en Agricultura Tropical “Alejandro de Humboldt”
(INIFAT), ubicado en Santiago de Las Vegas, municipio Boyeros, provincia La
Habana, Cuba.
Para el aislamiento se utilizaron raíces de 20 plantas de garbanzo de
diferentes zonas del país: las Tunas, Artemisa y La Habana, provenientes
de las variedades Nacional-27, Nacional-29 y Jamu-96. Los nódulos se
desinfectaron con una solución de hipoclorito de sodio al 5 % y se lavaron
dos veces con agua destilada estéril; los mismos se maceraron en un tubo
de ensayo. El extracto obtenido se sembró, sobre medio LMA con Rojo CongoA.
Las colonias crecidas se purificaron por agotamiento, fijando condiciones para
su crecimiento de 28-30 ºC de temperatura durante 72 horas.
A los aislados obtenidos se les realizó la caracterización metabólica
que incluyó el crecimiento de los mismos en medio LMA sin Rojo Congo,
en placas Petri de 9 cm posterior a las 72 horas de incubación a 30 ºC
de temperatura (6). La caracterización microscópica se determinó
mediante la tinción de Gram y demostración de la presencia de
cápsula. Se ejecutaron las siguientes pruebas: presencia de enzimas (oxidasa,
catalasa); degradación de almidón y proteínas como gelatina
y caseína. Utilización de citrato como fuente de carbono, producción
de Indol a partir del triptófano, motilidad, Vogues Proskauer, Rojo de
Metilo. También el uso de azufre a partir del crecimiento en medio Kliger
y utilización de azúcares: manitol, maltosa, dextrosa, glucosa,
fructosa, sacarosa y lactosa. Además, se determinó la degradación
de celulosa y producción de ácido en el medio de cultivo LMAB.
Todos los ensayos fueron montados por triplicado.
Para la identificación se compararon los resultados obtenidos con la
caracterización de la especie según el Manual de Sistemática
para Bacterias (Bergey).
El potencial de solubilización se determinó en condiciones in
vitro, a partir del crecimiento bacteriano sobre el medio PikosvkayaA.
El medio se esterilizó en autoclave durante 30 minutos a 121 ºC
y 1,5 atmósferas. Las placas Petri de 9 cm se mantuvieron a 30 ºC
de temperatura durante 48 horas, para cuantificar el halo de solubilización
formado. Se realizaron tres réplicas para cada cepa, las que se sembraron
por el Método de Colonia Gigante. El experimento se repitió en
tres ocasiones.
Además se determinó la producción de ácido indol
acético (AIA) siguiendo la metodología descrita (7). El experimento
se realizó con tres repeticiones por cepa y como control negativo se
utilizó el medio sin inocular. También se evaluó la compatibilidad
de las cepas que se determinó mediante el Método de Difusión
Zonal en Placas (6), utilizando como base el medio de cultivo Agar Mueller-Hinton
inoculado con las cepas de Mesorhizobium sp seleccionadas.
Los pocillos de 7 mm de diámetro, se rellenaron con productos elaborados
a partir de la fermentación de cepas de Azotobacter chroococcum
(cepa INIFAT-12), Bacillus megatherium var phosphaticum (INIFAT Bmcub
II) y Bacillus subtilis (INIFAT-101), todas ellas pertenecientes a
la Colección de Microorganismos Beneficiosos del Departamento de Agrobiotecnología
del Instituto de Investigaciones Fundamentales en Agricultura Tropical “Alejandro
de Humboldt” (INIFAT). Después de 48 horas de incubación a 30
ºC de temperatura se determinaron las dimensiones del halo de inhibición
presente en el medio. Para el resultado final se promedió el valor obtenido
en las tres repeticiones realizadas. Para la evaluación de los resultados
obtenidos se utilizó la escala propuesta (4), donde se considera que
un halo de 0–0,25 cm (compatibles), de 0,26–0,50 cm (medianamente compatibles)
y superior a 0,50 cm (incompatibles).
Los experimentos se ejecutaron sobre suelo Ferralítico Rojo (8) perteneciente
a zonas agrícolas del Instituto de Investigaciones Fundamentales en Agricultura
Tropical “Alejandro de Humboldt”, INIFAT, Santiago de las Vegas, durante tres
campañas entre los años 2009-2012, con la variedad Nacional-29.
Se empleó un diseño experimental de Bloques al Azar con cuatro
réplicas, un tamaño de parcela de 30 m2, seis surcos
y cuatro tratamientos, para la evaluación se desecharon los bordes.
La aplicación del producto se realizó a partir de una suspensión
del mismo en agua común a razón de 1:10 (v:v), embebiendo la semilla
durante 10 minutos. Posterior al oreo se procedió a la siembra.
Se evaluaron como indicadores de crecimiento la altura de la planta, peso total
de la planta, diámetro del tallo y peso seco de los nódulos. Se
determinó además, de forma cualitativa, la presencia de nódulos
en las raíces primarias y secundarias y la presencia de leghemoglobina
(tonos de rosados a rojos) para los aspectos de mayor incidencia en la producción,
se analizó el número y peso de las vainas y los granos por planta
(9).
Los resultados de los experimentos realizados en condiciones de laboratorio
in vitro fueron procesados teniendo en cuenta un Diseño Completamente
Aleatorizado utilizado para su ejecución, mientras que los obtenidos
en la fase experimental ejecutada en condiciones de campo fueron procesados
considerando el Diseño de Bloques al Azar. Las diferencias significativas
entre las medias de los tratamientos para las variables analizadas se discriminaron
según la prueba de Rangos Múltiples de Duncan al 5 % de significación.
El procesamiento de toda la información se realizó mediante el
programa STATGRAPHICS Plus Versión 5.1 (10).
RESULTADOS
Y DISCUSIÓN
A partir del muestreo
realizado a 20 plantas de garbanzo (Cicer arietinum L.) pertenecientes
a diferentes variedades, se purificaron cinco aislados que mostraron las características
típicas del género Mesorhizobium. En este caso se crecieron
en medio LMA (colonias entre 0,1 y 0,3 cm de diámetro a las 48 horas
de sembradas en el medio de cultivo, incubado a 32 ºC de temperatura) (6).
El objetivo de esta etapa de trabajo fue buscar heterogeneidad en la selección,
para diseñar una estrategia basada en una amplia diversidad genética
del cultivo, según las condiciones edafoclimáticas imperantes
en cada región, para obtener inoculantes con mayor espectro de acción
(11).
Referente a la descripción macromorfológica, los cinco aislados
muestran mediante prueba de Tinción de Gram, que todos son Bacilos cortos
Gram negativos y tienen presencia de cápsula. Todos coinciden con las
características descritas para el género Mezorhizobium, por lo
que, desde el punto de vista morfológico, no se puede descartar ninguno
de ellos, para ser utilizados en la biofertilización del cultivo del
garbanzo (Cicer arietinum L.)A.
La caracterización fisiológico-bioquímica (Tabla
I), permitió diferenciar los microorganismos y eliminar a los aislados
RM-2, RM-4 y RM-10 por presentar una reacción almidón positiva,
respuesta que no coincide con las características al que pertenece el
género implicado (6).

Además de estas existen diversas características distintivas entre
los géneros de rizobios. Por ejemplo Azorhizobium contiene cepas que
forman nódulos de raíz y de tallo y fijan nitrógeno en
condiciones de vida libre. Bradyrhizobium crece lentamente y producen
álcali en medio YMA, mientras que Allorhizobiun, Rhizobium
y Sinorhizobium crecen rápido y producen ácido en ese
medio de cultivo. En el caso que nos ocupa como es el género Mesorhizobium,
presenta colonias de crecimiento lento o moderado y produce ácido en
medio LMAA.
El mismo incluye bacterias que presentan un alto grado de especificidad, que
solo nodulan una muy estrecha gama de especies vegetales, por lo que se hace
imprescindible una estrategia de manejo adecuada que permita contar con cepas
que establezcan una relación eficiente (12).
A partir de estos resultados, el trabajo continuó solamente con las cepas
R-1 y R-3, ya que son las que reúnen las características correspondientes
al género Mesorhizobium, y por lo tanto, son las que presentan
posibilidades en cuanto a inducir la nodulación en el cultivo del garbanzo
(Cicer arietinum L), dada la especificidad de este microorganismo con
su hospedero (13).
Para estas cepas se completó la caracterización fisiológica-bioquímica
mediante la determinación de la utilización del algunos azúcares
como fuente de carbono tales como (fructosa, glucosa, sacarosa, lactosa, maltosa,
dextrosa y manitol) todos mostraron resultados positivosA.
Para los rizobios se define su taxonomía sobre la base de la filogenia
de los genes 16S rRNA, algunas características fenotípicas permiten
distinguir entre los diferentes géneros. El estudio morfológico
y fisiológico que comúnmente se lleva a cabo para la caracterización
de estos microorganismos, permite al menos diferenciar géneros muy diferentes
fenotípicamente entre sí como Bradyrhizobium, Mesorhizobium
y la familia Rhizobiaceae (12).
Las cepas R-1 y R-3 fueron sometidas a un estudio más profundo de caracterización,
para determinar su potencial metabólico, y posteriormente poder valorar
la posibilidad de sustituir, con alguna de ellas, a la INIFAT GR-1, en la biofertilización
del cultivo del garbanzo (Cicer arietinum L.).
La solubilización de fósforo es un proceso de gran importancia
para los cultivos implicados en la interacción planta-microorganismo,
ya que es uno de los componentes principales del ácido ribonucléico
y desoxiribonucléico, además de ser el portador de energía
de la molécula adenosina trifosfato (ATP) y de sus dos precursores mono
y difosfato (AMP y ADP). Su presencia en las moléculas de ADN de los
cromosomas permite los procesos de almacenamiento, replicación y conjuntamente
con el ARN, la transcripción de información genética. Este
elemento es regulador de la vegetación, por tanto es un factor que favorece
los períodos críticos como son: la fecundación, maduración
y movimiento de las reservas de la planta (14).
La presencia de este nutriente tiene gran importancia para la fijación
biológica de nitrógeno durante la interacción rizobios-leguminosa,
afectando, la carencia del mismo, el correcto funcionamiento del nódulo,
por lo que la estimación de la actividad solubilizadora es sin dudas
una herramienta para la selección de materiales (cepas) promisorios para
la biofertilización, teniendo en cuenta que con la actividad solubilizadora,
los microorganismos pueden aportar entre el 20-40 % de las necesidades de este
nutriente para el cultivo (12).
Según los resultados que se muestran en la figura
las cepas R-1 y R-3 presentan un halo de solubilización superior a 0,25,
incluso superan en un alto por ciento a la cepa INIFAT GR-1 en la solubilización
de fósforo in vitro, por lo que se puede inferir que las mismas
tienen potencial para incrementar la disponibilidad de este nutriente, teniendo
en cuenta la concordancia de estas pruebas con el comportamiento de los microorganismos
en su ambiente natural (15).
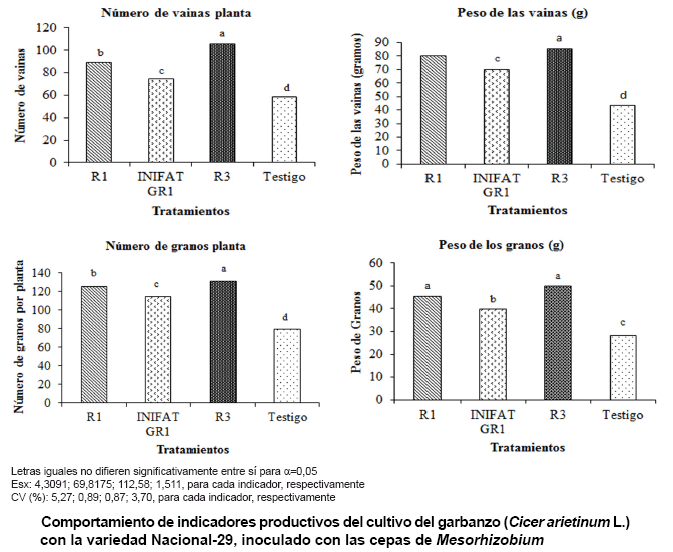
Para los rizobios se describe la capacidad de solubilizar el fósforo
contenido en el suelo mediante la acción de las enzimas fosfatasas y
ácidos orgánicos, entre otras sustancias, al igual que las Pseudomonas,
Bacillus y Enterobacter. Que las cepas presenten la dualidad
en cuanto a la fijación de nitrógeno y solubilización de
fósforo con tenores apreciables, resultan de interés para la elaboración
de productos multipropósitos que beneficien los cultivos, y tiene, por
lo tanto, particular trascendencia en este trabajo.
Otro proceso no menos importante, es la producción de fitohormonas por
parte de las bacterias promotoras del crecimiento vegetal, particularmente,
el ácido indol acético (AIA). Mediante su liberación por
parte de los microorganismos, se estimula el crecimiento de los cultivos a partir
de diferentes mecanismos fisiológicos (12).
Además posibilita la penetración del Rhizobium mediante
el intercambio de señales bioquímicas diversas emitidas por el
macro y microsimbionte. Este proceso infectivo, regulado y complejo, culmina
con la formación en la planta de una estructura altamente organizada:
el nódulo, que puede considerase como un nuevo órgano de la misma.
En el mismo la bacteria se diferenciará en su forma endosimbionte fijadora
de nitrógeno atmosférico (bacteroide). La transformación
del microorganismo es tan importante que el mismo puede multiplicarse en vida
libre y fijar nitrógeno en medios sintéticos especiales, pero
no en ausencia del hospedero, existiendo con frecuencia una marcada especificidad
entre ambos (4).
En el presente trabajo se valuaron los niveles de liberación de esta
sustancia por parte de las dos cepas de Mesorhizobium, las mismas muestran
valores de 20 µgmL-1 con clara superioridad con respecto a
la cepa INIFAT GR-1. Para este grupo de microorganismos se refiere la presencia
de esta hormona dentro de sus productos metabólicos, y se atribuye a
la misma, parte del efecto estimulador del crecimiento que se obtiene mediante
su aplicación. Estos resultados guardan relación con lo reportado
por otros autores para el género (16).
Existen estudios que demuestran la posibilidad de aplicar rizobios con otros
microorganismos con potencial biofertilizante y demuestran efectividad de la
inoculación combinada. En este estudio se demuestra que las dos cepas
pueden combinarse con Azotobacter chroococcum (cepa INIFAT-12), Bacillus
megatherium var phosphaticum (cepa INIFAT Bmcub II), y Bacillus subtilis
(cepa INIFAT-101), al igual que con la INIFAT GR-1, ya que todas son compatibles
por presentar halos de inhibición del crecimiento bacteriano entre 0,07-0,12
cm. Lo que demuestra que en un futuro se podrían realizar investigaciones
donde se exploten los beneficios de las coinoculaciones de estos microorganismos
(6).
Como parte de la caracterización a la que fueron sometidas las cepas
de Mesorhizobium se incluyó su relación in vitro
con plaguicidas químicos que tienen posibilidades de ser aplicados en
el manejo del cultivo del garbanzo (Cicer arietinum L.), teniendo en
cuenta que este cultivo es altamente sensible a enfermedades, fundamentalmente
a la afectación de hongos del suelo e insectos.
Existe coincidencia con la respuesta de los productos Cropstar y ApronStar,
los que resultaron compatibles para las cepas de Mesorhizobium R-1
y R-3. Así como Poncho, Celest Top Gaucho FS-60 y Celest como medianamente
compatibles con resultados muy similares a los que se evidencian frente a la
INIFAT GR-1. Se destacan por su toxicidad los productos Gaucho MT, Yunta y TMTD.
Resulta evidente la agresividad del Thiram como sustancia activa que compone
dos de estos plaguicidas, por lo que se debe tener en cuenta para estudios posteriores
con otros cultivos, los resultados obtenidos y valorar su compatibilidad especifica
con cada cultivar, para evitar así errores de manejo agrícola.
La influencia de la concentración de los productos utilizados puede condicionar
la acción inhibitoria en algunos casos, teniendo en cuenta que los mismos
se trabajaron de forma pura. Al disminuir su dosis, los efectos deben ser más
leves sobre los microorganismos. Además, las condiciones in vitro
implican una interacción máxima entre la sustancia química
y la bacteria, lo que igualmente eleva la probabilidad de obtener resultados
negativos. No obstante, la sensibilidad de las bacterias promotoras del crecimiento
vegetal ante la presencia de fungicidas se describe también por otros
autoresC.
De forma general, se considera que las cepas R-1 y R-3 podrían combinarse
con los plaguicidas químicos, al igual que la cepa INIFAT GR-1, lo que
sin dudas, sería de gran utilidad en la búsqueda de una propuesta
de manejo integral del cultivo del garbanzo (Cicer arietinum L.).
En la Tabla II se puede
apreciar el potencial de ambas cepas de Mesorhizobium para estimular
diferentes indicadores de crecimiento y desarrollo del cultivo del garbanzo,
aunque se destaca la cepa R-3 con mayores incrementos en todos los indicadores
de crecimiento y desarrollo evaluados.
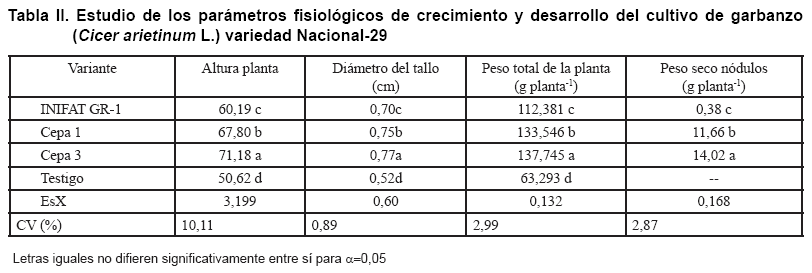
Los resultados obtenidos demuestran un adecuado desarrollo del cultivo, así
como el establecimiento de una relación positiva en la asociación
planta y microorganismo que determinan el comportamiento de la especie vegetal.
Además, brindan criterios para evaluar el desarrollo de la planta y su
respuesta ante el tratamiento biológico; de ahí la necesidad de
un régimen balanceado nutrición-biofertilización.
Durante la fase de desarrollo reproductivo, que se encuentra entre los 60 y
80 días, y que constituye una de las más importantes, al coincidir
con el llenado del grano, requiere de mayores suministros para compensar la
demanda y lograr el rendimiento esperado, por lo que la biofertilización
juega un importantísimo papel, ya que coloca a disposición de
la planta, los niveles de nitrógeno adecuados y el aporte de fósforo
mediante la solubilización (14).
Los nódulos se ubicaron fundamentalmente en la raíz principal,
en forma de racimos de gran tamaño. En las raíces secundarias
se detectó su presencia, caracterizada por un menor volumen en los mismos.
En ambos casos se demostró, la presencia de la leghemoglobina, particularmente
para las variantes inoculadas con las cepas R-1 y R-3. Este aspecto resulta
muy importante porque demuestra que el proceso de fijación biológica
de nitrógeno se realiza de forma efectiva, por lo que la asociación
entre microorganismos y hospedero es satisfactoria (5).
Este trabajo permitió evaluar la ventaja de utilizar cepas autóctonas
con alta capacidad de competencia, provenientes de nódulos de diferentes
regiones y que muestran su potencial biológico. Teniendo en cuenta la
efectividad de la asociación, inferida a partir del incremento en los
indicadores de crecimiento, desarrollo y rendimiento evaluados, se puede concluir
que las cepas utilizadas son capaces de competir con las nativas.
Resulta evidente la importancia de una correcta selección, para provocar
un efecto adecuado en la estimulación del desarrollo del cultivo. En
el tipo de suelo utilizado y con la variedad empleada, la cepa R-3 muestra una
clara superioridad, de ahí lo imprescindible de realizar experimentos
similares cuando se requiera discriminar entre cepas y seleccionar solo las
de mayores potencialidades.
Los indicadores evaluados, como componentes del rendimiento, tienen una repercusión
directa en la producción del cultivo, el que igualmente mostró
incrementos por el efecto de la inoculación de las cepas de Mesorhizobium
(Figura).
Es evidente la semejanza del comportamiento de las cepas R-1 y R-3, y la superioridad
de ambas al compararla con la INIFAT GR-1, por lo que como resultado principal
de este trabajo se seleccionan las mismas para sustituir a esta última
en la biofertilización del cultivo del garbanzo (Cicer arietinum
L.), fundamentalmente para la variedad Nacional-29, debido a la respuesta significativamente
superior con respecto al testigo (plantas sin aplicación de Mesorhizobium).
En trabajos posteriores sería conveniente valorar la posibilidad de elaborar
un producto multicepas que permita un mayor efecto de acción del inoculante
en los distintos agroecosistemas donde se siembra el cultivo del garbanzo (Cicer
arietinum L.), así como la posibilidad de combinar estos microorganismos
con especies solubilizadoras de fósforo y plaguicidas químicos
o biológicos en condiciones in vivo, para proponer un manejo integral
del cultivo.
Teniendo en cuenta que la inoculación de leguminosas con rizobios se
llevará a cabo por mucho tiempo, la mejor opción para el manejo
de este grupo de cultivos, es el continuo desarrollo de los biofertilizantes
cada vez más efectivos que deberá ser un trabajo permanente y
de vital importancia para la agricultura mundial y en especial para Cuba.
CONCLUSIONES
- Las cepas R-1
y R-3 pertenecen al género Mesorhizobium.
- Ambas cepas
de Mesorhizobium, muestran potencialidades de uso para la agricultura,
teniendo en cuenta que solubilizan fósforo, producen ácido indol
acético en niveles superiores a la INIFAT GR-1 y, al igual que ella,
son compatibles con microorganismos de interés agrícola y plaguicidas
químicos.
- Las cepas R-1
y R-3 estimulan el rendimiento y la nodulación del cultivo del garbanzo
(Cicer arietinum L) variedad Nacional 29, por lo que son promisorias
para sustituir a la cepa INIFAT GR-1 en la biofertilización del mismo.
- Se destaca
por su superioridad la cepa R-3 por mostrar incrementos en todos los indicadores
evaluados.
Nota al
pie
ABécquer,
C. J. Caracterización y selección de rizobios aislados de
leguminosas nativas de Sancti-Spíritus, Cuba. [Tesis de Doctorado],
Universidad de La Habana, La Habana, Cuba, 2002.
BMartínez,
V. R.; López, M.; Dibut, B.; Parra, C. y Rodríguez, J. La
fijación biológica del nitrógeno atmosférico en
el medio tropical. edit. MPPAT, Caracas, 2007, 190 p.
CAlbretch,
J.; Fontanetto, H. y Sillón, M. Informe sobre el cultivo del garbanzo.
Red de Agricultura de Precisión. Fitopatología, Inst. Departamento
de Producción Vegetal-FCA UNL INTA EEA, Córdoba, 2011, p. 15.
BIBLIOGRAFÍA
1. Marschner, P.; Crowley, D. y Rengel, Z. “Rhizosphere interactions between
microorganisms and plants govern iron and phosphorus acquisition along the root
axis – model and research methods”. Soil Biology and Biochemistry,
vol. 43, no. 5, mayo de 2011, pp. 883-894, ISSN 0038-0717, DOI 10.1016/j.soilbio.2011.01.005.
2. Hayashi, M.; Saeki, Y.; Haga, M.; Harada, K.; Kouchi, H. y Umehara, Y. “Rj
(rj) genes involved in nitrogen-fixing root nodule formation in soybean”.
Breeding Science, vol. 61, no. 5, 2012, pp. 544–553, ISSN 1347-3735,
1344-7610.
3. Bonaldi, K.; Gargani, D.; Prin, Y.; Fardoux, J.; Gully, D.; Nouwen, N.; Goormachtig,
S. y Giraud, E. “Nodulation of Aeschynomene afraspera and A. indica
by Photosynthetic Bradyrhizobium Sp. Strain ORS285: The Nod-Dependent
Versus the Nod-Independent Symbiotic Interaction”. Molecular Plant-Microbe
Interactions, vol. 24, no. 11, 13 de octubre de 2011, pp. 1359-1371, ISSN
0894-0282, DOI 10.1094/MPMI-04-11-0093.
4. Martínez, R. y Dibut, B. Biofertilizantes Bacterianos. edit.
Científico-Técnica, La Habana, Cuba, 2012, 279 p., ISBN 978-959-05-0659-8.
5. Shagarodsky, T. M. L.; Chiang, M.; Cabrera, O.; Chaveco, M. R.; López,
B.; Dibut, M.; Dueñas, M.; Vega, N. y García, E. Manual de
instrucciones técnicas para el garbanzo (Cicer arietinum L.) en las condiciones
de Cuba. edit. INIFAT, 2005, 20 p., ISBN 959-246-133-3.
6. Madigan, M.; Martinko, J.; Stahl, D. y Clark, D. Brock Biology of Microorganisms.
13.a ed., edit. Pearson, 2012, 1155 p., ISBN 978-0-321-73551-5.
7. “The genus Bacillus” [en línea]. En: eds. Brenner, D. J.;
Krieg, N. R.; Staley J. T.; Garrity G. M.; Boone D. R.; De Vos, P.; Goodfellow,
M.; Rainey, F. A.; y Schleifer, K.-H., Bergey’s Manual® of
Systematic Bacteriology, edit. Springer US, Boston, MA, 2005, pp. 751-778,
ISBN 978-0-387-24144-9, [Consultado: 25 de enero de 2016], Disponible en: <http://link.springer.com/10.1007/0-387-28022-7>.
8. Hernández, A.; Pérez, J.; Bosch, D. y Castro, N. Clasificación
de los suelos de Cuba 2015. edit. Ediciones INCA, Mayabeque, Cuba, 2015, 93
p., ISBN 978-959-7023-77-7.
9. Cárdenas, T. R. M.; Ortiz, P. R.; Echevarría, H. A. y Shagarodsky,
S. T. “Caracterización y selección agroproductiva de líneas
de garbanzo (Cicer arietinum L.) introducidas en Cuba”. Cultivos
Tropicales, vol. 33, no. 2, junio de 2012, pp. 69-74, ISSN 0258-5936.
10. Statistical Graphics Crop. STATGRAPHICS® Plus [en
línea]. (ser. Profesional), versión 5.1, [Windows], 2000, Disponible
en: <http://www.statgraphics.com/statgraphics/statgraphics.nsf/pd/pdpricing>.
11. Ribeiro, C. M. y Cardoso, E. J. B. N. “Isolation, selection and characterization
of root-associated growth promoting bacteria in Brazil Pine (Araucaria angustifolia)”.
Microbiological Research, vol. 167, no. 2, 20 de enero de 2012, pp.
69-78, ISSN 0944-5013, DOI 10.1016/j.micres.2011.03.003.
12. Camelo, M.; Vera, S. P. y Bonilla, R. “Mecanismos de acción de las
rizobacterias promotoras del crecimiento vegetal”. Revista CORPOICA. Ciencia
y Tecnología Agropecuaria, vol. 12, no. 2, 2011, pp. 159-166, ISSN
0122-8706.
13. Gerding, M.; O’Hara, G. W.; Bräu, L.; Nandasena, K. y Howieson, J.
G. “Diverse Mesorhizobium spp. with unique nodA nodulating the South
African legume species of the genus Lessertia”. Plant and Soil,
vol. 358, no. 1-2, 7 de marzo de 2012, pp. 385-401, ISSN 0032-079X, 1573-5036,
DOI 10.1007/s11104-012-1153-3.
14. Afzal, A. y Bano, A. “Rhizobium and phosphate solubilizing bacteria
improve the yield and phosphorus uptake in wheat (Triticum aestivum)”.
International Journal of Agriculture and Biology, vol. 10, 2008, pp.
85–88, ISSN 1814-9596, 1560-8530.
15. Ho, B.; Ho, T. K.; Ho, T. W.; Huang, E.-H.; Nutrimen, F. J. P.; Ho, B.;
Ho, T. K.; Ho, T. W. y Huang, E.-H. Microorganisms, microbial phosphate
fertilizers and methods for preparing such microbial phosphate fertilizers
[en línea]. no. WO2009070966 A1, no. solc. PCT/CN2008/001850, 11 de junio
de 2009, [Consultado: 25 de enero de 2016], Disponible en: <http://www.google.com/patents/WO2009070966A1?cl=en>.
16. Inaba, S.; Ikenishi, F.; Itakura, M.; Kikuchi, M.; Eda, S.; Chiba, N.; Katsuyama,
C.; Suwa, Y.; Mitsui, H. y Minamisawa, K. “N2O Emission from Degraded
Soybean Nodules Depends on Denitrification by Bradyrhizobium japonicum
and Other Microbes in the Rhizosphere”. Microbes and Environments,
vol. 27, no. 4, 2012, pp. 470-476, ISSN 1347-4405, 1342-6311, DOI 10.1264/jsme2.ME12100.
Recibido: 15 de
mayo de 2015
Aceptado: 3 de diciembre de 2015
Alicia Castillo
Sallé, Unidad de Biotecnología INIA “Las Brujas” Ruta 48,
km 10, Canelones Uruguay. Email: acastillo@inia.org.uy


