Estrategia
criogénica para el establecimiento de un banco de germoplasma de piña (Ananas
comosus var. Comosus)
Cryogenic
strategy for the establishment of a germplasm bank of pineapple (Ananas
comosus var. Comosus)
Ariel Villalobos
Olivera,I Roberto Méndez Pelegrín,I Justo González Olmedo,II
Alitza Iglesias Alfonso,II Julia Martínez Rodríguez,II
René Carlos Rodríguez Escriba,II Gustavo Yasser Lorente González,II
Nicolás Quintana Bernabé,I Romelio Rodríguez Sánchez,II
Fernanda Vidigal Duarte Souza,III Marcos Edel Martínez MonteroII
IUniversidad
de Ciego de Ávila (UNICA), Cuba.
IICentro de Bioplantas, UNICA, Cuba.
IIIEMBRAPA Mandioca e Fruticultura, Brasil.
RESUMEN
En la piña se han
utilizado protocolos de crioconservación basados en un procedimiento de vitrificación.
Sin embargo, se desconoce aún la influencia de algunos factores técnicos para
lograr una estrategia criogénica con una aplicación de rutina a un amplio número
de genotipos. Además hasta la fecha, no se han realizado ningún análisis histológico
para visualizar cambios estructurales durante un procedimiento de crioconservación.
En la presente investigación se determinaron diferentes aspectos técnicos de
una estrategia criogénica para aumentar los niveles de supervivencia de los
ápices a la inmersión en nitrógeno líquido. Estos fueron: tipo de ápice, compuesto
por 3-4 primordios foliares con un tamaño aproximado de 2,5-3mm; precultivo
en 0,3 mol L-1 de sacarosa; aplicación de la solución de carga 0,4
mol L-1+2 0,4 mol L-1 glicerol; temperatura de aplicación
de la solución vitrificadora PVS2 a 0 °C durante 420 min. El análisis de la
visualización de los cambios estructurales ocurridos en los ápices crioconservados
reveló que las células meristemática presentes en el domo apical y los primordios
foliares en formación, sufrieron pocas alteraciones celulares y mantuvieron
casi intacta sus características morfo-fisiológica en las mejores condiciones
de supervivencia. Se aplicó de manera exitosa un procedimiento de vitrificación
para nueve accesiones del banco de germoplasma in vitro del centro
de Bioplantas. Lo anterior constituye una importante etapa para el establecimiento
de un banco de germoplasma a larga plazo del cultivo de la piña.
Palabras
clave: ápices, germoplasma, histología, vitrificación.
ABSTRACT
In pineapple have
been used cryopreservation protocols based on a vitrification procedure. However,
the influence of some technical factors is still unknown to achieve a strategy
cryogenic routine application to a wide range of genotypes. Furthermore, there
has been no histological analysis to display any structural changes during a
process of cryopreservation. In the present investigation different technical
aspects of a cryogenic strategy are determined to increase survival levels from
the apexes to immersion in liquid nitrogen. These were: type of apex, consisting
of 3-4 leaf primordia with an approximate size of 2,5-3mm; preculture 0,3 mol
L-1 sucrose; application of the loading solution 0,4 mol L-1+2
0,4 mol L-1 mol glycerol; application temperature of the vitrification
solution PVS2 at 0 °C for 420 min. The analysis of the display of structural
changes in the cryopreserved apices revealed that the meristematic cells in
the apical dome and leaf primordia in formation, suffered few cellular alterations
and kept almost intact its morpho-physiological characteristics in the best
conditions of survival. The method of vitrification was applied successfully
for 9 accessions of the in vitro genebank of Bioplant center. This
is an important step for the establishment of a gene bank for long-term cultivation
of pineapple.
Key words:
apices, germplasm, histology, vitrification.
INTRODUCCIÓN
La piña
(Ananas comosus var. Comosus) es uno de los principales frutales del
mundo, es cultivada con el fin de satisfacer necesidades alimenticias de la
población y constituye un importante renglón para la producción
de conservas y venta de fruta fresca (1). Esta fruta después del banano
y el mango, es la fruta tropical más importante, con una producción
mundial en el año 2012 que alcanzó 23 333 886 toneladas (2).
La piña para Cuba constituyó una de las principales plantaciones
de la provincia de Ciego de Ávila, recayendo más del 80 % de la
producción nacional en la variedad Española roja, de bajo potencial
reproductivo, aunque en los últimos años se han introducido nuevos
cultivares como el Cayena lisa y el ‘MD-2’, de buenos rendimiento, pero son
más exigente a las condiciones ambientales (1, 2, 3).
En la actualidad, los recursos genéticos de la piña son conservados
generalmente en colecciones de campo (4). Además se utilizan las técnicas
de cultivo in vitro, como alternativa para responder a las necesidades
de conservación de genes (5). Sin embargo, hasta la fecha, la opción
más prometedora para el almacenamiento a largo plazo es la crioconservación
mediante la creación de un banco genético básico donde
los cultivos se almacenarían en espacio reducido, protegidos de las contaminaciones
y con un mantenimiento limitado (6, 7, 8, 9). El material vegetal se transfiere
a nitrógeno líquido, en el cual la temperatura es suficientemente
baja (-196 °C), para que se suspenda el metabolismo y se eviten los procesos
que reducen la estabilidad genética durante el almacenamiento (10, 11,
12).
En la crioconservación de especies que se propagan vegetativamente, los
tejidos organizados tales como ápices o meristemos son de preferencia
por su estabilidad genética (13, 14). Además, éstos se
recomiendan como el explante por excelencia a almacenar germoplasma porque se
pueden obtener plantas libres de virus (crioterapia) regeneradas directamente
a partir de estos materiales crioconservados (15, 16).
En el caso de la piña se han utilizado protocolos basados en un procedimiento
de vitrificación (17, 18). En los últimos años se ha implementado
la técnica de micro-goteo/vitrificación en ápices de piña
donde se ha logrado incrementar la supervivencia de los ápices (19, 20).
Sin embargo, se desconoce aún la influencia de algunos factores técnicos
para lograr una estrategia criogénica con una aplicación de rutina
a un amplio número de genotipos de piña. Además se han
realizado pocas investigaciones para visualizar los cambios estructurales a
nivel celular durante las diferentes etapas de un procedimiento de crioconservación.
Por lo que este trabajo tuvo como objetivo determinar diferentes aspectos técnicos
de una estrategia criogénica que aumenten la supervivencia en nitrógeno
líquido para ápices de vitroplantas de piña, visualizar
los cambios estructurales por histología durante la crioconservación
y aplicar el procedimiento de vitrificación para nueve accesiones del
banco in vitro de germoplasma de piña.
MATERIALES
Y MÉTODOS
La
investigación se realizó en el laboratorio de Mejoramiento Genético
del Centro de Bioplantas de la (Universidad de Ciego de Ávila), utilizando
como material vegetal vitroplantas de piña (Ananas comosus var.
Comosus) ‘MD-2’ provenientes de un Banco de germoplasma in vitro micropropagadas
según el protocolo establecido (21).
Etapa I. Acondicionamiento de las vitroplantas donantes: Se
utilizaron vitroplantas después de cuatro subcultivos. Multiplicadas
en medio de cultivo líquido con sales MS+100 mg L-1mioinositol
+2,1 mg L-1BA+ 0,3 mg L-1ANA +1,0 mg L-1Tiamin
+30 g L-1 sacarosa (0,08 mol L-1), con un pH del medio
justado a 5,67 según Skoog (22). Las plantas se subcultivaron cada 30
días y crecieron a 27±2°C y fotoperíodo de luz artificial
de 18 h día-1, entre 1500 y 2000 lux de iluminación.
Etapa II. Pre-cultivo de ápices: Se utilizaron dos tipos
de ápices: ápices tipo I (2,5-3 mm de longitud) con una pequeña
base apical y tres a cuatro primordios foliares que lo cubrían; y ápices
con la pequeña base apical con uno o dos primordios foliares (ápices
tipo II) (0,8-1,3 mm de longitud), para luego determinar el tipo de ápice
más adecuado antes y después de inmersión en nitrógeno
líquido durante un tiempo de (0-30 min). La disección del explante
se realizó bajo un estéreo microscopio (ACUS SCOPE) en un gabinete
de flujo laminar a partir de vitroplantas. Los ápices se cultivaron durante
dos días, cinco ápices por placa de Petri que contenían
un medio de cultivo MS semisólido suplementado con 100 mg L-1
Mioinositol 1,0 mg L-1, Tiamina 30 g L-1 y 0,08 mol L-1
sacarosa. Luego se determinó los efectos del precultivo en sacarosa suplementando
0,1; 0,3; 0,5 y 0,7 mol L-1 de sacarosa, para mejora de la supervivencia
de los ápices crioconservados. Después se determinó el
efecto de la solución de carga, teniendo en consideración los
mejores tratamientos del experimento anterior, donde los explantes precultivados
en sacarosa se sometieron a 1mL de las soluciones de carga (0,4 mol L-1
sacarosa+ 2,0 mol L-1glicerol; 0,75 mol L-1 sacarosa+
1,0 mol*L-1glicerol) en crioviales con capacidad total
de 2 ml durante 25 min a 25 °C.
Etapa III. Deshidratación con la solución vitrificadora
PVS2: A los dos días de precultivo los ápices pasaron
a los crioviales (2mL de volumen total) que contenían 1,5 mL de solución
de PVS2 a temperatura ambiente ±25 °C. El material vegetal se mantuvo
durante un período de tiempo (0-30 min) a 25 °C, para determinar
el tiempo de deshidratación en PVS2. Después se determinó
el tiempo de deshidratación en PVS2 del material en un periodo de tiempo
(0–180 min) a 25 °C de acuerdo vegetal según la aplicación
de la solución de carga antes de la inmersión en nitrógeno
líquido y posterior a la inmersión en nitrógeno líquido.
Además, es necesario señalar que se realizó la evaluación
del número total de grupos OH por la fórmula siguiente: Molaridad
*
NA * [OH] Donde, NA- Constante de Avogadro 6,022 x 10 23mol-1,
[OH] grupos OH por molécula.
Después para mejorar la supervivencia de los ápices durante la
crioconservación se evaluó el efecto de la temperatura teniendo
en consideración los mejores tratamientos de los acápites anteriores
con las siguientes modificaciones, donde el material vegetal se mantuvo durante
un período de tiempo (0–540 min) a 25 °C y 0 °C.
Etapa IV. Inmersión en nitrógeno líquido:
Posteriormente los crioviales se sumergieron en nitrógeno líquido
y se mantuvieron por 2 h en estas condiciones.
Etapa V. Calentamiento: El calentamiento de los crioviales
se realizó en un baño de agua a (+) 40 °C, durante 2-3 min.
Etapa VI. Destoxificación (solución de descarga):
La solución vitrificadora PVS2 de los crioviales se reemplazó
una vez por 1 mL de una solución de 1,2 mol L-1 de sacarosa
y se mantuvo durante 30 min a 25 °C.
Etapa VII. Recuperación: Los ápices de los diferentes
tratamientos se pasaron a papel de filtro que cubrió la superficie de
placas de Petri que contenía el medio de micropropagación pero
desprovistos de los reguladores del crecimiento.
Etapa VIII. Evaluación de supervivencia: A la semana,
los ápices se transfirieron a placas de Petri que contenían medio
de micropropagación con idénticas condiciones iniciales 27±2°C
y fotoperíodo de luz artificial de 18 h día-1, entre
1500 y 2000 lux de iluminación, durante tres semanas. La evaluación
de la supervivencia se realizó según lo establecido por Martinez-
Montero (23), considerando la porcentaje de supervivencia, el número
de ápices que mostró síntomas de recrecimiento a las cinco
semanas de recuperación midiéndole su tamaño. Los porcentajes
de supervivencia se expresaron con respecto al total de ápices usados
por tratamiento.
Análisis histológico durante la crioconservación
de ápices de piña
El análisis histológico se realizó a partir de muestras
de ápices deshidratados y crioconservados del cultivar MD2 los cuales
fueron sometidos durante 0, 180, 300, 420 y 540 min en la solución vitrificadora
PVS3 a 0 °C.
Se siguió un procedimiento similar para todas las muestras. Estas se
fijaron en solución F.A.A (formol - ácido acético - alcohol
etílico) al 5-5-50 % (v/v), respectivamente. A continuación se
lavaron en agua corriente durante 24 h para eliminar el exceso de fijador. Una
vez concluido el lavado, el tejido fue deshidratado en concentraciones seriadas
de alcohol etílico (30, 50, 70, 80 y 90 %) y tres veces por alcohol etílico
absoluto, durante 2 h cada pase. Después del proceso de deshidratación
las muestras se aclararon en alcohol- Bensol (50 % v/v), Luego se continuó
la deshidratación en tres pases de Bensol durante 1 h y finalmente se
embebieron en una serie de tres pases de parafina con un período de impregnación
de 1 h por pase. Seguidamente se incluyeron en bloques de parafina a los que
se le realizaron cortes seriados con un grosor de 20 µm, en un micrótomo
manual de deslizamiento vertical. La técnica de tinción utilizada
fue la tinción de Flemming (24). Para la observación de las muestras
se utilizó un microscopio Carl Zeiss al cual se le acopló una
cámara digital Canon Power Shot A620 con la que se tomaron todas las
imágenes.
Después de realizado el procedimiento de vitrificación, fue validado
en nueve accesiones del banco de germoplasma nacional piña, tomando en
consideración los mejores tratamientos de los acápites anteriores
(Tabla I). Además
de la evaluación de la supervivencia, de los ápices deshidratados
y crioconservados, respectivamente a las seis semanas de incubación.

Tratamiento
estadístico de los datos
Se realizaron experimentos monofactoriales con más de dos niveles, con
cinco repeticiones y se aplicó un diseño completamente aleatorizado.
En el procesamiento estadístico de los datos se empleó el utilitario
SPSS para Windows (25). En todos los casos se comprobó la distribución
normal de los datos mediante la prueba de homogeneidad de las varianzas a través
de la prueba Levene. Se realizaron pruebas aramétricas (ANOVA y Tukey)
p<0,05. En algunos casos se necesitó la transformación de datos
según x’=2 arcosen ((x/100)0,5.
RESULTADOS
Y DISCUSIÓN
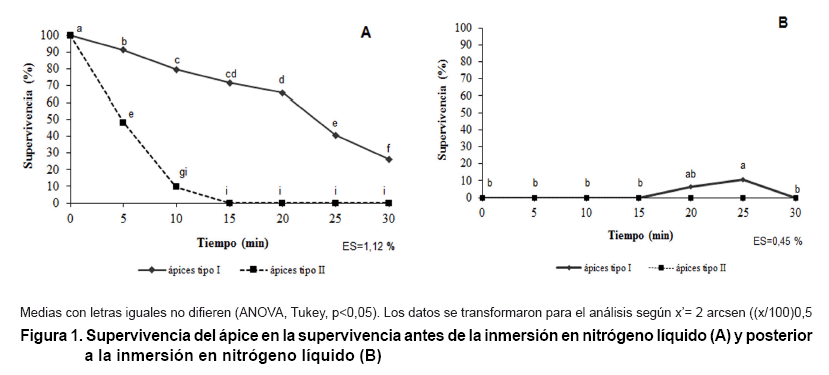
En la Figura 1 se observó
una mayor tolerancia con diferencias significativas para los ápices del
tipo I (Figura 1A)
con respecto a los ápices del tipo II (Figura
1B). Los ápices del tipo I soportaron los niveles de deshidratación
al PVS2 tres veces más, hasta los 30 min de exposición.
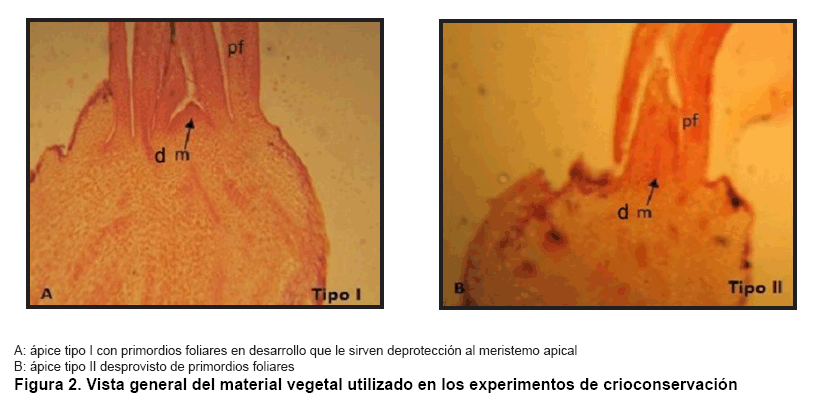
Cuando
se realizó una observación al microscopio óptico también
se evidenciaron diferencias entre los tipos de ápices utilizados. La
Figura 2 muestra la
sección longitudinal de los dos tipos de ápices. El ápice
tipo I (Figura 2A),
consta de 3 a 4 primordios foliares, que garantizan cierto grado de protección
al meristemo, y un ápice tipo II (Figura
2B) compuesto por uno o dos primordios foliares donde el meristemo queda
prácticamente descubierto, los cuales resultaron ser más susceptibles
a los tratamientos de deshidratación.
Generalmente, diversos autores aceptan, que para una crioconservación
exitosa de los ápices, éstos deben consistir en un domo meristemático
más uno o dos primordios foliares con un tamaño de 0,5-2 mm de
longitud, dependiendo de las especies (26). Sin embargo, se recomienda, que
es necesaria una selección apropiada del tamaño y el estado de
desarrollo del material inicial como factor esencial para alcanzar altas tasas
de recuperación después del calentamiento (27). Por lo anterior
se seleccionaron los ápices de tipo I para continuar en la estrategia
criogénica en los siguientes experimentos.
En contraste con los resultados de tolerancia obtenidos anteriormente solo se
observó un 5,3 % de supervivencia para los ápices del tipo I cuando
a los 25 min se deshidrataron por la solución vitrificadora PVS2, se
enfriaron en nitrógeno líquido. Al realizar la evaluación
de la coloración del tejido se observó que en la totalidad de
los casos si éstos se mantenían de color verde intenso, podían
recrecer a los 45 días de evaluación. Sin embargo, si cambiaban
de coloración verde hacia amarilla-pálida no podían crecer,
y por lo tanto morían.
Por otro lado, y para comparar el comportamiento de los ápices seleccionados
en las Figuras 3 y
4 se muestra la histología
realizada a ápices de tipo I sin tratamientos crioprotectores (tiempo
0) antes (Figura 3A y B)
y después (Figura
4A y B) de la inmersión en nitrógeno líquido. Los explantes
estuvieron formados por el domo meristemático o meristemo apical (Figura
3A y 4A) y una
zona subapical de células parenquimáticas (Figura
3B y 4B).
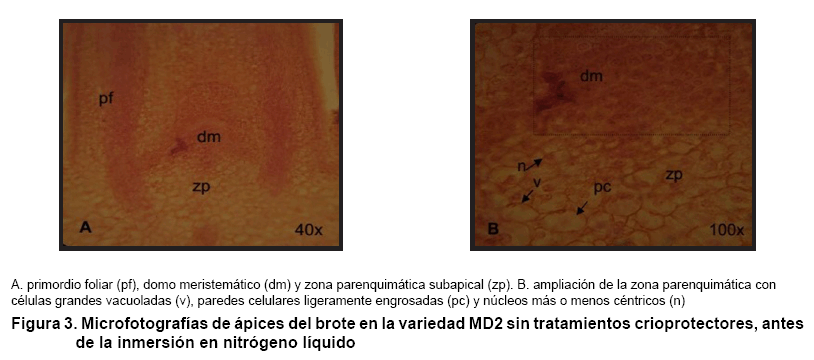
La histología de los ápices sin tratamientos crioprotectores antes
de la inmersión en nitrógeno líquido mostró que
las células de la zona subapical o células parenquimáticas
(Figura 4B), se presentan
más grandes con paredes celulares más o menos engrosadas, vacuolas
más grandes en comparación con la zona meristemática. No
existe una clara definición en cuanto a la formación del meristemo
en fila (rib meristem) como se observa claramente en plantas adultas desarrolladas
ex vitro.
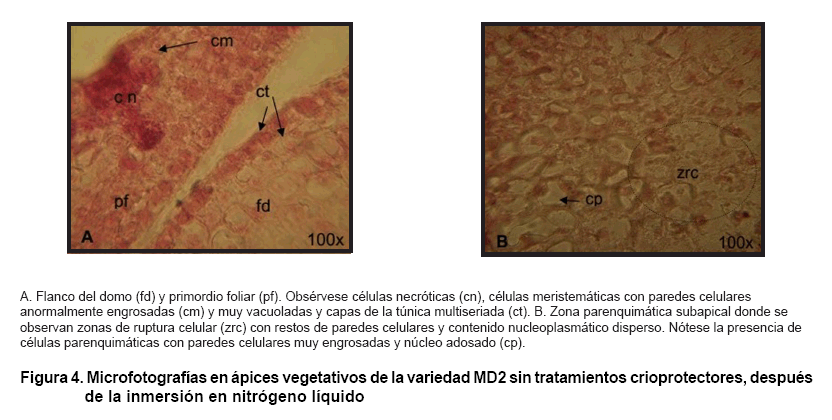
Por su parte, en la histología de los ápices sin tratamientos
crioprotectores después de la inmersión en nitrógeno líquido,
se observó que en la zona apical (Figura
4A) existió heterogeneidad celular, donde algunas células
conservaron sus características meristemáticas, en el caso de
los estratos celulares correspondiente a las células más jóvenes
del domo meristemático, se observaron células necróticas,
células meristemáticas con paredes celulares anormalmente engrosadas
y con pequeñas vacuolas o espacios eriplamáticos, además
las capas de la túnica se mostraron multiseriadas. Mientras que en la
zona parenquimática subapical (Figura
4B), las células estuvieron más vacuoladas, algunas fueron
dañadas, mostrando zonas de ruptura celular, con restos de paredes celulares
y contenido núcleo plasmático disperso. Nótese la presencia
de células parenquimáticas con paredes celulares muy engrosadas
y núcleo adosado. Finalmente se observó que existió un
número de células con el citoplasma contraído en la pared
celular.
Semejantes observaciones fueron realizadas por (28) en meristemos de Musa
spp, donde en los meristemático no enfriados las células mantenían
forma más o menos regular y no se distinguían vacuolas en su citoplasma.
Sin embargo, después de congelar las muestras por debajo de -30 °C,
observaron que a medida que las células eran menos meristemáticas
existía un incremento en número y tamaño de las vacuolas
presentes en estas.
Como era esperado para una concentración de sacarosa de 0,3 mol L-1
se alcanzaron los mejores niveles de supervivencia para los ápices posterior
a la inmersión en nitrógeno líquido y al calentamiento
(Figura 5B). Por lo
tanto, esta concentración de sacarosa se seleccionó para continuar
la experimentación. Los resultados de diferentes grupos de investigación
son variados en el sentido de estandarizar concentraciones apropiadas de sacarosa
durante la crioprotección. Para cada material a crioconservar debe encontrarse
la concentración adecuada ya que esta varía según la especie
o explante (4, 13, 28).
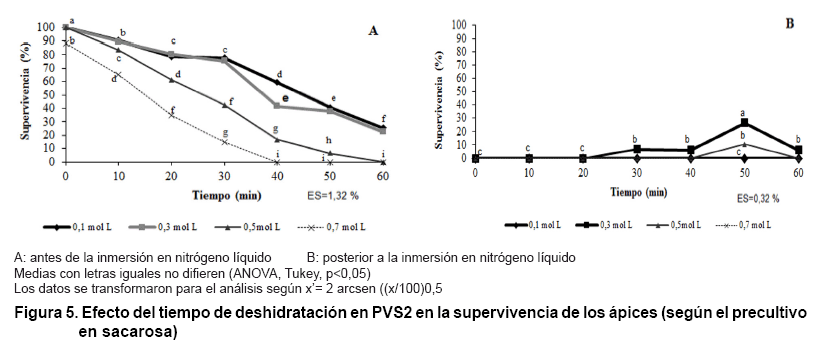
Cuando se emplea sacarosa se debe determinar la concentración adecuada
que toleran las células antes de iniciar el proceso de crioconservación,
basado en dos aspectos fundamentales, la deshidratación osmótica
y la toxicidad a las células (4). Los resultados más importantes
de este experimento fue la seleccionó de la concentración de sacarosa
de 0,3 mol*L-1 para continuar la experimentación.
En la Figura 6 se observó
que los niveles de tolerancia a la deshidratación por la solución
PVS2 se incrementaron notablemente al emplear los tratamientos de la solución
de carga hasta 180 min (Figura
6A).
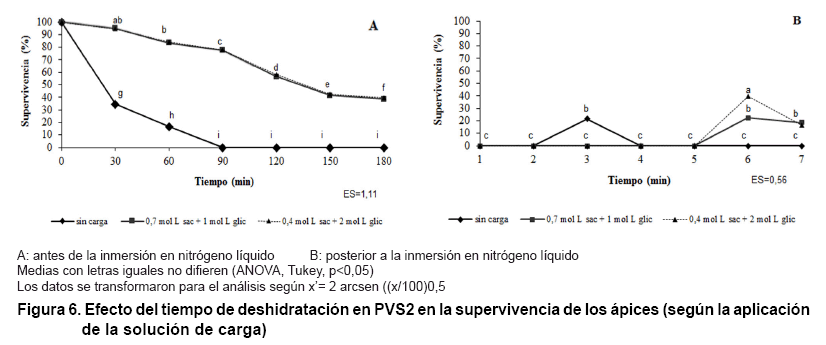
Por su parte, los niveles de supervivencia a la crioconservación también
se elevaron hasta un 40 %, con diferencias significativas a los 150 min de deshidratación
en PVS2 a favor de la mezcla crioprotectora de sacarosa 0,4 mol*L-1
y glicerol 2 mol*L-1
(Figura 6B), por lo
que ésta última será la solución de carga que se
empleará en los siguientes experimentos. Sin embargo, se evidenció
que no fue posible obtener un incremento en la supervivencia de los ápices
aunque se utilice un mayor tiempo de incubación.
Lo anterior coincide con los resultados publicados con respecto a la utilización
del tiempo de pre-tratamiento en las concentraciones de glicerol y sacarosa
mediante los procedimientos de vitrificación (9, 12). Lo que indica que
es el tiempo adecuado para que se activen los mecanismos necesarios involucrados
en la tolerancia de las células a los diferentes momentos estresantes
en una estrategia de crioconservación.
Cuando se determinó el número total de grupos OH por moléculas
de las mezclas utilizadas (sacarosa + glicerol) para comparar los resultados
de supervivencia con diferencias estadísticas obtenidos en la Figura
6. Para el caso de la mezcla 0,4 mol*L-1
sacarosa + 2,0 mol*L-1
glicerol rinde 55,402 x 1023 grupos OH total por moléculas mientras que
la mezcla 0,75 mol*L-1
sacarosa + 1,0 mol L-1 glicerol rinde 54,198 x 1023 grupos
OH total por moléculas. De esta forma es evidente el porqué de
las diferencias significativas. El reordenamiento de los grupos hidroxilo de
las moléculas de diferentes azúcares y poli-alcoholes constituye
un factor importante para una efectiva crioconservaciónA.
En la Figura 7 se muestran
los resultados al disminuir la temperatura de aplicación del PVS2. Se
observó un aumento en el tiempo de tolerancia hasta los 480 min (Figura
7A) y los máximos valores de supervivencia a la crioconservación
se incrementaron hasta un 45 % a los 420 min de exposición al PVS2 (Figura
7B). Por lo tanto, en la continuación de la estrategia criogénica
se disminuirá la temperatura hasta 0 °C para aplicar el PVS2.
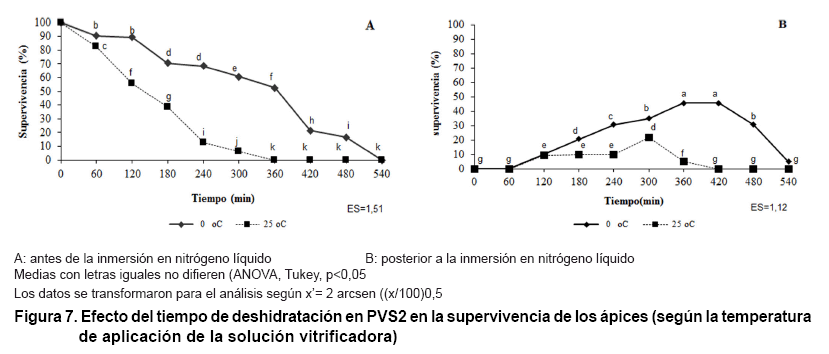
Según Takagi (29) en la crioconservación de ápices de brotes
de especies tropicales mejoro la supervivencia de Dioscorea alata a la crioconservación
desde un 47 % hasta un 91 % disminuyendo la temperatura desde 25 °C hasta
0 °C durante la deshidratación por PVS2). En la actualidad existen
evidencias de estudios de Calorimetría Diferencial de Barrido donde varios
autores hipotetizan al respecto (15). Los autores plantean que el mecanismo
de protección del PVS2 no solo está relacionado con la no formación
de cristales de hielo, sino que además se basa en la restricción
de la movilidad molecular y la desorganización de la estructura de los
cristales de hielo.
En la Figura 8 se observó
que existieron claras evidencias estadísticas donde la solución
vitrificadora PVS2 (Figura
8 A) es menos efectiva que la PVS3 (Figura
8 B) para el caso de los ápices de piña empleados. Esto se
manifiesta en los mayores valores de supervivencia a partir de los 180 min de
aplicadas las soluciones vitrificadoras durante la deshidratación de
los ápices. En el caso, de la supervivencia de los ápices crioconservados
también los máximos niveles se alcanzan con la solución
vitrificadora PVS3.
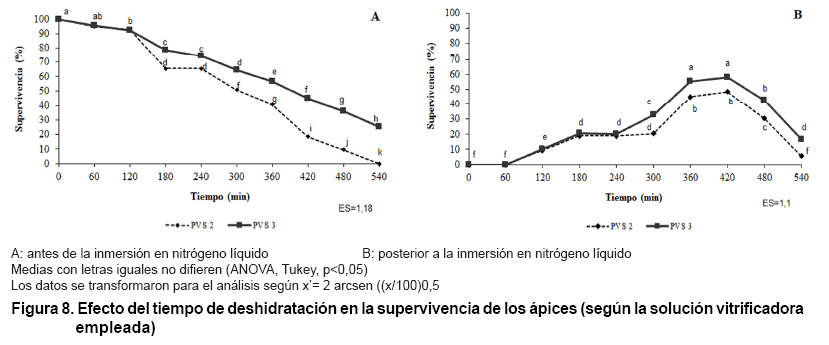
Lo anterior pudiera tener su explicación en que la solución PVS2
utiliza al compuesto químico dimetilsulfóxido que debe ser muy
bien investigado su empleo porque tiene efectos fisiológicos y mutagénicos
negativos para algunos materiales vegetales.
Los resultados negativos de tolerancia coinciden con lo informado para otros
sistemas biológicos y está asociado al alto grado de toxicidad
del dimetilsulfóxido (9) accesiones, se puede apreciar que el material
vegetal mantuvo un porcentaje de supervivencia entre 6,3 -65 %.
Con relación a lo anterior, en la Tabla
II se puede apreciar la aplicación de la estrategia criogénica
a nueve accesiones del banco de germoplasma in vitro, donde se pudo
comprobar la respuesta variada de los diferentes genotipos en la supervivencia
después de la crioconservación. El material vegetal durante el
proceso de crioconservación puede sufrir varios estreses entre los que
se encuentran cambios de pH, cambios mecánicos, deshidratación
(daños osmóticos), daños en la rehidratación, estrés
oxidativo y estrés por bajas temperaturas (30). Los porcentajes de supervivencia
alcanzados por los ápices de piña crioconservados pudrían
estar influenciados por alguno de estos estreses.

CONCLUSIONES
- Se
determinaron diferentes aspectos técnicos de una estrategia criogénica
para aumentar los niveles de supervivencia de los ápices a la inmersión
en nitrógeno líquido. Estos fueron: tipo de ápice compuesto
por 3-4 primordios foliares con un tamaño aproximado 2.5-3 mm; precultivo
en 0,3 mol L-1 de sacarosa; aplicación de la solución
de carga 0,4 mol L-1 sacarosa +2 mol L-1 de glicerol;
temperatura de aplicación de la solución vitrificadora PVS3
a 0 °C
durante 420 min. Mientras que en la visualización de los cambios estructurales
ocurridos en los ápices crioconservados se observó que las células
meristemáticas presentes en el domo apical y los primordios foliares
en formación, sufrieron pocas alteraciones celulares y mantuvieron
casi intactas sus características morfo-fisiológicas en las
mejores condiciones de supervivencia. Se aplicó de manera exitosa un
procedimiento de vitrificación para 9 accesiones del banco de germoplasma
in vitro del Centro de Bioplantas
Nota al
Pie
AThinh,
N. T. Cryopreservation of germplasm of vegetatively propagated tropical
monocots by vitrification. Doctoral Paper, Kobe University, Faculty of
Agriculture, Japan, 1997.
BIBLIOGRAFÍA
1. Rodríguez,
R.; Villalobo, A.; Pino, Y.; Concepción, O.; Martínez, E.; González,
J. y Santos, R.‘‘Rapid Introduction of ‘MD-2’ Pineapple Using Micropropagation’’.
Pineapple News, no. 19, 2012, p. 24.
2. Cerda, R. N. V. ‘‘Competitividad y Acceso Al Mercado Centroamericano De Piña
Producida en Nicaragua’’. REICE: Revista Electrónica de Investigación
en Ciencias Económicas, vol. 2, no. 3, 27 de agosto de 2014, pp.
188-207, ISSN 2308-782X, DOI 10.5377/reice.v2i3.1455.
3. Villalobo, A.; González, J.; Santos, R. y Rodríguez, R. ‘‘Morpho-physiological
changes in pineapple plantlets (Ananas comosus (L.) merr.) during acclimatization’’.
Ciência e Agrotecnologia, vol. 36, no. 6, diciembre de 2012,
pp. 624-630, ISSN 1413-7054, DOI 10.1590/S1413-70542012000600004.
4. Martinez-Montero, M. E. y Harding, K. ‘‘Cryobionomics: Evaluating the Concept
in Plant Cryopreservation’’ [en línea]. En: eds. Barh D., Khan M. S.,
y Davies E., PlantOmics: The Omics of Plant Science, edit. Springer
India, 2015, pp. 655-682, ISBN 978-81-322-2171-5, DOI: 10.1007/978-81-322-2172-2_23,
[Consultado: 30 de enero de 2016], Disponible en: <http://link.springer.com/chapter/10.1007/978-81-322-2172-2_23>.
5. Engelmann, F. ‘‘Use of biotechnologies for the conservation of plant biodiversity’’.
In Vitro Cellular & Developmental Biology - Plant, vol. 47, no.
1, 3 de noviembre de 2010, pp. 5-16, ISSN 1054-5476, 1475-2689, DOI 10.1007/s11627-010-9327-2.
6. Food and Agriculture Organization of the United Nations. The Role of
Biotechnology in Exploring and Protecting Agricultural Genetic Resources.
edit. Food & Agriculture Organization, 2006, 208 p., ISBN 978-92-5-105480-2.
7. Martinez-Montero, M. E.; Martinez, J. y Engelmann, F. ‘‘Cryopreservation
of Sugarcane Somatic Embryos’’. Cryoletters, vol. 29, no. 3, 1 de mayo
de 2008, pp. 229-242, ISSN 0143-2044.
8. Raven, P. H.; Guerrant, E. O.; Havens, K. y Maunder, M. Ex situ Plant
Conservation: Supporting Species Survival In The Wild. edit. Island Press,
22 de febrero de 2013, 536 p., ISBN 978-1-59726-756-4.
9. Raven, P. y Havens, K. ‘‘Ex Situ Plant Conservation and Cryopreservation:
Breakthroughs in Tropical Plant Conservation’’. International Journal of
Plant Sciences, vol. 175, no. 1, 2014, pp. 1-2, ISSN 1058-5893, DOI 10.1086/674030.
10. Benson, E. E.; Betsou, F.; Fuller, B. J.; Harding, K. y Kofanova, O. ‘‘Translating
Cryobiology Principles into Trans-Disciplinary Storage Guidelines for Biorepositories
and Biobanks: A Concept Paper’’. Cryoletters, vol. 34, no. 3, 1 de
mayo de 2013, pp. 277-312, ISSN 0143-2044.
11. Vendrame, W.; Faria, R. T. de; Sorace, M. y Sahyun, S. A. ‘‘Orchid cryopreservation’’.
Ciência e Agrotecnologia, vol. 38, no. 3, junio de 2014, pp.
213-229, ISSN 1413-7054, DOI 10.1590/S1413-70542014000300001.
12. Matsumoto, T.; Yamamoto, S.; Fukui, K.; Rafique, T.; Engelmann, F. y Niino,
T. ‘‘Cryopreservation of Persimmon Shoot Tips from Dormant Buds Using the D
Cryo-plate Technique’’. The Horticulture Journal, vol. Advance Publication,
2015, ISSN 2189-0110, 2189-0102, DOI 10.2503/hortj.MI-043.
13. Berjak, P.; Bartels, P.; Benson, E. E.; Harding, K.; Mycock, D. J.; Pammenter,
N. W.; Sershen y Wesley-Smith, J. ‘‘Cryoconservation of South African plant
genetic diversity’’. In Vitro Cellular & Developmental Biology - Plant,
vol. 47, no. 1, 26 de octubre de 2010, pp. 65-81, ISSN 1054-5476, 1475-2689,
DOI 10.1007/s11627-010-9317-4.
14. Marco, M. A. y Serrano, M. F. ‘‘Crioconservación: herramienta para
la conservación ex situ de material vegetal’’. Cuadernos de Biodiversidad,
no. 38, 2012, pp. 9-12, ISSN 1575-5495, 2254-612X, DOI 10.14198/cdbio.2012.38.03.
15. González, A. M. T. y Engelmann, F. Crioconservación de
plantas en América Latina y el Caribe. edit. Instituto Interamericano
de Cooperación para la Agricultura, San José, C.R., 2013, 204
p., ISBN 978-92-9248-446-0.
16. Morris, G. J. y Acton, E. ‘‘Controlled ice nucleation in cryopreservation
– A review’’. Cryobiology, vol. 66, no. 2, abril de 2013, pp. 85-92,
ISSN 0011-2240, DOI 10.1016/j.cryobiol.2012.11.007.
17. Gonzalez-Arnao, M. T.; Marquez, R. M.; Villavicencio, C. U.; Martinez, M.
M. E. y Engelmann, F. ‘‘Cryopreservation of pineapple (Ananas comosus)
apices by vitrification’’ [en línea]. En: eds. Engelmann F. y Takagi
H., Cryopreservation of tropical plant germplasm?: current research progress
and application, (ser. JIRCAS International Agriculture Series, no. ser.
8), edit. IPGRI, Rome, 2000, pp. 390-392, ISBN 978-92-9043-428-3, Centre IRD
de Bondy, [Consultado: 1 de febrero de 2016], Disponible en: <http://www.documentation.ird.fr/hor/fdi:010023396>.
18. Gámez-Pastrana, R.; Martínez-Ocampo, Y.; Beristain, C. I.
y González-Arnao, M. T. ‘‘An improved cryopreservation protocol for pineapple
apices using encapsulation-vitrification’’. Cryoletters, vol. 25, no.
6, 1 de noviembre de 2004, pp. 405-414, ISSN 0143-2044.
19. Hu, W.-H.; Liu, S.-F. y Liaw, S.-I. ‘‘Long-term Preconditioning of Plantlets:
a Practical Method for Enhancing Survival of Pineapple (Ananas Comosus
(l.) Merr.) Shoot Tips Cryopreserved Using Vitrification’’. Cryoletters,
vol. 36, no. 4, 1 de julio de 2015, pp. 226-236, ISSN 0143-2044.
20. Souza, F. V. D.; Kaya, E.; Vieira, L. de J.; Souza, E. H. de; Amorim, V.
B. de O.; Skogerboe, D.; Matsumoto, T.; Alves, A. A. C.; Ledo, C. A. da S. y
Jenderek, M. M. ‘‘Droplet-vitrification and morphohistological studies of cryopreserved
shoot tips of cultivated and wild pineapple genotypes’’. Plant Cell, Tissue
and Organ Culture (PCTOC), vol. 124, no. 2, 31 de octubre de 2015, pp.
351-360, ISSN 0167-6857, 1573-5044,
DOI 10.1007/s11240-015-0899-8.
21. Daquinta, M. y Benegas, R. ‘‘Brief review of tissue culture of pineapple’’.
Pineapple News, vol. 3, no. 7, 1997.
22. Murashige, T. y Skoog, F. ‘‘A Revised Medium for Rapid Growth and Bio Assays
with Tobacco Tissue Cultures’’. Physiologia Plantarum, vol. 15, no.
3, 1 de julio de 1962, pp. 473-497, ISSN 1399-3054, DOI 10.1111/j.1399-3054.1962.tb08052.x.
23. Martinez-Montero, M. E.; Engelmann, F. y Arnao, M. T. G. Cryopreservation
of Tropical Plant Germplasm with Vegetative Propagation - Review of Sugarcane
(Saccharum spp.) and Pineapple (Ananas Comusus (L.) Merrill) Cases. edit.
INTECH Open Access Publisher, 2012, 396 p., ISBN 978-953-51-0302-8.
24. Johansen, D. A. Plant Microtechnique. edit. McGraw-Hill, 1940,
544 p.
25. IBM SPSS Statistics [en línea]. versión 20, [Windows],
edit. IBM Corporation, U.S, 2011, Disponible en: <http://www.ibm.com>.
26. Panis, B. ‘‘Cryopreservation of Monocots’’ [en línea]. En: ed. Reed
B. M., Plant Cryopreservation: A Practical Guide, edit. Springer New
York, 2008, pp. 241-280, ISBN 978-0-387-72275-7, DOI: 10.1007/978-0-387-72276-4_11,
[Consultado: 1 de febrero de 2016], Disponible en: <http://link.springer.com/chapter/10.1007/978-0-387-72276-4_11>.
27. de los
Ángeles, T. M.; Román, M. I.; González, C.; Manzano, A.
R. y Mayor, Z. F. ‘‘Evaluación fenotipica y bioquímica de plantas
regeneradas de meristemos proliferantes crioconservados de plátano (Musa
spp.)’’. Agrotecnia de Cuba, vol. 35, no. 1, 2011, pp. 1–11, ISSN
2079-3472, 0568-3114.
28. Turner, S. R.; Senaratna, T.; Bunn, E.; Tan, B.; Dixon, K. W. y Touchell,
D. H. ‘‘Cryopreservation of shoot tips from six endangered Australian species
using a modified vitrification protocol’’. Annals of Botany, vol. 87,
no. 3, 2001, pp. 371–378, ISSN 1095-8290, 0305-7364.
29. Takagi, H. ‘‘Recent developments in cryopreservation of shoot apices of
tropical species’’. En: Proceedings of an international workshop, edit.
International Plant Genetic Resources Institute (IPGRI), Tsukuba, Japan, 2000,
pp. 178-193, ISBN 92-9043-428-7, CABDirect2, JIRCAS International Agriculture
Series No.8.
30. Kaczmarczyk, A.; Menon, A.; Al-Hanbali, A.; Funnekotter, B.; Bunn, E.; Phang,
P. Y. y Mancera, R. L. Current Issues in Plant Cryopreservation. edit.
INTECH Open Access Publisher, 2012, book p., ISBN 978-953-51-0191-8.
Recibido:
15 de mayo de 2015
Aceptado: 28 de enero de 2016
Ariel Villalobos
Olivera, Universidad de Ciego de Ávila (UNICA), Cuba. Email: ariel@unica.cu









