Efecto de la madurez en la crioconservación de semillas de Nicotiana tabacum L.
Effect of the ripening in the cryopreservation of the Nicotiana tabacum L. seeds
Juan L. Pérez-Rodríguez,I Gilberto Torrecilla Guerra,I Otilio Ruiz Padrón,I René C. Rodríguez Escriba,II Gustavo Y. Lorente González,II Marcos E. Martínez-Montero,II Justo L. González OlmedoII
IEstación
Experimental del Tabaco. carretera Santa Lucía, km 2, Cabaiguán, CP: 62410,
Sancti Spíritus, Cuba.
IICentro de Bioplantas, Universidad de Ciego de Ávila, carretera
Morón km 9, Ciego de Ávila, CP 69450, Ciego de Ávila, Cuba.
RESUMEN
La presente investigación tuvo como objetivo determinar el efecto de la madurez en la crioconservación de semillas de Nicotiana tabacum L. cv Sancti Spíritus 96 (SS-96). El estudio se realizó en la Estación experimental del tabaco de Cabaiguán, Sancti Spíritus, perteneciente al Instituto de Investigaciones del Tabaco, entre los años 2012 y 2014. Las semillas de SS-96 se colectaron a los 14, 21, 28, 35, 42, 49 y 56 días después de la antesis (DDA) y se les determinó masa fresca y masa seca de 1000 semillas, porcentaje de humedad (base masa fresca) y potencia germinativa (PG), además de evaluar su tolerancia a la desecación. Al mismo tiempo, semillas de cada día de colecta se conservaron a 5 ºC o en nitrógeno líquido y, transcurridos 30 días, les fue evaluada su PG y se sometieron a las pruebas de envejecimiento acelerado y pérdida de electrólitos. Durante el desarrollo de la investigación se determinó que la madurez fisiológica de las semillas de SS-96 se alcanza a los 29,6 DDA, con un contenido de agua de 30,6 % y masa seca de 1000 semillas de 81,2 mg. Se estableció 35 DDA como el momento idóneo para la colecta de semillas en este cultivar. Una colecta antes de esta fecha provoca una disminución en la tolerancia a la desecación producto de la inmadurez de las semillas; una recolección posterior conlleva a la pérdida de vigor debido a la mayor exposición de las semillas a las condiciones ambientales.
Palabras clave: antesis, conservación, desecación, vigor.
ABSTRACT
The main objective of this investigation was to determine the effect of the ripening in the cryopreservation of the Nicotiana tabacum L seeds. cv Sancti Spíritus 96 (SS-96). This study was done between the years 2012 and 2014, at the Tobacco experimental station located in Cabaiguan, Sancti Spiritus. SS-96 seeds were harvest at the 14, 21, 28, 35, 42, 49 and 56 days after the anthesis (DAA), determining the fresh and dry mass to over 1000 seeds, the humidity percentage (fresh mass) and germinating power (GP), as well as evaluate the tolerance of it to desiccation. At the same time, seeds collected every day, were conserved in 5 ºC or liquid nitrogen, and within 30 days, its GP was evaluated and put under accelerated aging and electrolyte leakage tests. During the research it was determined that the physiological ripeness of SS-96 seeds is reached at 29,6 DAA, with a 30,6 % of water and a dry mass of 1000 seeds of 81,2 mg of weight. 35 DAA were established as the optimum momentum for the harvest. The anticipation of the recollection process will end up in a diminishing the desiccation tolerance levels due to the lack of ripeness of seeds; meanwhile a late recollection ends up in lack of potency due to a larger exposure to the environment.
Key words: anthesis, conservation, desiccation, vigor.
INTRODUCCIÓN
La colección
de Nicotiana, presente en el banco de germoplasma del Instituto de Investigaciones
del Tabaco de Cuba, progresa constantemente con nuevas variedades y especies
(1). Conservar a largo plazo la variabilidad genética del género
es de vital importancia con el fin de introducir genes de valor en las variedades
comerciales (2) y reconstruir o reforzar las poblaciones in situA.
Desde la década de los 80 del pasado siglo, a nivel mundial se han realizado
varias investigaciones en la crioconservación como alternativa a los
métodos tradicionales de almacenamiento de semillas (3, 4). Las técnicas
de crioconservación utilizan normalmente nitrógeno líquido
(–196 ºC) debido a su costo relativamente bajo. El objetivo es alcanzar
temperaturas inferiores a –130 ºC para lograr condiciones de baja energía
cinética molecular y una difusión extremadamente lenta, de tal
forma que las reacciones químicas se encuentren prácticamente
paralizadas (5); bajo estas condiciones, se postulan longevidades extremadamente
largas (3).
Basados en experimentos de almacenamiento llevados durante 10 años y
a partir de la ecuación de viabilidad, Walters et al (3). pronosticaron
una viabilidad de 3,400 años para semillas de lechuga conservadas a -196
ºC. Por consiguiente, la crioconservación puede ser de gran utilidad
en la conservación de las colecciones bases y duplicado en los bancos
de germoplasmas de semillas, sin dejar de lado las condiciones clásicas,
útiles para el almacenamiento a corto plazo (colección activa)
(5).
Se ha demostrado desde los años 60 del pasado siglo que la diversidad
genética puede ser preservada en los bancos de germoplasma. En el nuevo
siglo la pregunta cambia de ¨si¨ es viable a ¨cómo¨ optimizar
el proceso de conservación (6). La madurez con que se colectan y conservan
las semillas se identifica como determinante en su longevidad (7, 8, 9). El
objetivo de la investigación estuvo dirigido a determinar el efecto de
la madurez en la germinación y el vigor de semillas crioconservadas de
Nicotiana tabacum L.
MATERIALES Y MÉTODOS
El estudio se
realizó en la Estación Experimental del Tabaco de Cabaiguán,
perteneciente al Instituto de Investigaciones del Tabaco de Cuba, durante las
campañas tabacaleras 2012-2013 y 2013-2014. Para la realización
de la investigación se seleccionó la accesión Nicotiana
tabacum Linnaeus cultivar Sancti Spíritus 96 (SS-96). Este cultivar
presenta alto potencial productivo (2 906 kg ha-1), magnífica
calidad (444 kg ha-1, en clases superiores) y excelente combustibilidad
(>20 s). Es uno de los cultivares más plantados en la región
central y oriental del país (10).
Las semillas de SS-96 se sembraron en bandejas de polietileno expandido con
sustrato orgánico con composición según investigacines
anteriores (11), basadas en la tecnología de producción de posturas
en bandejas flotantes descrita por García y Andino (12). El trasplante
de las posturas al campo se realizó a los 45 días. La distancia
de plantación fue de 30 cm entre plantas y 180 cm entre hileras, y la
fertilización, riego y cuidados fitosanitarios se realizaron según
lo establecido por el instructivo técnico del cultivo (13). La colecta
se realizó a intervalos de siete días, a los 14, 21, 28, 35, 42,
49 y 56 días después de la antesis (DDA). Para cada día
de colecta se determinó masa fresca y masa seca de 1000 semillas.
Los ensayos de humedad se realizaron empleando el método de secado al
horno a temperatura baja constante (14), a una temperatura de 103 °C durante
4 h con tres repeticiones de 0,5 g de semillas cada una. El contenido de humedad
se expresó en porcentaje de masa fresca.
En los ensayos de germinación se realizaron cuatro repeticiones de 100
semillas cada una. Las semillas se colocaron en placas Petri de 9 cm de diámetro
sobre dos discos de papel de filtro humedecidos con 5 mL de agua destilada.
La incubación se realizó a 27±2 ºC con un fotoperiodo
de 12 h y una intensidad de 350 µmol m-2 s-1. En
todos los ensayos la emergencia de la radícula fue el criterio para considerar
que la germinación de la semilla había tenido lugar. La potencia
germinativa (PG) se determinó a los 14 días después de
embebidas las semillas, al contar el número de semillas germinadas durante
ese intervalo de tiempo entre el total de semillas (14).
Para evitar los daños de imbibición, previo a los ensayos de germinación,
las semillas con más de 35 DDA se humidificaron dispersándolas
de manera uniforme en placas Petri sin tapa. Seguidamente, se introdujeron en
una desecadora de vidrio con H2O en su interior, evitando el contacto
directo de las semillas con el agua. Las semillas se incubaron bajo estas condiciones
hasta alcanzar un contenido de humedad superior al 14 %.
Con el propósito de ilustrar el papel de la síntesis de determinados
metabolitos en la tolerancia a la desecación de semillas de SS-96 se
evaluó para cada día de colecta los valores de PG medidos solo
después de deshidratar las semillas hasta valores de 10,0; 7,5; 5,0 y
2,5 % de humedad. La deshidratación se realizó mediante la exposición
al agente desecante silicagel autoindicador, en desecadoras de vidrio cerradas
herméticamente a temperatura ambiente, en proporción 1:3 (masa
de semillas: masa silicagel autoindicador). El tiempo de exposición al
agente desecante estuvo determinado por la intensidad de la desecación
requerida.
Para determinar el efecto del momento de colecta en la germinación y
el vigor de las semillas crioconservadas de SS-96 muestras de semillas colectadas
a los diferentes DDA se dividieron en dos porciones de igual masa. Una porción
se introdujo directamente en una cámara de refrigeración a 5 ºC
(no crioconservadas) y la otra en tanques con nitrógeno líquido
(crioconservadas). Transcurridos 30 días los crioviales se retiraron
y se dejó que la temperatura estuviera en equilibrio con la temperatura
ambiente. A cada muestra se les determinó su PG y se sometieron a las
pruebas de envejecimiento acelerado (EA) y escape de electrólitos (EE).
Para la realización de las pruebas de EA y EE las semillas fueron previamente
acondicionadas. Según el porcentaje de humedad, las semillas se secaron
o hidrataron hasta alcanzar un 14 % de humedad. La prueba de EA se realizó
según la metodología descrita por Pérez-RodríguezB.
El ensayo se realizó hasta disminuir la germinación a un valor
inferior al 50 % de la PG inicial. Entonces, para cada intervalo se calculó
el tiempo transcurrido para que cada muestra alcanzara el 50 % de la germinación
inicial (T50) (15). La prueba de EE se realizó con algunas modificaciones
(16). Para cada muestra se colocaron cuatro repeticiones con 0,15 g de semillas
cada una en 35 ml de agua desionizada a 30±0,5 ºC. Los lixiviados
se recogieron después de 24 h de imbibición y la conductividad
se midió con un medidor de conductividad.
En el procesamiento estadístico de los datos se utilizó el Statistical
Package for Social Sciences (17). Se comprobó el ajuste a la distribución
normal de los datos de cada tratamiento (Kolmogorov-Smirnov) y la homogeneidad
de las varianzas (Levene). Se realizó un Análisis de Varianza
(ANOVA) para determinar las posibles diferencias significativas entre las medias
y para discriminar entre estas se utilizó el procedimiento de diferencia
honestamente significativa (HSD) de Tukey. En algunos casos fue necesaria la
transformación de los datos para lograr los supuestos de las pruebas
paramétricas realizadas. Cada tabla y figura de la sección Resultados
y Discusión describe el tratamiento estadístico específico
ejecutado.
RESULTADOS Y DISCUSIÓN
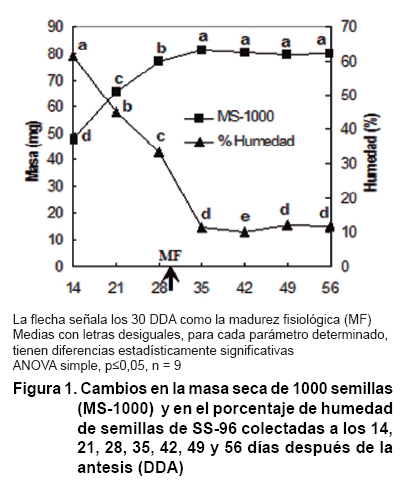
Durante la fase inicial de desarrollo de las semillas de SS-96 la humedad desciende rápidamente (Figura 1), desde 61 % a los 14 DDA hasta valores inferiores al 11 % a los 35 DDA; aunque entre los 28 DDA y 35 DDA este descenso se hace más acentuado. La masa seca de 1000 semillas (MS-1000) aumenta de forma aproximadamente lineal. Sin embargo, a partir de los 35 DDA tanto la MS-1000 como la humedad tienden a permanecer constantes; comportamiento que se mantiene hasta los 56 DDA. Las semillas alcanzan su madurez fisiológica (MF) a los 30 DDA, determinada según procedimiento descrito por Sanhew y Ellis (18), con humedad de 28 % y MS-1000 de 81 mg (Figura 1). A partir de ese momento la masa seca tiende a permanecer prácticamente constante hasta los 56 DDA.
Las variables
cuantitativas referidas se correlacionan con el estado de desarrollo de semillas
ortodoxas dicotiledoneas en otras especies (19). Existe relación entre
la ganancia de masa seca, la humedad y la PG con el estado o etapa de desarrollo
de la semillaC.
Por lo tanto, es posible relacionar con cierta aproximación el desarrollo
morfológico de semillas de SS-96, con los valores obtenidos de estas
variables, analizadas en conjunto.
En el estado inicial de desarrollo (hasta los 14 DDA), existe un aumento progresivo
de la masa seca, producto de la formación del embrión. No obstante,
las semillas no poseen las reservas necesarias para germinar (20), razón
por la cual la PG de las semillas de SS-96 frescas, las no crioconservadas y
las crioconservadas, fue cero (Figura 2).
Al avanzar el
estudio, la PG de las semillas frescas se incrementa significativamente hacia
los 21 DDA. Resultado similar muestran las semillas no crioconservadas, aunque
en este caso la germinación alcanza valores significativamente superiores
solo a partir de los 28 DDA (Figura
2).
Sin embargo, la semilla crioconservada presenta un comportamiento diferente
en la primera parte del estudio al compararla con los demás tratamientos
analizados (Figura 2).
Mientras que para las semillas frescas y las no crioconservadas se incrementa
rápidamente la PG a
partir de los 14 DDA, la germinación de las crioconservadas apenas alcanza
un 10,5 % a los 28 DDA y solo toma valores semejantes a los restantes tratamientos
a partir de los 35 DDA.
Las semillas inmaduras carecen de metabolitos indispensables en su longevidad
durante la conservación (Ej: proteínas LEA ) (21, 22), ácidos
ribonucleicos mensajeros (ARNm), requeridos para la síntesis
de proteínas durante el proceso de germinación y azúcares
(9)). La baja concentración de estos metabolitos en estadíos tempranos
de desarrollo de las semillas de SS-96 pudiera ser el origen del descenso en
la PG durante los 30 días de almacenamiento de la semilla no crioconservada
al compararla con la semilla fresca, ambas colectadas a los 21 DDA.
Asimismo, la causa principal de la menor PG de las semillas crioconservadas
pudiera estar relacionada con el alto porcentaje de humedad todavía presente
en ellas al alcanzar los 28 DDA. Los cristales de hielo, formados principalmente
durante el descongelamiento después de la exposición al NL (9),
por su conformación espacial, causan daños en las membranas celulares.
Además, al ocurrir el desplazamiento del agua para la formación
de hielo extracelular, la concentración intracelular de soluto se eleva
paulatinamente y pone en peligro el funcionamiento a nivel celular (7, 23).
Las semillas de SS-96 poco después de alcanzar la madurez fisiológica
(30 DDA), sufren una acelerada pérdida de agua. En esta etapa la conexión
vascular con la planta madre disminuye (24), con lo cual el porcentaje de humedad
en la semilla desciende rápidamente hasta alcanzar el equilibrio con
la humedad del ambiente (Figura
1). Esta tolerancia a la desecación se correlaciona en otras especies
con la presencia de proteínas LEA (21, 22) y de azúcares (9, 16).
Las LEA, son un grupo de proteínas altamente hidrofílicas que
se acumulan en semillas durante los estados finales de la formación del
embrión (9, 25, 26) y que junto a azúcares como la rafinosa y
trealosa juegan un papel importante en la formación intracelular del
estado vítreo y en la protección de las membranas celulares (9,
21, 22).
El estado vitreo posee características similares a las de un sólido,
como son la disminución del movimiento molecular, pero con las propiedades
de un líquido (9). Debido a que la viscosidad del citoplasma al vitrificar
es extremadamente alta, se evita la fusión entre sistemas de membranas
y cambios conformacionales en las proteínas. Además, se reduce
considerablemente la velocidad de las reacciones de envejecimiento y la formación
de cristales de hielo (23, 25). Esta es la causa fundamental por la cual la
PG alcanza valores significativamente superiores para todos los tratamientos
a partir de los 35 DDA.
Por otro lado, al ser desecada la semilla colectada a los 21 DDA hasta un 10
% de humedad disminuye significativamente su PG, la cual desciende abruptamente
al continuar el secado hasta valores de 7,5 y 5 % y se hace nula al ser desecada
de forma extrema a 2,5 % (Figura 3). Sin embargo, para la
semilla colectada a los 28 DDA el descenso de la PG solo se hace significativa
al desecar hasta un 5 % y para la colectada a los 35 DDA no hubo diferencias
significativas en su PG, incluso a valores de humedad de 2,5 %. Resultados similares
a los 35 DDA se obtienen al desecar mediante el mismo procedimiento ilustrado
en la Figura 3 a las
semillas colectadas a los 42, 49 y 56 DDA.
Este resultado
está en estrecha relación con los valores de MS-1000 y humedad
mostrados en la Figura
1. Varios de los compuestos sintetizados en la semilla durante esta etapa
(entre los 30 DDA y 35 DDA para semillas de SS-96), además de su correspondencia
con la adquisición de la tolerancia a la desecación, se vinculan
con una mayor longevidad de las semillas durante su almacenamiento (15, 20).
Así, considerando los tratamientos evaluados, no es posible una colecta
adecuada de la semilla antes de los 35 DDA, sin tomar una semilla inmadura,
que durante el almacenamiento a largo plazo pierda de forma temprana su viabilidad.
A pesar de lo antes expuesto, no es posible seleccionar el mejor momento de
colecta posterior a los 35 DDA tomando como base los resultados de MS-1000,
humedad, PG y tolerancia a la desecación (Figuras
1, 2 y 3).
Se utilizaron indicadores de vigor como discriminantes al predecir la influencia
de las condiciones de conservación en la longevidad de las semillas (16,
18). En el presente estudio el vigor fue evaluado mediante las pruebas EE y
EA (16, 18).
Las pruebas de envejecimiento acelerado pueden brindar, en intervalos cortos
de tiempo, información valiosa sobre las condiciones de conservación
más adecuadas para lograr mayor longevidad en las semillas de una especie
dada (27). En la Figura
4 se observa un mínimo en la conductividad de los lixiviados y un
aumento del tiempo para alcanzar el 50 % de la germinación inicial (T50)
de semillas de SS-96 hacia los 35 DDA. Los 35 DDA constituyen la primera medición
realizada en el estudio a las semillas de SS-96 después de adquirir estas
la MF. Además, al alcanzar este estado de desarrollo la humedad de las
semillas se reduce hasta valores inferiores al 11 %. Ambos hechos están
en concordancia con una mayor integridad de las membranas celulares y, por lo
tanto, con el vigor mostrado (23).
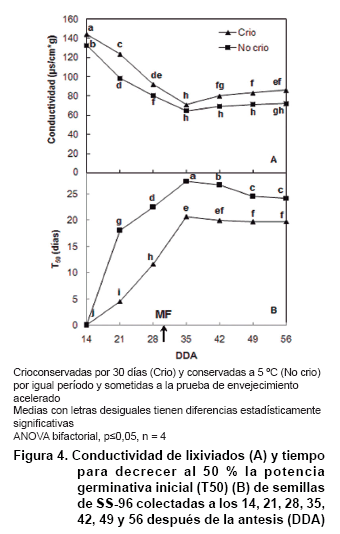
Igualmente, es de destacar el aumento en el EE y en la sensibilidad de las semillas
a la prueba de EA posterior a los 35 DDA, tanto las crioconservadas como las
no crioconservadas. Este comportamiento sugiere una pérdida de vigor
si las semillas no son colectadas inmediatamente después de la acelerada
pérdida en el contenido de agua, posterior a la MF. Este comportamiento
pudiera ser consecuencia del efecto de una mayor exposición de las semillas
a las condiciones ambientales (elevada temperatura y humedad), las que pudieran
acelerar las reacciones de envejecimiento (16).
De forma general, las semillas de SS-96 no crioconservadas tuvieron un mayor
vigor que las crioconservadas. Sin duda, el elevado contenido de humedad presente
en las semillas, muy por encima de lo normado (entre 5 y 7 %) (14), provoca
un aumento en el EE y en la sensibilidad de las semillas a la prueba de EA (24).
Se hace necesario comprobar en futuras investigaciones el efecto del porcentaje
de humedad en la longevidad de las semillas crioconservadas, como un factor
determinante (7, 16, 28).
No se tiene conocimiento en la literatura consultada de un estudio de la influencia
de la madurez en la crioconservación de semillas. Tampoco se encontraron
evidencias de una investigación semejante, al menos dirigida a la semilla
fresca, en el género Nicotiana. Sin embargo, comportamiento similar al
mostrado por las semillas frescas de SS-96 durante su desarrollo se reportó
en semillas de frijol (16, 18), arabidopsis (29) y tomate (30). En todos los
casos existe coincidencia que el momento donde la humedad de la semilla alcanza
el equilibrio con la humedad ambiental, posterior a la MF y la pérdida
acelerada en el contenido de agua (en la vecindad de los 35 DDA en este estudio),
es el mejor momento para colecta.
CONCLUSIONES
Nota al Pie
ABacchetta,
G.; Bueno, A.; Fenu, G.; Jiménez-Alfaro, B.; Mattana, E.; Piotto, B.
y Virevaire, M. Conservación ex situ de plantas silvestres.
edit. Principado de Asturias, La Caixa, 2008, 375 p.
BPérez,
R. J. L. Crioconservación de semillas de Nicotiana tabacum cv Sancti
Spíritus 96. [Tesis de Maestría], Universidad de Ciego de
Ávila Máximo Gómez Báez, Ciego de Ávila,
Cuba, 2014, 70 p.
CZhu,
H. The Effect of Drying on Desiccation Tolerance and Late Embryogenesis
Abundant Protein Gene Expression in Immature Seeds of Phalaenopsis amabilis
[en línea]. [Master These], Grand Valley State University, Michigan,
USA, 2014, 714 p., [Consultado: 1 de febrero de 2016], Disponible en:
<http://scholarworks.gvsu.edu/theses/714>.
BIBLIOGRAFÍA
1. Torrecilla,
G.; Cabrera, M. y Pérez-Rodríguez, J. L. ‘‘Principales descriptores
para la caracterización morfo-agronómica del género Nicotiana’’.
Cuba Tabaco, vol. 13, no. 2, 2012, pp. 44-50, ISSN 0138-7456.
2. Tesfaw, A. y Feyissa, T. ‘‘Current trends in genetic manipulations to enhance
abiotic and biotic stresses in tobacco’’. African Journal of Biotechnology,
vol. 13, no. 21, 2015, pp. 2095-20102, ISSN 1684-5315, DOI 10.4314/ajb.v13i21.
3. Walters, C.; Wheeler, L. y Stanwood, P. C. ‘‘Longevity of cryogenically stored
seeds’’. Cryobiology, vol. 48, no. 3, junio de 2004, pp. 229-244, ISSN
0011-2240, DOI 10.1016/j.cryobiol.2004.01.007.
4. Veiga-Barbosa, L.; Mira, S.; González-Benito, M. E.; Souza, M. M.;
Meletti, L. M. M. y Pérez-García, F. ‘‘Seed germination, desiccation
tolerance and cryopreservation of Passiflora species’’. Seed Science
and Technology, vol. 41, no. 1, 1 de abril de 2013, pp. 89-97, ISSN 0251-0952,
1819-5717, DOI 10.15258/sst.2013.41.1.08.
5. Cejas, I.; Vives, K.; Laudat, T.; González-Olmedo, J.; Engelmann,
F.; Martínez-Montero, M. E. y Lorenzo, J. C. ‘‘Effects of cryopreservation
of Phaseolus vulgaris L. seeds on early stages of germination’’.
Plant Cell Reports, vol. 31, no. 11, 28 de julio de 2012, pp. 2065-2073,
ISSN 0721-7714, 1432-203X, DOI 10.1007/s00299-012-1317-x.
6. Walters, C. ‘‘Optimising seed banking procedures’’. En: Smith R. D., Seed
Conservation: Turning Science Into Practice, edit. Royal Botanic Gardens,
Kew, 2003, pp. 725-743, ISBN 978-1-84246-052-8.
7. Walters, C.; Ballesteros, D. y Vertucci, V. A. ‘‘Structural mechanics of
seed deterioration: Standing the test of time’’. Plant Science, vol.
179, no. 6, diciembre de 2010, (ser. Translational Seed Biology: From Model
Systems to Crop Improvement), pp. 565-573, ISSN 0168-9452, DOI 10.1016/j.plantsci.2010.06.016.
8. Rajjou, L.; Duval, M.; Gallardo, K.; Catusse, J.; Bally, J.; Job, C. y Job,
D. ‘‘Seed Germination and Vigor’’. Annual Review of Plant Biology,
vol. 63, no. 1, 2012, pp. 507-533, ISSN 1545-2123, 1543-5008, DOI 10.1146/annurev-arplant-042811-105550,
PMID: 22136565.
9. Verdier, J.; Lalanne, D.; Pelletier, S.; Torres-Jerez, I.; Righetti, K.;
Bandyopadhyay, K.; Leprince, O.; Chatelain, E.; Vu, B. L.; Gouzy, J.; Gamas,
P.; Udvardi, M. K. y Buitink, J. ‘‘A Regulatory Network-Based Approach Dissects
Late Maturation Processes Related to the Acquisition of Desiccation Tolerance
and Longevity of Medicago truncatula Seeds’’. Plant Physiology,
vol. 163, no. 2, 1 de octubre de 2013, pp. 757-774, ISSN 1532-2548, DOI 10.1104/pp.113.222380,
PMID: 23929721.
10. Pino, A. L. ‘‘Sancti Spiritus 96 «Variedad de tabaco negro resistente
al moho azul (Peronospora hyoscyami de bary f. sp. tabacina), a la
pata prieta (Phytophthora nicotianae breda de hann), al virus del mosaico
del tabaco (tmv) y su homólogo androestéril Sancti Spiritus 96»’’.
Cuba Tabaco, vol. 8, no. 2, 2007, pp. 58-59, ISSN 0138-7456.
11. Hernández, Y.; León, Y.; Hernández, J. M. y Monroy,
A. L. ‘‘Nuevos sustratos para la producción de plántulas de tabaco
en semilleros flotantes’’. Cuba Tabaco, vol. 5, no. 2, 2004, pp. 15-19,
ISSN 0138-7456.
12. García, M. y Andino, V. ‘‘Tecnología de bandejas flotantes
en la producción de plántulas de tabaco en Cuba’’. Cuba Tabaco,
vol. 3, no. 1, 2002, pp. 30-33, ISSN 0138-7456.
13. Espino, E. M.; Uriarte, B. E.; Cordero, P. L.; Rodríguez, N.; Izquierdo,
A.; Blanco, L. E.; Hernández, J. M.; Quintana, G.; Benítez, O.;
Ibizate, J. y Díaz, M. Instructivo técnico para el cultivo
del tabaco en Cuba. edit. Instituto de Investigaciones del Tabaco, Artemisa,
Cuba, 2012, 147 p., ISBN 978-959-7212-07-2.
14. Engels, J. M. M. y Visser, L. Guía para el manejo eficaz de un
banco de germoplasma. (ser. Manuales de Bioversity para Bancos de Germoplasma,
no. ser. 6), edit. Bioversity International, 2007, 209 p., ISBN 978-92-9043-767-3.
15. Pu, X.; Huang, Y. F.; Pan, C. L.; Yao, L.; Ai, X. R. y Deng, Z. J. ‘‘Effects
of temperature, light, desiccation and cold storage on germination of Sophora
tonkinensis (Leguminosae) seeds’’. African Journal of Biotechnology,
vol. 14, no. 12, 2015, pp. 1015-1019, ISSN 1684-5315, DOI 10.4314/ajb.v14i12.
16. Bailly, C.; Audigier, C.; Ladonne, F.; Wagner, M. H.; Coste, F.; Corbineau,
F. y Côme, D. ‘‘Changes in oligosaccharide content and antioxidant enzyme
activities in developing bean seeds as related to acquisition of drying tolerance
and seed quality’’. Journal of Experimental Botany, vol. 52, no. 357,
15 de abril de 2001, pp. 701-708, ISSN 0022-0957, 1460-2431, DOI 10.1093/jexbot/52.357.701,
PMID: 11413206.
17. IBM SPSS Statistics [en línea]. versión 20, [Windows],
edit. IBM Corporation, U.S, 2011, Disponible en: <http://www.ibm.com>.
18. Sanhewe, A. J. y Ellis, R. H. ‘‘Seed development and maturation in Phaseolus
vulgaris I. Ability to germinate and to tolerate desiccation’’. Journal
of Experimental Botany, vol. 47, no. 7, 7 de enero de 1996, pp. 949-958,
ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/47.7.949.
19. Jolivet, P.; Boulard, C.; Bellamy, A.; Valot, B.; d’Andréa, S.; Zivy,
M.; Nesi, N. y Chardot, T. ‘‘Oil body proteins sequentially accumulate throughout
seed development in Brassica napus’’. Journal of Plant Physiology,
vol. 168, no. 17, 15 de noviembre de 2011, pp. 2015-2020,
ISSN 0176-1617, DOI 10.1016/j.jplph.2011.06.007.
20. Sumathi, S. y Srimathi, P. ‘‘Seed development and maturation studies in
Chinese medicinal plant babchi (Psoralea corylifolia)’’. Seed Science
and Technology, vol. 43, no. 1, 1 de abril de 2015, pp. 80-89, ISSN 0251-0952,
1819-5717, DOI 10.15258/sst.2015.43.1.09.
21. Delahaie, J.; Hundertmark, M.; Bove, J.; Leprince, O.; Rogniaux, H. y Buitink,
J. ‘‘LEA polypeptide profiling of recalcitrant and orthodox legume seeds reveals
ABI3-regulated LEA protein abundance linked to desiccation tolerance’’. Journal
of Experimental Botany, vol. 64, no. 14, 11 de enero de 2013, pp. 4559-4573,
ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/ert274, PMID: 24043848.
22. Liu, Y.; Wang, L.; Jiang, S.; Pan, J.; Cai, G. y Li, D. ‘‘Group 5 LEA protein,
ZmLEA5C, enhance tolerance to osmotic and low temperature stresses
in transgenic tobacco and yeast’’. Plant Physiology and Biochemistry,
vol. 84, noviembre de 2014, pp. 22-31, ISSN 0981-9428, DOI 10.1016/j.plaphy.2014.08.016.
23. Kaviani, B. ‘‘Conservation of plant genetic resources by cryopreservation’’.
Australian Journal of Crop Science, vol. 5, no. 6, 2011, p. 778, ISSN
1835-2707.
24. Sreenivasulu, N. y Wobus, U. ‘‘Seed-Development Programs: A Systems Biology–Based
Comparison Between Dicots and Monocots’’. Annual Review of Plant Biology,
vol. 64, no. 1, 29 de abril de 2013, pp. 189-217, ISSN 1543-5008, 1545-2123,
DOI 10.1146/annurev-arplant-050312-120215.
25. Battaglia, M.; Olvera-Carrillo, Y.; Garciarrubio, A.; Campos, F. y Covarrubias,
A. A. ‘‘The enigmatic LEA proteins and other hydrophilins’’. Plant Physiology,
vol. 148, no. 1, 2008, pp. 6–24, ISSN 0032-0889.
26. Chatelain, E.; Hundertmark, M.; Leprince, O.; Gall, S. L.; Satour, P.; Deligny-Penninck,
S.; Rogniaux, H. y Buitink, J. ‘‘Temporal profiling of the heat-stable proteome
during late maturation of Medicago truncatula seeds identifies a restricted
subset of late embryogenesis abundant proteins associated with longevity’’.
Plant, Cell & Environment, vol. 35, no. 8, 1 de agosto de 2012,
pp. 1440-1455, ISSN 1365-3040, DOI 10.1111/j.1365-3040.2012.02501.x.
27. Milosevic, M.; Vujakovic, M. y Karagic, D. ‘‘Vigour tests as indicators
of seed viability’’. Genetika, vol. 42, no. 1, 2010, pp. 103-118, ISSN
0534-0012, DOI 10.2298/GENSR1001103M.
28. Treuren, R. van; Groot, E. C. de y Hintum, T. J. L. van. ‘‘Preservation
of seed viability during 25 years of storage under standard genebank conditions’’.
Genetic Resources and Crop Evolution, vol. 60, no. 4, 17 de noviembre
de 2012, pp. 1407-1421, ISSN 0925-9864, 1573-5109, DOI 10.1007/s10722-012-9929-0.
29. Locascio, A.; Roig-Villanova, I.; Bernardi, J. y Varotto, S. ‘‘Current perspectives
on the hormonal control of seed development in Arabidopsis and maize: a focus
on auxin’’. Frontiers in Plant Science, vol. 5, 2014, p. 412, ISSN
1664-462X, DOI 10.3389/fpls.2014.00412, PMID: 25202316PMCID: PMC4142864.
30. Berry, T. y Bewley, J. D. ‘‘Comparisons between the roles of the fruit tissues,
osmoticum and abscisic acid in maintaining tomato seed development and storage
protein synthesis’’. Seed Science Research, vol. 3, no. 01, marzo de
1993, pp. 25–34, ISSN 1475-2735,
DOI 10.1017/S0960258500001537.
Recibido: 15 de
mayo de 2015
Aceptado: 27 de enero de 2016
Juan L. Pérez-Rodríguez, Estación Experimental del Tabaco. carretera Santa Lucía, km 2, Cabaiguán, CP: 62410, Sancti Spíritus, Cuba. Email: espec.banco@eetcab.co.cuAfiliación