Sistema
informático para contar semillas de Nicotiana tabacum
Computer
system to count seeds of Nicotiana tabacum
Yunieski
Martínez-Espinosa,I Juan L. Pérez-Rodríguez,II Cosme E.
Santiesteban-Toca,III Evelio L. Báez-PerezIII
IDepartamento
de Ciencias Informáticas, Universidad “Máximo Gómez Báez” de Ciego de Ávila,
carretera a Morón km 19 ½, Ciego de Ávila, Cuba, 65400.
IIEstación Experimental del Tabaco carretera Santa Lucía km 2. Cabaiguán,
Sancti Spíritus, Cuba.
IIILaboratorio de Informática Aplicada, Centro de Bioplantas, carretera
a Morón km 19 ½, Ciego de Ávila, Cuba, 65400.
RESUMEN
En Cuba, la conservación
de Nicotiana tabacum es de vital importancia debido a que constituye
uno de los principales rubros en la exportación y sustentabilidad de la economía
del país. La estación experimental de Cabaiguán en Sancti Spíritus, tiene entre
sus funciones la conservación del material genético de Nicotiana tabacum.
Debido al reducido tamaño de estas semillas (0,1-0,5 mm), su cuantificación
es uno de los principales problemas, observándose inconsistencia en el resultado
del conteo, alta tasa de error de un especialista a otro, labor intensiva y
pérdida de tiempo. Por tal motivo, se propone desarrollar un sistema informático
para la cuantificación de semillas de Nicotiana tabacum, basado en
técnicas de procesamiento digital de imágenes. Las imágenes de las semillas
se capturan en niveles de grises en un scanner convencional. La segmentación
de la imagen se realiza por umbralización a partir del histograma de frecuencia
de los niveles de grises. Las impurezas y ruidos en la imagen son eliminados
a partir del tamaño. Se calcula el tamaño medio de las semillas y el número
de semillas presente en cada clúster. Finalmente el número de semillas en la
imagen es determinado. Para evaluar la calidad y efectividad del sistema propuesto
se realizó una validación experimental en 15 imágenes conteniendo 1492 semillas,
para diferentes resoluciones (150 dpi, 300 dpi, 600 dpi y 1200 dpi). Los resultados
estadísticos demuestran la capacidad del sistema de contar las semillas con
una precisión superior al 99 % para las resoluciones iguales o superiores a
300 dpi.
Palabras
clave: calidad, material genético, procesamiento digital de imágenes.
ABSTRACT
In Cuba, conservation
of Nicotiana tabacum is vital because it is one of the main items on
the export and sustainability of the economy. The experimental station of Cabaiguán
in Sancti Spiritus, whose functions include the conservation of genetic material
from Nicotiana tabacum. Due to the small size of these seeds (0,1-0,5
mm), quantification has become one of the main problems, showing inconsistency
in results of the count (high error rate) of a specialist to another, labor
intensive and time lost. Therefore, it is propose to develop a computer system
for quantification of Nicotiana tabacum seeds, based on techniques
of digital image processing. Seedsimagesare captured ingray levelsina conventionalscanner.
Image segmentation is performed by thresholding the histogram from the frequency
of gray levels. Impurities and image noise are eliminated from size. The average
seed size and number of seeds present in each cluster is calculated. Finally,
the number of seeds in the image is determined. To assess the quality and effectiveness
of the proposed system an experimental validation was performed on 15 images
containing 1492 seeds for different resolutions (150 dpi, 300 dpi, 600 dpi and
1200 dpi). Statistical results prove the ability of the system to count seeds
with an accuracy above 99 % for the same or higher than 300 dpi resolutions.
Key words:
quality, genetic material, digital image processing.
INTRODUCCIÓN
En nuestro país,
el tabaco (Nicotiana tabacum Linneaus), históricamente es uno
de los productos agrícolas comercializables de mayor prestigio a nivel
mundial. Con el fin de conservar este material genético en cualquiera
de sus fórmulas reproductivas (semillas, esquejes, tubérculos,
etc.) se han creado los “bancos de germoplasma”. Cuya misión consiste
en ubicar, recolectar, conservar y caracterizar el plasma germinal de las plantas
que, por sus atributos, son consideradas de interés prioritario, además
de aportar conocimiento científico orientado a la optimización
de la conservación y uso de los recursos fitogenéticos. Esto permite
conservar el patrimonio genético vegetal y por tanto, la variabilidad
genética de este género, lo que constituye el fundamento esencial
de los programas de mejoramiento genético y de selección de genotipos.
A la par, se desarrollan y emplean técnicas de crioconservación
para lograr condiciones de baja energía cinética molecular y una
difusión extremadamente lenta, de tal forma que las reacciones químicas
se encuentren prácticamente paralizadas; bajo estas condiciones, se postulan
longevidades extremadamente largas. Sin embargo, estudios resientes muestran
que después de un periodo de almacenamiento, donde no se muestran síntomas
en la disminución de la calidad de las semillas, ocurre una rápida
declinación de la viabilidad del material crioconservado (1).
Las condiciones de cultivo, cosecha y postcosecha, así como la humedad
y la temperatura de almacenamiento son factores fundamentales que el operador
debe tomar en consideración en el manejo de semillas en un banco de germoplasma
(2). Por lo tanto, la influencia de estos factores debe ser evaluada antes de
utilizar la crioconservación como estrategia segura para almacenar semillas
del género Nicotiana (1, 2, 3). Para determinar el día
óptimo de cosecha, el grado de madurez de la semilla juega un papel fundamental.
Este parámetro guarda estrecha relación con la masa seca o fresca
de las semillas. Sin embargo, teniendo en cuenta el reducido tamaño de
estas semillas, entre 0,1 y 0,5 mm (Tabla
I), su cuantificación manual es uno de los escollos principales en
el procesamiento de las mismas. Factor que introduce un alto nivel de error
en el proceso.

En los últimos años la incorporación de las técnicas
de Procesamiento Digital de Imágenes (PDI) constituye una alternativa
para la solución a este problema. Estas técnicas permiten la implementación
de una amplia gama de aplicaciones con diversos objetivos, tales como inspección,
clasificación, reconocimiento de objetos, mediciones, control de calidad
y control de procesos, lo que las hace muy atractivas para el sector alimenticio
y agrícola, al desarrollar sistemas para un amplio rango de productos,
debido a que permite construir herramientas capaces de realizar una inspección
y clasificación de forma objetiva, rápida, confiable y no invasiva,
evitando afectar la calidad.
El PDI permite realizar mediciones lo más exactas posibles de los objetos
y extraer el máximo de información contenida en la imagen, en
dependencia del problema en sí. Estas medidas pueden ser tan simples
como el número de objetos, tamaño o color del objeto, o más
complicadas como la forma, conectividad o apariencia (textura) de los objetos.
Existen numerosos ejemplos en la literatura de la aplicación de las técnicas
de PDI en el análisis y cuantificación de semillas (3, 4, 5, 6,
7, 8, 9, 10, 11, 12, 13, 14, 15). No obstante, ninguna de estas aplicaciones
permite el conteo de semillas tan pequeñas como las de Nicotiana
tabacum.
Es por ello que en el presente trabajo se propone un sistema informático
basado en técnicas de PDI para la cuantificación de semillas de
tabaco contenidas en una imagen, que permita reducir el riesgo de error que
se introduce en el proceso de conteo de las mismas.
MATERIALES
Y MÉTODOS
Las investigaciones
se realizaron en el laboratorio de Informática Aplicada del Centro de
Bioplantas, Universidad de Ciego de Ávila, en colaboración con
la Estación Experimental del Tabaco de Cabaiguán en Sancti Spíritus.
El desarrollo, implementación y puesta a punto de los algoritmos así
como el tratamiento de las imágenes, se realizó con la plataforma
de procesamiento de imágenes AForge.NET y el ambiente de desarrollo SharpDeveloment
ver. 4.4. Se trabajó con la variedad Nicotiana tabacum Linneaus
cv SanctiSpíritus96 y las imágenes se capturaron con un scanner
convencional CANNON, ImageCLASS, MF4570dw.
Para la puesta a punto de los algoritmos y del sistema en general se utilizaron
15 imágenes de semillas de tabaco que contienen 1492 semillas, cada una
de las imágenes fue capturada con diferentes resoluciones (150 dpi, 300
dpi, 600 dpi y 1200 dpi). En la Figura
1 se muestra una de estas imágenes y dos secciones ampliadas. El
análisis estadístico se realizó usando el paquete estadístico
SPSS (16).
RESULTADOS
Y DISCUSIÓN
Para realizar
el conteo de las semillas, primeramente es necesario poder separar en la imagen
qué es semilla y qué es fondo. Este proceso es conocido como segmentación
y es un paso fundamental en el PDI, donde cada caso tiene sus particularidades
en dependencia del tipo de imagen a analizar. Posteriormente es necesario detectar
los objetos de interés (semillas) y eliminar los ruidos presentes en
la imagen, ya sean por el proceso de captura de la imagen o por la misma naturaleza
de la misma. Para realizar la segmentación y mejora de la imagen se siguieron
una serie de pasos que se muestran en el algoritmo (Algoritmo 1) y que permitieron
extraer cada semilla o grupo de semillas presente en la imagen.
Algoritmo
1. Proceso de mejora, segmentación y detección
1) Normalizar la imagen, empleando como rango los valores menor y mayor de los
tonos de grises del histograma.
2) Umbralizar con un punto de corte que se calcula automáticamente en
dependencia del histograma.
3) Realizar una transformación morfológica “Apertura”
con el objetivo de eliminar posibles fragmentos de semillas partidas u otros
ruidos presentes en la imagen.
4) Detectar las semillas o grupos de semillas a través de la detección
de sus bordes.
En el proceso
de conteo resulta muy común el solapamiento entre semillas. Esto afecta
considerablemente la precisión del conteo realizado ya que cada grupo
es considerado una sola semilla. Por esta razón, se aplica un algoritmo
de conteo (Algoritmo 2) que incluye la aplicación oportuna de estadígrafos
para la identificación de la cantidad de semillas.
Algoritmo 2. Proceso de conteo de las semillas
1) Calcular el área promedio de cada semilla o grupo de semilla.
a) Calcular el área de cada semilla o grupo de semilla.
b) Calcular el área promedio temporal.
c) Calcular el área promediode las áreas menores que el área
promedio temporal.
2) Comparar el área promedio con las áreas de los elementos detectados,
de esta forma es posible determinar la cantidad de semillas presentes en losgrupos.
3) Determinar el número total de semillas.
Evaluación de la herramienta propuesta
La efectividad del método propuesto está condicionada directamente
a la calidad del proceso de toma de la imagen. La aparición de elementos
indeseables como impurezas en las muestras influye directamente en el resultado
final.
Para la evaluación de la herramienta propuesta, se realizó una
simplificación del problema, reduciéndolo a dos clases: semillas
(positivos) e impurezas (negativos). Donde las clasificaciones correctas serían
las semillas correctamente detectadas que son cuantificadas como verdaderos
positivos (VP) y las impurezas no detectadas como semillas que son cuantificadas
como verdaderos negativos (VN). Mientras que las clasificaciones incorrectas
serían las impurezas detectadas como semillas y las semillas clasificadas
de más en los grupos, que son cuantificadas como falsos positivos (FP)
y las semillas identificadas como impurezas y no identificadas en los grupos,
que son cuantificadas como falsos negativos (FN). La efectividad (Acc) de la
herramienta se calcula a través de la Ecuación 1 (8, 14).
Acc = (VP + VN)/ (VP + FP + VN + FN) (1)
El método desarrollado se explica a través de la Figura
2, donde se muestra la imagen de una pequeña cantidad de semillas
de tabaco, con el objetivo de mostrar mayores detalles (a); el resultado de
transformar la imagen original a escala de gris y su normalización, proceso
necesario para la posterior segmentación (b); se obtiene una imagen binaria
(c); se eliminan los ruidos presentes en la imagen como resultado de la operación
morfológica “apertura”, y se calcula la cantidad de semillas
en la imagen (d).

Para la evaluación de la herramienta propuesta, se procesaron un total
de 1492 semillas separadas en 15 grupos. A su vez, se tomaron cuatro imágenes
de cada grupo con las resoluciones (150 dpi, 300 dpi, 600 dpi y 1200 dpi), para
un total de 60 imágenes. En todos los casos se realizó el conteo
con la herramienta, aplicando las mismas configuraciones. Los resultados se
muestran en la Tabla II.
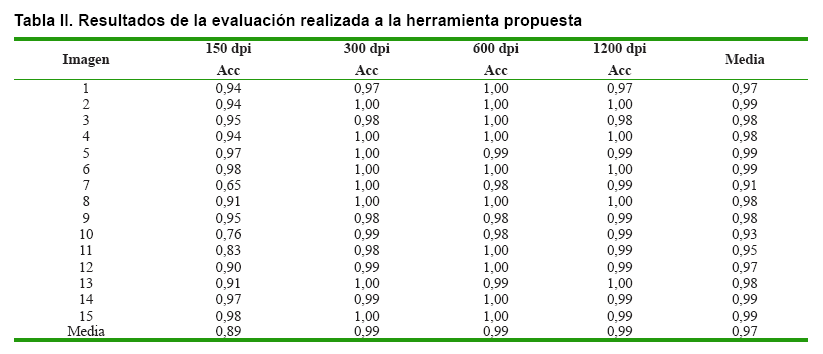
Los resultados de la resolución de 150 dpi son pobres, de una efectividad
del 89 %. Esto se debe a que en esta resolución los contornos de las
semillas no están bien definidos, lo que se incrementa en la presencia
de grupos de semillas.
Para las resoluciones de 300, 600 y 1200 dpi los resultados son similares con
una efectividad superior al 99 %, por lo que se recomienda utilizar una resolución
de 300 dpi por obvias razones de ahorro de memoria y disminución del
tiempo de ejecución.
CONCLUSIONES
- En la presente
investigación se propuso un sistema informático para la cuantificación
de semillas de Nicotiana tabacum contenidas en una imagen, aplicando
técnicas de PDI.
- Se realizó
la validación experimental del mismo en 15 imágenes con 1492
semillas y para las resoluciones de:150 dpi, 300 dpi, 600 dpi y 1200 dpi,
demostrándose que el sistema es capaz de contar semillas de reducido
tamaño (entre 0,1 y 0,5 mm), con una precisión superior al 99
% para las resoluciones iguales o superior a 300 dpi,sin que existan diferencias
estadísticamente significativas entre éstas.
- El sistema
se está aplicando en la Estación Experimental del Tabaco de
Cabaiguán, en Sancti Spíritus, con resultados satisfactorios.
BIBLIOGRAFÍA
1. Walters, C.;
Ballesteros, D. y Vertucci, V. A. ‘‘Structural mechanics of seed deterioration:
Standing the test of time’’. Plant Science, vol. 179, no. 6, diciembre
de 2010, (ser. Translational Seed Biology: From Model Systems to Crop Improvement),
pp. 565-573, ISSN 0168-9452, DOI 10.1016/j.plantsci.2010.06.016.
2. Buitink, J.; Leprince, O.; Hemminga, M. A. y Hoekstra, F. A. ‘‘Molecular
mobility in the cytoplasm: An approach to describe and predict lifespan of dry
germplasm’’. Proceedings of the National Academy of Sciences, vol.
97, no. 5, 29 de febrero de 2000, pp. 2385-2390, ISSN 0027-8424, 1091-6490,
DOI 10.1073/pnas.040554797, PMID: 10681458.
3. Bailly, C.; El-Maarouf-Bouteau, H. y Corbineau, F. ‘‘From intracellular signaling
networks to cell death: the dual role of reactive oxygen species in seed physiology’’.
Comptes Rendus Biologies, vol. 331, no. 10, octubre de 2008, (ser.
Les graines de la vie / The seeds of life),
pp. 806-814, ISSN 1631-0691, DOI 10.1016/j.crvi.2008.07.022.
4. Zapotoczny, P. ‘‘Discrimination of wheat grain varieties using image analysis
and neural networks. Part I. Single kernel texture’’. Journal of Cereal
Science, vol. 54, no. 1, julio de 2011, pp. 60-68, ISSN 0733-5210, DOI
10.1016/j.jcs.2011.02.012.
5. Alvarenga, R. O.; Filho, J. M. y Junior, F. G. G. ‘‘Avaliação
do vigor de sementes de milho superdoce por meio da análise computadorizada
de imagens de plântulas’’. Journal of Seed Science, vol. 34,
no. 3, 12 de septiembre de 2012, pp. 488-494, ISSN 2317-1545.
6. Chaugule, A. ‘‘Application of image processing in seed technology: A survey’’.
International Journal of Emerging Technology and Advanced Engineering,
vol. 2, no. 4, 2012, pp. 153–159, ISSN 2250-2459.
7. Chiquito, A. A.; Junior, G.; Guilhien, F. y Marcos-Filho, J. ‘‘Assessment
of physiological potential of cucumber seeds using the software Seedling Vigor
Imaging System® (SVIS®)’’. Revista Brasileira
de Sementes, vol. 34, no. 2, junio de 2012, pp. 255-263, ISSN 0101-3122,
DOI 10.1590/S0101-31222012000200010.
8. Daniel, I. O.; Adeboye, K. A.; Oduwaye, O. O. y Pobeni, J. ‘‘Digital seed
morpho-metric characterization of tropical maize inbred lines for cultivar discrimination’’.
International Journal of Plant Breeding and Genetics, vol. 6, no. 4,
2012, pp. 245–251, ISSN 1819-3595.
9. Mandal, S.; Roy, S. y Tanna, H. ‘‘A low-cost image analysis technique for
seed size determination’’. Current Science, vol. 103, no. 12, 2012,
pp. 1401–1403, ISSN 0011-3891.
10. Pourreza, A.; Pourreza, H.; Abbaspour-Fard, M.-H. y Sadrnia, H. ‘‘Identification
of nine Iranian wheat seed varieties by textural analysis with image processing’’.
Computers and Electronics in Agriculture, vol. 83, abril de 2012, pp.
102-108, ISSN 0168-1699, DOI 10.1016/j.compag.2012.02.005.
11. Shahin, M. A.; Symons, S. J. y Wang, N. ‘‘Predicting dehulling efficiency
of lentils based on seed size and shape characteristics measured with image
analysis: Predicting lentil dehulling with image analysis’’. Quality Assurance
and Safety of Crops & Foods, vol. 4, no. 1, marzo de 2012, pp. 9-16,
ISSN 17578361, DOI 10.1111/j.1757-837X.2011.00119.x.
12. Belsare, P. P. y Dewasthale, M. M. ‘‘Application Of Image Processing For
Seed Quality Assessment: A Survey’’. International Journal of Engineering
Research & Technology, vol. 2, no. 2, 28 de febrero de 2013, ISSN 2278-0181,
[Consultado: 1 de febrero de 2016], Disponible en: <http://www.ijert.org/view-pdf/2329/application-of-image-processing-for-seed-quality-assessment-a-survey>.
13. Pazoki, A.; Pazoki, Z. y Sorkhilalehloo, B. ‘‘Rain Fed Barley Seed Cultivars
Identification Using Neural Network and Different Neurons Number’’. World
Applied Sciences Journal, vol. 22, no. 5, 2013, pp. 755–762, ISSN 1818-4952.
14. Sandeep, V. V.; Kanaka, D. K. y Keshavulu, K. ‘‘Seed Image Analysis: Its
Applications in Seed Science Research’’. International Research Journal
of Agricultural Science, vol. 1, no. 2, 2013, pp. 30-36, ISSN 2327-3321.
15. Kaur, J. ‘‘Digital image analysis based on automated counting clustered
soybean seeds’’. International Journal of Computers & Technology,
vol. 12, no. 3, 3 de enero de 2014, pp. 3325-3328, ISSN 2277-3061.
16. IBM SPSS Statistics [en línea]. versión 20, [Windows],
edit. IBM Corporation, U.S, 2011, Disponible en: <http://www.ibm.com>.
Recibido: 15 de
mayo de 2015
Aceptado: 27 de enero de 2016
Yunieski Martínez-Espinosa,
Departamento de Ciencias Informáticas, Universidad “Máximo Gómez
Báez” de Ciego de Ávila, carretera a Morón km 19 ½,
Ciego de Ávila, Cuba, 65400. Email: ebaez@bioplantas.cu



