Citotoxicidad
de una aspartil peptidasa de Salpichroa origanifolia frente a la infección
causada por Phytophthora capsici en zapallitos verdes (Cucurbita
maxima, var. Zapallito)
Citotoxic
activity of an aspartic peptidase from Salpichroa origanifolia against
the infection caused on green zucchini (Cucurbita maxima, var. Zapallito)
by Phytophthora capsici
Dra.C.
Gabriela F. Rocha,I Dra.C. María E. Díaz,I,II Dra.C. Adriana
M. Rosso,I Dra.C. Mónica G. ParisiI
ILaboratorio
de Química Biológica, Departamento de Ciencias Básicas, Universidad Nacional
de Luján, Argentina.
IICONICET.
RESUMEN
Phytophthora
capsici es un oomicete patógeno que causa importantes pérdidas en la producción
de cultivos de interés agroeconómico. Los agroquímicos utilizados tradicionalmente
para combatir estos fitopatógenos causan efectos adversos sobre la salud y el
medio ambiente. Las plantas de la flora autóctona representan una fuente alternativa
de metabolitos antifúngicos naturales. En nuestro laboratorio hemos estudiado
la especie Salpichroa origanifolia, una hierba perenne autóctona del
Norte y Centro de Argentina cuyos frutos, en forma de baya ovoide, son comestibles.
A partir del extracto crudo de los frutos maduros de esta especie se purificó
por cromatografía de intercambio iónico mediante un proceso en batch, una aspartil
peptidasa a la cual denominamos salpichroína. El objetivo de este trabajo fue
estudiar el efecto antifúngico de la enzima sobre el patógeno P. capsici.
Salpichroína presentó un elevado efecto citotóxico sobre P. capsici
en los ensayos in vitro, con un valor de CIM de 1,2 µmol L-1.
Para evaluar el efecto de la enzima sobre el desarrollo de P. capsici
en vegetales, se realizaron bioensayos de inoculación controlada de zapallitos
verdes (Cucurbita máxima var Zapallito), observándose que los zapallitos
inoculados con salpichroína junto con el fitopatógeno permanecieron asintomáticos
durante siete días.
Palabras
clave: fungicidas, organismos patógenos, peptidasas.
ABSTRACT
Phytophthora
capsici is a phytopathogenic agent that causes significant losses in crops
of economic interest. The chemicals traditionally used to fight these pathogens
cause adverse effects on health and the environment. Native plants represent
an alternative source of natural antifungal metabolites. In our laboratory we
have studied a perennial herb, Salpichroa origanifolia, native to the
northern and central Argentina whose ovoid fruits are edible berry. An aspartyl
peptidase from the crude extract of the ripe fruit of this species was purified
by ion exchange chromatography using a batch process. The enzyme was called
salpichroín. In this work the antifungal effect of the aspartyl peptidase on
P. capsici was studied. It was obtained that salpichroín had a high
cytotoxic effect in vitro on strains of P. capsici (MIC: 1.2
µmol L-1). To evaluate the enzyme effect on the development of P.
capsici in vivo, inoculation controlled bioassays on green zucchini (Cucurbita
maximum var Zapallito) were performed. The fruit inoculated with the phytopathogen
and salpichroín remained asymptomatic for seven days.
Key words:
fungicides, pathogens, peptidase.
INTRODUCCIÓN
Los hongos fitopatógenos
son la principal causa de enfermedades infecciosas en las plantas. El control
de estos hongos con fungicidas sintéticos es aún la medida fitotécnica
más importante para aumentar los rendimientos de los cultivos. Sin embargo,
la utilización masiva y a veces indiscriminada de estos productos ha
incrementado la resistencia de los organismos fitopatógenos además
de provocar efectos adversos en la salud humana y el medio ambiente (1). En
este marco se plantea como esencial la búsqueda de agentes antimicrobianos
más seguros que puedan sustituir o disminuir el actual uso de agroquímicos.
El desarrollo de una agricultura sostenible ha llevado a investigadores de todo
el mundo a buscar nuevos compuestos para el control de enfermedades cuya actividad
y seguridad ambiental sea adecuada (2). En este sentido, se están evaluando
alternativas naturales, entre las cuales se encuentra el uso de extractos vegetales.
Con estos extractos se han obtenido resultados prometedores ya que se ha demostrado
la actividad antimicrobiana de diferentes extractos de plantas in vitro
e in vivo (3, 4, 5).
Las plantas han desarrollado un sofisticado sistema inmune innato en respuesta
a los patógenos invasores. Es así como la defensa de las plantas
implica una variedad de mecanismos celulares entre los que podemos mencionar
la generación rápida de especies reactivas de oxígeno (ROS),
la inducción de la respuesta hipersensible (HR) y la producción
de moléculas pequeñas (fitoalexinas) y proteínas con actividad
antimicrobiana. También se ha descripto la inducción de genes
que codifican endopeptidasas con distintos mecanismos catalíticos (6,
7). Las peptidasas cisteínicas están involucradas en muchos aspectos
del desarrollo y fisiología de las plantas incluyendo senescencia, embriogénesis,
desarrollo de flores y respuesta a distintos tipos de estrés ambiental
(8). Además, la acción farmacológica de las peptidasas
cisteínicas de plantas ha sido reconocida en investigaciones como potenciales
drogas para combatir enfermedades bacterianas y fúngicas (9, 10). Por
otro lado, las peptidasas aspárticas (APs) de origen vegetal han sido
descriptas como una parte fundamental del mecanismo de defensa de las plantas
frente a la infección por microorganismos patógenos (11).
En nuestro laboratorio hemos estudiado la especie Salpichroa origanifolia,
una hierba perenne autóctona del Norte y Centro de Argentina, Uruguay
y Brasil. Los frutos de esta especie tienen forma de baya ovoide, son comestibles
y comúnmente llamados huevitos de gallo. En extractos crudos de los frutos
maduros se encontró una peptidasa. A partir de dicho extracto se purificó
por cromatografía de intercambio aniónico y caracterizó
esta AP a la cual denominamos salpichroína (12).
Por otra parte, se ha descrito que el oomicete P. capsici causa la
putrefacción y tizón tardío de una gran variedad de huéspedes,
incluidos muchos de los miembros de la familia Solanaceae y Cucurbitaceae así
como Fabaceae. Entre los cultivos de interés agroeconómico afectados
se encuentran los cultivos de papa, de batata, de tomate, de pimiento, de berenjena
y de zapallitos. Es por ello, que el presente trabajo tuvo como objetivo determinar
la actividad citotóxica de la AP purificada a partir de frutos maduros
de S. origanifolia frente a la infección causada por
P. capsici en zapallitos verdes (Cucurbita maxima, var. Zapallito).
MATERIALES
Y MÉTODOS
Material
vegetal: Como fuente de enzimas proteolíticas se emplearon los
frutos maduros de la especie Salpichroa origanifolia (Lam.) Baill.
recolectados en la localidad de Luján, provincia de Buenos Aires, República
de Argentina. El fruto maduro es una baya ovoide, blanda, de color blanquecino
y sabor dulce.
Preparación del extracto crudo: Los frutos se trituraron
con etanol a -8ºC. El precipitado se resuspendió en buffer fosfato
de potasio 50 mM de pH 7,0 (4°C) y se obtuvo un extracto al 15% (p/V). Esta
preparación enzimática se denominó extracto crudo (EC).
Determinación de la actividad proteolítica: La
determinación de la actividad proteolítica fue realizada utilizando
caseína como sustrato (13). La reacción se inició con el
agregado de 100 µL de la solución enzimática a 900 µL
de solución de caseína al 0,5 % (p/V) en buffer fosfato de potasio
50 mM de pH 6,0 y luego de 15 minutos de incubación a 40 °C, la reacción
se detuvo con el agregado de 1 mL de TCA al 5 % (p/V). La suspensión
se dejó en reposo durante 20 minutos en baño de hielo y luego
fue centrifugada durante 10 min a 14000 rpm. Se midió la absorbancia
del sobrenadante a 280 nm para determinar los péptidos solubles obtenidos
por digestión proteolítica. La Unidad de actividad caseinolítica
(Ucas) fue definida como la cantidad de enzima necesaria para producir un incremento
de una unidad de absorbancia por minuto a 280 nm en las condiciones del ensayo.
Determinación de la concentración de proteínas:
La concentración de proteínas fue estimada por el método
de Bradford (14) empleando albúmina sérica bovina como estándar
para la construcción de la curva de calibración.
Purificación de la AP: La purificación se llevó
a cabo mediante cromatografía de intercambio aniónico con una
resina de DEAE-Sepharose Fast Flow (Sigma) equilibrada en buffer fosfato de
potasio 50 mM de pH 7,0. Las proteínas fueron eluidas con un gradiente
lineal de NaCl (0,0-0,6 M) con un flujo constante de 1 mL min-1.
La fracción activa fue desalada por cromatografía de exclusión
molecular con resinas de Sephadex G-10 y almacenada a -20 °C para posteriores
ensayos. La fracción activa eluída de la columna cromatográficas
fue analizada por SDS-PAGE en geles de poliacrilamida (15 %), en condiciones
reductoras y no reductoras y a temperatura ambiente (15). Los geles fueron teñidos
con Coomassie Brilliant Blue R-250 (CBB R-250) y con plata (16). En la electroforesis
SDS-PAGE se emplearon patrones de bajo peso molecular (Low Molecular Weight
Range Sigma Marker producto N° 3913M). Para los zimogramas se aplicó
la técnica de Kleiner y Stetler-Stevenson (17). Después de la
corrida electroforética, el gel se incubó durante la noche en
buffer de citrato de sodio (pH 4,0) con CaCl2 20 mM a 40 °C. Luego del lavado,
el gel se tiñó con CBB R-250 para el análisis de zimografía.
El desarrollo de una banda clara en el fondo azul del gel indicó la presencia
de actividad de la peptidasa.
Actividad antifúngica in vitro: El fitopatógeno
empleado en este estudio (P. capsici) fue aislado y caracterizado por
el grupo de investigación de Fitopatología de la Universidad Nacional
de Luján, a partir de vegetales de producción local, de la zona
Noreste de la provincia de Buenos Aires. Para determinar la actividad antifúngica
de salpichroína, discos de agar de 0,5 cm de diámetro con crecimiento
de micelio de la cepa fúngica estudiada fueron incubados con salpichroína
(2,4 µmol L-1), buffer fosfato de sodio 50 mM de pH 7,0 o agua
durante 24 horas. Los discos de agar fueron luego colocaron en placas de Petri
que contenían medio V8 (34 % de jugo de ocho vegetales V8®
y 3 % de agar) específico para el crecimiento de P. capsici.
Se colocó un disco de agar por placa y los ensayos se realizaron por
duplicado. Las placas fueron incubadas a temperatura ambiente durante diez días.
Al cabo de tres y diez días se controló el efecto inhibitorio
de la enzima sobre el crecimiento del micelio de la especie fúngica.
La concentración inhibitoria mínima (CIM) se definió como
la concentración mínima de salpichroína que produjo total
inhibición en el crecimiento de P. capsici. Para ello, se incubó
un disco de agar de 0,5 cm de diámetro con crecimiento de micelio de
la cepa fúngica con distintas concentraciones de la enzima (0,0- 0,6-
1,2- 2,4 µmol L-1) en medio líquido V8 (10 %) a 25°C durante
48 horas. La CIM se determinó visualmente y correspondió a la
menor concentración de salpichroína en la que no hubo desarrollo
miceliar del oomicete.
Inoculación controlada del fitopatógeno P. capsici
sobre zapallitos verdes: Para evaluar el efecto de salpichroína
sobre el desarrollo de P.capsici en vegetales se realizaron bioensayos de inoculación
controlada. Se emplearon zapallitos verdes (Curcubita máxima
var Zapallito), adquiridos en comercios de la ciudad de Luján, Bs As.
En primer lugar se lavó cuidadosamente la superficie del vegetal con
agua, para no producir lesiones. Se hicieron heridas de 3 mm de profundidad
en la región ecuatorial del vegetal con una aguja de disección
estéril para favorecer la infección. El bioensayo consistió
en colocar un disco de agar del medio de cultivo V8 con micelio de P. capsici
en activo crecimiento sobre la herida realizada en la piel de los zapallitos
limpios. Sobre el cultivo se colocó 50 µL de una solución
estéril de salpichroína (2,4 µmol L-1) o el mismo
volumen de agua estéril para el caso del control positivo. Para los controles
negativos se usaron discos de agar estéril, sin enzima ni el patógeno.
Para cada tratamiento se hicieron tres réplicas y el ensayo completo
se repitió dos veces. Todos los vegetales fueron incubados a 25 ºC
en cámara húmeda y con luz alternada.
El desarrollo de la infección se evaluó diariamente desde los
dos días después de la inoculación y durante siete días,
registrándose como el porcentaje de heridas infectadas por réplica
y calculando la media y la desviación estándar para cada tratamiento.
RESULTADOS
Y DISCUSIÓN
Aislamiento
y caracterización de la enzima pura
Se preparó un EC de frutos maduros de Salpichroa origanifolia
cuya concentración de proteínas fue de 0,5 mg mL-1
y con una actividad proteolítica de 145 Ucas mL-1. Si bien
en trabajos previos se realizó la purificación de la enzima mediante
un sistema FPLC (12), en este trabajo la purificación a partir del EC
se realizó en batch utilizando una cromatografía de intercambio
aniónico con una resina DEAE-Sepharose. Esta técnica permitió
obtener una mayor biomasa de enzima pura necesaria para ser utilizada en los
ensayos de inhibición microbiana. En el perfil cromatográfico
se observaron cinco picos de absorbancia a 280 nm de los cuales sólo
uno presentó actividad caseinolítica (Figura
1A). La fracción activa obtenida fue analizada por electroforesis
SDS-PAGE en condiciones reductoras y no reductoras. Se observó una única
banda con peso molecular aparente de 32 kDa cuando la muestra se preparó
en condiciones no reductoras (Figura
1B, calle 2). No se observaron diferencias en el perfil electroforético
cuando la muestra se preparó en condiciones reductoras y calentadas a
90°C (dato no mostrado). La pureza de la enzima fue evaluada también
por electroforesis nativa y se observó la presencia de una única
banda proteica (Figura
1B, calle 4). De la misma manera, en el zimograma correspondiente se observó
una única banda con movilidad relativa similar a la obtenida en el gel,
indicando la homogeneidad de la enzima purificada.
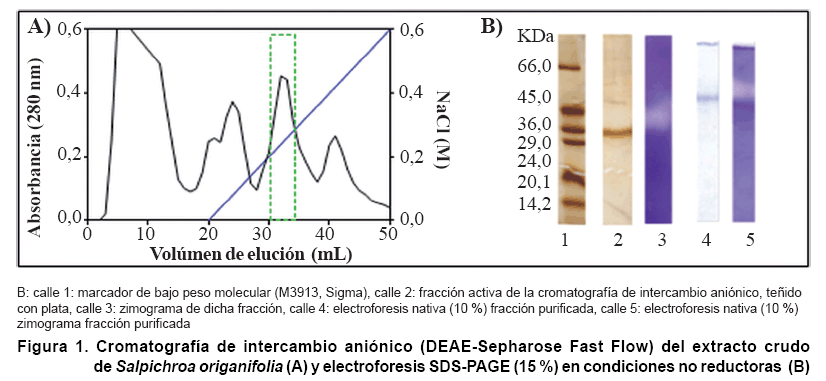
De acuerdo con los resultados obtenidos en los ensayos electroforéticos,
se estimó el peso molecular de la enzima salpichroína en 32 kDa,
valor que es del mismo orden que el obtenido para otras APs de origen vegetal
como las APs de tomate (37 kDa) (18) y tabaco (36-40 kDa) (19), la AP de papa
(38 kDa) (20) y la AP de Ficus racemosa (44 kDa) (21).
Actividad antifúngica de salpichroína
Se ha informado en la bibliografía la presencia de múltiples actividades
biológicas asociadas a las peptidasas, entre ellas la actividad antifúngica.
Se encontró que la bromelina purificada a partir de los tallos de piña
era un potente inhibidor de patógenos fúngicos de plantas y que
esa actividad estaba asociada a su actividad proteolítica (7). Por otra
parte se informó que la actividad antifúngica de las APs de papa
estaba relacionada con la presencia del PSI en la enzima madura (22). Por este
motivo se inició el estudio de la actividad antifúngica de salpichroína.
En primer lugar se evaluó el efecto inhibidor de la enzima sobre el desarrollo
miceliar de P. capsici (sección Materiales y Métodos).
En los ensayos microbiológicos, se encontró que la enzima ejercía
un fuerte efecto citotóxico sobre cepas de P. capsici ya que
no se observó desarrollo del micelio luego de la incubación en
la solución enzimática durante los diez días del ensayo
(Figura 2). Como era de esperar, se observó desarrollo
del micelio de las cepas en las placas que contenían los discos sumergidos
en agua y en buffer.

Estos resultados
son coincidentes con los informados por otros autores (22) para las APs de hoja
y tubérculos de papa, StAP1 y StAP3, las cuales mostraban acción
fungicida frente a Phytophthora infestans y Fusarium solani,
plagas que infectan los cultivos de papa. Además, comprobaron que la
actividad antifúngica de StAp1 y StAP3 estaba relacionada con la presencia
del PSI, dominio específico de las APs, que presenta alta homología
estructural con las proteínas del tipo saposinas (SAPLIPs) y que actúa
desestabilizando la membrana fosfolipídica del oomicete, provocando la
formación de poros y la pérdida de viabilidad celular del patógeno
(22).
De esta forma, la actividad fungicida de salpichroína podría deberse
a la potencial presencia del dominio PSI en su forma activa.
Comprobada la actividad citotóxica de la enzima sobre P. capsici,
se determinó la CIM de salpichroína sobre el crecimiento in
vitro del microorganismo (Figura 3). El valor de la CIM
fue de 1,2 µmol L-1, el cual es del mismo orden que los valores
de CIM informados para StAP1 y StAP3 sobre P. infestans (22).

En base a estos
resultados podemos inferir que salpichroína presenta interesantes propiedades
antimicrobianas sobre el crecimiento in vitro del fitopatógeno
P. capsici, oomicete que genera grandes pérdidas en la producción
de vegetales como zapallitos, pimientos y berenjenas entre otros.
Con el fin de comprobar la actividad citotóxica in vivo de la
enzima, se llevaron a cabo experimentos de inoculación controlada de
salpichroína sobre zapallitos verdes infectados por P. capsici.
El bioensayo consistió en colocar un disco de agar con micelio de P.
capsici en activo crecimiento en la piel de zapallitos limpios. Sobre el
cultivo se colocó una solución estéril de salpichroina
(2,4 µmol L-1) o el mismo volumen de agua estéril para
el caso del control positivo. Para los controles negativos se usó solo
un disco de agar sin ningún tratamiento previo. Se incubó a 25
°C en cámara húmeda durante siete días y se registró
la severidad de la lesión. Después de la incubación se
observaron signos de patogenicidad sobre todos los controles positivos.
Las muestras tomadas de la superficie de dichos frutos confirmaron que se trataba
de P. capsici debido a la presencia de esporangios con pedicelos típicamente
largos (Figura 4 A).

Los zapallitos sobre cuyos inóculos fue colocada la solución de
enzima no presentaron signos de infección y al igual que los controles
negativos permanecieron asintomáticos (Figura
4 B). Este comportamiento se repitió en todas las réplicas
del ensayo.
De acuerdo a estos resultados, la aspartil peptidasa salpichroína aislada
de frutos maduros de S. origanifolia, podría controlar la infección
de P. capsici sobre zapallitos verdes, en la etapa de poscosecha.
CONCLUSIONES
- Debido a que
el control de hongos fitopatógenos con fungicidas sintéticos
ha incrementado la resistencia de estos organismos, se están evaluando
alternativas naturales como extractos vegetales. Se han obtenido resultados
prometedores ya que se ha demostrado la actividad antimicrobiana de diferentes
extractos de plantas in vitro e in vivo. En particular,
se ha demostrado que las peptidasas de origen vegetal poseen actividad antimicrobiana.
- En este trabajo
hemos purificado una AP de frutos maduros de S. origanifolia por
cromatografía de intercambio iónico mediante un proceso en batch.
Además, hemos demostrado que la enzima purificada (salpichroína)
presenta un efecto citotóxico sobre el fitopatógeno Phytophthora
capsici ya que inhibe su crecimiento. Esto se pudo demostrar tanto in
vitro como in vivo, realizando ensayos de inoculación
controlada sobre zapallitos verdes.
- A partir de
estos resultados podemos afirmar que salpichroína puede controlar la
infección de P. capsici sobre zapallitos verdes, probablemente
por la actividad antifúngica del PSI de las APs que puede interaccionar
con la membrana celular del oomicete provocando la pérdida de viabilidad
celular.
- Estos resultados
son muy promisorios ya que la búsqueda de compuestos naturales de origen
vegetal para el control de plagas que afectan cultivos de importancia agroalimentaria
es un tema de interés social y económico.
AGRADECIMIENTOS
Los resultados
de este trabajo son parte de la tesis doctoral de la Ing. Gabriela Rocha. Agradecemos
el financiamiento recibido del Departamento de Ciencias Básicas de la
Universidad Nacional de Luján, del Programa de Subsidios para Investigación
de la Comisión de Investigaciones Científicas de la Provincia
de Buenos Aires (CIC 2013) y del Programa de Redes Internacionales de la Secretaría
de Políticas Universitarias del Ministerio de Educación de la
República Argentina.
BIBLIOGRAFÍA
1. Hahn, M. ‘‘The
rising threat of fungicide resistance in plant pathogenic fungi: Botrytis
as a case study’’. Journal of Chemical Biology, vol. 7, no. 4, 28 de
mayo de 2014, pp. 133-141, ISSN 1864-6158, 1864-6166, DOI 10.1007/s12154-014-0113-1.
2. Villa, M. A.; Pérez, L. R.; Morales, M. H. A.; Basurto, S. M.; Soto,
P. J. M. y Martínez, E. E. ‘‘Situación actual en el control de
Fusarium spp. y evaluación de la actividad antifúngica
de extractos vegetales’’. Acta Agronómica, vol. 64, no. 2, 2014,
pp. 194–205, ISSN 2323-0118.
3. Valenzuela, N. L.; Nieto Ángel, D.; Téliz Ortiz, D.; Alatorre
Rosas, R.; Orozco Santos, M. y Ortiz García, C. F. ‘‘Antifungal potential
of extracts from four vegetables species on the growth of Colletotrichum
gloeosporioides in postharvest papaya (Carica papaya)’’. Revista
Venezolana de Ciencia y Tecnología de Alimentos, vol. 4, no. 1,
2013, pp. 47-62, ISSN 2218-4384, CABDirect2.
4. Bálint, J.; Turóczi, B.; Máthé, I.; Benedek,
K.; Szabó, K.-A. y Balog, A. ‘‘In vitro and in vivo
effect of poplar bud (Populi gemma) Extracts on late blight (Phytophthora
infestans)’’. Acta Universitatis Sapientiae, Agriculture and Environment,
vol. 6, no. 1, 2014, pp. 5–12, ISSN 2068-2964, DOI 10.2478/ausae-2014-0007.
5. Ramaiah, A. K. y Garampalli, R. K. H. ‘‘In vitro antifungal activity of some
plant extracts against Fusarium oxysporum f. sp. Lycopersici’’.
Asian Journal of Plant Science and Research, vol. 5, no. 1, 2015, pp.
22–27, ISSN 2249-7412.
6. Kervinen, J. ‘‘Phytepsin’’. En: Barrett A. J., Woessner J. F., y Rawlings
N. D., Handbook of Proteolytic Enzymes, edit. Elsevier, 2 de diciembre
de 2012, pp. 118-124, ISBN 978-0-08-098415-5.
7. López-García, B.; Hernández, M. y Segundo, B. S. ‘‘Bromelain,
a cysteine protease from pineapple (Ananas comosus) stem, is an inhibitor
of fungal plant pathogens’’. Letters in Applied Microbiology, vol.
55, no. 1, 1 de julio de 2012, pp. 62-67, ISSN 1472-765X, DOI 10.1111/j.1472-765X.2012.03258.x.
8. Barrett, A. J.; Woessner, J. F. y Rawlings, N. D. Handbook of Proteolytic
Enzymes. edit. Elsevier, 2 de diciembre de 2012, 1182 p., ISBN 978-0-08-098415-5.
9. Seenivasan, R.; Roopa, L. y Geetha, S. ‘‘Investigations on purification,
characterization and antimicrobial activity of enzyme papain from Carica
papaya Linn’’. Journal of Pharmacy Research, vol. 3, no. 5, 2010,
pp. 1092-1095, ISSN 0974-6943, CABDirect2.
10. Ramos, M. V.; Souza, D. P.; Gomes, M. T. R.; Freitas, C. D. T.; Carvalho,
C. P. S.; Júnior, P. a. V. R. y Salas, C. E. ‘‘A Phytopathogenic Cysteine
Peptidase from Latex of Wild Rubber Vine Cryptostegia grandiflora’’.
The Protein Journal, vol. 33, no. 2, 5 de marzo de 2014, pp. 199-209,
ISSN 1572-3887, 1573-4943, DOI 10.1007/s10930-014-9551-4.
11. Breitenbach, H. H.; Wenig, M.; Wittek, F.; Jordá, L.; Maldonado-Alconada,
A. M.; Sarioglu, H.; Colby, T.; Knappe, C.; Bichlmeier, M.; Pabst, E.; Mackey,
D.; Parker, J. E. y Vlot, A. C. ‘‘Contrasting Roles of the Apoplastic Aspartyl
Protease APOPLASTIC, ENHANCED DISEASE SUSCEPTIBILITY1-DEPENDENT1 and
LEGUME LECTIN-LIKE PROTEIN1 in Arabidopsis Systemic Acquired Resistance,’’.
Plant Physiology, vol. 165, no. 2, 1 de junio de 2014, pp. 791-809,
ISSN, 1532-2548, DOI 10.1104/pp.114.239665, PMID: 24755512.
12. Rocha, G. F.; Obregon, W. D.; Munoz, F.; Guevara, M. G.; Fernandez, G.;
Rosso, A. M. y Parisi, M. G. ‘‘Isolation and characterization of an Aspartic
Protease from Salpichroa origanifolia Fruits’’. Protein and peptide
letters, vol. 22, no. 4, 2015, pp. 379–390,
ISSN 0929-8665.
13. Parisi, M. G.; Moreno, S. y Fernández, G. ‘‘Isolation and characterization
of a dual function protein from Allium sativum bulbs which exhibits
proteolytic and hemagglutinating activities’’. Plant Physiology and Biochemistry,
vol. 46, no. 4, abril de 2008, pp. 403-413, ISSN 0981-9428, DOI 10.1016/j.plaphy.2007.11.003.
14. Bradford, M. M. ‘‘A rapid and sensitive method for the quantitation of microgram
quantities of protein utilizing the principle of protein-dye binding’’. Analytical
Biochemistry, vol. 72, no. 1, 7 de mayo de 1976, pp. 248-254, ISSN 0003-2697,
DOI 10.1016/0003-2697(76)90527-3.
15. Laemmli, U. K. ‘‘Cleavage of structural proteins during the assembly of
the head of bacteriophage T4’’. Nature, vol. 227, no. 5259, 1970, pp.
680–685, ISSN 0028-0836.
16. Blum, H.; Beier, H. y Gross, H. J. ‘‘Improved silver staining of plant proteins,
RNA and DNA in polyacrylamide gels’’. Electrophoresis, vol. 8, no.
2, 1 de enero de 1987, pp. 93-99, ISSN 1522-2683, DOI 10.1002/elps.1150080203.
17. Kleiner, D. E. y Stetlerstevenson, W. G. ‘‘Quantitative Zymography: Detection
of Picogram Quantities of Gelatinases’’. Analytical Biochemistry, vol. 218,
no. 2, 1 de mayo de 1994, pp. 325-329, ISSN 0003-2697, DOI 10.1006/abio.1994.1186.
18. Rodrigo, I.; Vera, P. y Conejero, V. ‘‘Degradation of tomato pathogenesis-related
proteins by an endogenous 37-kDa aspartyl endoproteinase’’. European Journal
of Biochemistry, vol. 184, no. 3, 1989, pp. 663–669, ISSN 0014-2956.
19. Rodrigo, I.; Vera, P.; Loon, L. C. V. y Conejero, V. ‘‘Degradation of Tobacco
Pathogenesis-Related Proteins Evidence for Conserved Mechanisms of Degradation
of Pathogenesis-Related Proteins in Plants’’. Plant Physiology, vol.
95, no. 2, 2 de enero de 1991, pp. 616-622, ISSN 1532-2548, DOI 10.1104/pp.95.2.616,
PMID: 16668027.
20. Guevara, M. G.; Oliva, C. R.; Machinandiarena, M. y Daleo, G. R. ‘‘Purification
and properties of an aspartic protease from potato tuber that is inhibited by
a basic chitinase’’. Physiologia Plantarum, vol. 106, no. 2, 1 de junio
de 1999, pp. 164-169, ISSN 1399-3054, DOI 10.1034/j.1399-3054.1999.106203.x.
21. Devaraj, K. B.; Gowda, L. R. y Prakash, V. ‘‘An unusual thermostable aspartic
protease from the latex of Ficus racemosa (L.)’’. Phytochemistry,
vol. 69, no. 3, febrero de 2008, pp. 647-655, ISSN 0031-9422, DOI 10.1016/j.phytochem.2007.09.003.
22. Muñoz, F.; Palomares-Jerez, M. F.; Daleo, G.; Villalaín, J.
y Guevara, M. G. ‘‘Possible mechanism of structural transformations induced
by StAsp-PSI in lipid membranes’’. Biochimica et Biophysica Acta (BBA) -
Biomembranes, vol. 1838, no. 1, Part B, enero de 2014, pp. 339-347, ISSN
0005-2736, DOI 10.1016/j.bbamem.2013.08.004.
Recibido: 15 de
mayo de 2015
Aceptado: 15 de septiembre de 2015
Dra.C. Gabriela
F. Rocha, Laboratorio de Química Biológica, Departamento
de Ciencias Básicas, Universidad Nacional de Luján, Argentina. Email:
grocha@unlu.edu.ar



