Factores que controlan el contenido de fenoles en el cultivo de callos de Theobroma cacao
Factors controlling phenol content on Theobroma cacao callus culture
Janet Quiñones-Galvez, Martha Hernández de la Torre, Yemeys Quirós Molina, Yanelis Capdesuñer Ruiz, Reinaldo Trujillo Sánchez
Centro de Bioplantas,
Universidad de Ciego de Ávila. carretera a Morón, km 9, Ciego
de Ávila. CP 69450. Cuba.
RESUMEN
Theobroma cacao L. se conoce en la medicina popular como antiséptico, diurético y antiparasitario. Los alimentos derivados de esta planta son ricos en productos naturales de alto valor agregado, entre los que se destacan los compuestos fenólicos. Por lo que manejar su cultivo in vitro es una fuente alternativa para la producción de estos metabolitos. El presente estudio se realizó con el objetivo de obtener compuestos fenólicos a partir del cultivo de callos con estructuras embriogénicas. Se establecieron las condiciones de cultivo (agitación, luz y concentración de glucosa) para aumentar la concentración de fenoles en los callos y los elicitores para lograr su incremento en callos y excreción al medio de cultivo. La acumulación de compuestos fenólicos se favoreció con el suplemento adicional de glucosa, el crecimiento en agitación y a la oscuridad. La adición de ciclodextrinas hidroxipropiladas al azar permitió el incremento del rendimiento específico de fenoles y la biomasa.
Palabras clave: cacao, cultivo in vitro, glucosa.
ABSTRACT
Theobroma cacao L. is known in folk medicine as an antiseptic, diuretic and antiparasitic. Foods derived from this plant are rich in natural products of high added value, including phenolic compounds. As in vitro cultivation handle is an alternative source for the production of these metabolites. The present study was conducted to obtain phenolic compounds from callus culture with embryogenic structures. Culture conditions (agitation, light and glucose) were established to increase the concentration of phenols in calluses and elicitors to achieve the increase in callus and excretion into the culture area. The accumulation of phenolic compounds was favored with the additional supplement of glucose, growth in agitation and darkness. The addition of random hydroxylated cyclodextrins allowed the increase in the specific yield of phenols and biomass.
Key words: cacao, in vitro culture, glucose.
INTRODUCCIÓN
Las plantas
constituyen una fuente importante para el aislamiento de productos naturales
como drogas, tintes, saborizantes, alimentos, fragancias, y otros químicos
que se usan en la industria (1). Varios de estos compuestos son producto del
metabolismo secundario, que las plantas no necesitan para su crecimiento, pero
sí para su interacción con el medio ambiente que las rodea. Los
metabolitos secundarios se agrupan en cuatro clases principales: terpenos, glicósidos,
alcaloides y compuestos fenólicos, dentro de los cuales los fenólicos
tienen gran importancia en la interacción planta-medio ambiente (2).
Estos compuestos pueden ser de naturaleza compleja y se les asocia con importantes
actividades, tales como antioxidante (3), antihipertensiva (4), antitumoral
(5), insecticida (6), nematicida (7) y antimicrobiana (8). Los extractos de
la planta de Theobroma cacao L. (T. cacao), ricos en compuestos
fenólicos, se utilizan en medicina popular como antiséptico, diurético,
antiparasitario (9) y en la última década han incrementado los
estudios sobre estos compuestos en sus semillas y productos derivados. Sus funciones
fisiológicas en la salud de humanos y animales se han correlacionado
con actividades antimutagénica, antioxidante y antitumoral, entre otras
(5, 10, 11).
En el caso de T. cacao, es importante buscar alternativas con vistas
a la obtención de compuestos fenólicos, de manera tal que no se
afecten las plantaciones que se utilizan para obtener los productos comerciales
como el chocolate, la manteca y otros productos derivados. En este sentido,
el cultivo de células y tejidos es una alternativa biotecnológica
en estudio desde hace varios años para la obtención de productos
naturales de plantas. Hasta la fecha, existen diferentes estrategias para su
producción a partir del cultivo de células (callos y suspensiones
celulares) (12).
La obtención de productos activos a partir del cultivo de células
y tejidos tiene un potencial alto para la producción a gran escala y
por largos períodos de tiempo bajo condiciones controladas (13). Sin
embargo, en ocasiones se requiere de una gran cantidad de material vegetal para
producirlos (14) y por ello se desarrollan alternativas para incrementar el
rendimiento de los metabolitos en el cultivo in vitro de plantas, entre
las que se encuentra: la optimización de condiciones de cultivo (15)
y la elicitación (16, 17).
El cultivo de tejidos en T. cacao se estudia desde el siglo pasado,
la embriogénesis es una de las alternativas más estudiadas y fue
descrita inicialmente por Esan (18), posteriormente por Pence (19) y se trabaja
hasta la actualidad para la propagación de plantas (20); no obstante,
la diferenciación celular que se puede alcanzar con la formación
de embriones podrían facilitar también la obtención de
compuestos fenólicos. Actualmente existen resultados en el monitoreo
de la acumulación de fenoles en semillas y suspensiones celulares de
T. cacao (12), así como en callos embriogénicos y no
embriogénicos (21). No obstante, hasta la fecha existe poca información
sobre la manipulación de las condiciones de cultivo para la obtención
de compuestos fenólicos en el mismo.
Basados en los planteamientos anteriores, teniendo en cuenta la importancia
de los compuestos fenólicos presentes en T. cacao y las ventajas
del uso de las técnicas del cultivo in vitro para estos propósitos,
la investigación estuvo encaminada a evaluar el efecto de diferentes
factores que controlan la síntesis y excreción de compuestos fenólicos
en el cultivo de callos con estructuras embriogénicas de T. cacao.
MATERIALES Y MÉTODOS
El trabajo
experimental se realizó en los Laboratorios de Ingeniería Metabólica
y Cultivo de Células y Tejidos del Centro de Bioplantas, Ciego de Ávila,
Cuba. El material vegetal para el cultivo in vitro se colectó
en el banco de germoplasma de la Estación Experimental de Cacao de Baracoa,
Instituto de Investigaciones Agro-Forestales, Baracoa, Cuba.
Para la formación de callos con estructuras embriogénicas, se
siguió la combinación de las metodologías con modificaciones
en la concentración de glucosa (166,52 mmol L-1) y 2,4-D (ácido
2,4-Diclorofenoxiacético, 18,096 μmol L-1) de acuerdo
a los resultados de experimentos previos (resultados no mostrados) (22, 23).
Los estaminoides del clon UF677, previamente seleccionado por su contenido de
compuestos fenólicos (resultados no mostrados), se desinfectaron con
hipoclorito de sodio 1 % (v:v) por 20 min, posteriormente se enjuagaron con
abundante agua destilada estéril. El material vegetal se colocó
en frascos de cultivo que contenían 25 mL de medio semisólido
(10 explantes por frasco).
Para la iniciación de los callos, los estaminoides se colocaron en medio
de crecimiento de callos primarios (PCG) (22), constituido por sales del medio
basal DKW (24), suplementadas con glucosa (166,52 mmol L-1),
tiamina-HCl (2 mg L-1), ácido nicotínico (1 mg
L-1), glicina (2 mg
L-1), 2,4 D (18,096 μmol
L-1), TDZ (N-phenyl-N´-1,2,3–thidiazol
5-ylurea, 0,023 μmol L-1),
L- glutamina (250 mg L-1), mioinositol (200 mg
L-1) y gelrite (2,5 g L-1)
(DUCHEFA) por 14 días. Posteriormente, para la proliferación de
los callos, se subcultivaron en medio de crecimiento de callos secundarios (SCG)
(22) modificado por Maximova (23), constituido por las sales del medio basal
WPM (25), suplementadas con glucosa (166,52 mmol L-1), tiamina-HCl
(10 mg
L-1), ácido nicotínico
(1 mg
L-1), piridoxina (1 mg
L-1), mioinositol (100 mg
L-1), 2,4 D (18,096 μmol
L-1), 6-BA (6-benciladenina; 0,222 μmol
L-1) y gelrite (2,5 g L-1)
(DUCHEFA) por 14 días.
Finalmente se colocaron en medio de desarrollo de embriones (ED) (22),
constituido por sales del medio basal DKW, suplementadas con sacarosa (87,64
mmol L-1), glucosa (5,55 mmol L-1), tiamina-HCl (2 mg
L-1), ácido nicotínico
(1 mg
L-1), glicina (2 mg
L-1) y mioinositol (100mg
L-1), donde se subcultivaron cada 14
d hasta la formación de callos con estructuras embriogénicas.
Los cultivos se mantuvieron a la oscuridad con una temperatura de 25 ±
2 C. Los frascos de cultivo consistieron en pomos de vidrio de 250 mL
de capacidad con tapas plásticas de cierre twig-soft para los experimentos
relacionados con la formación de callos y erlenmeyers de 250 mL para
los de producción de fenoles.
Obtención de compuestos fenólicos mediante el manejo de
condiciones de cultivo de callos con estructuras embriogénicas
Para incrementar el contenido de fenoles y la biomasa de los callos con estructuras
embriogénicas se evaluó el efecto de tres factores (concentración
de glucosa, luz y agitación) en medio líquido de desarrollo de
embriones. Para determinar el efecto de la concentración de glucosa en
la concentración de fenoles y el incremento de la biomasa, se probaron
diferentes concentraciones de glucosa (277,54; 222,03; 166,52; 111,02; 55,08
y 0,00 mmol L-1). El experimento se realizó en condiciones
de agitación, en zaranda orbital (RETOMED®) a 120 rpm,
con una temperatura de 25 ± 2 °C y en condiciones de oscuridad, con
erlenmeyers cubiertos de polietileno negro.
El efecto de la luz se determinó en dos condiciones de cultivo: oscuridad,
con erlenmeyers cubiertos de polietileno negro, y luz, con lámparas blancas
fluorescentes (Sylvania, F40T12/D 40 W) que proporcionaron un flujo de fotones
fotosintéticos de 60 µmol m-2s-1, ambos a una temperatura de 25
± 2 °C, en condiciones de agitación y con 277,54 mmol
L-1 de glucosa.
Para evaluar el efecto de la agitación se evaluaron dos condiciones de
cultivo: estático y agitación, en zaranda orbital (RETOMED®)
a 120 rpm, con una temperatura de 25 ± 2 °C, en condiciones de oscuridad,
con erlenmeyers cubiertos de polietileno negro y con 277,54 mmol
L-1 de glucosa.
Para los tres experimentos se utilizó 1 g de callos para cada tratamiento
y se evaluaron tres réplicas. A los 0, 14 y 28 d se determinó
la concentración de fenoles solubles en los callos. Para cada tratamiento
se calculó el incremento de la masa seca, restando la masa inicial (0
d) a la masa final (28 d). Se realizaron tres determinaciones por réplica.
Influencia de agentes elicitores sobre la producción de fenoles y la
masa de callos con estructuras embriogénicas y su excreción al
medio de cultivo
Con el objetivo de estimular la síntesis de fenoles en callos con estructuras
embriogénicas y su excreción al medio de cultivo, se utilizó
la metodología descrita (15), con la modificaciones dadas por el uso
de Biojas® (Biojas, ácido jasmónico, 1 g
L-1 i.a.), producido por el Instituto
Cubano de Investigaciones de Derivados de la Caña de Azúcar (ICIDCA)
en lugar de metil jasmonato. Se evaluó el efecto de tres elicitores:
dos ciclodextrinas: ciclodextrinas hidroxipropiladas al azar (CDHA) y ciclodextrinas
dimetiladas al azar (CDMA) y el Biojas.
Se transfirió a cada erlenmeyer, 1 g de callos con estructuras embriogénicas.
Los tratamientos de elicitación fueron: control (sin elicitor); Biojas
100 µM; CDMA 50 mM; CDHA 50 mM; CDHA (50 mM)+ Biojas (100 μM) y CDMA
(50 mM)+ Biojas (100 µM). Cada Erlenmeyer contenía 25 mL de medio
ED líquido modificado según los resultados anteriores.
El medio de cultivo líquido con las ciclodextrinas se esterilizó
en autoclave a 120 oC durante 20 min. El Biojas se adicionó
en el momento de montaje del experimento, esterilizándolo mediante filtración,
con filtro de 0,45 μm. A los siete días de la aplicación
de los elicitores se determinó el incremento en la masa seca (MS) y la
concentración de fenoles en los callos con estructuras embriogénicas
y en el medio de cultivo (mg g-1 MS). Se procesaron tres erlenmeyers
en cada tratamiento, considerado cada uno como una réplica. Se realizaron
tres determinaciones por réplica.
Determinación de compuestos fenólicos
Para la extracción de compuestos fenólicos, los callos se liofilizaron
y maceraron hasta obtener polvo fino. Las muestras se extrajeron en Soxhlet
Büchi, de acuerdo al procedimiento descrito (26). Para ello se desengrasaron
previamente con hexano (Merk) a 70 °C por 3 h (3 g en 30 mL), se secaron
para eliminar los restos de hexano y se extrajeron con igual tiempo, temperatura
y proporción de metanol (Merk). El procedimiento se repitió tres
veces.
La extracción de los compuestos fenólicos excretados al medio
de cultivo se realizó con la adición de igual volumen de acetato
de etilo frío que de medio de cultivo y se dejó en agitación
en la oscuridad toda la noche. La fase orgánica se concentró hasta
sequedad 60 °C en un rotoevaporador (Rotadex, Heidolph 94200) y finalmente
se resuspendió en 1 mL de metanol.
La cuantificación de fenoles se realizó en espectrofotómetro
(T70, UV/VIS spectrometer, PG Instruments Ltd., China) según procedimiento
(27). A 100 μL del extracto vegetal, se le adicionaron
900 μL
de agua destilada y 100 μL
del reactivo de Folin-Ciocalteu. La mezcla se dejó reposar durante cinco
minutos, luego se agregaron 600 μL
de una solución de 1 mol L-1 NaOH saturada con Na2CO3
y se incubó por 1 h a 25 °C para permitir el desarrollo del color.
Se midieron las absorbancias en espectrofotómetro a 725 nm. El contenido
de compuestos fenólicos se expresó en mg de fenoles por g de masa
seca (mg
g-1MS), referidos a una curva patrón
de ácido clorogénico.
Análisis estadístico
El procesamiento estadístico de los resultados se realizó con
el utilitario Statistical Package for Social Sciences (SPSS) versión
20 para Windows (28). Se realizaron pruebas paramétricas (T-test, ANOVA
de un factor y bifactorial). Se aplicaron pruebas de Tukey HSD en los casos
en los cuales los ANOVA presentaron diferencias significativas. Previamente
se demostró que los datos de cada tratamiento cumplían los supuestos
de distribución normal y homogeneidad de varianzas, según las
pruebas Kolmogorov-Smirnov y Levene respectivamente para p=0,05. Los detalles
del tratamiento estadístico aparecen en cada figura o tabla en el acápite
resultados y discusión.
RESULTADOS Y DISCUSIÓN
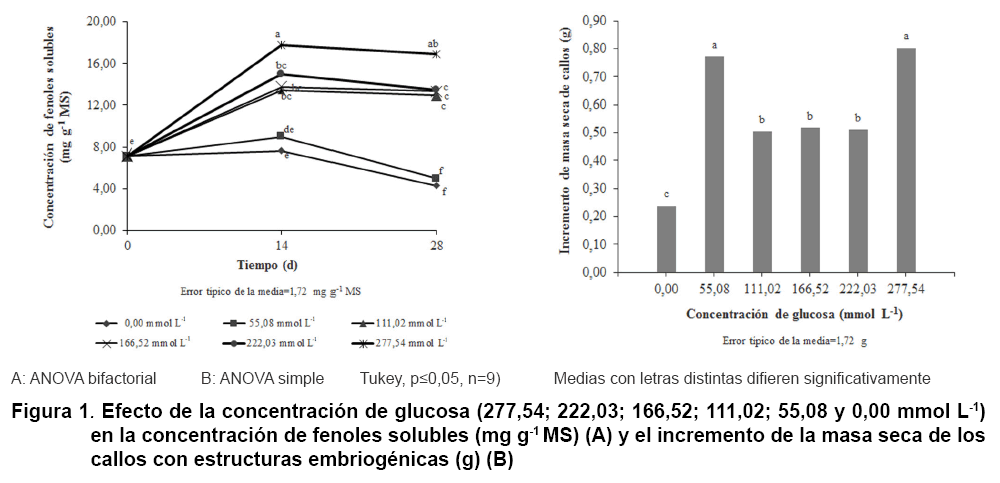
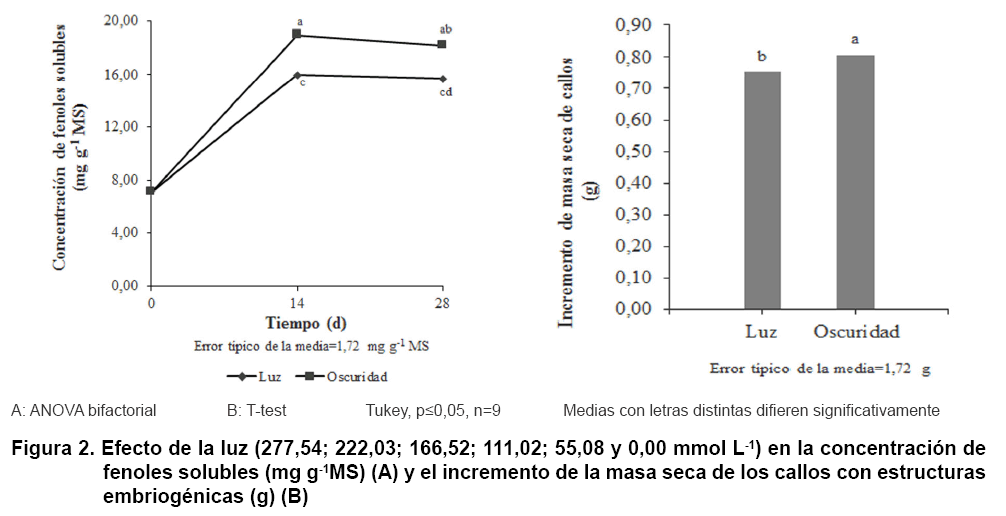
En las Figuras 1, 2 y 3 se muestran los resultados relacionados con el efecto de la concentración de glucosa (Figura 1), la luz (Figura 2) y la agitación (Figura 3) en la concentración de fenoles solubles (A) y en el incremento de la masa seca de los callos con estructuras embriogénicas (B).


La concentración de fenoles solubles (Figura
1 A) tuvo un máximo (17,79 y 16,87 mg
g-1 MS) a los 14 y 28 días, para
el tratamiento de mayor concentración de glucosa (277,54 mmol L-1),
sin diferencias significativas a iguales tiempos con 222,03 mmol L-1
del azúcar. En tanto que a 55,08 mmol L-1 la concentración
de fenoles fue baja, sin diferencias con el control. Mientras que, el incremento
de masa se favoreció con la mayor concentración de glucosa (277,54
mmol L-1), sin diferencia con la menor (55,08 mmol L-1),
con 0,3 g por encima del resto de los tratamientos y 0,56 g superior al control.
Estos resultados pueden estar relacionados con el estrés osmótico
provocado por altas concentraciones de azúcares, que pudieron favorecer
la síntesis y acumulación de los compuestos fenólicos.
Sin embargo, el incremento de la masa se puede asociar tanto con el aumento
de la síntesis de fenoles como con la diferenciación de los embriones
para el tratamiento con más glucosa. Este comportamiento no fue igual
con la menor concentración, donde el incremento de masa no se correspondió
con un aumento en la diferenciación de los embriones.
La producción de algunos fenoles está estrechamente relacionada
con los azúcares (29). Su síntesis incrementa con el uso de glucosa
durante el cultivo in vitro de Vitis vinífera L., en
concentraciones de 58,00; 234,00 y 468,00 mmol L-1 (30). Lo que se
asoció con que estos azúcares alteran la expresión de genes
estructurales y regulatorios, especialmente UDP-glucosa:antocianidin 3-0-glucosiltransferasa,
junto a una reprogramación masiva en rutas de señales de transducción.
Este gen se correlacionó con el contenido de antocianinas en frutos de
Vitis vinífera L. (31). Se comprobó que la síntesis
de antocianinas y de algunos flavonoides se favorece con el incremento de glucosa
(30). Por lo que el incremento de compuestos fenólicos que se obtuvo
en el presente experimento (Figura
1A) podría estar relacionado con la síntesis de diferentes
fenoles, entre los que deben encontrarse antocianinas y flavonoides.
La concentración de fenoles solubles (Figura
2A) y el incremento de la masa seca de los callos (Figura
2B) fueron mayores en condiciones de oscuridad que a la luz. La concentración
de fenoles tuvo un máximo (18,97 mg
g-1 MS) a los 14 d que se mantuvo, sin
diferencias significativas, a los 28 d (18,21 mg
g-1 MS). El incremento de masa seca
en los callos cultivados a la oscuridad fue ligeramente superior (0,05 g) a
los que se encontraban a la luz, no obstante esta diferencia de masa aportó
a la diferencia encontrada en la concentración de fenoles.
El efecto de la luz en el desarrollo de estructuras embriogénicas y tejidos
se ha estudiado a profundidad en los últimos años, como es el
caso de la influencia de la luz en la embriogénesis de cultivos como
Campanula punctata var. rubriflora (32) y Agave tequilana
var. Azul (33). Sin embargo, son menores los estudios realizados sobre
la influencia de la luz en la síntesis de metabolitos secundarios. En
este sentido, se conoce que la ausencia de luz puede hacer que los cultivos
se estresen, y por consiguiente se active la síntesis de algunos metabolitos
secundarios. Por ejemplo, la producción furanocumarinas se estimula a
la oscuridad durante el cultivo in vitro de brotes de Ruta graveolens
ssp divaricata (34); sin embargo, la síntesis de ácidos
fenólicos se estimuló en presencia de las luces blanca y azul.
Para el caso de la concentración de fenoles solubles en callos de T.
cacao, los mejores resultados fueron en condiciones de oscuridad; no obstante,
en condiciones de luz también se obtuvieron compuestos fenólicos,
lo que indica que en cada condición podrían estar acumulándose
diferentes grupos de compuestos fenólicos, lo que habría que comprobar
en futuras investigaciones.
Al analizar el efecto de la agitación en la concentración de fenoles
solubles (Figura 3A)
y el incremento de la masa seca de los callos (Figura
3B), se encontró que la agitación influyó de manera
positiva en ambos parámetros. La concentración de fenoles fue
mayor en agitación a partir de los 14 d (19,57 mg
g-1 MS), sin diferencias significativas
con los 28 d (19,13 mg
g-1 MS), con un incremento además,
de la masa seca a los 28 d, que supera al cultivo estático en 0,1 g.
La agitación es un factor que puede influir también en la obtención
de fenoles.
En el cultivo in vitro de embriones de Manguifera indica L.
se encontró presencia de fenoles tanto en condiciones de cultivo estática
como con agitación (35) y esta última favoreció el crecimiento
de los embriones somáticos, sin que estos se afectaran por la presencia
de compuestos tóxicos, como es el caso de algunos fenoles.
En la Figura 3 se puede
observar también que el aumento en la concentración de fenoles
no afectó el incremento de masa en el tratamiento de agitación.
Esto se ve reflejado también en la Figura
4, donde se pueden observar los callos con estructuras embriogénicas
(fundamentalmente embriones globulares) (A, B y C) y diferentes estados en la
formación de los embriones (embrión acorazonado (D), torpedo (E)
y cotiledonar (F)), a los 28 d de estar en agitación, oscuridad y con
glucosa a 50 g
L-1.

En resumen, las condiciones de cultivo juegan un papel fundamental, no solo
en el establecimiento del cultivo in vitro, sino también en
la producción de metabolitos en cultivos ya establecidos. La fuente de
carbono, la luz y la agitación son los factores que se evaluaron en el
presente trabajo.
Los mejores resultados se obtuvieron para 50 g
L-1 de glucosa, en la oscuridad y con
agitación. Estos tratamientos incrementaron tanto la masa seca como el
contenido de fenoles. No obstante, hasta este momento solo se obtuvo aumento
en el contenido de fenoles en los callos, por lo que se ensayaron diferentes
elicitores para estimular su excreción al medio de cultivo.
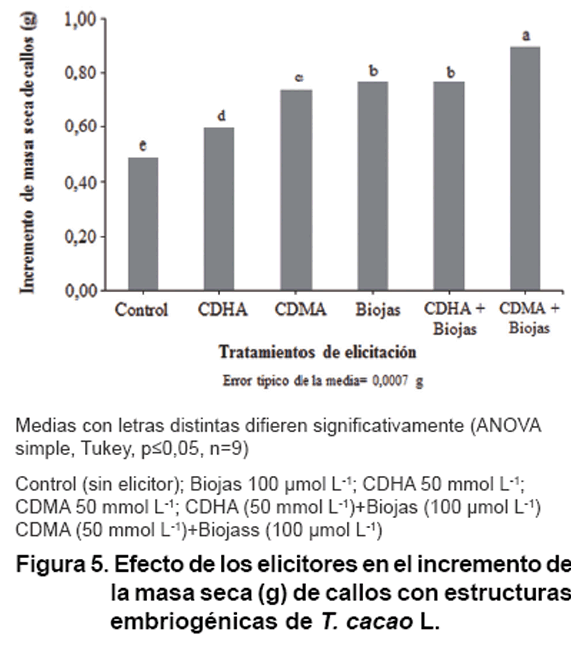
Los resultados del efecto de los tratamientos de elicitación probados,
el incremento de la masa seca y la concentración de fenoles solubles
en los callos con estructuras embriogénicas de T. cacao L. se
muestran en las Figuras
5 y 6, respectivamente.
Todos los elicitores estimularon el incremento de masa seca de callos (Figura
5) en comparación con el control. La combinación CDMA+Biojas
fue la que estimuló en mayor medida el incremento de masa de callos con
estructuras embriogénicas con 1,83 veces el incremento del control. El
elicitor que estimuló menor incremento de masa fue CDHA, con solo 1,22
veces el valor del control.
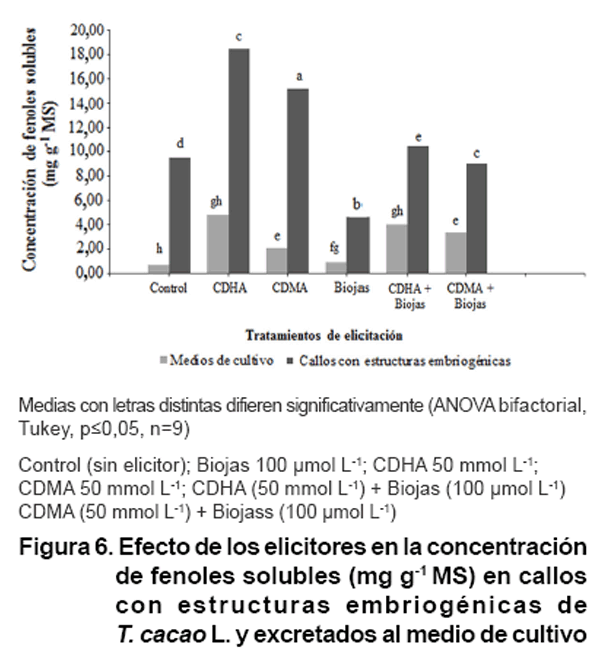
El efecto de los elicitores en la producción de fenoles durante el cultivo
de callos con estructuras embriogénicas de T. cacao fue positivo
(Figura 6). La concentración
de fenoles en los callos con estructuras embriogénicas incrementó
en todos los casos, excepto para el tratamiento con Biojas, que mantuvo la concentración
de fenoles por debajo del control.
La mayor concentración de fenoles en callos y medio de cultivo se obtuvo
con el tratamiento CDHA (18,50 y 4,82 mg
g-1 MS respectivamente).
Sin embargo, la excreción de fenoles al medio de cultivo, no mostró
diferencias significativas con CDHA+Biojas (4,05 mg
g-1 MS). Los menores valores se encontraron
en el control y Biojas. Por lo que en las condiciones de elicitación
probadas el tratamiento de CDHA mostró el mejor resultado, solo y combinado
con Biojas.
La adición de elicitores es una práctica común para incrementar
el contenido de metabolitos secundarios que tienen baja o nula concentración
en el cultivo in vitro comparado con plantas intactas (14). Se ha comprobado
que las ciclodextrinas tienen una fuerte actividad elicitando cultivos celulars
de V. vinifera para la producción de resveratrol y esta actividad
se logra solo con ciclodextrinas y con la combinación de éstas
con metiljasmonato (36, 37).
En suspensiones celulares Silybum marianum L., el metil jasmonato y
las ciclodextrinas CDHA y CDMA estimularon la síntesis y excreción
al medio de cultivo de flavolignanos y alcohol coniferílico (15), los
mejores resultados se obtuvieron con la combinación de CDMA a 50 mmol
L-1 + metiljasmonato 100 μmol L-1. Sin embargo, en
el cultivo de callos con estructuras embriogénicas de T. cacao
(Figura 6) se obtuvo
mayor excreción de compuestos fenólicos al medio de cultivo con
el tratamiento de CDHA 50 mmol L-1 sin diferencias con el de CDHA
a 50 mmol L-1 + Biojas 100 μmol
L-1.
En el presente trabajo, la acumulación de compuestos fenólicos
en callos se favoreció con el suplemento adicional de glucosa, el crecimiento
en agitación y a la oscuridad.
CONCLUSIONES
El uso de elicitores
provocó un incremento significativo de compuestos fenólicos y
los valores que se obtuvieron en callos (9,02-18,50 mg
g-1
MS) con todos los tratamientos, excepto Biojas, están por encima de los
que se obtuvieron en estudios anteriores (datos no mostrados) para las flores
de plantas en ambiente natural (7,44 mg
g-1
MS) y cercanos a los de hojas (19,98 mg
g-1
MS).
La excreción al medio de cultivo se mantuvo por debajo de lo encontrado
en los extractos de órganos de plantas en ambiente natural y se desconoce
cuáles son los compuestos fenólicos presentes en cada caso.
Para futuras investigaciones, se hace necesario incrementar los niveles de excreción
de los fenoles al medio de cultivo así como identificar su composición
química.
AGRADECIMIENTOS
Los autores agradecemos al banco de germoplasma de la Estación Experimental de Cacao de Baracoa, Instituto de Investigaciones Agro-Forestales, Baracoa, Cuba, por donar el material vegetal para el establecimiento del cultivo in vitro, y a los proyectos nacionales “Obtención e identificación de compuestos fenólicos a través de la aplicación de las técnicas de cultivo de células y tejidos en Theobroma cacao L” y “Obtención de extractos vegetales bioactivos, ricos en metabolitos secundarios para el control de plagas y enfermedades de cultivos de importancia agrícola”, que permitieron realizar esta investigación .
BIBLIOGRAFÍA
1. Vanisree, M.;
Lee, C.-Y.; Lo, S.-F.; Nalawade, S. M.; Lin, C. Y. y Tsay, H.-S. ‘‘Studies on
the production of some important secondary metabolites from medicinal plants
by plant tissue cultures’’. Botanical Bulletin of Academia Sinica,
vol. 45, no. 1, 2004, pp. 1–22, ISSN 0006-8063.
2. Ávalos, G. A. y Pérez-Urria, C. E. ‘‘Metabolismo secundario
de plantas’’. REDUCA (Biología), vol. 2, no. 3, 5 de octubre
de 2011, pp. 119-145, ISSN 1989-3620.
3. Kelebek, H. y Selli, S. ‘‘Identification of phenolic compositions and the
antioxidant capacity of mandarin juices and wines’’. Journal of Food Science
and Technology, vol. 51, no. 6, 15 de diciembre de 2011, pp. 1094-1101,
ISSN 0022-1155, 0975-8402, DOI 10.1007/s13197-011-0606-7.
4. Esquivel, G. E.; Noriega, C. R.; Bello, G. M.; Saavedra, M. A. y Salgado,
G. R. ‘‘Plantas utilizadas en la medicina tradicional mexicana con propiedades
antidiabéticas y antihipertensivas’’. Biológicas, vol.
14, no. 1, 2012,
pp. 45–52, ISSN 2007-705X, 2007-8145.
5. Li, Y.; Feng, Y.; Zhu, S.; Luo, C.; Ma, J. y Zhong, F. ‘‘The effect of alkalization
on the bioactive and flavor related components in commercial cocoa powder’’.
Journal of Food Composition and Analysis, vol. 25, no. 1, febrero de
2012, pp. 17-23, ISSN 0889-1575, DOI 10.1016/j.jfca.2011.04.010.
6. Céspedes, C. L.; Muñoz, E.; Lamilla, L.; Molina, S. F. y Alarcon,
J. ‘‘Insect growth regulatory, molting disruption and insecticidal activity
of Calceolaria talcana (Calceolariaceae: Scrophulariaceae) and Condalia
microphylla Cav. (Rhamnaceae)’’. En: Céspedes C. L., Sampietro D.
A., Seigler D. S., y Rai M., Natural Antioxidants and Biocides from Wild
Medicinal Plants, edit. CABI, Wallingford, UK, 2013, pp. 214-238, ISBN
978-1-78064-233-8.
7. Abdelnabby, H. M. y Abdelrahman, S. M. ‘‘Nematicidal activity of selected
flora of Egypt’’. Egyptian Journal of Agronematology, vol. 11, no.
1, 2012, pp. 106–124, ISSN 1110-6158.
8. Céspedes, C. L.; Salazar, J. R.; Ariza-Castolo, A.; Yamaguchi, L.;
Ávila, J. G.; Aqueveque, P.; Kubo, I. y Alarcón, J. ‘‘Biopesticides
from plants: Calceolaria integrifolia s.l.’’. Environmental Research,
vol. 132, julio de 2014, pp. 391-406, ISSN 0013-9351, DOI 10.1016/j.envres.2014.04.003.
9. dwards, H. G.; Villar, S. E. J.; de Oliveira, L. F. C. y Hyaric, M. L. ‘‘Analytical
Raman spectroscopic study of cacao seeds and their chemical extracts’’. Analytica
Chimica Acta, vol. 538, no. 1–2, 4 de mayo de 2005, pp. 175-180, ISSN 0003-2670,
DOI 10.1016/j.aca.2005.02.039.
10. Quiñones, G. J.; Trujillo, S. R.; Capdesuñer, R. Y.; Quirós,
M. Y. y Hernández, T. M. ‘‘Potencial de actividad antioxidante de extractos
fenólicos de Theobroma cacao L. (cacao)’’. Revista Cubana
de Plantas Medicinales,
vol. 18, no. 2, junio de 2013, pp. 201-215, ISSN 1028-4796.
11. Onomo, P. E.; Niemenak, N.; Djocgoue, P. F.; Ondobo, M. L. y Ndoumou, D.
O. ‘‘Heritability of polyphenols, anthocyanins and antioxidant capacity of Cameroonian
cocoa (Theobroma cacao L.) beans’’. African Journal of Biotechnology,
vol. 14, no. 36, 2015, pp. 2672-2682, ISSN 1684-5315, DOI 10.4314/ajb.v14i36.
12. Rojas, L. F.; Gallego, A.; Gil, A.; Londoño, J. y Atehortúa,
L. ‘‘Monitoring accumulation of bioactive compounds in seeds and cell culture
of Theobroma cacao at different stages of development’’. In Vitro
Cellular & Developmental Biology - Plant, vol. 51, no. 2, 3 de
abril de 2015, pp. 174-184, ISSN 1054-5476, 1475-2689, DOI 10.1007/s11627-015-9684-y.
13. Bourgaud, F.; Gravot, A.; Milesi, S. y Gontier, E. ‘‘Production of plant
secondary metabolites: a historical perspective’’. Plant Science, vol.
161, no. 5, octubre de 2001, pp. 839-851, ISSN 0168-9452, DOI 10.1016/S0168-9452(01)00490-3.
14. Ramachandra, R. S. y Ravishankar, G. A. ‘‘Plant cell cultures: Chemical
factories of secondary metabolites’’. Biotechnology Advances, vol.
20, no. 2, mayo de 2002, pp. 101-153, ISSN 0734-9750, DOI 10.1016/S0734-9750(02)00007-1.
15. Belchi, N. S.; Pedreño, M. A. y Corchete, P. ‘‘Methyl jasmonate increases
silymarin production in Silybum marianum (L.) Gaernt cell cultures
treated with ß-cyclodextrins’’. Biotechnology Letters, vol. 33,
no. 1, 25 de septiembre de 2010, pp. 179-184, ISSN 0141-5492, 1573-6776, DOI
10.1007/s10529-010-0406-6.
16. Pérez, A. N. L.; Labrada, F. A.; Pérez, A. C. y Pérez,
A. ‘‘Estimulación de cardenólidos en brotes de Digitalis purpurea
L. cultivados in vitro mediante elicitores’’. Revista Colombiana
de Biotecnología, vol. 16, no. 1, 2014, pp. 51–61, ISSN 0123-3475.
17. Riedel, H.; Akumo, D. N.; Saw, N.; Kütük, O.; Neubauer, P. y Smetanska,
I. ‘‘Elicitation and precursor feeding influence phenolic acids composition
in Vitis vinifera suspension culture’’. African Journal of Biotechnology,
vol. 11, no. 12, 2014, pp. 3000-3008, ISSN 1684-5315, DOI 10.4314/ajb.v11i12.
18. Esan, E. B. ‘‘Tissue culture studies on cacao (Theobroma cacao
L.). A supplementation of current research’’ [en línea]. En: 5th
International Cocoa Research Conference, edit. Ibadan, Nigeria, 1975, pp.
116–125, [Consultado: 11 de enero de 2016], Disponible en: <http://www.sidalc.net/cgi-bin/wxis.exe/?IsisScript=ARTIC.
xis&method=post&formato=2&cantidad=1&expresion= mfn=001018>.
19. Pence, V. C.; Hasegawa, P. M. y Janick, J. ‘‘Asexual embryogenesis in Theobroma
cacao L’’. Journal American Society for Horticultural Science,
vol. 104, 1979, pp. 145-148, ISSN 0003-1062.
20. Pancaningtyas, S. ‘‘Study on the presence and influence of phenolic compounds
in callogenesis and somatic embryo development of cocoa (Theobroma cacao
L.).’’. Pelita Perkebunan (Coffee and Cocoa Research Journal), vol.
31, no. 1, 2015, pp. 14–20, ISSN 0215-0212.
21. Alemanno, L.; Ramos, T.; Gargadenec, A.; Andary, C. y Ferriere, N. ‘‘Localization
and Identification of Phenolic Compounds in Theobroma cacao L. Somatic
Embryogenesis’’. Annals of Botany, vol. 92, no. 4, 10 de enero de 2003,
pp. 613-623, ISSN 0305-7364, 1095-8290, DOI 10.1093/aob/mcg177, PMID: 12933367.
22. Li, Z.; Traore, A.; Maximova, S. y Guiltinan, M. J. ‘‘Somatic embryogenesis
and plant regeneration from floral explants of cacao (Theobroma cacao
L.) using thidiazuron’’. In Vitro Cellular & Developmental
Biology - Plant, vol. 34, no. 4, octubre de 1998, pp. 293-299, ISSN 1054-5476,
1475-2689, DOI 10.1007/BF02822737.
23. Maximova, S. N.; Alemanno, L.; Young, A.; Ferriere, N.; Traore, A. y Guiltinan,
M. J. ‘‘Efficiency, genotypic variability, and cellular origin of primary and
secondary somatic embryogenesis of Theobroma cacao L.’’. In Vitro
Cellular & Developmental Biology - Plant, vol. 38, no. 3, mayo
de 2002, pp. 252-259, ISSN 1054-5476, 1475-2689, DOI 10.1079/IVP2001257.
24. Driver, J. A. y Kuniyuki, A. H. ‘‘In vitro propagation of Paradox
walnut rootstock (Juglans hindsii x Juglans regia, tissue culture)’’. Hortscience,
vol. 19, 1984, pp. 507-509, ISSN 0018-5345.
25. Lloyd, G. y McCown, B. ‘‘Commercially-feasible micropropagation of Mountain
laurel, Kalmia latifalia by use of shoot-tip culture’’. Acta Horticulturae,
vol. 30, 1981, pp. 421-427, ISSN 0567-757.
26. Ahmad, A.; Alkarkhi, A. F.; Hena, S.; Siddique, B. M. y Dur, K. W. ‘‘Optimization
of Soxhlet extraction of Herba Leonuri using factorial design of experiment’’.
International Journal of Chemistry, vol. 2, no. 1, 2010, pp. 198-205,
ISSN 1916-9698.
27. Friend, J. ‘‘Lignin and associated phenolic acids in cell walls’’. En: Gurr
S. J., McPherson M. J., y Bowles D. J., Molecular plant pathology: a practical
approach, edit. IRC Press at Oxford University Press, 1992, pp. 51- 59,
ISBN 978-0-19-963351-7.
28. IBM SPSS Statistics [en línea]. versión 20, [Windows], edit.
IBM Corporation, U.S, 2011, Disponible en: <http://www.ibm.com>.
29. Castellarin, S. D.; Gambetta, G. A.; Wada, H.; Shackel, K. A. y Matthews,
M. A. ‘‘Fruit ripening in Vitis vinifera: spatiotemporal relationships
among turgor, sugar accumulation, and anthocyanin biosynthesis’’. Journal
of Experimental Botany, 16 de mayo de 2011, p. err150, ISSN 0022-0957,
1460-2431, DOI 10.1093/jxb/err150, PMID: 21586429.
30. Dai, Z. W.; Meddar, M.; Renaud, C.; Merlin, I.; Hilbert, G.; Delrot, S.
y Gomès, E. ‘‘Long-term in vitro culture of grape berries and
its application to assess the effects of sugar supply on anthocyanin accumulation’’.
Journal of Experimental Botany, vol. 65, no. 16, 8 de enero de 2014,
pp. 4665-4677, ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/ert489, PMID: 24477640.
31. Zheng, Y.; Li, J. h.; Xin, H. p.; Wang, N.; Guan, L.; Wu, B. h. y Li, S.
h. ‘‘Anthocyanin profile and gene expression in berry skin of two red Vitis
vinifera grape cultivars that are sunlight dependent versus sunlight independent’’.
Australian Journal of Grape and Wine Research, vol. 19, no. 2, 1 de
junio de 2013, pp. 238-248, ISSN 1755-0238, DOI 10.1111/ajgw.12023.
32. Sivanesan, I.; Lim, M. Y. y Jeong, B. R. ‘‘Somatic embryogenesis and plant
regeneration from leaf and petiole explants of Campanula punctata Lam.
var. rubriflora Makino’’. Plant Cell, Tissue and Organ Culture
(PCTOC), vol. 107, no. 2, 3 de junio de 2011, pp. 365-369, ISSN 0167-6857,
1573-5044, DOI 10.1007/s11240-011-9983-x.
33. Rodríguez, S. A.; Acevedo, H. G.; Rodríguez, D. J. M.; Rodríguez,
G. B.; Cervantes, M. J. y Castellanos, H. O. A. ‘‘Effect of light quality and
culture medium on somatic embryogenesis of Agave tequilana Weber var.
Azul’’. Plant Cell, Tissue and Organ Culture (PCTOC), vol.
104, no. 2, 25 de agosto de 2010, pp. 271-275, ISSN 0167-6857, 1573-5044, DOI
10.1007/s11240-010-9815-4.
34. Szopa, A.; Ekiert, H.; Szewczyk, A. y Fugas, E. ‘Production of bioactive
phenolic acids and furanocoumarins in in vitro cultures of Ruta
graveolens L. and Ruta graveolens ssp. divaricata (Tenore) Gams.
under different light conditions’’. Plant Cell, Tissue and Organ Culture
(PCTOC), vol. 110, no. 3, 7 de abril de 2012, pp. 329-336, ISSN 0167-6857,
1573-5044, DOI 10.1007/s11240-012-0154-5.
35. Pérez, H. J. B. y Grajal, M. M. J. ‘‘In Vitro Culture of
Immature Zygotic Mango Embryos and Plantlet Development’’. HortScience,
vol. 46, no. 11, 11 de enero de 2011, pp. 1528-1532, ISSN 0018-5345, 2327-9834.
36. Belchí, N. S.; Almagro, L.; Lijavetzky, D.; Bru, R. y Pedreño,
M. A. ‘‘Enhanced extracellular production of trans-resveratrol in Vitis
vinifera suspension cultured cells by using cyclodextrins and methyljasmonate’’.
Plant Cell Reports, vol. 31, no. 1, 7 de septiembre de 2011, pp. 81-89,
ISSN 0721-7714, 1432-203X, DOI 10.1007/s00299-011-1141-8.
37. Belchí, N. S.; Almagro, L.; Sabater, J. A. B.; Fernández,
P. F.; Bru, R. y Pedreño, M. A. ‘‘Early signaling events in grapevine
cells elicited with cyclodextrins and methyl jasmonate’’. Plant Physiology
and Biochemistry, vol. 62, enero de 2013, pp. 107-110, ISSN 0981-9428,
DOI 10.1016/j.plaphy.2012.11.001.
Recibido: 15 de
mayo de 2015
Aceptado: 18 de enero de 2016
Janet Quiñones-Galvez, Centro de Bioplantas, Universidad de Ciego de Ávila. carretera a Morón, km 9, Ciego de Ávila. CP 69450. Cuba. Email: jquinones@bioplantas.cu