Evaluación
cualitativa de monoterpenos en Rosmarinus officinalis cultivados con
agua tratada magnéticamente
Qualitative
evaluation of monoterpenes in Rosmarinus officinalis cultivated with
magnetically treatment water
Yilan
Fung Boix,I Jorge Molina Torres,II Enrique
Ramírez Chávez,II Liliana Gómez Luna,I
Janet Quiñones-Galvez,III Albys Ferrer
Dubois,I Elizabeth Isaac Alemán,I Ann CuypersIV
ICentro
Nacional de Electromagnetismo Aplicado, CNEA. Universidad de Oriente, ave Las
Ameritas s/n. Santiago de Cuba, Cuba, CP 90400.
IICINVESTAV, Unidad Irapuato. km 9.6 libramiento norte, CP 36821.
Irapuato, Guanajuato. México.
IIICentro de Bioplantas, Universidad de Ciego de Ávila.
Carretera a Morón, km 9. Ciego de Ávila. CP 69450, Cuba.
IVCentro de Ciencias Ambientales. Universidad de Hasselt. Bélgica.
RESUMEN
La familia Lamiaceae
(labiatae labiadas), está formada por numerosas especies entre ellas
el Rosmarinus officinalis L. La misma constituye una de las especies
con mayor poder antioxidante por la presencia de sus aceites esenciales, monoterpenos
y compuestos fenólicos. Su propagación vegetativa en Cuba es una
de sus dificultades y en estos momentos se encuentra retirada del Formulario
Nacional de Fitofármacos, debido a la disponibilidad en el país.
El agua tratada magnéticamente ha sido muy utilizada en el riego ya que
estimula el crecimiento y desarrollo de las plantas, mostrando que su aplicación
puede activar el metabolismo de las células; sin embargo, los estudios
han sido muy limitados en estos aspectos. El objetivo del trabajo fue evaluar
los compuestos bioactivos monoterpenos presentes en la especie Rosmarinus
officinalis L., cultivadas con agua tratada magnéticamente en Santiago
de Cuba. Los extractos n-hexano fueron analizados a través del método
de cromatografía de capa fina de alta resolución (HPTLC), en sílica
gel (placas Fluka, alufoils analítica espesor 0,2 mm), con sistema de
solvente de tolueno y acetato de etilo, soluciones estándares de monoterpenos:
cineol, borneol, geraniol, linalol, citral, eucaliptol, citronelal y dos tipos
de reveladores la vainillina en etanol al 10 % y una solución de ácido
sulfúrico en etanol, la observación fueron con luz blanca. Se
obtuvo como resultado que los extractos de las plantas tratadas con 120 mT y
las plantas control, se identificaron la presencia de monoterpenos con un factor
de retención (Rf) entre 0,08-0,93.
Palabras
clave: cromatografía, campo magnético, lamiaceae, plantas
medicinales.
ABSTRACT
Lamiaceae (labiatae
labiadas) family have many species for example Rosmarinus officinalis
L., it is one of the species with the highest antioxidant power by the presence
of essential oils, monoterpenes and phenolic compounds. Its vegetative propagation
in Cuba is one of its difficulties and in recent years, this species has been
removed from the National Formulary of Phytopharmaceuticals because of its availability.
The magnetically treated water has been used for irrigation because it stimulates
the growth and development of plants, showing that its application can activate
metabolism of cells; however, studies have been very limited in these respects.
The aim of this work was to evaluate monoterpen bioactive compounds present
in the species Rosmarinus officinalis L., cultivated with magnetically
treated water in Santiago de Cuba. N-hexane extracts were analysed by the method
of thin layer chromatography of high-resolution (HPTLC) silica gel (fluka plates,
foils analytical Alu thickness 0, 2 mm) with a solvent system of toluene and
ethyl acetate. Monoterpen standard solutions as cineol, borneol, geraniol, linalool,
citral, eucalyptol, citronellal were used and two types of developers vanillin
in 10 % ethanol and a solution of sulphuric acid in ethanol, the observation
was with white light. The results showed that hexane extracts from treated plants
with 120 mT and control plants had the presence of monoterpens, and it was identified
with retention factor (Rf) between 0,08 to 0,93.
Key words:
chromatography, magnetic field, lamiaceae, medicinal plants.
INTRODUCCIÓN
Rosmarinus
officinal L.es una de las plantas utilizadas en la medicina tradicional,
debido a la presencia de diferentes compuestos entre los que se encuentran los
compuestos fenólicos, ácido rosmarinico, flavonoides, monoterpenos,
ac. carnosico, carnosol y rosmanol (1). Debido a su alto contenido de estos
metabolitos presenta elevada actividad antioxidante y sus extractos constituyen
excelente secuestradores de radicales libres (estrés oxidativo) (2),
o moléculas que al reaccionar con las proteínas, grasas y ácidos
nucleicos, pueden causar cambios que originan enfermedades cardíacas,
cáncer, Alzheimer y envejecimiento prematuro.
Las condiciones ecológicas en diferentes países pueden influir
en los compuestos fitoquímicos de las plantas, ya que pueden ser acumulados
particularmente debido a las respuestas de las condiciones ambientales (3).
Por lo que dependiendo del lugar geográfico donde crezcan las plantas
bajo condiciones de clima, suelo, humedad, altura sobre el nivel del mar generan
diferentes cambios en cantidad y tipos de moléculas bioactivas presentes;
por ejemplo, las variedades de romero originarias de Portugal se caracterizan
por poseer altas cantidades de mirceno, mientras que en Francia es el alcanfor
y en Marruecos el cineol los que se encuentran en mayor concentración
(4, 5).
En Cuba esta planta crece de manera espontánea y sus cultivos se encuentra
en jardines privados. Es una especie que florece esporádicamente y cuando
lo hace, sus semillas presentan poca viabilidad. Del mismo modo, su propagación
vegetativa en la mayoría de las ocasiones presenta dificultades en el
enraizamiento de las estacas y cuando logran generar raíces su crecimiento
es muy lento (6). Actualmente se encuentra retirada del formulario nacional
de fitofármacos y apifármacos por disponibilidad del cultivoA;
y en los últimos años esta especie forma parte del listado de
plantas priorizadas para el desarrollo de la medicina natural y tradicional
en nuestro país.
Recientemente, el uso de los campos magnéticos para la estimulación
del crecimiento vegetal es cada vez más utilizada debido a la menor influencia
perjudicial sobre el medio ambiente. Entre los métodos empleados se destaca
el agua tratada con campo magnético estático en sistemas de riego,
reportándose los efectos beneficiosos en la producción y rendimiento
de las plantas.aunque estos estudios son todavía muy limitados se plantea
que los efectos biológicos del campo magnético dependen de los
niveles de inducción magnética, tiempo de exposición, contenido
de iones, calidad, volumen y flujo del agua, así como la temperatura
(7).
El agua tratada magnéticamente ha sido utilizada en la agricultura y
su aplicación en el riego mejora el crecimiento, desarrollo y productividad
en las plantas (8). Estudios realizados hasta la actualidad han demostrado el
papel significativo del riego con agua tratada magnéticamente sobre las
plantas, siendo recomendada para el ahorro del agua en el riego (9, 10).
Otros estudios del tema han mostrado que la aplicación de campos magnéticos
en el agua de riego puede activar el metabolismo celular. Investigaciones en
plantas de frijol regadas con agua tratada magnéticamente obtuvieron
un incremento en el crecimiento, concentración de giberelinas (GA3),
kinetina, pigmentos fotosintéticos (clorofila a, b y carotenoides), en
comparación con plantas que fueron regadas con agua sin tratamiento magnético
(8). Otros estudios en la irrigación con agua tratada magnéticamente
en plantas de garbanzo indujo un efecto positivo en el porcentaje de germinación
y rendimientos de dichas plantas (11, 12). Otros autores utilizaron 125 mT en
la germinación de Glyxine max, obteniendo un incremento de la
rubisco (13). En la especie Raphanus sativus se obtuvieron estimulación
en la síntesis de lípidos en cloroplastos, mitocondrias y membrana
celular cuando fue aplicado el campo magnético con una densidad de flujo
de 500 μT (14). También fueron encontrados aumentos positivos en
el rendimiento de las semillas, y estimulación en la síntesis
de los lípidos en rábano (14, 15).
El objetivo del trabajo fue evaluar la presencia de los compuestos bioactivos
monoterpenos presentes en la especie Rosmarinus officinalis L. cultivadas
con agua tratada magnéticamente en Santiago de Cuba, a través
de las técnicas de cromatografía de capa fina de alta resolución
(TLC/HPTLC).
MATERIALES
Y MÉTODOS
Las plantas
fueron cultivadas en la parcela experimental (CNEA) en Santiago de Cuba, mediante
la metodología planteada (16). La especie fue depositada en el herbario
del Centro de Biodiversidad y Ecosistemas (BIOECO) en la misma provincia con
registro No. 21324.
Material vegetal
Como material inicial se emplearon hojas de plantas adultas de la especie Rosmarinus
officinalis L. de 50 cm de longitud, cultivadas en los canteros de la parcela
experimental del CNEA, las mismas tenían seis meses de edad.
Se tomaron los datos meteorológicos existentes en el período durante
el cual se desarrolló la investigación, la temperatura osciló
entre 30 ºC+2; un valor promedio de humedad relativa entre 60 y 70 %; precipitaciones
entre 55 y 60 mm3. El sustrato estaba formado por materia orgánica y
tierra (1:2), así como los diferentes tipos de minerales.
En las propiedades físicas del suelo se encuentran:
Materia orgánica > 4,3 %
Conductividad eléctrica: 271 μs
cm-1
pH: 6,8
El riego se realizó dos veces al día a través de un sistema
de microjet por goteo, durante 30 minutos, el cual tiene entre sus accesorios
una bomba itur y un sistema distribuidor, controlado por válvulas que
garantizan que el riego se realice por secciones.
Las características del agua de riego utilizada fueron:
Velocidad del agua: 1,4 – 1,6 m/s
Caudal de la bomba: 2,54 – 2,91 m3h-1
Conductividad eléctrica: 208 μscm-1
Ph: 7,50
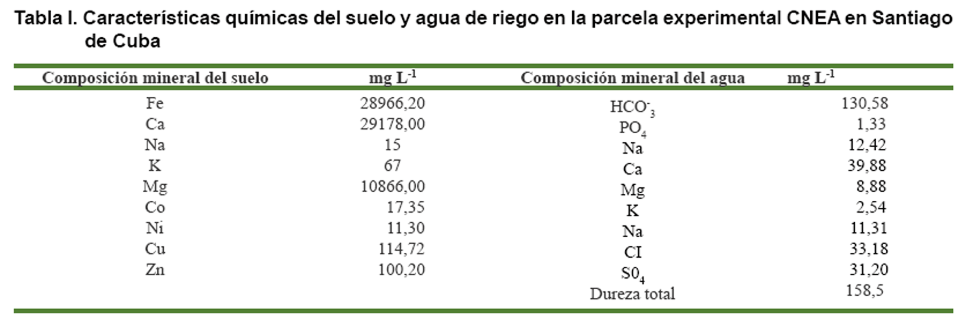
Se realizó el análisis químico al suelo y agua de riego,
obteniéndose los siguientes valores promedios (Tabla
I).
Tratamiento magnético
Para cada tratamiento magnético se utilizó un magnetizador exterior
de imanes permanentes, diseñado, construido y calibrado en el centro
nacional de electromagnetismo aplicado (CNEA). Se utilizó un magnetizador
exterior de imanes permanentes con una longitud de 10 cm y una inducción
magnética de 120 mT, la inducción magnética fue medida
con un Microweberímetro 192041, de error relativo de las mediciones menores
del 5 %. El tamaño de muestra fue de 40 plantas por cada tratamiento.
Los tratamientos estudiados fueron:
Tratamiento 1 (T1): plantas testigo, que no fueron regadas con agua tratada
magnéticamente.
Tratamiento 2 (T2): plantas regadas con agua tratada magnéticamente a
una inducción magnética de 120 mT.
Obtención de los extractos con solvente hexano a partir de hojas de R.
officinalis L.
Las hojas fueron colectadas y sometidas a un proceso de secado en una estufa
a 40 ºC hasta peso constante. Se emplearon tres gramos de hojas como peso
inicial de cada tratamiento en 100 ml del solvente. Se realizaron extracciones
sucesivas con hexano como solvente, con la finalidad de lograr un mayor agotamiento
del material vegetal seco triturado. La extracción se realizó
con el equipo Soxhlet durante cuatro horas de reflujo continuo. Lo extraído
se filtró y concentró en un equipo Rotoevaporador Buchi modelo
461 a temperatura de 40 0C, hasta reducirlo a un volumen de 10 ml, para luego
ser almacenado para su posterior análisis.
Análisis
bioquímico
La determinación de los pigmentos fotosintéticos de R. officinalis
l. se realizó según metodología (17). Para ello se pesaron
100 mg de hojas frescas, se colocaron en un mortero con acetona al 80 %, en
el que se maceraron y pasaron a un papel de filtro Whatman (GF/A, 110 mm), se
obtuvo como volumen final 20 ml de la solución.
Las mediciones se realizaron en un espectrofotómetro UV-1602, a longitudes
de onda de 663, 646 y 470 nm, y como blanco acetona al 80 %.
Los cálculos se realizaron a través de las fórmulas:
Chl a (μg
ml-1extracto) =12,21 * A663-2,81*A646
Chl b (μg
ml-1extracto) =20,13 * A646–5,03*A663
Carotenoides (μg
ml-1extracto)=1000*A470–3,27*Chla- 104*Chl b-L
La evaluación cualitativa se realizó a través de la técnica
de Cromatografía en Capa Fina de Alta Resolución (HPTLC), en sílica
gel (placas Fluka, Alufoils analítica thickness 0,2 mm). Se aplicaron
en la cromatoplaca 2 microlitros de las soluciones estándares de monoterpenos:
cineol, borneol, geraniol, linalol, citral, eucaliptol y citronelal, además
de los dos extractos preparados previamente. El sistema de solventes fue: tolueno
y acetato de etilo (93:7), una vez desarrollada la placa fue revelada con dos
tipos de soluciones: vainillina en etanol y la segunda solución etanol
con ácido sulfúrico, luego fue calentada la placa a 110 0C durante
cinco minutos, observada a la luz blanca (18).
Los datos experimentales obtenidos de la concentración de pigmentos fotosintéticos,
se procesaron estadísticamente mediante un análisis de varianza
de clasificación simple para un 95 % de confianza, y una prueba de t-Student.
Los resultados se expresaron en valores medios±error estándar.
RESULTADOS
Y DISCUCIÓN
Para la
variable concentración de pigmentos fotosintético aunque no existieron
diferencias estadísticamente significativas, desde el punto de vista
biológico los mayores valores de clorofilaa (1,70±0,04
mg L-1), clorofilab (0,60±0,04 mg L-1)
y carotenos (0,52±0,04mg L-1)
fueron en las plantas tratadas siendo el testigo los menores valores de clorofila
a (1,40±0,06mg L-1),
clorofilab (0,33±0,03mg L-1)
y carotenos (0,40±0,03 mg L-1
)(Tabla II).

En la figura se muestra
la evaluación cualitativa de los monoterpenos presentes en extractos
hexano de R. officinalis L:,cultivados con agua tratada magnéticamente
y con agua sin tratamiento magnético. Se presentan los estándares
de monoterpenos cineol, borneol, geraniol, linalol, citral, eucaliptol y citronelal,
además de los extractos.
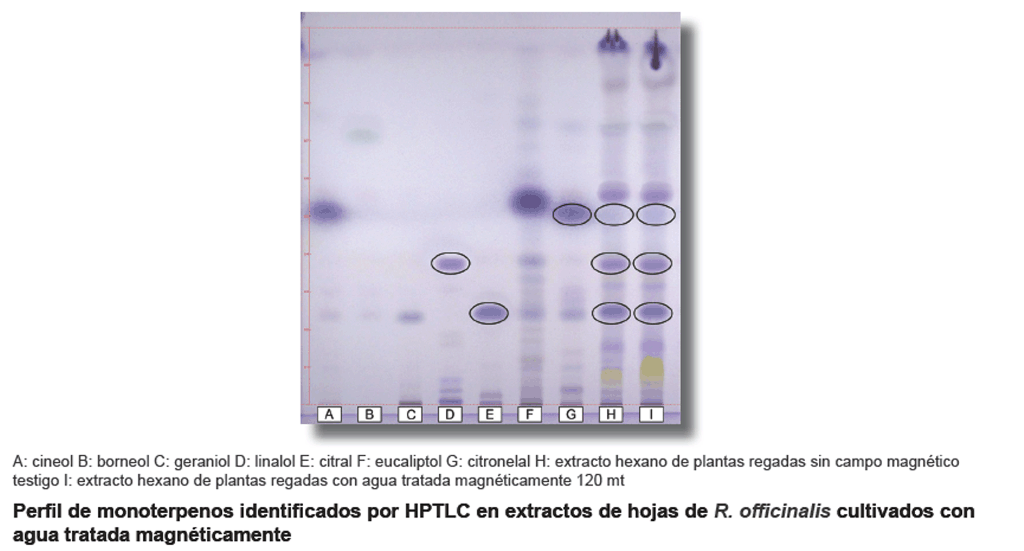
El estudio de los compuestos bioactivos en los extractos procedentes de las
plantas regadas sin y con agua tratada magnéticamente, mostraron la presencia
de algunos de los compuestos estándares en su composición, existiendo
coincidencia de la estándares linalol (0,38), citral (0,25) y citronelal
(0,50) para los extractos procedentes de plantas regadas sin y con agua tratada
magnéticamente como se observa en la (Tabla
III).

En los resultados algunos de los compuestos presentes en nuestros extractos
están relacionados con la composición química de los aceites
esenciales en la especie Rosmarinus officinalis cultivado en Pakistán,
los cuales fueron determinados por métodos de cromatografía gaseosa
y espectrometría de masa. En donde aparecen los grupos de monoterpenos
oxigenados con un 67 % y los hidrogenados en un 27 % (3).
Debido a la importancia de los antioxidantes naturales existen estudios sobre
los diferentes tipos de obtención y propiedades, pero la escasa difusión
de los mismos y las diferentes condiciones de experimentación, hacen
que se necesite de ajustes de ciertos parámetros de extracción
como solventes y dosificación para que puedan más utilizados.
En la familia de las Lamiaceae, el aceite esencial se produce en las hojas por
estructuras secretoras como los tricomas glandulares, peltados y capitados.
En este aspecto el R. officinalis se han reportado diversos compuestos
químicos, los cuales han sido agrupados de manera general por diversos
autores, y se han identificado presencia de a-pineno, ß-pineno, canfeno,
ésteres terpénicos como el 1,8-cineol, alcanfor, linalol, verbinol,
carnosol, rosmanol, isorosmanol, 3-octanona, isobanil-acetato y ß-cariofileno;
los ácidos vanílico, caféico, clorogénico, oleanólico,
rosmarínico, carnósico, ursólico, butilínico, betulínico,
betulina, a-amirina, ß-amirina, borneol, terpineol, linalol, citronelal
y acetato de bornilo (19, 20).
Estudios realizados en Melissa officinalis perteneciente a la misma
familia del R. officinalis reportaron en sus aceites esenciales compuestos
similares como linalol, citronelal, metilcitronelal, siendo los monoterpenos
los mayoritarios en la composición fitoquímica (21).
Los resultados obtenidos demuestran que las plantas regadas con agua tratada
magnéticamente a una inducción de 120 mT, se obtuvieron mejores
valores en la concentración de pigmentos fotosintéticos, en comparación
con las plantas testigo. Al igual que se comprobaron la presencia de los monoterpenos
linalol, citronelal y citral en los extractos obtenidos de plantas regadas con
agua tratada magnéticamente y plantas control. Demostrándose que
el campo magnético no varió ningún compuesto en ambos extractos;
la ausencia de los demás estándares en la placa, pudo ser debido
al método de extracción utilizado.
Este estudio contribuyó al conocimiento de la aplicación del agua
tratada con campo magnético estático y su influencia en el riego
del romero. Al mismo tiempo se utilizó el método de HPTLC como
una herramienta rápida y económica para el análisis de
drogas secas y extractos naturales. Todo ello permite la obtención de
una materia prima desde el campo con mejor calidad, y que pueda ser utilizada
en la elaboración de extractos antioxidantes naturales.
CONSLUSIONES
El trabajo
se obtuvo mayores valores de clorofila a, b y carotenos con respecto a las plantas
testigo. Se demuestra que el Rosmarinus officinalis cultivado con agua
tratada magnéticamente presenta los mismos compuestos que las plantas
sin tratamiento magnético. A través de las técnicas de
Cromatografía de Capa Fina o Cromatografía de Capa Fina de Alta
Resolución (TLC/HPTLC) se puede autenticar de forma preliminar y rápida,
sustancias presentes en extractos naturales que son utilizados como medicamentos
naturales o Fitofármacos.
AGRADECIMIENTOS
Los autores
ofrecen las gracias a la colaboración internacional de la Secretaría
de Relaciones Exteriores (SRE)/CINVESTAV. Irapuato (México). Proyecto
VLIR/UO, Universidad de Hasselt (Bélgica)/ Universidad de Oriente/CNEA
(Cuba).
Notas al
pie
A
Buró nacional de farmacia MINSAP. Formulario nacional fitofármacos
y apifármacos. Edit. Ciencias médicas, la Habana, 2010.
BIBLIOGRAFÍA
1. Fernández,
L. F.; Palomino, O. M. y Frutos, G. ‘‘Effectiveness of Rosmarinus officinalis
essential oil as antihypotensive agent in primary hypotensive patients and its
influence on health-related quality of life’’. Journal of Ethnopharmacology,
vol. 151, no. 1, 10 de enero de 2014, pp. 509-516, ISSN 0378-8741, DOI 10.1016/j.jep.2013.11.006.
2. Afonso, M. S.; de O Silva, A. M.; Carvalho, E. B.; Rivelli, D. P.; Barros,
S. B.; Rogero, M. M.; Lottenberg, A. M.; Torres, R. P. y Mancini-Filho, J. ‘‘Phenolic
compounds from Rosemary (Rosmarinus officinalis L.) attenuate oxidative
stress and reduce blood cholesterol concentrations in diet-induced hypercholesterolemic
rats’’. Nutrition & Metabolism, vol. 10, 2013, p. 19, ISSN 1743-7075,
DOI 10.1186/1743-7075-10-19.
3. Hussain, A. I.; Anwar, F.; Chatha, S. A. S.; Jabbar, A.; Mahboob, S. y Nigam,
P. S. ‘‘Rosmarinus officinalis essential oil: antiproliferative, antioxidant
and antibacterial activities’’. Brazilian Journal of Microbiology,
vol. 41, no. 4, diciembre de 2010, pp. 1070-1078, ISSN 1517-8382, DOI 10.1590/S1517-83822010000400027.
4. Boix, Y. F.; Victório, C. P.; Defaveri, A. C. A.; Arruda, R. D. C.
D. O.; Sato, A. y Lage, C. L. S. ‘‘Glandular trichomes of Rosmarinus officinalis
L.: Anatomical and phytochemical analyses of leaf volatiles’’. Plant Biosystems
- An International Journal Dealing with all Aspects of Plant Biology, vol.
145, no. 4, 1 de diciembre de 2011, pp. 848-856, ISSN 1126-3504, DOI 10.1080/11263504.2011.584075.
5. Rodríguez, E. A.; Árias, A. J.; Vásquez, E. G.; Martínez,
J. R. y Stashenko, E. E. ‘‘Rendimiento y capacidad antioxidante de extractos
de Rosmarinus officinalis, Salvia officinalis y Psidium guajava obtenidos
con CO2 supercrítico’’. Revista de la Academia Colombiana de Ciencias
Exactas, Físicas y Naturales, vol. 36, no. 140, septiembre de 2012,
pp. 305-316, ISSN 0370-3908.
6. Herrera, J. G. Á.; Rodríguez, S. L. y Chacón, E. ‘‘Efecto
de diferentes tamaños de esqueje y sustratos en la propagación
del romero (Rosmarinus officinalis L.)’’. Agronomía Colombiana,
vol. 25, no. 2, 6 de marzo de 2010, pp. 224-230, ISSN 2357-3732.
7. Teixeira,
da S. J. A. y Dobránszki, J. ‘‘Impact of magnetic water on plant growth’’.
Environmental and Experimental Biology, vol. 12, 2014, pp. 137–142,
ISSN 2255-9582.
8 . Ali, Y.; Samaneh, R. y Kavakebian, F. ‘‘Applications of Magnetic Water Technology
in Farming and Agriculture Development: A Review of Recent Advances’’. Current
World Environment, vol. 9, no. 3, 31 de diciembre de 2014, pp. 695-703,
ISSN 09734929, 23208031, DOI 10.12944/CWE.9.3.18.
9 . Mostafazadeh-Fard, B.; Khoshravesh, M.; Mousavi, S. y Kiani, A. ‘‘Effects
of Magnetized Water and Irrigation Water Salinity on Soil Moisture Distribution
in Trickle Irrigation’’. Journal of Irrigation and Drainage Engineering,
vol. 137, no. 6, 2011, pp. 398-402, ISSN 0733-9437, DOI 10.1061/(ASCE)IR.1943-4774.0000304.
10 . El Sayed, H. E. S. A. ‘‘Impact of magnetic water irrigation for improve
the growth, chemical composition and yield production of broad bean (Vicia faba
L.) plant’’. American Journal of Experimental Agriculture, vol. 4,
no. 4, 2014, pp. 476-496, ISSN 2231-0606.
11. Qados, A. M. S. A. y Hozayn, M. ‘‘Magnetic water technology, a novel tool
to increase growth, yield and chemical constituents of lentil (Lens esculenta)
under greenhouse condition’’. American-Eurasian Journal of Agricultural
and Environmental Science, vol. 7, no. 4, 2010, pp. 457-462, ISSN 1818-6769,
CABDirect2.
12. Ibrahim, A. y Mohsen, B. ‘‘Effect of irrigation with magnetically treated
water on faba bean growth and composition’’. International Journal of Agricultural
Policy and Research, vol. 1, no. 2, 2013, pp. 24–40, ISSN 2350-1561.
13. Shine, M. b.; Guruprasad, K. . y Anand, A. ‘‘Effect of stationary magnetic
field strengths of 150 and 200?mT on reactive oxygen species production in soybean’’.
Bioelectromagnetics, vol. 33, no. 5, 1 de julio de 2012, pp. 428-437,
ISSN 1521-186X, DOI 10.1002/bem.21702.
14. Novitskii, Y. I.; Novitskaya, G. V. y Serdyukov, Y. A. ‘‘Lipid utilization
in radish seedlings as affected by weak horizontal extremely low frequency magnetic
field’’. Bioelectromagnetics, vol. 35, no. 2, 1 de febrero de 2014,
pp. 91-99, ISSN 1521-186X, DOI 10.1002/bem.21818.
15. Maffei, M. E. ‘‘Magnetic field effects on plant growth, development, and
evolution’’. Plant Physiology, vol. 5, 2014, p. 445, ISSN 0032-0889,
1532-2548, DOI 10.3389/fpls.2014.00445.
16. Sturdivant, L. y Blakley, T. Bootstrap guide to medicinal herbs in the garden,
field & marketplace [en línea]. edit. San Juan Naturals, NY, U.S.A.,
1998, ISBN 978-0-9621635-7-9, [Consultado: 8 de febrero de 2016], Disponible en:
<http://agris.fao.org/agris-search/search.do?recordID=US201300044137>.
17. Lichtenthaler, H. K. y Wellburn, A. R. ‘‘Determinations of total carotenoids
and chlorophylls a and b of leaf extracts in different solvents’’. Biochemical
Society Transactions, vol. 11, no. 5, 1 de octubre de 1983, pp. 591-592,
ISSN 0300-5127, 1470-8752, DOI 10.1042/bst0110591.
18. Wagner, H. y Bladt, S. Plant Drug Analysis: A Thin Layer Chromatography
Atlas. edit. Springer Science & Business Media, 1996, 373 p., ISBN
978-3-540-58676-0.
19. Derwich, E.; Benziane, Z.; Chabir, R. y Taouil, R. ‘‘In Vitro antibacterial
activity and GC/MS analysis of the essential oil extract of leaves of Rosmarinus
officinalis grown in Morocco’’. International Journal of Pharmacy &
Pharmaceutical Sciences, vol. 3, no. 3, 2011, pp. 89–95, ISSN 0975-1491.
20 . Türkmen, N.; Öz, A.; Sönmez, A.; Erol, T.; Gülümser,
D.; Yurdakul, B.; Kayir, Ö.; Elmastas, M. y Erenler, R. ‘‘Chemical Composition
of Essential Oil from Rosmarinus Officinalis L. Leaves’’. Journal
of New Results in Science, vol. 6, no. 6, 2014, pp. 27-31, ISSN 1304-7981.
21. Saeb, K. y Gholamrezaee, S. ‘‘Variation of essential oil composition of
Melissa officinalisL. leaves during different stages of plant growth’’.
Asian Pacific Journal of Tropical Biomedicine, vol. 2, no. 2, Supplement,
febrero de 2012, pp. S547-S549, ISSN 2221-1691, DOI 10.1016/S2221-1691(12)60271-8.
Recibido: 15 de
mayo de 2015
Aceptado: 29 de enero de 2016
Yilan Fung
Boix, Centro Nacional de Electromagnetismo Aplicado, CNEA. Universidad
de Oriente, ave Las Ameritas s/n. Santiago de Cuba, Cuba, CP 90400. Email: yilan@uo.edu.cu



