
Señales producidas por Rhizobium leguminosarum en la interacción con frijol común (Phaseolus vulgaris L.)
Signals produced by Rhizobium leguminosarum in the interaction with common bean (Phaseolus vulgaris L.)
Dra.C. María C. Nápoles GarcíaI, Dr.C. Juan C. Cabrera PinoII, Rob OnderwaterII, Ruddy WattiezIII, Ionel Hernández ForteI, Lisbel Martínez GonzálezI, Dra.C. Miriam Núñez VázquezI
IInstituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700.
IIUnité Biotechnologie-Materia Nova A.S.B.L., Rue des Foudriers, 1, 7822 Ghislenghien, Belgium.
IIIInstitute Biosciences, University of Mons, Belgium.
RESUMEN
La interacción Rhizobium-leguminosas depende de un complejo intercambio de señales, que se mantiene durante todo el proceso simbiótico y de las que solamente una combinación correcta permitirá una simbiosis eficiente. Estas plantas secretan flavonoides, reconocidos por bacterias compatibles y que inducen sus genes nod. Estos codifican las proteínas que sintetizan y exportan lipoquitooligosacáridos conocidos como factores Nod. Los factores Nod activan los procesos de infección e inician la división celular en la raíz, hasta la formación del nódulo y participan también en la fijación biológica del nitrógeno. Existen evidencias de que el uso de inductores de los genes nod incrementa la nodulación en algunas leguminosas. El objetivo de este trabajo fue estudiar la producción de algunas moléculas señales, inducidas por la isoflavona genisteína en una cepa de R. leguminosarum y evaluar el impacto de esa inducción en el efecto del inóculo sobre plantas de frijol común. La fracción lipídica en los inóculos fue extraída con n-butanol y analizada por cromatografía de capa fina, cromatografía líquida de alta resolución y cromatografía gaseosa acoplada a un espectrómetro de masas. En los inóculos inducidos con genisteína se detectó una cantidad superior de lipooligosacáridos (factores de nodulación) y de ácidos grasos de alto peso molecular, con diferencias significativas respecto a los controles sin inducir. En relación con ese enriquecimiento en moléculas señales, los inóculos inducidos con genisteína, mostraron un efecto positivo en las plantas de frijol de la variedad Cubacueto 25-9, con mayor número de nódulos y contenido de clorofila que las plantas no inoculadas (control).
Palabras clave: factores Nod, nodulación, simbiosis, leguminosa.
ABSTRACT
Legume-Rhizobium interaction depends on a complex signal exchange that continues throughout the entire symbiotic process, out of which just the correct combination will give rise to an efficient symbiosis. These plants secrete flavonoids that are recognized by compatible bacteria inducing their nod genes, which encode proteins that synthesize and export lipochitooligosaccharides called Nod factors. These factors activate infection process and initiate cell division in the root until making up the nodule and also participate in nitrogen biological fixation. There is evidence that the use of nod gene inducers increases some legume nodulation. The objective of this work was to study the production of some signal molecules induced by genistein isoflavon in a R. leguminosarum strain as well as to evaluate induction impact on inoculum effect upon common bean plants. Inoculum lipid fraction was isolated with n-butanol and analyzed by thin layer chromatography, high performance liquid chromatography and gas chromatography coupled to a mass spectrometer. Regarding the inocula induced with genistein, a higher amount of lipooligosaccharides (Nod factors) and high-molecular-weight fatty acids were detected, showing significant differences with non-induced controls. Concerning such signal molecule enrichment, genistein-induced inocula had a positive effect on “Cubacueto 25-9” bean plants, with a higher amount of nodules and chlorophyll content than non-inoculated plants (control).
Key words: Nod factors, nodulation, symbiosis, legumes.
INTRODUCCIÓN
Dentro del grupo de las leguminosas que poseen semillas comestibles, el frijol común (Phaseolus vulgaris L.) corresponde a una de las más importantes. La domesticación de este cultivo ocurrió varios miles de años atrás en Mesoamérica y en la región andina (1). Actualmente su cultivo se encuentra distribuido en los cinco continentes y representa la legumbre más importante en la dieta humana, al proporcionar proteínas y carbohidratos a más de 300 millones de personas, especialmente en América Latina, el Caribe y ÁfricaA. Como leguminosa, P. vulgaris, se puede asociar a bacterias del suelo que fijan nitrógeno, lo cual le permite crecer en condiciones de bajo contenido de Nitrógeno (N) (2, 3).
Durante los últimos años, diversas investigaciones han permitido conocer y entender la comunicación a nivel molecular que rige la simbiosis rizobios-leguminosas (4, 5). Los factores Nod o lipoquitooligosacáridos han sido las moléculas mejor estudiadas entre esas señales, con un papel esencial en la formación de los nódulos y su funcionamiento (6, 7). Otros autores han demostrado que estas moléculas pueden jugar un papel en la germinación, fotosíntesis, crecimiento y rendimiento de diversos cultivos, así como ante condiciones de estrés biótico y abiótico (8, 9).
Se han hecho grandes esfuerzos para mejorar esta relación, dado que esta simbiosis es, en gran medida, responsable de aportar el nitrógeno requerido en la agricultura mundial. Esta contribución ha estado enfocada en optimizar el estado fisiológico de las bacterias, para generar la producción de señales determinantes en la simbiosis, por lo que el objetivo de este trabajo fue estudiar la producción de algunas moléculas señales, inducidas por el isoflavonoide genisteína en una cepa de R. leguminosarum y evaluar el impacto de esa inducción en el efecto del inóculo sobre plantas de frijol común.
MATERIALES Y MÉTODOS
Cultivo bacteriano. Extracción de fracción lipídica
Se utilizó la cepa R. leguminosarum CF1, conocida por su simbiosis con el frijol y procedente del Instituto de Suelos, Ministerio de la Agricultura, La Habana, Cuba. A partir de ella se produjo un preinóculo en 50 mL de medio Extracto de Levadura Manitol (10), a pH 6,8; con el cual se inocularon 600 mL del mismo medio y otros 600 mL de este, al cual se le adicionó genisteína (Sigma) a una concentración final de 5 µM (5 micromoles de genisteína por litro de medio). Los inóculos se obtuvieron después de mantener los frascos a 150 r.p.m. durante 48 horas, en un agitador orbital, a 28 ± 2 ºC de temperatura.
Para cada caso se repitió tres veces el procedimiento, con lo cual se contó con tres muestras de cada tratamiento (sin inducir e inducido con genisteína).
Teniendo en cuenta que la mayoría de las señales reconocidas por su actividad biológica en la interacción Rhizobium-leguminosas son de naturaleza lipídica, se realizó una extracción selectiva de estas moléculas del inóculo, tratado con la genisteína (inducido) o no (control), utilizando un solvente de alta especificidad para este tipo de componentes. Para ello se utilizaron 180 mL de n-butanol en cada muestra. Se agitaron en zaranda orbital a 150 r.p.m. durante 15 minutos y se mantuvieron toda la noche en reposo y oscuridad a temperatura ambiente de 25 ± 2 ºC. Se extrajo la fase orgánica en cada muestra, se centrifugaron 12000 g, 10 ºC, 10 min. Todas las muestras se concentraron por rotoevaporación a 50-80 ºC hasta obtener 2 mL de cada una de ellas, estas se utilizaron para la detección de señales producidas por la bacteria.
Detección de señales
Análisis por cromatografía de capa fina (TLC, del inglés Thin Layer Chromatography)
Los componentes de la mezcla fueros separados por TLC, utilizando placas de gel de sílice (MERCK 60. GF-254). Se empleó n-propanol: agua: amonio concentrado 7:2:1, v:v:v, como solvente. Las manchas fueron visualizadas, utilizando un revelador a base de ácido sulfúrico en metanol.
Análisis por cromatografía líquida de alta resolución, fase inversa (HPLC-C18, del inglés High Performance Liquid Chromatography)
Con el objetivo de evaluar la presencia de factores de nodulación entre los metabolitos, 10 µL de todas las muestras fueron analizadas por HPLC, utilizando una columna de fase inversa Waters Symmetry C-18 (46 x 250 mm) de 5 µ de tamaño de partículas, instalada en un sistema HPLC Waters Alliance. La velocidad del flujo fue de 1 mL min-1 y como solventes se utilizaron agua (A) y acetonitrilo (B) con un gradiente: 0-10 min 18 % B, 10-30 min 60 % B, 30-35 min 95 % B, 35-45 min 18 % B. Se utilizó un detector espectrofotométrico UV-Waters a una longitud de onda de 214 nm.
Análisis por cromatografía gaseosa acoplada a un espectrómetro de masas (GC-MS, del inglés Gas Chromatography - Mass Spectrometry)
Los derivados volátiles de los ácidos grasos fueron preparados por sililación, utilizando como reactivo el BSTFA (N, O-Bis (trimetilsilil) trifluoroacetamida) en combinación con trimetil clorosilano (TMCS) (Kit BSTFA+TMCS, Supelco). Para el análisis por GC-MS se utilizó un cromatógrafo de gases, acoplado a un espectrómetro de masas marca Shimadzu GC-MS QP-2010; sistema equipado con autoinyector AOC-20i, automuestreador AOC-20s y un sistema de inserción directa, controlado por el software “GC-MS solution”. Se empleó una columna Optima 5 MS (30 m × 0,25 mm DI, 0,25 µm espesor de película). Las condiciones de los análisis cromatográficos fueron la temperatura del inyector 310 °C; la temperatura del horno 100 °C durante seis minutos. Posteriormente se incrementó a 320 °C a razón de 20 °C min-1, manteniéndose durante cinco minutos. El volumen de inyección fue de 1 µL y el flujo en la columna de 0,75 mL min-1, usando helio como gas de arrastre.
Efecto sobre la nodulación y el crecimiento de plantas
Se utilizó la variedad de frijol Cubacueto 25-9. Las semillas fueron inoculadas con 0,5 mL de una suspensión de bacterias de 5,4 x 108 UFC mL-1 y sembradas sobre un suelo Ferralítico Rojo Lixiviado típico, éutrico (11). Las plantas se mantuvieron en condiciones de cámara de crecimiento con fotoperiodo de 12 horas luz, a 24 ± 2 °C y se regaron cada día con agua corriente. Transcurridos 35 días se determinó el número de nódulos totales, la masa seca aérea (posterior secado a 65 °C durante cinco días) y el contenido de clorofila mediante SPAD. Como tratamientos se emplearon un control sin inocular y un tratamiento inoculado con el biopreparado inducido.
Los datos fueron procesados por análisis de varianza simple. Se utilizó el test de comparación de medias de Tukey para α<0,05, con el objetivo de discriminar diferencias entre las medias. Todos los gráficos fueron realizados en el programa Microsoft Excel 2010.
RESULTADOS Y DISCUSIÓN
Detección de señales
El perfil de separación por TLC sobre un soporte de gel de sílice (fase normal) de cada una de las réplicas de los tratamientos control e inducidos, se representa en la Figura 1.
Si bien este método es relativamente poco específico para el análisis y la separación de mezclas complejas, constituye una herramienta útil para estimar de una manera rápida la complejidad de las muestras e identificar diferencias en su composición (12), algo que se evidencia en el mayor número de manchas obtenidas para los tratamientos inducidos, respecto al control.
El perfil cromatográfico característico de la media de los tratamientos control y la media de los extractos inducidos con genisteína se observa en la Figura 2 (a y b).
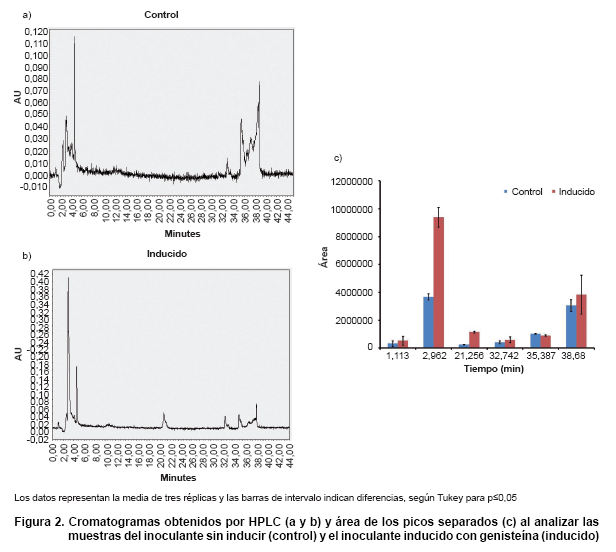
Adicionalmente, se representa el área promedio para cada pico, considerando la media de cada tratamiento (Figura 2c).
En los picos correspondientes a los 2 y 21 minutos, se evidencia una diferencia en el área (concentración) entre los tratamientos sin inducir e inducido, siendo superior la concentración de estos compuestos cuando se induce. Los picos obtenidos a 1, 32, 35 y 38 minutos, no mostraron diferencias significativas entre los tratamientos. Es de señalar el área del segundo pico (t 2 min) correspondiente a la muestra inducida, muy superior al resto de los picos obtenidos.
Teniendo en cuenta que no se dispone de estándares comerciales de factores de nodulación, es difícil afirmar con seguridad que estos picos se corresponden a dichas estructuras. No obstante, este análisis constituye una evidencia incuestionable sobre la diferencia marcada en el perfil de metabolitos producidos por la bacteria en presencia de la genisteína.
Al analizar las muestras mediante cromatografía gaseosa acoplada a un espectrómetro de masas (Figura 3), se identificaron cuatro picos diferentes, correspondientes a ácidos grasos de alto peso molecular (C16: ácido palmítico, C18: ácido oleico y C20: ácido eicosenoico).
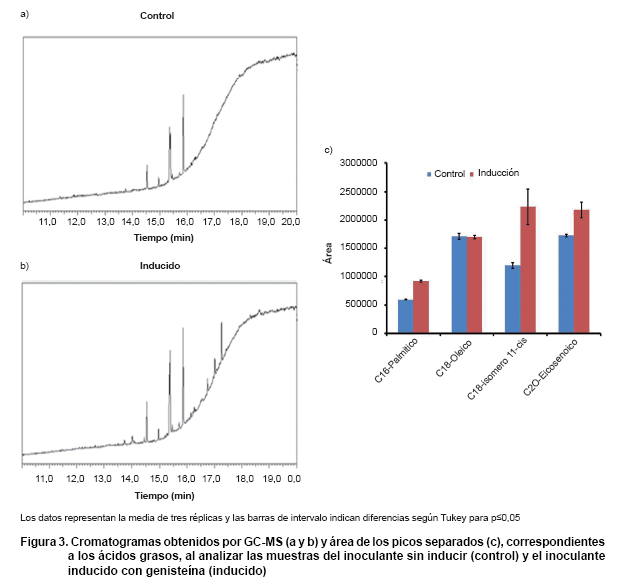
Los resultados muestran en todos los casos, excepto para el ácido oleico, que no evidencia diferencias entre ambos tratamientos, un incremento en el área de estos picos con el tratamiento inducido (Figura 3c). Esto significa que la genisteína promueve en la bacteria, no solamente la producción de factores de nodulación, sino además otros componentes de naturaleza lipídica como los ácidos grasos.
Los ácidos grasos de alto peso molecular son componentes estructurales de los lipooligosacáridos asociados a la nodulación. Los factores Nod consisten en un esqueleto de 3-5 moléculas de N-acetil-glucosamina, que en el grupo amino del extremo no reducido se encuentra acilado con un ácido graso de
16-20 átomos de C de largo (C16-C20) (13). Otros autores han encontrado igualmente un incremento de estos ácidos grasos en factores Nod producidos por cepas simbiontes de frijol ante la presencia de inductores de los genes nod y en condiciones de estrés abiótico (14).
La función biológica de los factores de nodulación está bien documentada; sin embargo, se desconoce una posible función de los ácidos grasos en el proceso de nodulación. No obstante, se ha descrito que los ácidos grasos de alto peso molecular exhiben actividad antimicrobiana en ensayos in vitro, por lo que una posible función pudiera ser como moléculas defensivas, ante la presencia de patógenos en el suelo (15). Estas estructuras de ácidos grasos son; además, componentes de las membranas celulares de las plantas y se ha demostrado su acumulación en las raíces de plantas de soya colonizadas por Bradyrhizobium japonicum (16). Algunos ácidos grasos de alto peso molecular son precursores de la síntesis del ácido jasmónico, el cual es fundamental en las respuestas de la planta ante los estreses bióticos y abióticos (17). Curiosamente, la incubación de B. japonicum con jasmonato o su derivado metilado, induce la expresión de genes nod y consiguientemente aumenta la nodulación y la fijación del nitrógeno (18).
En el cromatograma de la muestra inducida (Figura 3b) se observa la presencia de varios picos con tiempos de retención entre 17 y 18 minutos, que no aparecen en la muestra control. La estructura de estos compuestos no aparece informada en la base de datos conectada al GC-MS, por lo que su elucidación estructural requeriría de análisis adicionales. De esta manera, la genisteína está induciendo en la bacteria, la producción de otras moléculas diferentes a las ya identificadas (factores de nodulación y ácidos grasos).
Mediante los tres métodos utilizados para caracterizar los compuestos lipídicos y detectar la presencia de factores Nod en las muestras de inoculantes, se identificaron estas estructuras en mayor cuantía en el inoculante inducido con genisteína. Este isoflavonoide induce la transcripción de los genes nod en varias especies de rizobios, lo que se traduce en la producción de factores de nodulación desde la bacteria, que a su vez inducen la formación de los nódulos en la leguminosa (19).
Resultados similares fueron encontrados en la cepa simbionte de soya Bradyrhizobium elkanii ICA 8001, al ser inducida en la síntesis y excreción de factores Nod. El análisis de perfiles cromatográficos obtenidos por HPLC y TLC mostraron diferencias positivas en el número de picos, el área de los mismos y el número de manchas, respectivamente, cuando se compararon con el control sin inducir (20). Estos resultados también fueron correlacionados directamente con la respuesta en nodulación de las plantas de soya.
Efecto sobre la nodulación y el crecimiento de plantas
Al analizar el efecto de ambos tratamientos sobre las plantas de frijol común (tabla), se pudo observar un efecto superior del tratamiento inoculado con el biopreparado inducido sobre el número de nódulos formados con respecto al control. La masa seca aérea no mostró diferencias significativas entre ambos tratamientos; sin embargo, el contenido de clorofilas evidenció el efecto positivo de la inoculación.
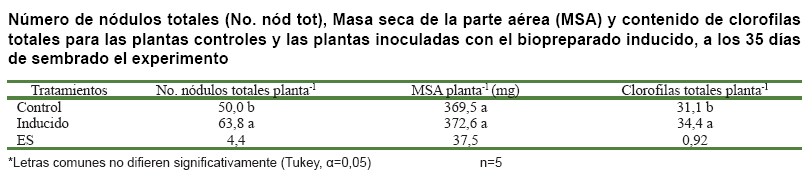
Es importante resaltar el hecho de que las plantas control también nodularon. Ello se debe a que se utilizó un suelo sin esterilizar, por lo que es muy posible que en el residieran poblaciones de rizobios afines a esta leguminosa, capaces de establecer una interacción simbiótica eficiente. Esto justifica, además de que formaran nódulos en abundante cantidad, que tuviesen un efecto positivo sobre la masa seca de las plantas. No obstante, la presencia de mayor cantidad y diversidad de señales en el inoculante inducido (Figuras 1, 2 y 3) le confirió una calidad superior a este tratamiento, destacándose en el número de nódulos formados sobre las plantas y en el contenido de clorofila. Este indicador constituye una medida indirecta de la fijación del nitrógeno, llevada a cabo en dichas estructuras radiculares. Se plantea que la percepción de factores Nod activa las vías biosintéticas requeridas para la nodulación y la vía involucrada en el flujo de calcio, importantes para la eficiencia en la infección (21).
Los mayores valores de nodulación, unido al incremento en clorofilas, relacionado con el contenido de N, indican que la inducción tuvo un efecto positivo sobre la fijación de nitrógeno. El frijol común produce y trasloca N en forma de ureidos, alantoína y alantoato (22, 23). Los ureidos son considerados más favorables energéticamente para transportar el N desde los nódulos hasta las hojas (24). Se ha demostrado que sólo requieren la mitad de ATP necesaria para producir amidas en su síntesis y menos carbono, lo que le confiere ventajas a estas leguminosas ureídicas sobre las amídicasB.
Otros resultados muestran que el empleo de inoculantes inducidos en la producción de factores de nodulación en la cepa B. elkanii ICA 8001, actúa indirectamente sobre el catabolismo de los ureidos en plantas de soya (25).
La importancia de los factores Nod en la interacción con las leguminosas, no sólo está relacionada con la nodulación y la eficiencia en la fijación biológica del N en condiciones normales y de estrés abiótico. La similitud de su estructura con los quitooligosacáridos, derivados de la pared celular fúngica y activadores de defensa (26), así como evidencias directas sobre la reducción de enfermedades (27) e indirectas sobre la activación de enzimas de defensa (28), suponen una participación de estas moléculas en determinadas respuestas de inmunidad a la invasión por patógenos.
Comparado con otras leguminosas, el frijol común no es de las plantas que puede fijar con mayor eficiencia el nitrógeno (29); sin embargo, existen algunas variedades de P. vulgaris y cepas de rizobios afines, que exhiben altos rangos de fijación (30). En la actualidad nuevas investigaciones intentan mejorar la FBN en frijol, las que incluyen desde el empleo de cepas más competitivas y eficientes, la búsqueda de variedades (31, 32), hasta el desarrollo de inoculantes y formulaciones más complejas. En este estudio se ha optado por inducir en el inoculante la síntesis y la excreción de metabolitos de especial interés y función en esta interacción.
Resulta interesante, en estudios futuros, comparar además, el efecto del inóculo inducido y el inóculo sin inducir, sobre las plantas de frijol. No obstante, resultados de otros ensayos con frijol y en el cultivo de la soya, reiteran resultados positivos al emplear los inoculantes inducidos sobre inóculos sin inducir y sobre el testigo sin inocular (9, 33).
CONCLUSIONES
Notas al pie
ACGIAR. Common bean [en línea]. [Consultado: 15 de febrero de 2016], Disponible en: <http://www.cgiar.org/our-strategy/crop-factsheets/beans/>.
BKabahuma, M. K. Enhancing biological nitrogen fixation in common bean (Phaseolus vulgaris L) [en línea]. Graduate Theses and Dissertations, Iowa State University, 2013, 81 p., [Consultado: 12 de enero de 2016], Disponible en: <http://lib.dr.iastate.edu/etd/13162>.
BIBLOGRAFÍA
1. Rodiño, P. A.; Santalla, M.; Ron, A. M. D. y Drevon, J.-J.‘‘Co-evolution and Migration of Bean and Rhizobia in Europe’’ [en línea]. En: ed. Lichtfouse E., Sociology, Organic Farming, Climate Change and Soil Science, (ser. Sustainable Agriculture Reviews, no. ser. 3), edit. Springer Netherlands, 2010, pp. 171-188, ISBN 978-90-481-3332-1, DOI: 10.1007/978-90-481-3333-8_7, [Consultado: 11 de enero de 2016], Disponible en: <http://link.springer.com/chapter/10.1007/978-90-481-3333-8_7>.
2. López, G. M. G.; Ormeño, O. E.; Velázquez, E.; Rogel, M. A.; Acosta, J. L.; Gónzalez, V.; Martínez, J. y Martínez, R. E. ‘‘Rhizobium etli taxonomy revised with novel genomic data and analyses’’. Systematic and Applied Microbiology, vol. 35, no. 6, septiembre de 2012, pp. 353-358, ISSN 0723-2020, DOI 10.1016/j.syapm.2012.06.009.
3. Ribeiro, R. A.; Ormeño-Orrillo, E.; Dall’Agnol, R. F.; Graham, P. H.; Martinez-Romero, E. y Hungria, M. ‘‘Novel Rhizobium lineages isolated from root nodules of the common bean (Phaseolus vulgaris L.) in Andean and Mesoamerican areas’’. Research in Microbiology, vol. 164, no. 7, septiembre de 2013, pp. 740-748, ISSN 0923-2508, DOI 10.1016/j.resmic.2013.05.002.
4. Ferguson, B. J.; Indrasumunar, A.; Hayashi, S.; Lin, M.-H.; Lin, Y.-H.; Reid, D. E. y Gresshoff, P. M. ‘‘Molecular Analysis of Legume Nodule Development and Autoregulation’’. Journal of Integrative Plant Biology, vol. 52, no. 1, 1 de enero de 2010, pp. 61-76, ISSN 1744-7909, DOI 10.1111/j.1744-7909.2010.00899.x.
5. Murray, J. D. ‘‘Invasion by Invitation: Rhizobial Infection in Legumes’’. Molecular Plant-Microbe Interactions,vol. 24, no. 6, 4 de mayo de 2011, pp. 631-639, ISSN 0894-0282, DOI 10.1094/MPMI-08-10-0181.
6. Ibáñez, F. y Fabra, A. ‘‘Rhizobial Nod factors are required for cortical cell division in the nodule morphogenetic programme of the Aeschynomeneae legume Arachis’’. Plant Biology, vol. 13, no. 5, 1 de septiembre de 2011, pp. 794-800, ISSN 1438-8677, DOI 10.1111/j.1438-8677.2010.00439.x.
7. Oldroyd, G. E. D.; Murray, J. D.; Poole, P. S. y Downie, J. A. ‘‘The Rules of Engagement in the Legume-Rhizobial Symbiosis’’. Annual Review of Genetics, vol. 45, no. 1, 2011, pp. 119-144, ISSN 0066-4197, DOI 10.1146/annurev-genet-110410-132549, PMID: 21838550.
8. Atti, S.; Bonnell, R.; Prasher, S. y Smith, D. L. ‘‘Response of soybean {Glycine max (L.) Merr.} under chronic water deficit to LCO application during flowering and pod filling’’. Irrigation and Drainage, vol. 54, no. 1, 1 de febrero de 2005, pp. 15-30, ISSN 1531-0361, DOI 10.1002/ird.153.
9. Nápoles, M. C.; Guevara, E.; Montero, F.; Rossi, A. y Ferreira, A. ‘‘Role of Bradyrhizobium japonicum induced by genistein on soybean stressed by water deficit’’. Spanish Journal of Agricultural Research, vol. 7, no. 3, 1 de septiembre de 2009, p. 665, ISSN 2171-9292, 1695-971X, DOI 10.5424/sjar/2009073-451.
10. Vincent, J. M. Manual for the Practical Study of Root-nodule Bacteria. (ser. nternational Biological Programme), edit. Blackwell Science Ltd, Oxford, 1 de enero de 1975, 176 p., ISBN 978-0-632-06410-6.
11. Hernández, A.; Pérez, J.; Bosch, D. y Castro, N. Clasificación de los suelos de Cuba 2015. edit. Ediciones INCA, Mayabeque, Cuba, 2015, 93 p., ISBN 978-959-7023-77-7.
12. Sherma, J. y Fried, B. Handbook of Thin-Layer Chromatography. edit. CRC Press, 18 de abril de 2003, 1356 p., ISBN 978-0-8247-4866-1.
13. Streng, A.; Camp, R. op den; Bisseling, T. y Geurts, R. ‘‘Evolutionary origin of rhizobium Nod factor signaling’’. Plant Signaling & Behavior, vol. 6, no. 10, 1 de octubre de 2011, pp. 1510-1514, ISSN 1559-2324, DOI 10.4161/psb.6.10.17444, PMID: 21904113.
14. Estévez, J.; Soria-Díaz, M. E.; Córdoba, F. F. D.; Morón, B.; Manyani, H.; Gil, A.; Thomas-Oates, J.; Brussel, A. A. N. V.; Dardanelli, M. S.; Sousa, C. y Megías, M. ‘‘Different and new Nod factors produced by Rhizobium tropici CIAT899 following Na+ stress’’. FEMS Microbiology Letters, vol. 293, no. 2, 1 de abril de 2009, pp. 220-231, ISSN 0378-1097, 1574-6968, DOI 10.1111/j.1574-6968.2009.01540.x, PMID: 19260963.
15. Kachroo, A. y Kachroo, P. ‘‘Fatty Acid–Derived Signals in Plant Defense’’. Annual Review of Phytopathology, vol. 47, no. 1, 2009, pp. 153-176, ISSN 0066-4286, DOI 10.1146/annurev-phyto-080508-081820, PMID: 19400642.
16. Brechenmacher, L.; Lei, Z.; Libault, M.; Findley, S.; Sugawara, M.; Sadowsky, M. J.; Sumner, L. W. y Stacey, G. ‘‘Soybean Metabolites Regulated in Root Hairs in Response to the Symbiotic Bacterium Bradyrhizobium japonicum’’. Plant Physiology, vol. 153, no. 4, 1 de agosto de 2010, pp. 1808-1822, ISSN 1532-2548,DOI 10.1104/pp.110.157800, PMID: 20534735.
17. Wasternack, C. ‘‘Jasmonates: An Update on Biosynthesis, Signal Transduction and Action in Plant Stress Response, Growth and Development’’. Annals of Botany, vol. 100, no. 4, 10 de enero de 2007, pp. 681-697, ISSN 0305-7364, 1095-8290, DOI 10.1093/aob/mcm079, PMID: 17513307.
18. Mabood, F. y Smith, D. L. ‘‘Pre-incubation of Bradyrhizobium japonicum with jasmonates accelerates nodulation and nitrogen fixation in soybean (Glycine max) at optimal and suboptimal root zone temperatures’’. Physiologia Plantarum, vol. 125, no. 3, 1 de noviembre de 2005, pp. 311-323, ISSN 1399-3054, DOI 10.1111/j.1399-3054.2005.00559.x.
19. Subramanian, S. y Smith, D. A. ‘‘Proteomics Approach to Study Soybean and Its Symbiont Bradyrhizobium japonicum -A Review’’ [en línea]. En: ed. Board J., A Comprehensive Survey of International Soybean Research - Genetics, Physiology, Agronomy and Nitrogen Relationships, edit. InTech, 2 de enero de 2013, pp. 3-30, ISBN 978-953-51-0876-4, DOI 10.5772/45867, [Consultado: 11 de enero de 2016], Disponible en: <http://www.intechopen.com/books/a-comprehensive-survey-of-international-soybean-research-genetics-physiology-agronomy-and-nitrogen-relationships>.
20. Nápoles, G. M. C.; Cabrera, J. C.; Luyten, E.; Dombrecht, B.; Vanderleyden, J.; Hormaza, J. y Rodríguez, A. A. ‘‘Nod factor detection in B. elkanii ICA 8001. Culture medium influence’’. Cultivos Tropicales, vol. 35, no. 1, 2014, pp. 92-99, ISSN 0258-5936, CABDirect2.
21. Morieri, G.; Martinez, E. A.; Jarynowski, A.; Driguez, H.;Morris, R.; Oldroyd, G. E. D. y Downie, J. A. ‘‘Hostspecific Nodfactors associated with Medicago truncatula nodule infection differentially induce calcium influx and calcium spiking in root hairs’’. New Phytologist, vol. 200, no. 3, 1 de noviembre de 2013, pp. 656-662, ISSN 1469-8137, DOI 10.1111/nph.12475.
22. Alamillo, J. M.; Díaz, L. J. L.; Sánchez, M. M. V. y Pineda, M. ‘‘Molecular analysis of ureide accumulation under drought stress in Phaseolus vulgaris L.’’. Plant, Cell & Environment, vol. 33, no. 11, 1 de noviembre de 2010, pp. 1828-1837, ISSN 1365-3040, DOI 10.1111/j.1365-3040.2010.02187.x.
23. Díaz, L. J. L.; Gálvez, V. G.; Fernández, J.; Pineda, M. y Alamillo, J. M. ‘‘Developmental effects on ureide levels are mediated by tissue-specific regulation of allantoinase in Phaseolus vulgaris L.’’. Journal of Experimental Botany, vol. 63, no. 11, 6 de enero de 2012, pp. 4095-4106, ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/ers090, PMID: 22442417.
24. Todd, C. D.; Tipton, P. A.; Blevins, D. G.; Piedras, P.; Pineda, M. y Polacco, J. C. ‘‘Update on ureide degradation in legumes’’. Journal of Experimental Botany, vol. 57, no. 1, 1 de enero de 2006, pp. 5-12, ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/erj013, PMID: 16317038.
25. Freixas, J. A.; Torres, W.; Reynaldo, I. M. y Nápoles, M. C. ‘‘Niveles de ureidos en plantas de soya con diferentes inoculantes y sometidas a déficit hídrico’’. Cultivos Tropicales, vol. 32, no. 2, junio de 2011, pp. 122-135, ISSN 0258-5936.
26. Hamel, L.-P. y Beaudoin, N. ‘‘Chitooligosaccharide sensing and downstream signaling: contrasted outcomes in pathogenic and beneficial plant–microbe interactions’’. Planta, vol. 232, no. 4, 16 de julio de 2010, pp. 787-806, ISSN 0032-0935, 1432-2048, DOI 10.1007/s00425-010-1215-9.
27. Duzan, H. M.; Mabood, F.; Zhou, X.; Souleimanov, A. y Smith, D. L. ‘‘Nod factor induces soybean resistance to powdery mildew’’. Plant Physiology and Biochemistry, vol. 43, no. 10–11, octubre de 2005, pp. 1022-1030, ISSN 0981-9428, DOI 10.1016/j.plaphy.2005.08.004.
28. Nakagawa, T.; Kaku, H.; Shimoda, Y.; Sugiyama, A.; Shimamura, M.; Takanashi, K.; Yazaki, K.; Aoki, T.; Shibuya, N. y Kouchi, H. ‘‘From defense to symbiosis: limited alterations in the kinase domain of LysM receptorlike kinases are crucial for evolution of legume–Rhizobium symbiosis’’. The Plant Journal, vol. 65, no. 2, 1 de enero de 2011, pp. 169-180, ISSN 1365-313X, DOI 10.1111/j.1365-313X.2010.04411.x.
29. Martínez, R. E. ‘‘Diversity of Rhizobium-Phaseolus vulgaris symbiosis: overview and perspectives’’. Plant and Soil, vol. 252, no. 1, pp. 11-23, ISSN 0032-079X, 1573-5036, DOI 10.1023/A:1024199013926.
30. Hardarson, G. y Atkins, C. ‘‘Optimising biological N2 fixation by legumes in farming systems’’. Plant and Soil, vol. 252, no. 1, mayo de 2003, pp. 41-54, ISSN 0032-079X, 1573-5036, DOI 10.1023/A:1024103818971.
31. Abd-Alla, M. H. ‘‘Nodulation and nitrogen fixation in interspecies grafts of soybean and common bean is controlled by isoflavonoid signal molecules translocated from shoot’’. Plant Soil Environ, vol. 57, 2011, pp. 453–458, ISSN 1805-9368.
32. Devi, M. J.; Sinclair, T. R.; Beebe, S. E. y Rao, I. M. ‘‘Comparison of common bean (Phaseolus vulgaris L.) genotypes for nitrogen fixation tolerance to soil drying’’. Plant and Soil, vol. 364, no. 1-2, 27 de junio de 2012, pp. 29-37, ISSN 0032-079X, 1573-5036, DOI 10.1007/s11104-012-1330-4.
33. Nápoles, M. C.; Cabrera, J. C.; Varela, M.; González-Anta, G.; Nogueras, F.; Cricco, J.; Guevara, E. y Meira, S. ‘‘Influencia de inoculantes y factores edáficos en el rendimiento de la soya’’. Cultivos Tropicales, vol. 30, no. 3, septiembre de 2009, pp. 18-22, ISSN 0258-5936.
Recibido: 1 de octubre de 2014
Aceptado: 7 de agosto de 2015
Dra.C. María C. Nápoles García, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700.Email: tere@inca.edu.cu