Variaciones en la morfología y biomasa del sistema radical de plantas jóvenes de tomate (Solanum sp.)
Morphology and biomass variations in root system of young tomato plants (Solanum sp.)
Dra.C. Marta A. Álvarez Gil,I Dra.C. Ana Fita Fernández,II Dra.C. María del C. Ruiz Sánchez,III Dra.C. María del C. Bolarín JiménezIII
IInstituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32 700.
IIUniversidad Politécnica de Valencia, Valencia, España.
IIICEBAS-CSIC, Murcia, España.
RESUMEN
La escasa explotación de la variabilidad genotípica presente en las raíces de las plantas, es una opción atractiva para la mejora genética ante estrés abiótico y sustenta el objetivo de este trabajo: identificar variaciones genotípicas en caracteres del sistema radical de genotipos de tomate (Solanum sp.). Se estudiaron cinco genotipos de tomate: Jaguar, cultivar comercial híbrido Pera, Volgogradiskij (S. lycopersicum) y la entrada PE-47 (S. pennellii), colectados en Perú y el híbrido interespecífico Pera x PE-47. Las plantas se desarrollaron en hidroponía durante 26 días, desde la germinación, se les extrajo las raíces y se digitalizaron las imágenes sobre escáner para la evaluación de longitud total, diámetro promedio, área proyectada y longitud de las raíces, según categorías por diámetro del sistema radical completo, mediante el programa Win Rhizo Pro 2003. También se obtuvo la masa seca de la raíz y parte aérea. Los resultados indicaron que los genotipos difirieron en morfología, longitud según diámetro, la configuración espacial del sistema radical, así como en la biomasa de las raíces, fundamentalmente, con respecto a la especie silvestre PE-47, resistente a la salinidad. El híbrido interespecífico PxPE-47 podría ser empleado como portainjerto para incrementar la tolerancia a la sal de cultivares susceptibles.
Palabras clave: raíces, morfología, diversidad, portainjertos.
ABSTRACT
The scarce exploitation of genotypic variability present in plant roots is an attractive breeding choice with regard to abiotic stresses and supports the objective of this work, which is to identify genotypic variation in root system traits of tomato genotypes (Solanum sp.). Thus, five tomato genotypes were studied: the commercial hybrid cultivar Jaguar (S. lycopersicum), Pera, Volgogradiskij and PE-47 entry (S. pennellii), which were collected in Peru, and the interspecific hybrid PeraxPE-47. Plants were grown in hydroponics for 26 days since germination; their roots were extracted and images were digitalized on scanner to evaluate total length, average diameter, the projected area and root length, following the categories per diameter of the whole root system through software Win Rhizo Pro 2003. The dry mass of roots and aerial parts was also recorded. Results indicated that genotypes differed in morphology, length according to diameter, root system spatial configuration and biomass, mainly with respect to the wild salinity resistant species PE-47. The interspecific hybrid PxPE-47 could be used as a rootstock to increase salt tolerance of susceptible cultivars.
Key words: roots, morphology, diversity, rootstock.
INTRODUCCIÓN
Las raíces, no solamente proveen a la parte aérea de la planta de soporte estructural, sino también suministran los nutrientes y el agua. Así, la supervivencia de la planta depende de un apropiado crecimiento, desarrollo y funciones de las raíces. A principios de este siglo, se ha manifestado la necesidad de una segunda revolución verde, esta vez dirigida al incremento de los rendimientos de los cultivos que se desarrollan en suelos infértiles, cultivados por la mayoría de los agricultores del tercer mundo, con poco acceso a los fertilizantes (1). Existen informes que apoyan la importancia de la arquitectura del sistema radical como carácter agronómico y de desarrollo (2), con implicaciones para la arquitectura y crecimiento de la planta completa, resistencia a estreses abióticos, adquisición de nutrientes y respuesta a cambios ambientales (3).
Para lograr cultivares tolerantes a estrés ambiental, se necesita contar con variabilidad genética en caracteres relacionados con estos. Según algunos autores (4), el entendimiento de la variabilidad genética y el control genético de la arquitectura del sistema radical (SR) podrían asistir los programas de mejora genética para mejorar la tolerancia de los cultivos a ambientes estresantes, provocados por la alta salinización de los suelos.
Por otra parte, se conoce que la arquitectura del SR es propia de cada especie y se rige, según estudios realizados (5), por un programa de desarrollo postembrionario controlado genéticamente que determina la alta plasticidad fenotípica en respuesta al estrés ambiental. Los pocos informes de trabajos que hayan incluido la arquitectura del SR en el mejoramiento de los cultivos se debe, fundamentalmente, a las dificultades involucradas en la recuperación de las raíces en estudios sobre la arquitectura del SR in situ, por la escasez de métodos y modelos adecuados para su estudio. En los últimos años, se ha despertado el interés de la comunidad científica en estudiar las raíces, por lo que se emplean sistemas con menor dificultad, como la aeroponía, rizotrones e hidroponía (6, 7, 8).
Se han logrado algunos avances utilizando el organismo modelo Arabidopsis thaliana (L.) Heynh, en cuanto a la respuesta de las raíces a los estímulos ambientales, como gravedad y altas concentraciones de sal, con dos componentes; uno de percepción/ transmisión de señales y otro de traducción final de estas señales que, al parecer, convergen en la ruta de las auxinas, aunque no se pudo definir si las señales ambientales podrían también regular o modular los sitios en que ocurren las ramificaciones de las raíces laterales (9).
El tomate (Solanum lycopersicum L.), a pesar de ser uno de los cultivos hortícolas más importantes a nivel mundial y ser afectado por estrés ambiental, como la salinidad, el calor y la sequía (10), existe poca información sobre la magnitud de la variación genética en caracteres asociados con la arquitectura del SR y el potencial que representa esta variación para mejorar su tolerancia a ambientes específicos. En este caso, se ha especulado acerca del papel que parece jugar la arquitectura de la raíz, junto a las alteraciones anatómicas, en la respuesta a la salinidad en su fase iónica (11). En el caso del tomate, se ha demostrado que la técnica de injertos podría ser una alternativa para incrementar la tolerancia de los cultivares a altos tenores de salinidad, al emplear las raíces de cultivares tolerantes como portainjertos y la parte aérea del cultivar comercial susceptible como injerto (12).
En el tomate, se carece de la información básica sobre la variabilidad del SR de cultivares que podrían ser promisorios como portainjertos para sembrar bajo altas concentraciones de sal. Consecuentemente, el objetivo de este trabajo es identificar diferencias morfológicas y de arquitectura del SR de genotipos de tomate con diferente grado de tolerancia a la salinidad.
MATERIALES Y MÉTODOS
Material vegetal: el material vegetal utilizado en este estudio fue el híbrido comercial de tomate Jaguar (Solanum lycopersicum L.), suministrado por Ramiro Arnedo S. A. susceptible a altas concentraciones de sal; los cultivares Pera (P) y Volgogradiskij (V) y la entrada PE-47 (Solanum pennellii L.), que fueron colectados en Perú (13), con diferente grado de tolerancia a altas concentraciones de sal. También, fue incluido el híbrido interespecífico P x PE-47.
Condiciones de desarrollo y diseño experimental: las semillas de los genotipos P, J, V, PE-47 y PxPE-47 fueron esterilizadas superficialmente con lejía comercial (hipoclorito de sodio, 40 g de Cl- activo L-1) al 50 % durante 10 minutos. Después de lavadas, fueron colocadas sobre papel de filtro humedecido en placas petri selladas, en cámara oscura a 25 ± 1 oC. Las semillas, cuyas radículas habían emergido
(~ 0,5 cm), fueron colocadas sobre miraguano, en tubos Eppendorf ahuecados en el extremo, para facilitar el contacto con el agua. Una vez los cotiledones estuvieron totalmente expandidos, se trasplantaron 20 plántulas de cada genotipo, sostenidas con miraguano, a tubos Falcon ahuecados en el extremo, 10 de estas se colocaron en cada una de dos cubetas plásticas de 76x52x13 cm, con capacidad para 51,4 L, según diseño completamente aleatorizado, donde estuvieron durante 26 días, en disolución nutritiva Hoagland al 50 %, con aireación y el recambio de las disoluciones fue semanal.
Digitalización de las imágenes de las raíces: a los 26 días, se extrajeron las plantas de hidroponía y se separó la parte aérea y las raíces. Las raíces se colocaron en un escáner EPSON LA 1600+ (1600 x 3200 dpi) para obtener su imagen digitalizada. Posteriormente, esas imágenes fueron editadas manualmente (14) con el empleo del programa Adobe Photoshop, versión 10.
Caracteres evaluados: la parte aérea y las raíces de las plantas se secaron en estufa a 60 °C para evaluar la masa seca. Sobre las imágenes digitalizadas y editadas, se evaluaron la longitud total de las raíces (L) (cm), el diámetro promedio (D) (mm) y la proporción de la longitud de raíces por diámetro respecto a la longitud total (LD/L) (15, 16): LD1, muy finas (x <0,5 mm); LD2, finas (0,5 < x <2 mm) y LD3, pequeñas (>2 mm) y el área proyectada de la raíz (A) (cm2), mediante el software Win Rhizo Pro 2003.
Análisis estadístico: se realizó el análisis de varianza de un factor con datos completamente aleatorizados y se hicieron las comparaciones de las medias por Tukey (P≤95 %). Se empleó el paquete estadístico IBM SPSS, versión 20 para Windows (17).
RESULTADOS
La biomasa de la parte aérea fue superior en todos los cultivares con respecto a la especie silvestre (S. pennellii), PE-47; en el caso de la masa seca de las raíces, además de diferir todos los cultivares, significativamente, del bajo valor de PE-47, se observaron diferencias entre los genotipos cultivados; en este caso, la masa de raíces del cultivar Volgogradiskij y el híbrido interespecífico, PxPE-47, superó la desarrollada por Pera y Jaguar. Consecuentemente, los cultivares P y J tuvieron una relación masa de raíz/parte aérea inferior a V, PE-47 y PxPE-47 (Tabla I).
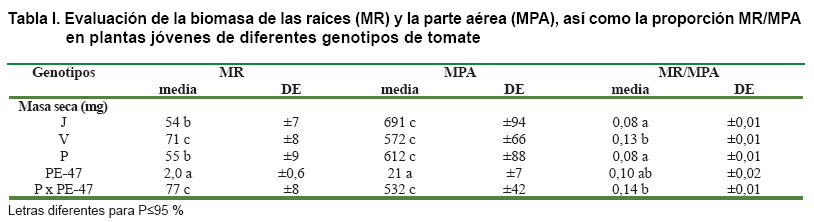
En concordancia con los valores de la biomasa de las raíces, la longitud total (L) del sistema radical completo (SRC), el diámetro promedio y el área (A) proyectada de la raíz, fueron inferiores en PE-47. En relación a los cultivares evaluados, sus raíces difirieron en el diámetro promedio, correspondiendo el diámetro superior a Volgogradiskij, el resto, Pera, Jaguar y el híbrido PxPE-47, tuvieron diámetros promedio similares (Tabla II).

La longitud de las raíces, según categorías por diámetro, permiten conocer la distribución de las raíces con distinto diámetro en el SRC, observándose diferencias según el genotipo evaluado, los cultivares Jaguar y Pera y el híbrido PxPE-47 tuvieron, aproximadamente, el 80 % de raíces finas, con diámetros inferiores a 0,5 mm. En cambio, la longitud de las raíces de esa categoría, desarrolladas en Volgogradiskij, fue de, aproximadamente, el 70 %, mientras que PE-47 difirió del resto de los genotipos con cerca del 90 % de las raíces de esta categoría (Tabla III).
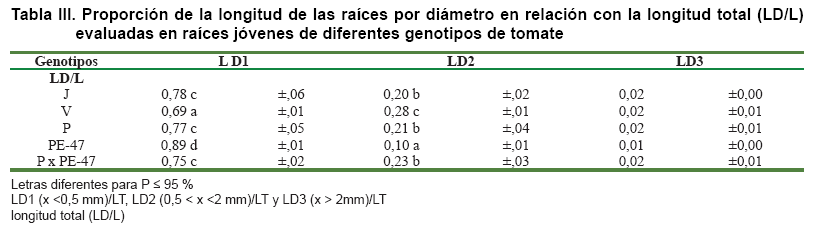
De igual forma, Volgogradiskij registró la mayor proporción de raíces (cerca del 30 %) entre 0,5 y 2 mm de diámetro, a diferencia de PE-47 con solo el 10 % de raíces en esta categoría, mientras que las raíces del resto de los genotipos fue similar en proporción (0,23-0,28) (Tabla III). Las raíces más gruesas (>2 mm) fueron escasas y no determinaron diferencias genotípicas, propio de plantas jóvenes de 26 días de germinadas. Estas diferencias en la longitud por diámetro es uno de los factores que determinan la configuración espacial o arquitectura del SR, distinguiéndose PE-47 y V de P, J y PxPE-47.
En la figura se puede apreciar la proyección espacial de los tres genotipos emparentados; PE-47, se distingue por tener raíces muy largas y finas, con pocas ramificaciones a lo largo de la raíz principal; en cambio, P y el híbrido interespecífico PxPE-47 tuvieron semejanza (al igual que V y J, no mostradas en el trabajo), caracterizándose por abundantes raíces laterales que se forman a partir de la raíz principal, tan largas como esta, resultando en una gran masa de raíces, con abundantes ramificaciones.

DISCUSIÓN
Los resultados de este trabajo, a nivel de SRC, en plantas jóvenes desarrolladas en hidroponía, indican la existencia de variaciones genotípicas para varios caracteres morfológicos y de biomasa (Tablas I, II y III). El empleo de la hidroponía permitió hacer el estudio del SRC, no teniendo que emplear métodos destructivos y las modificaciones de las raíces, por la presencia de barreras propias del sustrato, como la compactación. Este tipo de estudio del SRC, en estadios jóvenes de desarrollo, ha sido útil en plantas, donde se han identificado caracteres de las raíces nodales que sirven para tamizajes tempranos con vistas a mejorar la arquitectura de las raíces (18).
Al contrario de los cultivares y el híbrido interespecífico PxPE-47, la accesión silvestre (S. pennellii) PE-47, tiene un sistema radical extremadamente largo y se ramifica a lo largo de la raíz principal, son raíces de menor diámetro y el SRC proyecta un área más pequeña (Tabla II, figura), de poca biomasa; su SR posee el 80 % de las raíces en la categoría muy finas (Tabla III). Estas características le posibilita la exploración de las capas más profundas del suelo en busca de agua y nutrientes, lo cual es consistente con su procedencia y hábitat (Perú, silvestre) (13), así como con otros estudios realizados en especies silvestres de otros géneros (Cucurbita) (19). Las diferencias entre los SR de las especies silvestres y cultivadas, observadas también en este trabajo, han ocurrido, en su mayoría, durante el proceso de domesticación y mejora, lo que ha conllevado a arreglos espaciales contrastantes (20).
Al analizar los resultados obtenidos en las raíces de los genotipos emparentados P, PE-47 y PxPE-47,
se aprecia que el híbrido PxPE-47 tiene el SR semejante a uno de sus progenitores, el cultivar P, superándolo solo en la masa seca de las raíces. El SRC de PxPE-47 se caracteriza por abundantes raíces laterales, tan largas como la raíz principal y semejante en cuanto a arquitectura o proyección espacial (figura) al de P.
La arquitectura del SRC de una planta está determinada, entre otros, por la longitud de la raíz principal y la densidad de las raíces laterales y juega un papel fundamental en determinar si un genotipo se adapta o no a un ambiente específico (21). El hecho de que la arquitectura del SR del híbrido sea semejante al pariente cultivado lo hace atractivo para su empleo como portainjerto, ya que cuenta con una forma espacial que se adapta al cultivo, donde no se necesitan raíces tan profundas, sino amplias ramificaciones que garanticen una mayor área de absorción de agua y nutrientes en un área relativamente próxima.
Ha sido demostrado que algunos portainjertos eran capaces de aumentar simultáneamente la producción y la calidad del fruto de cultivares susceptibles injertados, cuando se utilizaban aguas salinas para el riego (12, 22, 23). Esto sustenta aún más las potencialidades del uso del híbrido PxPE-47 como portainjerto, pues además de tener una raíz vigorosa podría contribuir de manera significativa en la mejora del soporte, establecimiento y sobrevivencia de la planta bajo estrés biótico y abiótico (24). Sobre los progenitores el Pera (P), es un cultivar de tomate con un mecanismo de “inclusión” semi-halofítico al ser utilizado como portainjerto (25) y la entrada
PE-47 (S. pennellii)(13), que tiene reconocida tolerancia a la sal.
Las cualidades del híbrido PxPE-47 como portainjerto deberá ser demostrado en trabajos futuros, bajo condiciones de estrés salino. El aprovechamiento de la variabilidad genética presente en las especies silvestres, como fuente natural de mecanismos de respuesta diversa al estrés por sal, ayudará en la mejora de la tolerancia y a profundizar en los conocimientos sobre los procesos de respuesta ante ese estrés (26).
La mayoría de los genotipos, con una mayor proporción de raíces muy finas (Tabla III), pertenecientes al sistema de raíces terciario, pudieran tener ventajas para enfrentar estreses por déficit de agua, nutrientes o salinidad, ya que estas son responsables de gran parte de las respuestas de plasticidad morfológica rápida (iniciación, crecimiento y muerte), mecanismos por los cuales una planta puede adaptarse a su entorno; en cambio, el SR de V, con mayor proporción de raíces gruesas (0,69 muy finas y 0,30 finas), la mayoría laterales, pertenecientes al SR secundario, le confiere mayor fortaleza para el anclaje y penetración en suelos con cierta compactación.
CONCLUSIONES
- Las diferencias entre los genotipos estudiados en este trabajo podrían tener impacto para los programas de mejoramiento relacionados con la adaptación, fundamentalmente aquellos relacionados con el estrés por sequía, salinidad, déficit de nutrientes y compactación del suelo, lo que deberá ser demostrado en trabajos futuros.
- Se sugiere evaluar los cambios ocasionados en el SR por el estrés, atendiendo a los niveles de organización de este, sistema de raíces secundario y terciario por separado, ya que la evaluación del SRC brinda escasa información con fines de mejora genética.
- El manejo de las raíces, a partir del uso de portainjertos que eleven la tolerancia al estrés ambiental presente en el suelo, es una alternativa prometedora para mejorar la tolerancia de un cultivar susceptible, pero muy bueno en el mercado. Para avanzar en este sentido, se necesitará la integración de diversas disciplinas, desde las tecnologías “omics”, la fisiología vegetal, la agronomía y la mejora genética, hasta disciplinas relacionadas con la rizosfera (20).
- Se requiere de estudios que relacionen los caracteres evaluados en las raíces, en estadio juvenil, con los que determinan el comportamiento de la planta en estadio adulto, bajo condiciones estresantes para determinar su utilidad para la selección temprana.
BIBLIOGRAFÍA
1. Lynch, J. P. ‘‘Roots of the Second Green Revolution’’. Australian Journal of Botany, vol. 55, no. 5, 7 de septiembre de 2007, pp. 493-512, ISSN 1444-9862, DOI 10.1071/BT06118.
2. Coudert, Y.; Périn, C.; Courtois, B.; Khong, N. G.
y Gantet, P. ‘‘Genetic control of root development in rice, the model cereal’’. Trends in Plant Science, vol. 15, no. 4, abril de 2010, pp. 219-226, ISSN 1360-1385,
DOI 10.1016/j.tplants.2010.01.008.
3. Jung, J. K. H. y McCouch, S. ‘‘Getting to the roots of it: Genetic and hormonal control of root architecture’’. Frontiers in Plant Science, vol. 4, 2013, p. 186,
ISSN 1664-462X, DOI 10.3389/fpls.2013.00186,
PMID: 23785372PMCID: PMC3685011.
4. Singh, V.; Oosterom, V.; J, E.; Jordan, D. R.; Hunt, C. H. y Hammer, G. L. ‘‘Genetic Variability and Control of Nodal Root Angle in Sorghum’’. CropScience, vol. 51, no. 5, 1 de septiembre de 2011, pp. 2011-2020,
ISSN 0011-183X, DOI 10.2135/cropsci2011.01.0038.
5. Calderon, S. L.; Ibarra, C. M. E. y Zepeda, J. I. ‘‘Root Development and Abiotic Stress Adaptation’’ [en línea]. En: ed. Vahdati K., Abiotic Stress - Plant Responses and Applications in Agriculture, edit. InTech, 13 de marzo de 2013, ISBN 978-953-51-1024-8, DOI http://dx.doi.org/10.5772/55043, [Consultado: 6 de enero de 2016], Disponible en: <http://www.intechopen.com/books/abiotic-stress-plant-responses-and-applications-in-agriculture/root-development-and-abiotic-stress-adaptation>.
6. Tuberosa, R.; Salvi, S.; Sanguineti, M. C.; Maccaferri, M.; Giuliani, S. y Landi, P. ‘‘Searching for quantitative trait loci controlling root traits in maize: a critical appraisal’’ [en línea]. En: ed. Abe J., Roots: The Dynamic Interface between Plants and the Earth, (ser. Developments in Plant and Soil Sciences, no. ser. 101), edit. Springer Netherlands, 2003, pp. 35-54, ISBN 978-90-481-6407-3, DOI 10.1007/978-94-017-2923-9_5, [Consultado: 6 de enero de 2016], Disponible en: <http://link.springer.com/chapter/10.1007/978-94-017-2923-9_5>.
7. Laperche, A.; Devienne-Barret, F.; Maury, O.; Gouis, J. L. y Ney, B. ‘‘A simplified conceptual model of carbon/nitrogen functioning for QTL analysis of winter wheat adaptation to nitrogen deficiency’’. Theoretical and Applied Genetics, vol. 113, no. 6, 15 de agosto de 2006, pp. 1131-1146, ISSN 0040-5752, 1432-2242,
DOI 10.1007/s00122-006-0373-4.
8. Gaudin, A. C. M.; Mcclymont, S. A.; Holmes, B. M.; Lyons, E. y Raizada, M. N. ‘‘Novel temporal, fine scale and growth variation phenotypes in roots of adult stage maize (Zea mays L.) in response to low nitrogen stress’’. Plant, Cell& Environment, vol. 34, no. 12, 1 de diciembre de 2011, pp. 2122-2137, ISSN 1365-3040, DOI 10.1111/j.1365-3040.2011.02409.x.
9. Petricka, J. J.; Winter, C. M. y Benfey, P. N. ‘‘Control of Arabidopsis Root Development’’. Annual review of plant biology, vol. 63, 2 de junio de 2012,
pp. 563-590, ISSN 1543-5008, DOI 10.1146/annurev-arplant-042811-105501, PMID: 22404466PMCID: PMC3646660.
10. Cuartero, J.; Bolarín, M. C.; Moreno, V. y Pineda, B. ‘‘Tolerancia a la salinidad’’. En: La Adaptación Al Ambiente Y Los Estreses Abióticos En La Mejora Vegetal, edit. Andalucía. Consejería De Agricultura Y Pesca, Sevilla, 1 de noviembre de 2008, pp. 233-261, ISBN 978-84-8474-248-7.
11. Lovelli, S.; Perniola, M.; Tommaso, T. D.; Bochicchio, R. y Amato, M. ‘‘Specific Root Length and Diameter of Hydroponically-grown Tomato Plants under Salinity’’. Journal of Agronomy, vol. 11, no. 4, 1 de abril de 2012, pp. 101-106, ISSN 18125379, DOI 10.3923/ja.2012.101.106.
12. Sanchez, B. P.; Egea, I.; Flores, F. B. y Bolarin, M. C. ‘‘Tomato: Grafting to Improve Salt Tolerance’’ [en línea]. En: eds. Tuteja N., Gill S. S., Tiburcio A. F., y Tuteja R., Improving Crop Resistance to Abiotic Stress, edit. Wiley-VCH VerlagGmbH& Co. KGaA, 2012, pp. 1067-1084, ISBN 978-3-527-63293-0, [Consultado: 6 de enero de 2016], Disponible en: <http://onlinelibrary.wiley.com/doi/10.1002/9783527632930.ch42/summary>.
13. Cuartero, J. y Fernández, M. R. ‘‘Tomato and salinity’’. ScientiaHorticulturae, vol. 78, no. 1–4, 30 de noviembre de 1998, pp. 83-125, ISSN 0304-4238, DOI 10.1016/S0304-4238(98)00191-5.
14. Fita, A.; Picó, B.; Monforte, A. J. y Nuez, F. ‘‘Genetics of Root System Architecture Using Near-isogenic Lines of Melon’’. Journal of the American Society for Horticultural Science, vol. 133, no. 3, 5 de enero de 2008, pp. 448-458, ISSN 0003-1062, 2327-9788.
15. Zobel, R. W. y Waisel, Y. ‘‘A plant root system architectural taxonomy: A framework for root nomenclature’’. Plant Biosystems - An International Journal Dealing with all Aspects of Plant Biology, vol. 144, no. 2, 1 de junio de 2010, pp. 507-512, ISSN 1126-3504,
DOI 10.1080/11263501003764483.
16. Zobel, R. W. ‘‘A Developmental Genetic Basis for Defining Root Classes’’. Crop Science, vol. 51, no. 4,
1 de julio de 2011, pp. 1410-1413, ISSN 0011-183X, DOI 10.2135/cropsci2010.11.0652.
17. IBM SPSS Statistics [en línea]. versión 20, [Windows], edit. IBM Corporation, U.S, 2011, Disponible en: <http://www.ibm.com>.
18. Singh, V.; Oosterom, E. J. van; Jordan, D. R.; Messina, C. D.; Cooper, M. y Hammer, G. L. ‘‘Morphological and architectural development of root systems in sorghum and maize’’. Plant and Soil, vol. 333, no. 1-2, 23 de marzo de 2010, pp. 287-299, ISSN 0032-079X, 1573-5036, DOI 10.1007/s11104-010-0343-0.
19. Fita, A.; Postma, J.; Picó, B.; Nuez, F. y Lynch, J. ‘‘Root architecture variation in Cucurbita’’ [en línea]. En: ed. Pitrat M., Proceedings of the IXth EUCARPIA meeting on genetics and breeding of Cucurbitaceae, edit. INRA. Centre de Recherched’Avignon. Unité Génétique et Amélioration des Fruits et Légumes, Montfavet, France, 2008, pp. 487-491, ISBN 978-2-7380-1251-7, [Consultado: 6 de enero de 2016], Disponible en: <https://w3.avignon.inra.fr/dspace/handle/2174/254>.
20. de Dorlodot, S.; Forster, B.; Pagès, L.; Price, A.; Tuberosa, R. y Draye, X. ‘‘Root system architecture: opportunities and constraints for genetic improvement of crops’’. Trends in Plant Science, vol. 12, no. 10, octubre de 2007, pp. 474-481, ISSN 1360-1385, DOI 10.1016/j.tplants.2007.08.012.
21. Malamy, J. E. y Benfey, P. N. ‘‘Down and out in Arabidopsis: the formation of lateral roots’’. Trends in Plant Science, vol. 2, no. 10, octubre de 1997, pp. 390-396, ISSN 1360-1385, DOI 10.1016/S1360-1385(97)90054-6.
22. Flores, F. B.; Sanchez-Bel, P.; Estañ, M. T.; Martinez-Rodriguez, M. M.; Moyano, E.; Morales, B.; Campos, J. F.; Garcia-Abellán, J. O.; Egea, M. I.; Fernández-Garcia, N.; Romojaro, F. y Bolarín, M. C. ‘‘The effectiveness of grafting to improve tomato fruit quality’’. Scientia Horticulturae, vol. 125, no. 3, 28 de junio de 2010, pp. 211-217, ISSN 0304-4238, DOI 10.1016/j.scienta.2010.03.026.
23. Colla, G.; Rouphael, Y.; Leonardi, C. y Bie, Z. ‘‘Role of grafting in vegetable crops grown under saline conditions’’. ScientiaHorticulturae, vol. 127, no. 2,
8 de diciembre de 2010, (ser. SpecialIssueon Vegetable Grafting), pp. 147-155, ISSN 0304-4238, DOI 10.1016/j.scienta.2010.08.004.
24. Kumar, B.; Abdel, G. A. H.; Reyes, M. J.; Hochholdinger, F. y Lübberstedt, T. ‘‘Genotypic variation for root architecture traits in seedlings of maize (Zea mays L.) inbred lines’’. Plant Breeding, vol. 131, no. 4, 1 de agosto de 2012, pp. 465-478, ISSN 1439-0523,
DOI 10.1111/j.1439-0523.2012.01980.x.
25. Estañ, M. T.; Martinez-Rodriguez, M. M.; Perez-Alfocea, F.; Flowers, T. J. y Bolarin, M. C. ‘‘Grafting raises the salt tolerance of tomato through limiting the transport of sodium and chloride to the shoot’’. Journal of Experimental Botany, vol. 56, no. 412, 2 de enero de 2005, pp. 703-712, ISSN 0022-0957, 1460-2431, DOI 10.1093/jxb/eri027, PMID: 15557292.
26. Shelden, M. C.; Roessner, U.; Sharp, R. E.; Tester, M. y Bacic, A. ‘‘Genetic variation in the root growth response of barley genotypes to salinity stress’’. Functional Plant Biology, vol. 40, no. 5, 4 de junio de 2013, pp. 516-530, ISSN 1445-4416, DOI 10.1071/FP12290.
Recibido: 12 de diciembre de 2014
Aceptado: 4 de agosto de 2015
Dra.C. Marta A. Álvarez Gil, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32 700. Email: malvarez@inca.edu.cu



