http://dx.doi.org/10.13140/RG.2.1.2035.4805
Contenidos de carbono orgánico en suelos bajo diferentes coberturas vegetales y de cultivo
Contents of soil organic carbon under different agricultural and vegetation cover
M.Cs. Lucía A. Castillo-Pacheco,I Dr.C. Jose I. Bojórquez-Serrano,I Dr.C. Alberto Hernández-Jiménez,II Dr.c. Diego García-ParedesI
IUniversidad Autónoma de Nayarit, Ciudad de la Cultura Amado Nervo C.P. 63190, Tepic, Nayarit, México.
IIInstituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32 700.
RESUMEN
El carbono orgánico del suelo (COS) representa el mayor almacén de carbono (C) en los ecosistemas terrestres. La deforestación de las coberturas vegetales naturales y el uso agrícola intensivo incrementan las emisiones de CO2 a la atmósfera y por tanto aceleran los procesos del cambio climático global. El objetivo de este trabajo fue cuantificar los contenidos de COS bajo diferentes coberturas vegetales y de cultivo en la cuenca del río Mololoa, en el estado de Nayarit, México. A partir de la cartografía de regionalización geomorfológica, de las coberturas y uso del suelo existentes y con el apoyo de un sistema de información geográfica, se establecieron 27 sitios de muestreo. En cada uno se colectaron muestras de suelo de 0 a 30 cm de profundidad con tres repeticiones por cada sitio. A las muestras obtenidas se les determinó la densidad aparente, la concentración de COS y se calculó el C almacenado en los primeros 30 cm de profundidad. El mayor contenido de COS se encontró en los bosques de encino (140 Mg ha-1). Los contenidos de COS de los pastizales, vegetación secundaria, bosques de pino, cultivos y selvas fueron estadísticamente iguales con 99, 83, 73, 53 y 53 Mg ha-1, respectivamente. Las coberturas con suelos que tienen los mayores contenidos de CO fueron el bosque de encino por tener la mayor concentración, y las zonas de cultivo, por tener la mayor superficie ocupada dentro de la cuenca.
Palabras clave: bosques primarios, bosque tropical, uso de la tierra.
ABSTRACT
Soil organic carbon (SOC) represents the major soil reservoir in the terrestrial ecosystems. The deforestation and the intensive agriculture use increases the CO2 emissions to the atmosphere, promoting the processes related with global climatic change. The objective of this work was to measure the content of SOC under different vegetation covers at the Mololoa basin in Nayarit State, Mexico. Using geomorphological regionalization and land use maps by geographic information system, 27 sampling sites were established. For each soil sampling of 30 cm depth, with three replicates in each site. The samples obtained were analyzed for bulk density, the organic carbon concentration and the carbon content within the top 30 cm depth. The was calculated oak forest had the highest SOC content (140 Mg ha-1). The SOC contents under grassland, secondary vegetation, pine forest, crop land and tropical forest were similar among them (99, 83, 73, 53 and 53 Mg ha-1, respectively). The land cover with higher SOC content were oak forest for its higher SOC concentration and the crop land for its higher area occupied within the studied basin.
Key words: primary forests, tropical forests, land use.
INTRODUCCIÓN
En el ciclo terrestre del carbono, el suelo contiene la mayor cantidad en interacción con la atmósfera, se estima que hay alrededor de 1,500 Pg C a 1 m de profundidad y cerca de 2,456 a dos metros; la vegetación (650 Pg) y la atmósfera (750 Pg) almacenan considerablemente menos cantidades que los suelos (1). Los flujos entre el carbono orgánico del suelo y la atmósfera son importantes ya que contribuyen con las emisiones de CO2 y con ello al calentamiento global (2, 3).
La acumulación de C orgánico en los bosques y selvas es importante por la captura y emisiones de gases de efecto invernadero, debido a que los cambios en el uso del suelo y de la cubierta vegetal afectan la cantidad de carbono almacenado en la vegetación y el suelo (4). En México, el sector que incluye la cubierta vegetal y el uso del suelo se considera la segunda fuente de las emisiones de gases de efecto invernadero después del consumo de combustibles fósiles (5). Por ello, la importancia del conocimiento de la cantidad de C almacenado en los ecosistemas, su dinámica y los cambios sobre todo, cuando están bajo altas presiones antropogénicas.
La cobertura vegetal y el uso del suelo juegan un papel importante en el COS y sus cambios, por un lado controlan la cantidad y calidad de compuestos orgánicos que aportan a los suelos, y posteriormente se determina la sensibilidad a la temperatura intrínseca de la descomposición de la materia orgánica (6). La mayoría de las coberturas naturales tienen ganancias de COS; mientras que los cambios de uso a la agricultura presentan pérdidas de COS (7).
En México, se han realizado estudios del contenido de C (4, 8–10); sin embargo, estos están referidos a la vegetación y pocos toman en cuenta al suelo. En este país en los suelos se reporta una media de 56,1 Mg ha-1 de COS en los primeros 20 cm de profundidad; asimismo, para las regiones ecológicas se destacan las selvas húmedas con 110,5 Mg ha-1, los manglares (106,1 Mg ha-1) y los bosques mesófilos de montaña (104,9 Mg ha-1); seguido de las selvas secas (69,6 Mg ha-1), los bosques de coníferas y encino (65,5 Mg ha-1) y los pantanos (62,0 Mg ha-1) (11).
En bosques templados de México se reportan contenidos de COS para bosque de Quercus (121,3 Mg ha-1) y bosque de Pinus (119,4 Mg ha-1) en suelos de conservación del Distrito Federal (12); en rodales conservados de pino-encino (103±35 Mg ha-1) de la reserva de la biósfera mariposa monarca en Michoacán (13); mientras que en suelos someros de bosques de diferentes especies de pinares de áreas naturales protegidas Pinus rudis (180 Mg ha-1), Pinus pseudostrobus (110), Pinus douglasiana (105), Pinus pátula (102), Pinus hartwegii (102), Pinus teocote (94), Pinus montezumae (76), Pinus spp. (71), Pinus ayacahuite (21), Abies vejarii (131) y Abies religiosa (92) (14).
En ecosistemas de pastizales se registran contenidos de COS de 90 Mg ha-1 en el Distrito Federal (12), mientras que en climas semiáridos de Tamaulipas en pastizales de 30, 20 y 10 años, 8,03, 7,33 y 4,13 Mg ha-1 respectivamente (15).
En suelos cultivados se reportan contenidos de COS de 46,1 Mg ha-1 (12), mientras que por otro lado se reporta los contenidos de COS en suelos en cuatro paisajes costeros del estado de Nayarit en 20, 50 y 100 cm de profundidad (16). En la llanura aluvial alta, dos perfiles de Cambisoles, uno con cultivo de sorgo con 26,1 Mg ha-1 en los primeros 20 cm de profundidad y el segundo con pastizal cultivado (40,7). En la llanura media, presenta cuatro perfiles; dos de Phaeozems desarrollados en bosque tropical subcaducifolio que tienen 53,7 y 67,1 Mg ha-1; un Cambisol cultivado con sorgo con 32,2 Mg ha-1 y un Solonetz con pastizal inducido (27,7). En la llanura aluvial baja registra dos perfiles de Cambisoles; uno cultivado con mango (33,2 Mg ha-1) y el otro con sorgo y maíz (10,9). Finalmente, en el paisaje de barras costeras, cuatro perfiles de Arenosoles; uno con cobertura vegetal de bosque tropical subcaducifolio (10,8 Mg ha-1); dos cultivados con plantaciones de cocotero (0,82) y tomatillo (0,96), y uno en dunas costeras (3,89).
El objetivo de este trabajo fue estimar los contenidos de COS en diferentes cubiertas vegetales y uso agrícola del suelo de la cuenca del rio Mololoa, que involucra 34 localidades de los municipios de Tepic, Xalisco y Santa María del Oro, en el estado de Nayarit.
MATERIALES Y MÉTODOS
Área de estudio
La cuenca del río Mololoa abarca 618 km2 de la cuenca del río Santiago-Aguamilpa en la parte central del estado de Nayarit, México, se localiza entre las coordenadas 21o44´15´´; 21o16´13´´ de Latitud Norte y 105º39´01´´; 105º00´53´´ de Longitud Oeste. Está delimitada por estructuras volcánicas aisladas, principalmente los volcanes San Juan, Coatepec, Tepeltiltic, Sangangüey y la caldera de Tepic (todas ellas originarias del Cuaternario, sobre un basamento del Terciario). La zona en estudio presenta seis ambientes morfogenéticos; sierra volcánica con laderas escarpadas del volcán San Juan, escudo volcánico con calderas, sierra volcánica con estrato volcanes, lomeríos, superficies de lomeríos y laderas de la cuenca baja y la llanura aluvial. Los primeros cinco corresponden a superficies erosivas representadas por sierras y escudos volcánicos, laderas y lomeríos de los volcanes San Juan, Sangangüey y calderas de Tepic y Tepeltitic; mientras que el último, a la llanura aluvial–valle de Matatipac (17).
El clima de la región es cálido subhúmedo con lluvias en verano y régimen de lluvia invernal de 4 %, presenta una diversidad local que va de templado subhúmedo en la parte más alta de los volcanes (12-18 oC), semicálido en la parte media de la cuenca (valle Matatipac) (18-22 oC), y cálido en la sección baja hacia la desembocadura con el río Santiago (mayor a 22 oC). La precipitación media anual es de 1 180 mm (18).
La formación de suelos está en dependencia de los relieves y los tipos de rocas volcánicas; en la parte del volcán San Juan, que en sus últimas etapas tuvo erupciones de pómez y cenizas volcánicas, se desarrollan Andosoles, Cambisoles y Regosoles; mientras que en el resto de las laderas de la cuenca hay Leptosoles, Alisoles, Luvisoles, Feozems y Cambisoles. En las partes depresionales del valle, donde hay drenaje deficiente da lugar a la manifestación del proceso de gleyzación y se forman los Gleysoles. En general todos los suelos presentan pH ácido (entre 4,9 y 6,9) (19).
El 38 % de la superficie de la zona presenta vegetación natural y el 44 % son tierras de cultivo (caña de azúcar, aguacate y maíz, principalmente), el resto son vegetación secundaria, construcciones y cuerpos de agua. Las principales coberturas vegetales son bosques de encino y de pino, distribuidos en las elevaciones mayores de los volcanes y con tasa de deforestación de 0,1 ha año-1 (20); y las selvas y pastizales se localizan en la parte baja de la cuenca, con ritmo de pérdida de 0,3 ha año-1 (20).
Las especies dominantes en cada cobertura son para el bosque de pino (Pinus devoniana, Pinus montezumae y Pinus pseudosptrobus), bosque de encino (Quercus glaucescens, Quercus laeta y Quercus obtusata), vegetación secundaria (Belotia mexicana, Bocconia arborea, Byrsonima crassifolia, Cecropia peltata, Cochlospermun vitifolium, Croton panamensis, Guazuma ulmifolia, Helicteres guazumaefolia, lantana camara, Luhea candida, Trema micranta, Psidium sartorianum, Psidium guajava, Tecoma stans, Montano akarvinski, Phitolacca rugosa, Rawolfia heterophylla, Solanun mtorvum, Waltheria americana y Zanthoxylon fagara), pastizales con diversas especies de los géneros (Aristídia, Bouteloua, Panicum, Eragrostis, Stipa, Trachypogon y Trisetum) y cultivos (Saccharum officinarum, Persea americana y Zea mays) (21).
Selección de sitios de muestreo
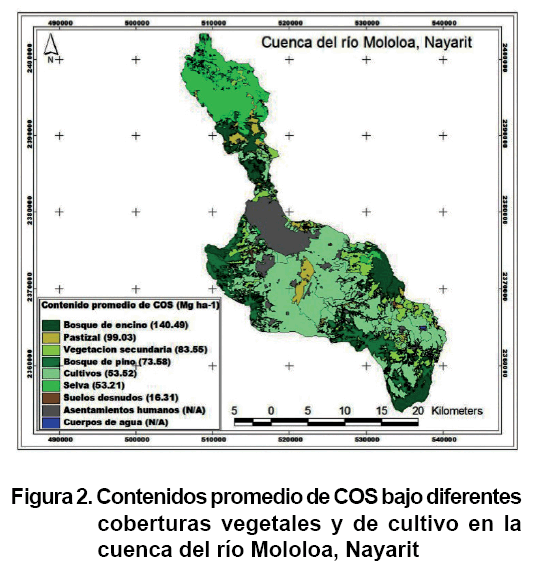
Para la selección de los sitios de muestreo se tuvo en cuenta, por un lado, la regionalización geomorfológica de la cuenca del río Mololoa, a nivel de ambientes morfogenéticos, paisajes geomorfológicos y tipos de relieve (17), y por otro, el estudio de coberturas vegetales y usos del suelo (20). Con el apoyo del sistema de información geográfica ArcView 3.2, sobre la base de las unidades de los seis paisajes geomorfológicos se sobrepusieron primero, las unidades de cuatro grandes grupos de cobertura, en este caso de vegetación natural, vegetación secundaria, tierras de cultivo y tierras eriales; para este estudio no se tuvieron en cuenta los cuerpos de agua (presas y ríos) y las coberturas con asentamientos humanos. Seguido de las unidades de los siete grupos de cobertura de bosque de encino (Be), bosque de pino (Bp), selvas (Se), vegetación secundaria (matorral) (Vs), pastizal (Pa), cultivos (Cu) y suelos desnudos (Sd) (Figura 1).

El criterio de selección de los sitios de muestreo fue de al menos una muestra compuesta por relieve diferente en cada grupo de cobertura, lo que resulto en un total de 27 sitios: Be seis, Bp tres, Se dos, Vs seis, Pa tres, Cu seis y Sd uno. La distribución de sitios está en función de los relieves que afectó cada grupo de cobertura vegetal y cultivo. En cada sitio seleccionado, se diseño un triángulo de 10 m cada lado y en sus vértices se tomaron muestras individuales de suelo a 30 cm de profundidad y se determinó la densidad aparente con el método del cilindro (100 cm3).
Determinación de carbono orgánico del suelo (COS)
Para determinar el COS las muestras de suelo se prepararon según el método AS-01 (22), para lo que se secaron al aire y luego se separaron las gravas de suelo fino mediante tamizado de 0,5 mm. La determinación de la materia orgánica del suelo se realizó a través del método de Walkley y Black (AS-07), el cual se basa en la oxidación de carbón orgánico del suelo por medio de una disolución de dicromato de potasio y el calor de reacción que se genera al mezclarla con ácido sulfúrico concentrado. Se aplicó como corrección el factor 1,298 (1/0,77).
La cantidad de carbono orgánico en suelo se estimó usando la siguiente ecuación:
COS=CO (Da) m
donde:
COS=Carbono orgánico total en suelo por superficie (Mg ha-1);
CO= Carbono orgánico total (%)
Da= Densidad aparente (g/cm3)
m= Profundidad del suelo (cm)
Análisis y representación de los datos
A los valores de COS se les realizó un análisis de varianza bajo un diseño completamente al azar, considerando los tipos de cobertura como tratamientos. El valor del estadístico de normalidad (Shapiro-Wilk) fue de 0,924 (<0,0001). A los contenidos medios de carbono (Mg ha-1) se les aplicó una prueba de rango múltiple (Duncan α=0,05), mediante el software SAS versión 9.1 (23).
Con el SIG se representaron los contenidos promedio de las diferentes coberturas vegetales y de cultivo (Figura 2). Asimismo, al tener en cuenta la superficie que cubre cada tipo de cobertura vegetal y de cultivo, dentro de la cuenca, se calcularon los contenidos de COS con que contribuyen en la zona estudiada.
RESULTADOS Y DISCUSIÓN
El mayor contenido de COS se encuentra en la cobertura de bosque de encino (140,4 Mg ha-1), por encima de los suelos bajo otras coberturas. Los contenidos de COS de las coberturas de pastizal, vegetación secundaria, bosque de pino, cultivo y selvas fueron estadísticamente iguales con 99,0, 83,5, 73,5, 53,5 y 53,2 Mg ha-1 respectivamente. Finalmente, el suelo desnudo tuvo el contenido más bajo de todas las coberturas estudiadas con 16,3 Mg ha-1 (Tabla).
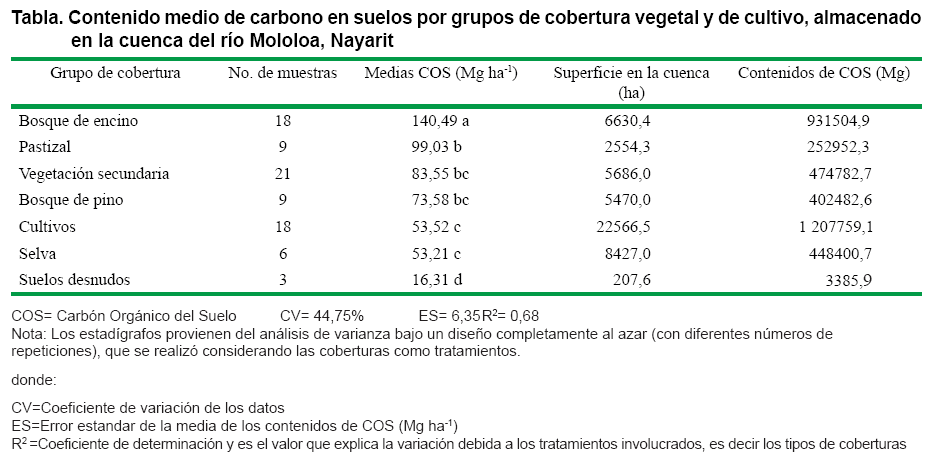
Las coberturas de bosque de encino y pino de las partes más altas de los volcanes San Juan, Sangangüey y Tepeltiltic, abarcan poco más de 12,000 ha de la cuenca del río Mololoa. Resultaron con niveles de COS de 140,49 y 73,5 Mg ha-1 respectivamente, muy por encima de los promedio presentados para bosques de coníferas y encino de México de 66,5 Mg ha-1 (11), al igual que en rodales conservados de pino encino de la reserva de la biósfera mariposa monarca en Michoacán (103±35 Mg ha-1) (14) y en bosques de encino en el suelo de conservación del Distrito Federal (121,3 Mg ha-1) (12). En el caso del bosque pino de la cuenca estudiada, el contenido promedio fue menor que en el bosque de Pinus (119,4 Mg ha-1) en suelos de conservación del Distrito Federal (12); y los reportados para diferentes especies de pinares de áreas naturales protegidas de México, en el caso de Pinus pseudostrobus (110 Mg ha-1) y Pinus montezumae (76 Mg ha-1) (13).
Los bosques de pino encino almacenan entre 40 y 80 % del COS en los horizontes A del suelo (13); también se reporta en este trabajo valores de COS para bosques de pino encino aprovechados (39 Mg ha-1) y perturbados (13 Mg ha-1). Estos resultados indican la importancia de conservarlos en su condición natural.
Las selvas tropicales de la cuenca del río Mololoa ocupan 8,427 ha y tienen contenidos de COS promedio (30 cm) de 53,21 Mg ha-1, por debajo de los registros para las selvas secas (69,6 Mg ha-1) y selvas húmedas (110,5 Mg ha-1) de México (11); igualmente resultan más bajos que los contenidos en suelos (en la capa de 0-20 cm), con selva tropical subcaducifolia de la llanura costera de Nayarit (16) y en suelos ferralíticos rojos con selvas tropicales de Cuba (67 Mg ha-1) (24).
Los pastizales de la cuenca del río Mololoa están dispersos y derivan de cambios de la cubierta vegetal para el uso pecuario. Abarcan poco más de 2,500 ha y presentan contenidos promedio de COS de 99 Mg ha-1, muy similar a los obtenidos en pastizales (90 Mg ha-1) del área de conservación del Distrito Federal (12) y por encima de los Cambisoles de la llanura costera de Nayarit (40,7 Mg ha-1) (16) y de suelos ferralíticos rojos de Cuba (48 Mg ha-1) (24); asimismo, de los pastizales de clima semiárido de Tamaulipas con 30, 20 y 10 años sin manejo, con 8,03, 7,33 y 4,13 Mg ha-1 respectivamente (15).
El cambio de uso del suelo es la causa principal de la reducción del contenido de C. Se estiman pérdidas entre 30 y 50 % del COS en la capa arable, después de un largo tiempo de cultivo, de ahí que cuando se deforestan los bosques y selvas, tiene lugar una reducción en los contenidos de CO como lo reportan algunos autores (24), al comparar suelos (20 cm) con cobertura de selvas tropicales (67 Mg ha-1), pastizales (48 Mg ha-1) y cultivados (32 Mg ha-1). Asimismo (16), al comparar perfiles con cubierta vegetal de selva tropical subcaducifolia con cultivo (sorgo) se reduce la cantidad de COS hasta un 60 %.
Las estimaciones de COS en el matorral espinoso Tamaulipeco y en tres pastizales sin manejo, por 10, 20 y 30 años, son de 14,2, 8,0, 7,3 y 4,1 Mg ha-1 respectivamente. La reaparición y el desarrollo a través del tiempo de las especies arbóreas y arbustivas del matorral natural en pastizales abandonados además de conservar el suelo, tienen un potencial de almacén del carbono (15).
Las áreas de cultivo representan el 44 % de la superficie de la cuenca estudiada, con más de 22 mil hectáreas. La mayor extensión es de caña de azúcar, el promedio de COS estimado en los primeros 30 cm de profundidad fue de 53,5 Mg ha-1 por encima de suelos cultivados del Distrito Federal (46.1 Mg ha-1) (12), los suelos ferralíticos rojos de Cuba (32 Mg ha-1) (24) y de cuatro perfiles de Cambisoles de la llanura costera de Nayarit con 26,1, 32,2, 33,2 y 10,9 Mg ha-1 (16).
El manejo del cultivo es importante en el contenido del COS. Los cambios en el contenido de COS de los primeros 15 cm de un Vertisol con diferentes formas de manejo se muestran a continuación: sin cultivar (66,8 Mg ha-1); con siembra directa y aporte de residuos después del empacado del rastrojo de maíz, sorgo, cebada y trigo (58,8 Mg ha-1); con siembra directa y aporte total de los residuos de cosecha (53,1 Mg ha-1) y con siembra convencional y quema de los residuos de cosecha (44,8 Mg ha-1) (25).
Los cambios en el contenido de COS en un Ultisol bajo cultivo de caña de azúcar que tuvo previamente una cubierta vegetal de bosque tropical y el cambio de uso de la tierra tuvieron un impacto significativo en la concentración total del COS. Demuestran que la caña de azúcar cultivada después del bosque tropical secundario tiene una tasa positiva en la captura de nuevo carbono, pero una pérdida significativa en el carbono original del bosque tropical (26). Después de 56 años de cultivo de caña, la concentración de COS fue más baja que en el bosque tropical en más del 60 %; mientras que el cultivo de caña de 35 años no tuvo reducción significativa en la concentración del COS a 1 m de profundidad. Los resultados indican que cuando los bosques naturales son convertidos a cultivos de caña de azúcar hay una reducción continua en el COS por largos periodos de tiempo (26).
Finalmente, en los suelos desnudos solo crece vegetación herbácea durante el periodo de lluvias (junio a octubre) y con frecuencia presentan incendios. Están en una superficie reducida de la cuenca (207 ha) y también contienen niveles bajos de COS (16,3 Mg ha-1), lo que sugiere el alto grado de deterioro de este ecosistema.
CONCLUSIONES
- Por grupo de cobertura vegetal el bosque de encino presentó el contenido mayor de C, mientras que los de menor almacén fueron los suelos desnudos.
- Las coberturas con más relevancia en la cantidad de almacenamiento de COS fueron el bosque encino por ser la que presenta la mayor concentración, y las zonas de cultivo, por la superficie que ocupan dentro de la cuenca representan la mayor cantidad de C almacenado.
- En los escenarios sobre los cambios de uso del suelo en México también se proyecta que se modifican los contenidos de carbono de los suelos (27), estiman que el cambio de coberturas de matorrales y pastizales a labranza de conservación puede ser la alternativa más favorable para conservar los almacenes de COS y evitar la pérdida como CO2.
- En el caso del cambio de uso del suelo de selva baja caducifolia a los sistemas de labranza se deben adoptar prácticas con mayor entrada de residuos vegetales como los pastizales.
AGRADECIMIENTOS
Al Consejo Nacional de Ciencia y Tecnología, por la beca otorgada a la primera autora (CVU 447226) para la realización de los estudios de Maestría en Ciencias Biológica Agropecuarias en el área de Ciencias Ambientales.
BIBLIOGRAFÍA
1. FAO. Captura de carbono en los suelos para un mejor manejo de la tierra. Informes sobre recursos mundiales de suelos, no. 96, Roma, Italia, 2002, p. 73, ISBN 92-5-304690-2.
2. Lal, R. ‘‘Soil carbon sequestration to mitigate climate change’’. Geoderma, vol. 123, no. 1–2, noviembre de 2004, pp. 1-22, ISSN 0016-7061, DOI 10.1016/j.geoderma.2004.01.032.
3. Lal, R. y Stewart, B. A. Principles of Sustainable Soil Management in Agroecosystems. edit. CRC Press, 10 de junio de 2013, 571 p., ISBN 978-1-4665-1346-4.
4. Aryal, D. R.; De Jong, B. H. J.; Ochoa, G. S.; Esparza, O. L. y Mendoza, V. J. ‘‘Carbon stocks and changes in tropical secondary forests of southern Mexico’’. Agriculture, Ecosystems & Environment, vol. 195, 1 de octubre de 2014, pp. 220-230, ISSN 0167-8809, DOI 10.1016/j.agee.2014.06.005.
5. de Jong, B.; Anaya, C.; Masera, O.; Olguín, M.; Paz, F.; Etchevers, J.; Martínez, R. D.; Guerrero, G. y Balbontín, C. ‘‘Greenhouse gas emissions between 1993 and 2002 from land-use change and forestry in Mexico’’. Forest Ecology and Management, vol. 260, no. 10, 15 de octubre de 2010, pp. 1689-1701, ISSN 0378-1127, DOI 10.1016/j.foreco.2010.08.011.
6. Dawson, J. J. C. y Smith, P. ‘‘Carbon losses from soil and its consequences for land-use management’’. Science of The Total Environment, vol. 382, no. 2–3, 1 de septiembre de 2007, pp. 165-190, ISSN 0048-9697, DOI 10.1016/j.scitotenv.2007.03.023.
7. Xiong, X.; Grunwald, S.; Myers, D. B.; Ross, C. W.; Harris, W. G. y Comerford, N. B. ‘‘Interaction effects of climate and land use/land cover change on soil organic carbon sequestration’’. Science of The Total Environment, vol. 493, 15 de septiembre de 2014, pp. 974-982, ISSN 0048-9697, DOI 10.1016/j.scitotenv.2014.06.088.
8. Masera, O. R. ‘‘Carbon mitigation scenarios for Mexican forests: methodological considerations and results’’. INTERCIENCIA, vol. 20, no. 6, 1995, pp. 388–395, ISSN 0378-1844.
9. de Jong, B. H. J.; Cairns, M. A.; Haggerty, P. K.; Ramírez-, M. N.; Ochoa, G. S.; Mendoza, V. J.; González, E. y March, M. I. ‘‘Land-Use Change and Carbon Flux Between 1970s and 1990s in Central Highlands of Chiapas, Mexico’’. Environmental Management, vol. 23, no. 3, abril de 1999, pp. 373-385, ISSN 0364-152X, 1432-1009, DOI 10.1007/s002679900193.
10. Figueroa, N. C.; Etchevers, B. J. D.; Velázquez, M. A. y Acosta, M. M. ‘‘Concentración de carbono en diferentes tipos de vegetación de la Sierra Norte de Oaxaca’’. Terra Latinoamericana, vol. 23, no. 1, 2005, pp. 57–64, ISSN 2395-8030.
11. Segura, C. M. A.; Sánchez, G. P.; Ortiz, S. C. A. y Gutiérrez, C. M. del C. ‘‘Carbono orgánico de los suelos de México’’. Terra Latinoamericana, vol. 23, no. 1, 2005, pp. 21–28, ISSN 2395-8030.
12. Vela, C. G.; López, B. J.; Gamiño, R. y Lourdes, M. de. ‘‘Niveles de carbono orgánico total en el Suelo de Conservación del Distrito Federal, centro de México’’. Investigaciones Geográficas, vol. 77, abril de 2012, pp. 18-30, ISSN 0188-4611.
13. Cruz, F. G. y Etchevers, B. J. D. ‘‘Contenidos de carbono orgánico de suelos someros en pinares y abetales de áreas protegidas de México’’. Agrociencia, vol. 45, no. 8, diciembre de 2011, pp. 849-862, ISSN 1405-3195.
14. Pérez, R. S.; Ramírez, M. I.; Jaramillo, L. P. F. y Bautista, F. ‘‘Contenido de carbono orgánico en el suelo bajo diferentes condiciones forestales: reserva de la biosfera mariposa monarca, México’’. Revista Chapingo. Serie ciencias forestales y del ambiente, vol. 19, no. 1, abril de 2013, pp. 157-173, ISSN 0186-3231, DOI 10.5154/r.rchscfa.2011.09.062.
15. Yerena, Y. J. I.; Jiménez, P. J.; Alanís, R. E.; Aguirre, C. O. A.; González, T. M. A. y Treviño, G. E. J. ‘‘Dinámica de la captura de carbono en pastizales abandonados del noreste de México’’. Tropical and Subtropical Agroecosystems, vol. 17, 2014, pp. 113–121, ISSN 1870-0462.
16. Murray, N. R. M.; Bojorquez, S. J. I.; Hernández, J. A.; García, P. J. D.; Madueño, M. A.; Bugarin, M. R. y Orozco, B. M. G. ‘‘Pérdidas de carbono en suelos de la Llanura Costera de Nayarit, México’’. Revista Bio Ciencias, vol. 1, no. 4, 10 de enero de 2012, pp. 38-46, ISSN 2007-3380, DOI 10.15741/rev bio ciencias.v1i4.22, carbono orgánico; suelo.
17. Bojórquez, S. J. I.; Nájera, G. O.; Hernández, J. A. y Murray, N. R. ‘‘Formas del relieve en la cuenca del río Mololoa’’. En: Marceleño F. S. y Nájera G. O., La cuenca del río Mololoa y su problemática socioambiental, edit. Universidad Autónoma de Nayarit, Tepic, Nayarit, 2014, pp. 47-66, ISBN 978-607-7868-73-6.
18. Nájera, G. O. y Bojórquez, S. J. I. ‘‘El clima de la cuenca del río Mololoa’’. En: Marceleño F. S. y Nájera G. O., La cuenca del río Mololoa y su problemática socioambiental, edit. Universidad Autónoma de Nayarit, Tepic, Nayarit, 2014, pp. 67-81, ISBN 978-607-7868-73-6.
19. Vivanco, J. C.; Bojórquez, J. I.; Murray, R. M.; Nájera, O.; Flores, F. y Hernández, A. ‘‘Características de los principales suelos de la cuenca del río Mololoa, Tepic, Nayarit, México’’. Cultivos Tropicales, vol. 31, no. 1, marzo de 2010, pp. 32-40, ISSN 0258-5936.
20. Nájera, G. O.; Bojórquez, S. J. I.; Cifuentes, L. J. L. y Marceleño, F. S. ‘‘Cambio de cobertura y uso del suelo en la cuenca del río Mololoa, Nayarit’’. Revista Bio Ciencias, vol. 1, no. 1, 1 de julio de 2010, pp. 19-29, ISSN 2007-3380, DOI 10.15741/rev bio ciencias.v1i1.8.
21. Téllez, V. O.; Flores, F. G.; Martínez, R. A.; González, F. R. E.; Segura, H. G.; Ramírez, R. R.; Domínguez, M. A. y Calzada, I. Listados Florísticos de México XII: Flora de la reserva ecológica Sierra de San Juan, Nayarit, México. edit. Cromocolor SA de CV., Nayarit, México, 1995, 49 p.
22. Secretaría de Medio Ambiente y Recursos Naturales. Especificaciones de fertilidad, salinidad y clasificación de suelos. Estudios, muestreo y análisis [en línea]. no. NOM-021-SEMARNAT-2000, Inst. Diario Oficial de la Federación, México, 31 de diciembre de 2002, p. 85, Segunda Sección, [Consultado: 12 de marzo de 2013], Disponible en: <http://www.semarnat.gob.mx/node/18>.
23. SAS Institute. Statistical Analysis Software SAS/STAT® [en línea]. versión 9.1.3, edit. SAS Institute Inc, Cary, N.C., USA, 2013, Disponible en: <http://www.sas.com/en_us/software/analytics/stat.html#>.
24. Hernández, J. A.; Cabrera, R. A.; Borges, B. Y.; Vargas, B. D.; Bernal, F. A.; Morales, D. M. y Ascanio, G. M. O. ‘‘Degradación de los suelos Ferralíticos Rojos Lixiviados y sus indicadores de la Llanura Roja de La Habana’’. Cultivos Tropicales, vol. 34, no. 3, septiembre de 2013, pp. 45-51, ISSN 0258-5936.
25. García, S. R.; Espinosa, V. D.; Figueroa, S. B.; García, C. N. E. y Gallardo, J. F. ‘‘Reservas de carbono orgánico y de fracciones húmicas en un vertisol sometido a siembra directa’’. Terra Latinoamericana, vol. 24, no. 2, abril de 2006, pp. 241-251, ISSN 0187-5779.
26. Deng, W.; Wu, W.; Wang, H.; Luo, W. y Kimberley, M. O. ‘‘Temporal dynamics of iron-rich, tropical soil organic carbon pools after land-use change from forest to sugarcane’’. Journal of Soils and Sediments, vol. 9, no. 2, 26 de noviembre de 2008, pp. 112-120, ISSN 1439-0108, 1614-7480, DOI 10.1007/s11368-008-0053-x.
27. González, M. L.; Acosta, M. M.; Carrillo, A. F.; Báez, A. y González, C. J. M. ‘‘Cambios de carbono orgánico del suelo bajo escenarios de cambio de uso de suelo en México’’. Revista mexicana de ciencias agrícolas, vol. 5, no. 7, noviembre de 2014, pp. 1275-1285, ISSN 2007-0934.
Recibido: 14/01/2015
Aceptado: 30/10/2015
M.Cs. Lucía A. Castillo-Pacheco, Universidad Autónoma de Nayarit, Ciudad de la Cultura Amado Nervo C.P. 63190, Tepic, Nayarit, México. Email: iranbojorquez@hotmail.com


