http://dx.doi.org/10.13140/RG.2.2.17308.08324
Efecto de la adición de cachaza, roca fosfórica y biofertilizantes en el suelo sobre el contenido de fósforo y el desarrollo de plántulas de caña de azúcar
Effect of the filter cake, phosphoric rock and biofertilizer addition to the soil on the phosphorous content and sugar cane seedlings
Leónides Castellanos-González,I Maikel Abreus-Jiménez,I Cid Naudi Silva-Campos,II Ramón Rivera-Espinosa,III Inoel Fuentes-Romero,I Enrique Parets-Selva,I Renato de Mello-Prado,II Margarita RomeroI
ICentro de Estudios para la Transformación Agraria Sostenible. Facultad de Ciencias Agrarias. Universidad de Cienfuegos, carretera a Rodas, km 4, Cienfuegos, Cuba.
IIFacultad de Ciencias Agrarias y Veterinarias. UNESP, Campus Jaboticabal, Sao Paulo, Brasil.
IIIInstituto Nacional de Ciencias Agrícolas, gaveta postal 1, San José de las Lajas, Mayabeque, Cuba. CP 32 700.
RESUMEN
El cultivo de la caña de azúcar tiene importancia a escala mundial y puede afectarse productivamente por el déficit de fósforo. El objetivo del trabajo fue evaluar el efecto de la adición al suelo de cachaza, roca fosfórica y los biofertilizantes Azotofos® y Ecomic® sobre su contenido de fósforo asimilable y el desarrollo de plántulas de caña de azúcar variedad CP 5243. La investigación se condujo en macetas con un suelo Luvisol, donde se plantaron dos vitroplantas de 60 días. Los tratamientos se dispusieron en un diseño completamente aleatorizado con tres repeticiones. Se evaluaron nueve tratamientos compuestos por la adición al suelo de cachaza, roca fosfórica y los biofertilizantes en diferentes combinaciones. Las evaluaciones morfométricas, biológicas y agroquímicas se realizaron a los 60 días después de la plantación. Los datos obtenidos fueron sometidos a un análisis de varianza. Las medias fueron comparadas por el test de Tukey utilizando el programa estadístico ASISTAT. Se verifica la simbiosis de las micorrizas con las plántulas de caña de azúcar, tanto en los tratamientos con Glomus cubense como en los que no se aplicó. La combinación de cachaza y roca fosfórica con los biofertilizantes Ecomic® y Azotofo® incrementa el número de brotes en las plántulas de caña de azúcar. La aplicación de cachaza+Ecomic®, cachaza+Azotofos®, roca fosfórica+Ecomic®, roca fosfórica+Azotofos® y roca+cachaza+Ecomic® incrementan el fósforo soluble en el suelo estudiado.
Palabras clave: abono orgánico, nutrición, Saccharum.
ABSTRACT
The sugar cane crop has global importance scale and it can be affected productively by the phosphorous deficit. This work aims to evaluate the effect of filter cake, phosphoric rock, and the Azotofo® and Ecomic® biofertilizer addition to the soil on the phosphorous content and the development of sugar cane seedlings CP 5243 variety. The investigation was carried out in pots with a Luvisol soil where two vitroplants of 60 days were planted. The treatments were prepared in a completely randomized design with three repetitions. Nine treatments were evaluated by the addition to the soil of filter cake, phosphoric rock and the biofertilizers in different combinations. The morphometric, biological and agrochemical evaluations were carried out 60 days after planting. The obtained data were submitted to variance analysis. The media were compared by Tukey´s test using the statistical program ASISTAT. The simbiosis of mycorrhizae with sugarcane seedlings was verified both at treatments with Glomus cubense and in which was not applied. The combination of filter cake and phosphoric rock with the biofertilizers Ecomic® and Azotofos® increased the number of buds in the sugar cane seedlings. The application of filter cake+Ecomic®, filter cake+Azotofos®, phosphoric rock+Ecomic®, phosphoric rock+Azotofos® and rock+filter cake+Ecomic® increases the soluble phosphorous in the studied soil.
Key words: organic fertilizer, nutrition, Saccharum.
INTRODUCCIÓN
La caña de azúcar es un cultivo que despierta interés a nivel mundial por su importancia, no solo por la obtención de azúcar y sus derivados, sino por la relación con una de las biotecnologías más accesibles, para la generación de energía limpia en sustitución del petróleo (1).
El fósforo (P) constituye un elemento esencial para todos los organismos vivos (2). Como nutrimento imprescindible de las plantas está caracterizado por el alto grado de interacción con el suelo y es uno de los más deficientes para los cultivos en los suelos tropicales, siendo crítico en algunos países como Brasil (3) y en algunas áreas cañeras en Cuba (4).
Este elemento ejerce un efecto decisivo sobre el crecimiento y desarrollo de la caña de azúcar, por su influencia en aspectos como la brotación, el desarrollo radical, la elongación de los tallos, el ahijamiento y la población de tallos molibles (2).
Existen indicios de que el empleo de una fuente de fertilizante fosfatado, mezclado con compuestos orgánicos, produce incrementos en la disponibilidad del nutriente y en la actividad microbiana de los suelos, así como aumento en el crecimiento de las plantas (5–8). En este sentido, el uso de la cachaza (residual orgánico de la industria azucarera) puede reducir las dosis de fertilizante mineral en caña de azúcar, aumentándose la disponibilidad de P en el suelo (9–11). Los beneficios obtenidos por el uso de este compuesto se pueden atribuir al aumento de la actividad de los microorganismos y enzimas que facilitan el proceso de solubilización de P en el suelo (11).
La cachaza puede ser empleada entonces para sustituir parcialmente la fertilización fosfatada mineral (1, 12), pero la información sobre el efecto del uso del fosfato natural, asociado con la cachaza y los microorganismos, en la disponibilidad de P en el suelo y la respuesta de la planta es aún insuficiente.
Los microorganismos solubilizadores de fósforo tienen gran importancia dentro de la microbiota del suelo, por poseer la habilidad de romper el enlace entre los grupos fosfatos y los compuestos de origen orgánico o mineral. Muchas de las bacterias solubilizadoras de fósforo se encuentran dentro del grupo de las Rizobacterias promotoras del crecimiento de las plantas. Particularmente Pseudomonas fluorescens ha sido ampliamente informada como solubilizadora de fósforo (13).
Aunque los resultados son contradictorios en cuanto al uso de los microorganismos solubilizadores de fósforo, algunos autores informan que su adición proporciona un aumento en los contenidos de este elemento en el suelo (14), en la absorción por las plantas y en su productividad (15).
La aplicación directa de las rocas fosfóricas naturales molidas, como fuente de fósforo para los cultivos, constituye una alternativa a la fertilización fosfatada en muchos países tropicales (2). La adición de bacterias solubilizadoras de fósforo a la roca fosfórica se recomienda como una alternativa para aumentar la solubilización de este elemento (16).
Es reconocido que muchas especies de plantas, adquieren los nutrientes por medio de interacciones que establecen con los microorganismos que viven en la rizosfera, especialmente con aquellos que se han denominado simbiontes, tales como los Hongos Micorrízicos Arbusculares (HMA) (17). Estos microorganismos participan en la translocación de nutrientes presentes en el suelo, fundamentalmente el fósforo. Existe una gran diversidad de especies de hongos HMA en el suelo y su comportamiento está condicionado a las características de este o der los sustratos en los que se encuentre y al cultivo que se emplee (18). Este grupo se encuentra entre los microrganismos biofertilizantes más estudiados en Cuba y se cuenta con algunos resultados en caña de azúcar (19).
A partir de estos antecedentes surge la hipótesis de que la cachaza, enriquecida con HMA y Azotofos®, así como la adición de una fuente de fosfato natural, pueden aumentar el P disponible en el suelo y por tanto la absorción de este elemento en caña de azúcar. Por ello, el objetivo del presente trabajo fue evaluar el efecto de la adición al suelo de cachaza, roca fosfórica, Azotofos® y HMA, sobre el contenido de fósforo en el suelo y el desarrollo de plántulas de caña de azúcar.
MATERIALES Y MÉTODOS
La investigación se condujo en las áreas aledañas a la facultad de Ciencias Agrarias en la Universidad de Cienfuegos, en el período comprendido de septiembre a diciembre de 2013.
Se utilizaron macetas de 3 kg con un suelo Alítico de baja actividad arcillosa (20), que corresponde a un suelo Luvisol (21). El suelo fue recolectado en un campo cultivado anteriormente con caña de azúcar, en la Empresa Azucarera “Carlos Baliño”, provincia Villa Clara, Cuba, a una profundidad de 0 a 0,40 m.
Inmediatamente después de la recolección, el suelo se secó al aire, los grumos fueron desmenuzados y tamizados (malla de 4 mm). Seguidamente se realizó el análisis químico para evaluar la fertilidad, presentando las siguientes características: pH (KCl)= 5,5; materia orgánica= 5,4 %; contenido de P en el suelo= 21 mg por 100 g de suelo (método Bray-2) (22).
Se evaluaron nueve tratamientos:
1. Control
2. Suelo + cachaza
3. Suelo + roca fosfórica
4. Suelo + cachaza + Azotofos®
5. Suelo + cachaza + Ecomic®
6. Suelo + roca fosfórica + Azotofos®
7. Suelo + roca fosfórica + Ecomic®
8. Suelo + roca fosfórica + cachaza + Azotofos®
9. Suelo + roca fosfórica + cachaza + Ecomic®
Los tratamientos se condujeron en un diseño completamente aleatorizado con tres repeticiones. Las unidades experimentales (repeticiones) estuvieron constituidas por las macetas. En todos los tratamientos se aplicó, de manera uniforme, nitrógeno (200 mg dm3); en forma de urea (46 % de N) y potasio (150 mg dm3); en forma de cloruro de potasio (60 % de K2O) (23).
Se plantaron dos vitroplantas variedad CP 5243, de 60 días en cada maceta, obtenidas del laboratorio de reproducción in vitro de la Estación Territorial de Investigación de la Caña de Azúcar (ETICA) en Villa Clara. Las plántulas fueron regadas diariamente hasta el 80 % de la capacidad del campo.
La roca fosfórica se obtuvo de apatitas de origen magmático (granulometría en polvo) del yacimiento de Trinidad de Guedes, Matanzas, Cuba; con una composición de P2O5 total = 24 % y P2O5 soluble en ácido cítrico a 2 %= 6,5 %. Se aplicó a razón de 0,175 g kg-1 de suelo, equivalente a 60 mg kg-1 de P2O5.
Se utilizó una cachaza descompuesta de 60 días de edad, obtenida en la Empresa Azucarera "Elpidio Gómez", cuyo análisis químico (24) arrojó las siguientes características, expresadas en g kg-1: N= 18; P= 12,1; K= 4,3; Ca= 96,4; Mg= 10,2; S= 3,4. El análisis microbiológico mostró 2,5 x 102 unidades formadoras de colonias (ufc) de microorganismos solubilizadores de fósforo por gramo, (12). La dosis empleada fue de 25 t ha-1 en base seca (12,5 g dm3 de suelo).
El biopreparado micorrízico utilizado (EcoMic®) fue obtenido en el Instituto Nacional de Ciencias Agrícolas (INCA), a base de Glomus cubense, con una concentración de 29 esporas por gramo de suelo, aplicándose 10 g del mismo por maceta (5 g por vitroplanta), justamente debajo de las raíces de cada plántula.
El biofertilizante Azotofos® fue obtenido en el laboratorio de Suelos y Fertilizantes en Barajagua y contenía 108 ufc de Azotobacter chroococcum y Pseudomonas fluorescens por gramo de sustrato. El bioproducto fue aplicado a razón de 1 kg ha-1.
A los 60 días se evaluó la altura, grosor y número de hijos de cada plántula. Además se evaluó la concentración de P en suelo, la materia orgánica y el pH en cada unidad experimental.
Las variables fúngicas, frecuencia e intensidad micorrizíca, se determinaron al finalizar el experimento, mediante tinción con Azul de tripano (24). A las raíces de cada plántula se le determinó, el porcentaje de colonización, la densidad visual y el peso del endófito, en el laboratorio del INCA.
Los datos de la altura, el grosor, el número de hijos de las plantas, el porcentaje de colonización en las raíces, la densidad visual, el peso del endófito, el pH, la materia orgánica y la concentración de fósforo en suelo, fueron sometidos a un análisis de varianza. Las medias de las variables fueron comparadas por el test de Tukey (P<0,05) (25), utilizando el programa estadístico ASISTAT (26).
RESULTADOS Y DISCUSION
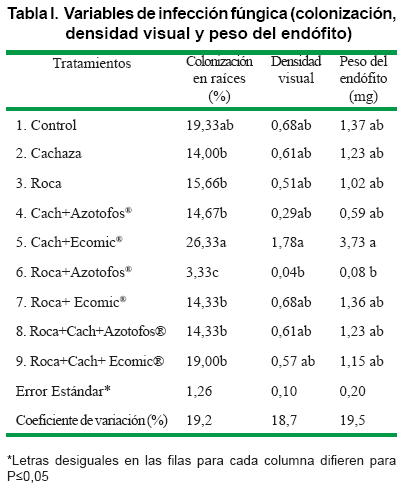
Las raíces de las plántulas de caña mostraron infección por micorrizas en todos los tratamientos, destacándose el porcentaje de colonización en las que recibieron cachaza + EcoMic®, con diferencia estadística, en relación con las fertilizadas solo con roca fosfórica + Azotofos®, pero no difirieron de las del control (Tabla I).
La densidad visual y el peso del endófito en las plántulas no se incrementó en ningún tratamiento, con respecto al control y sólo se manifestó diferencia estadística entre las plántulas fertilizadas con cachaza + EcoMic® y las que sólo recibieron roca fosfórica + Azotofos®. Esto confirma la presencia de cepas nativas de HMA en el suelo de la Empresa Azucarera "Carlos Baliño".
Se demuestra que la cachaza puede constituir un sustrato favorable para la acción beneficiosa de los HMA, aunque los nativos no necesitaron de este para infectar, incluso ante la presencia de la roca fosfórica, pero sí se observó, en cierta medida, disminución de la simbiosis ante la presencia de Azotofos®. Hay que tener en cuenta que este biofertilizante está compuesto por bacterias de la especie Azotobacter chroococcum y de Pseudomonas, sobre las cuales se discute mucho si pueden tener efectos sinérgicos o antagónicos con otros microorganismos. En este sentido, otros autores señalan como positivo, la adición de Azotobacter chroococcum y Bacillus megatherium a HMA en guayaba (Psidium guajaba L.) (27).
La presencia de HMA en suelos cañeros también fue estudiada por otros autores, estableciéndose diferencias en cuanto a la colonización en raíces, entre los tratamientos donde se aplicó HMA y cachaza solamenteA.
Para las variables altura y grosor de las plantas no hubo diferencias entre los tratamientos del ensayo (Tabla II); sin embargo, el número de brotes o hijos de las plántulas de caña se incrementó, en relación con el testigo, para los tres tratamientos que recibieron Ecomic®, pero también para el que recibió roca fosfórica + cachaza + Azotofos®.
Estos resultados demuestran, de alguna forma, la eficiencia de la aplicación de la micorriza y también del Azotofos®, pero este último biofertilizante solo superó al testigo cuando se aplicó en presencia de cachazaA.
Tal vez se requiere dar seguimiento por más tiempo a los experimentos o realizar evaluaciones en condiciones de campo, para verificar la acción beneficiosa de la cachaza con Ecomic® o con Azotofos®; ya que con relación al beneficio de la adición de la cachaza a los HMA, los criterios están compartidos. Algunos investigadores informan que el sustrato cachaza + litonita produjo un efecto positivo de Glomus manihotis sobre las vitroplantas de caña de azúcar en la fase de adaptación (28), mientras que otros, a partir de ensayos en caña planta, no recomiendan la mezcla de cachaza con MHA porque estos últimos no manifiestan todo su potencialA.
El contenido de fósforo en el suelo estuvo influenciado por algunos tratamientos realizados a las plántulas de caña de azúcar, no así el pH y la materia orgánica (Tabla III).
Se presentaron incrementos de P soluble con respecto al control, en los tratamientos que se fertilizaron con cachaza + EcoMic®, cachaza con Azotofos®, roca fosfórica + EcoMic®, roca fosfórica + Azotofos® y roca + cachaza + EcoMic®.
Se destacan los tratamientos con presencia de cachaza, enriquecidos con micorrizas y Azotofos®, también roca + EcoMic®, con o sin adición de roca fosfórica, evidenciando que existen reservas de P en esos suelos, que pueden solubilizarse y ponerse en función de las plantas de caña por diferentes vías.
El fósforo soluble en el suelo se incrementó en todos los tratamientos en relación con su concentración, antes de plantar las vitroplantas, que manifestaba 21 mg por 100 gramos de suelo y el mínimo alcanzado por el testigo fue 53,72 mg por 100 g de suelo. Esto se explica en los tratamientos que recibieron la roca fosfórica, porque la misma aportó 60 mg de P2O5 por kg de suelo y en los que recibieron cachaza, porque esta tenía en su composición 12,1 g kg-1 de P2O5. A esto hay que agregar que la cachaza tenía asociado una población de 2,5 x 102 ufc de microorganismos solubilizadores de fósforo por gramo.
En el control solo podría explicarse este aumento por la existencia suficiente de fósforo fijado, como se ha referido anteriormente y que la microflora nativa (los HMA que se observaron colonizando las raíces y el resto de bacterias, actinomicetos y hongos) asociada a la rizosfera de las plantas, bajo condiciones específicas, producen ácidos orgánicos en su metabolismo que liberan el P fijado.
En otros ensayos realizados en maíz (Zea mays L.), la cachaza incrementó el P soluble en el suelo, lo que se atribuyó a la cantidad de este nutriente en la misma (146 mg kg-1 de suelo) y a la masa microbiana asociada (2,97 x 105 y 2,2 x 103 ucf de bacterias y hongos respectivamente, por gramo de cachaza) (4).
Estos resultados constituyen los primeros de este tipo sobre un suelo de la Empresa Azucarera "Carlos Baliño" y demuestran que pueden existir alternativas para la fertilización fosfatada con algunas de las variantes de adición de HMA o Azotofos® al suelo; aunque deben ser verificados en condiciones de campo, así como precisar si existe o no efecto sinérgico entre la bacteria fosfosolubilizadora y los HMA, como han recomendado otros investigadores (29).
En relación con la roca fosfórica, aunque los niveles de P soluble son bajos, no es necesario aplicarla en este suelo, ya que hay suficientes cantidades de P insoluble en el mismo, pero sería necesario seguirlo evaluando en otras áreas de la Empresa.
Con respecto a la necesidad de aplicar EcoMic®, hay que seguir profundizando en el estudio, ya que algunos investigadores plantean que los HMA nativos de determinados ambientes, pueden tener un nivel de adaptabilidad tal, que pueden ser más efectivos que las especies introducidas (30).
Otros investigadores señalan que las especies de hongos micorrízicos introducidos en condiciones de campo pueden ser más efectivas que las nativas y favorecer el desarrollo de las plantas (31); no obstante, en el suelo estudiado, los aplicados solubilizaron más P que los nativos.
Se requiere profundizar en la identificación y nivel de inóculo de los HMA en las fundamentales áreas cañeras de la empresa Azucarera "Carlos Baliño", donde se emplean residuos de la industria azucarera, como la cachaza, que pudieran favorecer el nivel de inóculo de los hongos micorrízicos arbusculares. Además sería interesante evaluar otras cepas de HMA, para determinar su efectividad en los diferentes suelos que tiene la Empresa.
CONCLUSIONES
NOTA AL PIE
ACrespo, A. B. Efecto de micorrizas benéficas (Mycoral®) y cachaza, en el peso de la caña y rendimiento neto de azúcar, en la Compañía Azucarera Tres Valles, Honduras. Tesis de Grado, Escuela el Zamorano, 2006, Honduras, 43 p.
BIBLIOGRAFÍA
1. de Almeida Júnior, A. B.; do Nascimento, C. W.; Sobral, M. F.; da Silva, F. B. y Gomes, W. A. “Fertilidade do solo e absorção de nutrientes em cana-de-açúcar fertilizada com torta de filtro”. Revista Brasileira de Engenharia Agrícola e Ambiental, vol. 15, no. 10, 2011, pp. 1004–1013, ISSN 1415-4366.
2. Arzola, P. N. C.; Fundora, H. O. y de Mello, P. R. Manejo de suelos para una agricultura sostenible [en línea]. Ed. FCAV-Unesp, 2013, 509 p., ISBN 978-85-61848-11-8, [Consultado: 7 de julio de 2016], Disponible en: <http://www.funep.org.br/visualizar_livro.php?idlivro=2753>.
3. Malavolta, E. Manual de Química Agrícola: Adubos e Adubação [en línea]. Ed. Agronômica Ceres, 1981, São Paulo, Brasil, 594 p., ISBN 978-85-318-0018-4, [Consultado: 7 de julio de 2016], Disponible en: <http://www.estantevirtual.com.br/b/e-malavolta/manual-de-quimica-agricola-adubos-e-adubacao/2574894528>.
4. Castellanos, G. L.; de Melo, P. R.; Reyes, H. A.; Asis, L.; Caione, G.; Rosato, M. L.; Parets, S. E. y Júnior, de A. H. “Efecto de la torta del filtro enriquecida con fosfato natural y microorganismos en el suelo y planta en un suelo oxisol”. Centro Agrícola, vol. 40, no. 2, 2013, pp. 31–37, ISSN 0253-5785.
5. Jiang, X.; Wright, A. L.; Wang, X. y Liang, F. “Tillage-induced changes in fungal and bacterial biomass associated with soil aggregates: A long-term field study in a subtropical rice soil in China”. Applied Soil Ecology, vol. 48, no. 2, junio de 2011, pp. 168-173, ISSN 0929-1393, DOI 10.1016/j.apsoil.2011.03.009.
6. Shrivastava, M.; Kale, S. P. y D’Souza, S. F. “Rock phosphate enriched post-methanation bio-sludge from kitchen waste based biogas plant as P source for mungbean and its effect on rhizosphere phosphatase activity”. European Journal of Soil Biology, vol. 47, no. 3, mayo de 2011, pp. 205-212, ISSN 1164-5563, DOI 10.1016/j.ejsobi.2011.02.002.
7. Zhang, Q. C.; Shamsi, I. H.; Xu, D. T.; Wang, G. H.; Lin, X. Y.; Jilani, G.; Hussain, N. y Chaudhry, A. N. “Chemical fertilizer and organic manure inputs in soil exhibit a vice versa pattern of microbial community structure”. Applied Soil Ecology, vol. 57, junio de 2012, pp. 1-8, ISSN 0929-1393, DOI 10.1016/j.apsoil.2012.02.012.
8. Krey, T.; Vassilev, N.; Baum, C. y Eichler-Löbermann, B. “Effects of long-term phosphorus application and plant-growth promoting rhizobacteria on maize phosphorus nutrition under field conditions”. European Journal of Soil Biology, vol. 55, marzo de 2013, pp. 124-130, ISSN 1164-5563, DOI 10.1016/j.ejsobi.2012.12.007.
9. Caione, G.; Lange, A.; Benett, C. G. S. y Fernandes, F. M. “Fontes de fósforo para adubação de cana-de-açúcar forrageira no cerrado”. Pesquisa Agropecuária Tropical, vol. 41, no. 1, 19 de enero de 2011, pp. 66-73, ISSN 1983-4063, DOI 10.5216/pat.v41i1.8497.
10. Santos, D. H.; Silva, M. de A.; Tiritan, C. S.; Foloni, J. S. S. y Echer, F. R. “Qualidade tecnológica da cana-de-açúcar sob adubação com torta de filtro enriquecida com fosfato solúvel”. Revista Brasileira de Engenharia Agrícola e Ambiental, vol. 15, no. 5, 1 de mayo de 2011, pp. 443-449, ISSN 1415-4366, DOI http://dx.doi.org/10.1590/S1415-43662011000500002.
11. Yang, S. D.; Liu, J. X.; Wu, J.; Tan, H. W. y Li, Y. R. “Effects of Vinasse and Press Mud Application on the Biological Properties of Soils and Productivity of Sugarcane”. Sugar Tech, vol. 15, no. 2, junio de 2013, pp. 152-158, ISSN 0972-1525, 0974-0740, DOI 10.1007/s12355-012-0200-y.
12. Santos, D. H.; Tiritan, C. S.; Foloni, J. S. S. y Fabris, L. B. “Produtividade de cana-de-açúcar sob adubação com torta de filtro enriquecida com fosfato solúvel”. Pesquisa Agropecuária Tropical, vol. 40, 1 de octubre de 2010, pp. 454-461, ISSN 1517-6398.
13. Martínez, V.; López, M.; Brossard, F.; Tejada, G.; Pereira, A. y Parra, Z. Procedimientos para el estudio y fabricación de Biofertilizantes Bacterianos. (ser. B, no. ser. 11), Ed. Instituto Nacional de Investigaciones Agrícola, 2006, Maracay, Venezuela, 88 p., ISBN 980-318-212- 9.
14. Abou-el-Seoud, I. I. y Abdel-Megeed, A. “Impact of rock materials and biofertilizations on P and K availability for maize (Zea Maize) under calcareous soil conditions”. Saudi Journal of Biological Sciences, vol. 19, no. 1, enero de 2012, pp. 55-63, ISSN 1319562X, DOI 10.1016/j.sjbs.2011.09.001.
15. Singh, H. y Reddy, M. S. “Effect of inoculation with phosphate solubilizing fungus on growth and nutrient uptake of wheat and maize plants fertilized with rock phosphate in alkaline soils”. European Journal of Soil Biology, vol. 47, no. 1, enero de 2011, pp. 30-34, ISSN 11645563, DOI 10.1016/j.ejsobi.2010.10.005.
16. Yu, X.; Liu, X.; Zhu, T. H.; Liu, G. H. y Mao, C. “Co-inoculation with phosphate-solubilzing and nitrogen-fixing bacteria on solubilization of rock phosphate and their effect on growth promotion and nutrient uptake by walnut”. European Journal of Soil Biology, vol. 50, mayo de 2012, pp. 112-117, ISSN 1164-5563, DOI 10.1016/j.ejsobi.2012.01.004.
17. Guerra, S. B. E. “Micorriza arbuscular. Recurso microbiológico en la agricultura sostenible”. Tecnología en Marcha, vol. 21, no. 1, 2008, pp. 191-201, ISSN 0379-3962, 2215-3241.
18. Herrera-Peraza, R. A.; Hamel, C.; Fernández, F.; Ferrer, R. L. y Furrazola, E. “Soil–strain compatibility: the key to effective use of arbuscular mycorrhizal inoculants?”. Mycorrhiza, vol. 21, no. 3, abril de 2011, pp. 183-193, ISSN 0940-6360, 1432-1890, DOI 10.1007/s00572-010-0322-6.
19. Peña, B. M. D.; Zayas, P. M. R. de y Rodríguez, F. R. M. “La producción científica sobre biofertilizantes en Cuba en el período 2008-2012: un análisis bibliométrico de las revistas cubanas”. Cultivos Tropicales, vol. 36, no. 1, marzo de 2015, pp. 44-54, ISSN 0258-5936.
20. Hernández, J. A.; Pérez, J. J. M.; Bosch, I. D. y Castro, S. N. Clasificación de los suelos de Cuba 2015. Ed. Ediciones INCA, 2015, Mayabeque, Cuba, 93 p., ISBN 978-959-7023-77-7.
21. Soil Survey Staff. Keys to Soil Taxonomy [en línea]. (eds. Natural Resources Conservation Service y Agriculture Dept), 11.a ed., Ed. Natural Resources Conservation Service, 12 de mayo de 2010, Washington, 344 p., ISBN 978-0-16-085427-9, [Consultado: 27 de junio de 2016], Disponible en: <https://www.amazon.com/Keys-Soil-Taxonomy-Survey-Staff/dp/016085427X>.
22. Bray, R. H. y Kurtz, L. T. “Determination of total, organic, and available forms of phosphorus in soils”. Soil science, vol. 59, no. 1, 1945, pp. 39–46, ISSN 0038-075X.
23. Bataglia, O. C.; Furlani, A. M. C.; Teixeira, J. P. F.; Furlani, P. R. y Gallo, J. R. Métodos de análise química de planta [en línea]. (ser. Boletin Técnico, no. ser. 78), Ed. Instituto Agronômico, 1983, Campinas, São Paulo, Brasil, 49 p., ISSN 0100-3100, [Consultado: 7 de julio de 2016], Disponible en: <https://www.bdpa.cnptia.embrapa.br/consulta/busca?b= ad&id=204327&biblioteca=CPAO&busca= autoria:%22FURLANI,%20P.R.%22&qFacets= autoria:%22FURLANI,%20P.R.%22&sort= &paginacao=t&paginaAtual=1>.
24. Giovannetti, M. y Mosse, B. “An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots”. New Phytologist, vol. 84, no. 3, marzo de 1980, pp. 489-500, ISSN 0028646X, DOI 10.1111/j.1469-8137.1980.tb04556.x.
25. Tukey, J. W. “Bias and confidence in not quite large samples”. The Annals of Mathematical Statistics, vol. 29, no. 2, junio de 1958, pp. 614-623, ISSN 0003-4851, DOI 10.1214/aoms/1177706647.
26. Santos, S. F. de A. y Vieira, de A. C. A. “Principal Components Analysis in the Software Assistat-Statistical Assistance” [en línea]. En: VII World Congress on Computers in Agriculture, Ed. American Society of Agricultural and Biological Engineers, Reno, NV, USA, 2009, DOI 10.13031/2013.29066, ISSN 2151-0032, [Consultado: 27 de junio de 2016], Disponible en: <http://elibrary.asabe.org/abstract.asp?JID=1&AID=29066&CID=wcon2009&T=1>.
27. Ramos, H. L.; Reyna, G. Y.; Lescaille, A. J.; Telo, C. L.; Arozarena, D. N. J.; Ramírez, P. M. y Martín, A. G. M. “Hongos micorrízicos arbusculares, Azotobacter chroococcum, Bacillus megatherium y FitoMas-E: una alternativa eficaz para la reducción del consumo de fertilizantes minerales en Psidium guajava, L. var. Enana Roja cubana”. Cultivos Tropicales, vol. 34, no. 1, marzo de 2013, pp. 05-10, ISSN 0258-5936.
28. Ortiz, R. Factores que afectan el desarrollo de vitro plantas de caña de azúcar en la fase adaptativa. Ed. Ediciones INCA, 2000, La Habana, Cuba, 36 p., ISBN 959-7023-12-1.
29. Fernández, B. L.; Bompadre, J.; Pergola, M.; Silvani, V.; Colombo, R.; Bracamonte, F. y Godeas, A. “Differential interaction between two Glomus intraradices strains and a phosphate solubilizing bacterium in maize rhizosphere”. Pedobiologia, vol. 55, no. 4, julio de 2012, pp. 227-232, ISSN 00314056, DOI 10.1016/j.pedobi.2012.04.001.
30. Lambert, D. H.; Cole, H. y Baker, D. E. “Adaptation of vesicular-arbuscular mycorrhizae to edaphic factors”. New Phytologist, vol. 85, no. 4, agosto de 1980, pp. 513-520, ISSN 0028-646X, 1469-8137, DOI 10.1111/j.1469-8137.1980.tb00766.x.
31. Dodd, J.; Krikun, J. y Haas, J. “Relative Effectiveness of Indigenous Populations of Vesicular-Arbuscular Mycorrhizal Fungi from Four Sites in the Negev”. Israel Journal of Botany, vol. 32, no. 1, 1 de enero de 1983, pp. 10-21, ISSN 0021-213X, DOI 10.1080/0021213X.1983.10676959.
Recibido: 04/07/2015
Aceptado: 31/03/2016
Leónides Castellanos González, Centro de Estudios para la Transformación Agraria Sostenible. Facultad de Ciencias Agrarias. Universidad de Cienfuegos, carretera a Rodas, km 4, Cienfuegos, Cuba. Email: lcastellanos@ucf.edu.cu