
http://dx.doi.org/10.13140/RG.2.2.31096.85761
Evaluación de diferentes cepas de micorrizas arbusculares en el desarrollo de plantas de arroz (Oryza sativa L.) en condiciones inundadas del suelo
Evaluation of different strains of arbuscular mycorrhizaein the development of rice plant (Oryza sativa L.) in flooded soil conditions
M.Cs. Michel Ruiz-Sánchez,I M.Cs. Yaumara Muñoz-Hernández,II Dr.C. José M. Dell’Amico-Rodríguez,I M.Cs. Jaime Simó-González,III Dr.C. Juan A. Cabrera-RodríguezI
I Unidad Científico Tecnológica de Base «Los Palacios», Instituto Nacional de Ciencias Agrícolas, gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700, Cuba.
II Universidad de Pinar del Río «Hermanos Saiz Montes de Oca», calle Martí final, # 270 esq. a 27 de noviembre, Pinar del Río, Cuba.
III Instituto de Investigaciones de Viandas Tropicales (INIVIT), Apartado 6, Santo Domingo, Villa Clara, CP 53 000. Cuba.
REsumen
Los hongos micorrízico arbusculares están representados en todos los suelos y colonizan a más del 80 % de las plantas terrestres. Su asociación depende de muchos factores edafoclimáticos, de la planta y del hongo. En el cultivo de arroz se informó simbiosis micorrízica en condiciones de anaerobiosis. Es por ello que la investigación se realizó con el objetivo de evaluar la respuesta en plantas de arroz inoculadas con diferentes cepas de hongos micorrízicas arbusculares (Claroideoglomus claroideum, Glomus cubense, Rhizoglomus intraradices y Funneliformis mosseae) en condiciones inundadas del suelo Hidromórfico Gley Nodular Ferruginoso Petroférrico, con una lámina de agua 5 cm, en la Unidad Científica Tecnológica de Base “Los Palacios”. Los resultados obtenidos demuestran que el arroz se coloniza, aunque con porcentajes bajos, debido a la presencia de la lámina de agua, la cual afecta el establecimiento del hongo en la planta. En cuanto a la altura, el ahijamiento, masa seca de la parte aérea y de las raíces en las plantas de arroz se incrementaron cuando se inocularon con las diferentes cepas respecto al testigo no inoculado, observándose una eficiencia simbiótica superior en función del ahijamiento y la masa seca de la parte aérea con las cepas R. intraradices, G. cubense y C. claroideum, aunque siempre las cepas R. intraradices y G. cubense estuvieron entre las cepas de inóculos de HMA que manifestaron mayor efecto en el desarrollo de las plantas. Estos resultados sugieran el uso de estas cepas en la producción de biofertilizantes para el cultivo del arroz.
Palabras clave: colonización micorrízica, Rhizoglomus intraradices, Glomus cubense, aerobiosis, inundado.
ABSTRACT
The arbuscular mycorrhizal fungi are represented in all soils and colonize more than 80 % of terrestrial plants. Their association depends on many edaphoclimatic factors, plant and fungus. In rice cultivation mycorrhizal symbiosis was reported under anaerobic conditions. That is why the research was conducted in order to evaluate the response in rice plants inoculated with different strains of arbuscular mycorrhizal fungi (Claroideoglomus claroideum, Glomus cubense, Rhizoglomus intraradices y Funneliformis mosseae) in flooded conditions of Gley Nodular Hidromorphic Ferruginous Petroferrics soil, with a water depth of 5 cm in the Scientific Technological Base Unit “Los Palacios”. The results demonstrate that rice colonized, even with low percentages due to the presence of the water layer, which affects the establishment of the fungus in the plant. As for height, tillering, dry mass of the aerial part and roots in rice plants increased when there were inoculated with different strains than the control uninoculated observed a symbiotic efficiency higher depending on tillering and dry mass of the aerial part with strains R. intraradices, G. cubense and C. claroideum, but always strains R. intraradices and G. cubense were streigh among the strains of inoculum of AMF that showed greater effect on plant development. These results suggest the use of these strains in the production of bio-fertilizers for rice cultivation.
Key words: mycorrhizal colonization, Rhizoglomus intraradices, Glomus cubense, aerobiosis, flooded.
INTRODUCCIÓN
Es de gran importancia la reducción del consumo de agua, debido a la alta necesidad que tiene el cultivo del arroz en comparación otros cultivos. A nivel mundial, el monto anual de recursos hídricos para la agricultura está disminuyendo a causa de la creciente competencia del desarrollo industrial y urbano (1).
El cultivo del arroz se enfrenta a los retos del calentamiento global, la escasez de agua y otros factores limitan la capacidad de los agricultores para cultivarlo en condiciones inundadas. En Cuba se ha tenido que reducir las áreas de siembra por no contar con suficiente agua en los embalseA. A pesar de la baja disponibilidad de agua que existe y se avecina el futuro, se continúa sembrando arroz bajo riego, o sea con una lámina de agua, esta condición de anaerobiosis afecta la asociación micorrízica.
Sin embargo, se informó simbiosis micorrízica en condiciones de anaerobiosis para el cultivo del arroz inundado por diferentes autores (2); no obstante, se desconoce la respuesta de esta asociación con la inoculación de diferentes cepas de HMA.
Recientemente, informaron que la colonización micorrízica en plantas de arroz contribuye a su adaptación a condiciones de anaerobiosis y aerobiosis, así como a los cambios de una condición a la otra. También, detectaron la expresión de transportadores de fosfato y amonio considerados marcadores de la funcionalidad de la simbiosis, aun cuando los porcentajes de colonización micorrízica eran bajos (entre 8 y 25 %) dadas las condiciones de anaerobiosis (3). Estos resultados evidenciaron la funcionalidad de la simbiosis micorrízica, además de que la anaerobiosis entre otras causas, provocan bajos porcentajes de colonización y dificultan la señalización planta hongo.
Es importancia destacar que, el ambiente edáfico es determinante en la selección de cepas eficientes, debido a que este influye en la efectividad simbiótica y en el suministro de nutrientes para la planta. En la actualidad es una prioridad lograr una eficiencia mayor en la inoculación de estos microorganismos en los sistemas de producción.
Por otra parte, se informó que existe una alta especificidad suelo-cepa, no planta-cepa (4); aunque, se ha encontrado diferencias cuando se inoculan distintas cepas en un mismo cultivo y suelo (5, 6), comportamiento que nos hace pensar que aún no existe un panorama claro de las causas y condiciones que inducen las diferencias y más aún en el cultivo el arroz en condiciones inundadas.
A partir de lo anteriormente, esta investigación tuvo como objetivo, evaluar la respuesta en plantas de arroz inoculadas con diferentes cepas de hongos micorrízicas arbusculares (HMA) en condiciones inundadas del suelo Hidromórfico Gley Nodular Ferruginoso Petroférrico de Los Palacios, Pinar del Río, Cuba.
MATERIALES Y MÉTODOS
El experimento se realizó en condiciones de macetas, con el cultivar comercial de arroz (Oryza sativa L.) de ciclo corto INCA LP-5, que se cultivó en un suelo calificado como Hidromórfico Gley Nodular Ferruginoso Petroférrico (7), de las áreas de investigación de la UCTB “Los Palacios”, perteneciente al Instituto Nacional de Ciencias Agrícolas (INCA), con pH ligeramente acido; materia orgánica (MO) medio; fósforo (P) bajo y potasio (K) medio (Tabla).
Las plantas de arroz se cultivaron en macetas con 7 kg de capacidad, las que se llenaron con suelo procedente de la localidad mencionada, que se esterilizó previamente. Para la esterilización, el suelo se esparció sobre una manta de polietileno y se asperjó sobre éste una solución de formol al 4 % con una asperjadora manual con capacidad de 16 L; inmediatamente después todo el suelo se cubrió con mantas de polietileno durante 72 horas, posterior a este periodo el suelo se aireó a la sombra durante siete días y finalmente se procedió al llenado de las macetas.
Las semillas a sembrar fueron tratadas previamente por el método de recubrimiento (8), con las cepas de inóculos micorrízicos Claroideoglomus claroideum (Cc = 80 esporas g-1 de inóculo), Glomus cubense (Gc = 126 esporas g-1 de inóculo), Rhizoglomus intraradices (Ri = 42 esporas g-1 de inóculo) y Funneliformis mosseae (Fm = 38 esporas g-1 de inóculo), procedentes del cepario del INCA. En cada tratamiento se utilizaron 100 semillas de arroz que facilitó el procedimiento de recubrimiento y el cálculo de la cantidad de inóculo necesario a aplicar, a partir de la riqueza de propágulos de cada uno de ellos, de modo que se garantizara aproximadamente la aplicación de 600 esporas por maceta. En cada maceta se depositaron 10 semillas a un centímetro de profundidad y tres días después de la emergencia (DDE), se dejaron seis plantas por maceta.
Después de la siembra, todas las macetas se regaron hasta lograr una lámina de agua de 5 cm por encima de la superficie del suelo, duradera por un periodo de 24 horas, momento a partir del cual se drenaron, manteniendo el suelo a capacidad de campo hasta que brotaron dos hojas por planta. Con posterioridad, se restableció la lámina de agua y se mantuvo así hasta que finalizó el experimento (50 DDE).
La cantidad total de nutrientes, equivalente a 0,738 g de N; 0,301 g de P2O5 y 0,354 g de K2O por maceta, se aplicó a los 20 y 35 DDE, correspondiendo a cada momento el 50 % de la misma, utilizando como portadores Urea (46 % de N), Superfosfato Triple (46 % de P2O5) y Cloruro de Potasio (60 % de K2O), respectivamente.
Los tratamientos estudiados consistieron en plantas que se inocularon con cuatro cepas de HMA (Cc, Gc, Ri y Fm) y un testigo sin inocular (noMA), siguiendo un diseño experimental de Bloques Completamente al Azar con cuatro repeticiones.
En el invernadero donde fueron colocadas las macetas, las temperaturas diarias promedio diurnas y nocturnas fueron de 29 ºC y 24 ºC, respectivamente y la humedad relativa osciló entre 60-70 %, las cuales se midieron con un equipo Testoterm (JAPAN, testo® 610).
Se tomaron dos plantas por maceta en cada momento, para evaluar altura, ahijamiento o número de hijos, masa seca aérea y masa seca de la raíz a los 50 DDE. El porcentaje de colonización y la densidad visual se evaluaron a los 30, 40 y 50 DDE.
La altura de las plantas se midió desde la superficie del suelo hasta el extremo superior de la hoja más larga (9). El número de hijos se determinó por conteo de tallos en cada planta y a la cantidad determinada se le restó el valor 1 (planta madre). Se determinó, además, la biomasa aérea y de la raíz por separado y se colocaron en una estufa a 70 ºC hasta alcanzar masa constante. Se tomaron 200 mg de raíces de cada muestra que se tiñeron con azul tripan (10), posteriormente se utilizó el método de los interceptos (11) para cuantificar la colonización micorrízica. La densidad visual se determinó por medio de la evaluación de la ocupación fúngica del hongo en la raíz de cada intercepto asignándosele un nivel a los porcentajes de ocupación (12). Se calculó, además, el índice de eficiencia simbiótica en función de cada una de las variables evaluadas (13):
Índice de eficiencia simbiótica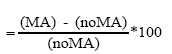
donde:
MA= Plantas inoculadas
noMA = Plantas no inoculadas
Esta investigación se repitió en tres ocasiones, en noviembre de 2009, enero 2010 y en marzo de 2010. Los datos obtenidos de las tres repeticiones en el tiempo se promediaron para su posterior Análisis de Varianza de Clasificación Doble y cuando existió diferencias significativas, las medias se compararon según la Prueba de Rangos Múltiples de Duncan (p≤0,05) (14), para lo cual se utilizó el Programa STATGRAPHICS Plus sobre Windows, versión 5.1 (15).
RESULTADOS Y DISCUSIÓN
Desarrollo de las plantas de arroz
Al analizar el comportamiento manifestado por las variables altura, ahijamiento, masa seca aérea y de la raíz en plantas de arroz a los 50 DDE (Figura 1), se comprobó que, con la excepción de la masa seca aérea (Figura 1 C), las plantas inoculadas con HMA reflejaron las magnitudes mayores. La excepción estuvo dada por la similitud encontrada en la masa seca aérea entre las plantas inoculadas con F. mosseae y las plantas sin inocular. Siempre R. intraradices y G. cubense estuvieron entre las cepas de inóculos de HMA que manifestaron mayor efecto sobre el desarrollo de las plantas.
Referido a la altura de las plantas, los valores mayores de esta variable se observaron en las plantas inoculadas con R. intraradices y G. cubense, estos resultados se corresponden (13) con los informados, al inocular plantas de arroz con diferentes cepas de HMA (R. intraradices y Glomus cubense) en condiciones similares de suelo y cultivo. En su caso, la altura se evaluó a los 30, 60 y 90 días después de la emergencia (DDE), observándose valores mayores en las plantas inoculadas y sin diferencias entre ellas, con respecto al testigo no inoculado.
Las condiciones en las que se realizó el experimento (macetas) limitaron el desarrollo de las plantas en cuanto ahijamiento, masa sea aérea y de las raíces, limitación que se hizo más evidente en la capacidad de ahijamiento, ya que la planta de arroz es capaz de emitir más de 20 hijos, cuando las condiciones de crecimiento y desarrollo son adecuadas (16, 17). No obstante, se encontraron incrementos en el número de hijos y en la masa seca aérea y de las raíces, provocado por la inoculación de las cepas C. claroideum, G. cubense y R. intraradices,respecto a F. mosseae y el testigo. Un comportamiento similar se informó recientemente (13) en plantas de arroz de igual cultivar e inoculadas con HMA, también en el cultivo de pastos (18, 19).
El incremento en el desarrollo de las plantas inoculadas (altura, ahijamiento, masa seca parte aérea y de las raíces) con respecto a las no inoculadas, puede deberse a un posible efecto de producción hormonal estimuladora de crecimiento, cuando se establece la asociación micorrízica. Recientemente algunos autores (20, 21), sugieren que las fitohormonas liberadas durante la colonización pueden contribuir de alguna manera al incremento del crecimiento de las plantas; aunque, los resultados en este sentido no están totalmente esclarecidos y en ocasiones son contradictorios (18, 20).
Los resultados indican que en el momento del reconocimiento de los simbiontes y después de establecida la colonización, debe existir un equilibrio en la liberación y producción de hormonas, tanto del HMA, como de la planta, que regulan el establecimiento de la colonización y determinan un mejor funcionamiento micorrízico, que se manifiesta en el crecimiento y desarrollo de la planta.
Colonización micorrízica y densidad visual
Al evaluar el porcentaje de colonización micorrízica y densidad visual, a los 30 DDE no se observó en el interior de la raíz ocupación fúngica en ninguno de los tratamientos estudiados. Diversas causas pudieron haber influido sobre la ocupación fúngica a los 30 DDE. La presencia de la lámina de agua, condiciona carencia de oxígeno en el suelo, lo que puede limitar la germinación de las esporas del hongo.
Unido a lo anterior, bajo las condiciones de un suelo inundado, se manifiesta un efecto de dilución de los exudados señales entre la planta de arroz y los HMA, tal es el caso de las estrigolactonas, consideradas hormonas de señalización en el cultivo (22, 23), que en su estructura química posee un enlace éter muy lábil, el cual puede ser fácilmente hidrolizado en la rizosfera (24, 25) y por lo tanto, se pueden afectar dos etapas del establecimiento de la simbiosis: la germinación de las esporas (26, 27) y el crecimiento hifal e inicio del proceso de colonización (28).
Después de los 30 DDE, se observó colonización de los HMA en las plantas de arroz (Figura 2), lo que puede explicarse por una mayor oxigenación de la zona rizosférica y transporte de oxígeno desde la biomasa aérea hacia las raíces, creando condiciones más favorables para la germinación de las esporas de HMA y posterior colonización de las plantas.
A los 40 y 50 DDE no se encontró colonización en las raíces de las plantas que no fueron inoculadas con cepas de HMA, debido a la esterilización a la que fue sometido el suelo; sin embargo, en las plantas inoculadas, se apreciaron porcentajes de colonización micorrízica que, aunque bajos, manifestaron una tendencia a incrementarse en el tiempo (Figura 2 A y B).
A los 40 DDE, la colonización micorrízica de las plantas de arroz inoculadas con R. intraradices y C. claroideum resultó similar (Figura 2 A); mientras que, a los 50 DDE (Figura 2 B) no se apreciaron diferencias en el efecto provocado por las cepas C. claroideum, G. cubense y R. intraradices.
Los resultados demostraron que después de determinado período de tiempo, las plantas de arroz son colonizadas por los HMA, debido a que estas son capaces de transportar oxígeno a las raíces y de esta forma el área rizoférica es oxigenada (16, 17), creando condiciones favorables para la germinación de las esporas de HMA y posterior colonización de las plantas.
Los porcentajes bajos de colonización micorrízica, encontrados a los 40 y 50 DDE, pueden deberse fundamentalmente a las modificaciones en la arquitectura de la raíz en la planta de arroz, provocado por la presencia de la lámina de agua, donde predominan raíces con mayor tejido aerénquima, dejando menos espacio al tejido cortical (29, 30), tejido en el cual se establece el hongo micorrízico en la raíz (30).
La intensidad de la ocupación fúngica (DV) que se encontró en el interior de las raíces a los 40 DDE (Figura 2 C), indicó que la micorrización se encontraba en las fases iniciales del proceso de establecimiento, donde aún no se detecta la presencia de los arbúsculos.
Sin embargo, a los 50 DDE (Figura 2 D), la intensidad de la ocupación fúngica indicó que el tratamiento inoculado con la cepa R. intraradices mostró una mejor interacción con la planta, seguido por G. cubense y C. claroideum,resultados que demuestran la capacidad de estos HMA en adaptarse a condiciones de inundación, puesto que estas cepas no son aislados residentes de suelos dedicados al monocultivo de arroz bajo estas condiciones.
La especie R. intraradices se caracteriza por presentar una tasa alta de colonización micorrízica y crecimiento relativamente rápido y, es por ello que se utiliza con frecuencia en la agricultura (3). De manera similar ocurre con la cepa de G. cubense en Cuba, que en diversas condiciones edafoclimáticas se ha adaptado y ha expresado su potencial en simbiosis con cultivos como frijol (4), pastos (18, 19) y en tomate (6).
Los resultados de esta investigación evidenciaron que las condiciones de inundación afectaron la colonización y la intensidad de la ocupación fúngica, por lo que al momento del trasplante a los 30 DDE, pudieran llevarse al campo plantas sin estar colonizadas; sin embargo, se logró colonización micorrízica pasados los 30 DDE.
En cuanto al índice de eficiencia simbiótica en función de las variables evaluadas, se encontraron los porcentajes mayores de eficiencia en el número de hijos por plantas (Figura 3). Este resultado es importante debido a que el ahijamiento forma parte de los componentes del rendimiento agrícola del arroz, puesto que este y el número de tallos por planta (emiten panícula) representan la misma variable, pero evaluado en distinto momento y define el rendimiento agrícola (17, 31).
Siempre las plantas inoculadas con la cepa R. intraradices y G. cubense estuvieron entre las de mayor índice de eficiencia simbióticarespecto al resto de los tratamientos en función de todas las variables.
Por otra parte, se encontró que las plantas inoculadas con F. mosseae resultaron ser la de menor eficiencia simbiótica, con respecto al resto de las cepas inoculadas en todas las variables, con la excepción de la masa radical que la eficiencia de F. mosseae fue superior al tratamiento inoculado con C. claroideum.
Todo este comportamiento pudiera atribuirse a las diferencias en la capacidad para tomar los nutrientes del suelo y transferirlos a la planta (32). Además, se informó (4) que el suelo es determinante en la colonización micorrízica, puesto que los HMA son microrganismos edáficos y sus propiedades físico-químicas determinan la capacidad de adaptabilidad y establecimiento, así como su eficiencia simbiótica.
En la investigación realizada resulta difícil asociar el comportamiento de las cepas de HMA con el medio edáfico, debido a las condiciones de oxidación - reducción a las que fue sometido el suelo (33), modifican el potencial redox, el pH, la solubilización de nutrientes para las plantas, entre otras propiedades y, por lo tanto, se torna complejo asociar el comportamiento de las cepas de HMA con las condiciones edáficas. Estas modificaciones condicionaron que tres de las cepas de HMA evaluadas manifestaran un comportamiento semejante y que la cepa F. mosseae, descrita como eficiente para condiciones de suelo ácido (34), reflejara el peor comportamiento, que se evidencio en un desarrollo más limitado de las plantas, lo cual se corroboró en la eficiencia simbiótica y la densidad visual.
Las condiciones antes mencionadas pudieron posibilitar que diferentes cepas de HMA manifestaran comportamientos semejantes, algo que probablemente no ocurriría si la investigación se ensayara en el mismo suelo y con la misma especie de planta, pero modificando las condiciones hídricas del suelo, o sea en condiciones de aerobiosis.
El comportamiento en las variables evaluadas en el experimento, permitió considerar la cepa F. mosseae como la menos eficiente, por manifestar la menor respuesta simbiótica y provocar un desarrollo más limitado de las plantas, aunque en sentido general fue superior su comportamiento respecto al tratamiento testigo (noMA), lo que refleja que las condiciones son desfavorables para un mejor funcionamiento micorrízico.
A modo de conclusión resaltar que, la condición de cultivo (anaerobiosis) y las características morfológicas de la planta de arroz (tipos de raíces, tejido aerénquima, transporte de oxígeno y exudados radicales), son determinate para el establecimiento y desarrollo de la colonización micorrízica en edades tempranas del cultivo.
Para las condiciones de suelo y cultivo evaluadas, la eficiencia simbiótica superior se obtuvo con las cepas R. intraradices, G. cubense y C. claroideum, en función del incremento en el ahijamiento y la masa seca aérea, aunque siempre la cepa R. intraradices y G. cubense estuvieron entre las cepas de HMA que manifestaron mayor efecto en el desarrollo de las plantas.
NOTA AL PIE
AGonzales, T. “Entorno de la producción de granos a nivel mundial y nacional, retos y perspectivas”. En: VI Encuentro ECOARROZ, Ed. Instituto de Investigaciones de grano, 2013.
BIBLIOGRAFÍA
1. Ashto, R.; Cerquiglini, C. y Hart, N. Perspectivas alimentarias (Resúmenes de mercado) [en línea]. Inst. División de Comercio y Mercados de la FAO, noviembre de 2013, Roma, Italia, p. 19, ISSN 0251-1541, [Consultado: 4 de julio de 2016], Disponible en: <http://www.fao.org/docrep/019/i3473s/i3473s.pdf>.
2. Ruiz, Sánchez, M.; Geada, D.; Muñoz, H. Y.; Martínez, A.; Santana, Y.; Benítez, M.; Aroca, R. y Ruiz, L. J. M. “La simbiosis micorrízica arbuscular en plantas de arroz (Oryza sativa L.) sometidas a estrés hídrico. Parte II Respuesta bioquímica”. Cultivos Tropicales, vol. 36, no. 3, septiembre de 2015, pp. 88-95, ISSN 0258-5936.
3. Vallino, M.; Fiorilli, V. y Bonfante, P. “Rice flooding negatively impacts root branching and arbuscular mycorrhizal colonization, but not fungal viability: Rice flooding, root branching and arbuscular fungi”. Plant, Cell & Environment, vol. 37, no. 3, marzo de 2014, pp. 557-572, ISSN 0140-7791, DOI 10.1111/pce.12177.
4. Rivera, R.; Fernández, F.; Fernández, K.; Ruiz, L.; Sánchez, C. y Riera, M. “Advances in the Management of Effective Arbuscular Symbiosis in Tropical Ecosystems”. En: Hamel C. y Plenchette C., Mycorrhizae in crop production, Ed. Haworth Food & Agricultural Products Press (HFAPP), Binghamton, NY, 2007, pp. 151-195, ISBN 978-1-56022-306-1, OCLC: 80179850.
5. Rodríguez, Y.; Fernández, A.; Peteira, B.; Fernández, F. y Solórzano, E. “Inducción de enzimas de defensa en dos variedades de arroz (Oryza sativa) por el hongo micorrízico arbuscular G. mosseae”. Revista Colombiana de Biotecnología, vol. 8, no. 2, 2006, pp. 35-39, ISSN 0123-3475, 1909-8758.
6. Mujica, P. Y. y Batlle, S. J. “Funcionamiento de la inoculación líquida con hongos micorrízicos arbusculares (HMA) en plantas de tomate (Solanum lycopersicum L.)”. Cultivos Tropicales, vol. 34, no. 4, diciembre de 2013, pp. 5-8, ISSN 0258-5936.
7. Hernández, J. A.; Pérez, J. J. M.; Bosch, I. D. y Castro, S. N. Clasificación de los suelos de Cuba 2015. Ed. Ediciones INCA, 2015, Mayabeque, Cuba, 93 p., ISBN 978-959-7023-77-7.
8. Fernández, F. “Avances en la producción de inoculantes micorrícicos arbusculares”. En: El manejo eficiente de la simbiosis micorrízica, una vía hacia la agricultura sostenible. Estudio de caso: El Caribe, Ed. Ediciones INCA, La Habana, Cuba, 2003, pp. 97-98, ISBN 959-7023-24-5.
9. IRRI (International Rice Research Institute). Standard Evaluation System for Rice [en línea]. 5.a ed., 2013, Manila, Philippines, 55 p., [Consultado: 1 de septiembre de 2016], Disponible en: <http://www.clrri.org/ver2/uploads/SES_5th_edition.pdf>.
10. Phillips, J. M. y Hayman, D. S. “Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection.”. Transactions of the British Mycological Society, vol. 55, no. 1, 1970, pp. 158-161, ISSN 0007-1536.
11. Giovannetti, M. y Mosse, B. “An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots”. New Phytologist, vol. 84, no. 3, marzo de 1980, pp. 489-500, ISSN 0028646X, DOI 10.1111/j.1469-8137.1980.tb04556.x.
12. Trouvelot, A. y Kough, J. “Mesure du Taux de Mycorhization VA d’un Systeme Radiculaire. Recherche de Methodes d’Estimation ayantune Signification Fonctionnelle” [en línea]. En: eds. Gianinazzi-Pearson V. y Gianinazzi S., Physiological and genetical aspects of mycorrhizae: Proceedings of the 1st European Symposium on Mycorrhizae, Ed. Institut National de la Recherche Agronomique, Paris, France, 1985, pp. 217-222, ISBN 978-2-85340-774-8, OCLC: 14268454, [Consultado: 4 de julio de 2016], Disponible en: <http://www.betterworldbooks.com/physiological-and-genetical-aspects-of-mycorrhizae-id-2853407748.aspx&utm_source=Affiliate&utm_campaign=Text&utm_medium=booklink&utm_term=3630151&utm_content=Homepage>.
13. Ruiz, S. M.; Santana, B. Y.; Muñoz, H. Y.; Martínez, A. Y.; Benitez, M.; Vishnu, B. B. y Peña, C. Y. “Simbiosis de micorrizas arbusculares en plantas de arroz (Oryza sativa L.) en condiciones de inundación y secano”. Acta Agronómica, vol. 64, no. 3, julio de 2015, pp. 227-233, ISSN 0120-2812, 2323-0118, DOI 10.15446/acag.v64n3.43087.
14. Duncan, D. B. “Multiple Range and Multiple F Tests”. Biometrics, vol. 11, no. 1, 1 de marzo de 1955, pp. 1-42, ISSN 0006-341X, DOI 10.2307/3001478.
15. Statistical Graphics Crop. STATGRAPHICS® Plus [en línea]. (ser. Profesional), versión 5.1, [Windows], 2000, Disponible en: <http://www.statgraphics.com/statgraphics/statgraphics.nsf/pd/pdpricing>.
16. Yoshida, S. Fundamentals of rice crop science [en línea]. Ed. International Rice Research Institute, 1981, Los Baños, Laguna, Philippines, 269 p., ISBN 971-10-4052-2, OCLC: 8491323, [Consultado: 4 de julio de 2016], Disponible en: <https://books.google.com.cu/books/about/Fundamentals_of_Rice_Crop_Science.html?id=323XxM076SsC&redir_esc=y>.
17. Jarma, A. A.; Degíovanni, V. B. y Montoya, R. A. “Índices fisiotécnicos, fases de crecimiento y etapas de desarrollo de la planta de arroz” [en línea]. En: Degiovanni V., Martn̕ez C. P., y Motta F., Producción eco-eficiente del arroz en América Latina, Ed. Centro Internacional de Agricultura Tropical (CIAT), 2010, pp. 60-78, ISBN 978-958-694-102-0, [Consultado: 4 de julio de 2016], Disponible en: <https://books.google.com.cu/books/about/Producci%C3%B3n_eco_eficiente_del_arroz_en_A.html?id=vdw-JYBkra8C&redir_esc=y>.
18. González, P. J.; Rivera, R.; Arzola, J.; Morgan, O. y Ramírez, J. F. “Efecto de la inoculación de la cepa de hongo micorrízico arbuscular glomus hoi-like en la respuesta de Brachiaria híbrido cv. Mulato II (CIAT 36087) a la fertilización orgánica y nitrogenada”. Cultivos Tropicales, vol. 32, no. 4, diciembre de 2011, pp. 05-12, ISSN 0258-5936.
19. González, C. P. J.; Ramírez, P. J. F.; Morgan, R. O.; Rivera, E. R. y Plana, L. R. “Contribución de la inoculación micorrízica arbuscular a la reducción de la fertilización fosfórica en Brachiaria decumbens”. Cultivos Tropicales, vol. 36, no. 1, marzo de 2015, pp. 135-142, ISSN 0258-5936.
20. Foo, E.; Ross, J. J.; Jones, W. T. y Reid, J. B. “Plant hormones in arbuscular mycorrhizal symbioses: an emerging role for gibberellins”. Annals of Botany, vol. 111, no. 5, 1 de mayo de 2013, pp. 769-779, ISSN 0305-7364, 1095-8290, DOI 10.1093/aob/mct041.
21. Pozo, M. J.; López, R. J. A.; Azcón, A. C. y García, G. J. M. “Phytohormones as integrators of environmental signals in the regulation of mycorrhizal symbioses”. New Phytologist, vol. 205, no. 4, marzo de 2015, pp. 1431-1436, ISSN 0028-646X, DOI 10.1111/nph.13252.
22. Fusconi, A. “Regulation of root morphogenesis in arbuscular mycorrhizae: what role do fungal exudates, phosphate, sugars and hormones play in lateral root formation?”. Annals of Botany, vol. 113, no. 1, 1 de enero de 2014, pp. 19-33, ISSN 0305-7364, 1095-8290, DOI 10.1093/aob/mct258.
23. Gutjahr, C. “Phytohormone signaling in arbuscular mycorhiza development”. Current Opinion in Plant Biology, vol. 20, agosto de 2014, pp. 26-34, ISSN 13695266, DOI 10.1016/j.pbi.2014.04.003.
24. Parniske, M. “Arbuscular mycorrhiza: the mother of plant root endosymbioses”. Nature Reviews Microbiology, vol. 6, no. 10, octubre de 2008, pp. 763-775, ISSN 1740-1526, 1740-1534, DOI 10.1038/nrmicro1987.
25. Cardoso, C.; Zhang, Y.; Jamil, M.; Hepworth, J.; Charnikhova, T.; Dimkpa, S. O. N.; Meharg, C.; Wright, M. H.; Liu, J.; Meng, X.; Wang, Y.; Li, J.; McCouch, S. R.; Leyser, O.; Price, A. H.; Bouwmeester, H. J. y Ruyter-Spira, C. “Natural variation of rice strigolactone biosynthesis is associated with the deletion of two MAX1 orthologs”. Proceedings of the National Academy of Sciences, vol. 111, no. 6, 11 de febrero de 2014, pp. 2379-2384, ISSN 0027-8424, 1091-6490, DOI 10.1073/pnas.1317360111.
26. Umehara, M.; Hanada, A.; Yoshida, S.; Akiyama, K.; Arite, T.; Takeda-Kamiya, N.; Magome, H.; Kamiya, Y.; Shirasu, K.; Yoneyama, K.; Kyozuka, J. y Yamaguchi, S. “Inhibition of shoot branching by new terpenoid plant hormones”. Nature, vol. 455, no. 7210, 11 de septiembre de 2008, pp. 195-200, ISSN 0028-0836, 1476-4687, DOI 10.1038/nature07272.
27. Rochange, S. “Strigolactones and Their Role in Arbuscular Mycorrhizal Symbiosis” [en línea]. En: eds. Koltai H. y Kapulnik Y., Arbuscular Mycorrhizas: Physiology and Function, Ed. Springer Netherlands, Dordrecht, 2010, pp. 73-90, ISBN 978-90-481-9488-9, [Consultado: 4 de julio de 2016], Disponible en: <http://link.springer.com/10.1007/978-90-481-9489-6_4>.
28. López-Ráez, J. A.; Charnikhova, T.; Fernández, I.; Bouwmeester, H. y Pozo, M. J. “Arbuscular mycorrhizal symbiosis decreases strigolactone production in tomato”. Journal of Plant Physiology, vol. 168, no. 3, febrero de 2011, pp. 294-297, ISSN 0176-1617, DOI 10.1016/j.jplph.2010.08.011.
29. Yoshida, S.; Kameoka, H.; Tempo, M.; Akiyama, K.; Umehara, M.; Yamaguchi, S.; Hayashi, H.; Kyozuka, J. y Shirasu, K. “The D3 F-box protein is a key component in host strigolactone responses essential for arbuscular mycorrhizal symbiosis”. New Phytologist, vol. 196, no. 4, diciembre de 2012, pp. 1208-1216, ISSN 0028-646X, DOI 10.1111/j.1469-8137.2012.04339.x.
30. Gutjahr, C. y Parniske, M. “Cell and Developmental Biology of Arbuscular Mycorrhiza Symbiosis”. Annual Review of Cell and Developmental Biology, vol. 29, no. 1, 6 de octubre de 2013, pp. 593-617, ISSN 1081-0706, 1530-8995, DOI 10.1146/annurev-cellbio-101512-122413.
31. Smith, S. E.; Facelli, E.; Pope, S. y Smith, F. A. “Plant performance in stressful environments: interpreting new and established knowledge of the roles of arbuscular mycorrhizas”. Plant and Soil, vol. 326, no. 1-2, enero de 2010, pp. 3-20, ISSN 0032-079X, 1573-5036, DOI 10.1007/s11104-009-9981-5.
32. Smith, S. E. y Smith, F. A. “Roles of Arbuscular Mycorrhizas in Plant Nutrition and Growth: New Paradigms from Cellular to Ecosystem Scales”. Annual Review of Plant Biology, vol. 62, no. 1, 2 de junio de 2011, pp. 227-250, ISSN 1543-5008, 1545-2123, DOI 10.1146/annurev-arplant-042110-103846.
33. León, L. A. y Arregocés, O. Química de los suelos inundados. Guía de estudio [en línea]. (no. ser. 04SR–09.01), Ed. CIAT, 1981, Cali, Colombia, 40 p., [Consultado: 1 de septiembre de 2016], Disponible en: <http://ciat-library.ciat.cgiar.org/articulos_ciat/Digital/61657_La_%20qu%C3%ADmica_%20de_%20suelos_%20inundados.pdf>.
34. Rivera, E. R.; Fernández, S. K.; Ruiz, M. L.; González, C. P. J. y Martín, A. G. “Beneficios y factibilidad del modelo planta micorrizada eficientemente como elemento constitutivo de la producción agrícola”. En: XIX Congreso Científico Internacional, Ed. Ediciones INCA, Mayabeque, Cuba, 28 de noviembre de 2014, ISBN 978-959-7023-73-9.
Recibido: 22/07/2015
Aceptado: 14/04/2016
M.Cs. Michel Ruiz Sánchez, Unidad Científico Tecnológica de Base «Los Palacios», Instituto Nacional de Ciencias Agrícolas, gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700, Cuba. Email: mich@inca.edu.cu