http://dx.doi.org/10.13140/RG.2.1.1511.1927
Comunicación corta
Actividad anhidrasa carbónica en micorrizas arbusculares
Anhydrase carbonic activity in arbuscular mycorrhiza
Dra.C. Yakelin Rodríguez-Yon,I Romel Chiriboga-Morocho,II M.Cs. Elmo G. Concha-Egas,III M.Cs. Regla M. Lara-RodríguezI
IInstituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700, Cuba.
IICorporación de Estudios, Servicios, Investigación e Inversiones para el Sector Agroambiental (CESIIA), Ecuador.
IIIHacienda "Hermanos Concha Egas", Ecuador.
RESUMEN
La acción de la metaloenzima anhidrasa carbónica (AC) en plantas se ha asociado fundamentalmente al incremento de la concentración de CO2 dentro del cloroplasto, para incrementar la tasa de carboxilación de la enzima Rubisco; siendo esta la reacción que integra el CO2 en carbohidratos durante la fotosíntesis. No obstante, la actividad AC también se ha encontrado en tejidos no verdes como raíces, nódulos, hojas etioladas, semillas, así como en bacterias y hongos; donde desempeña funciones diversas y específicas. En el presente estudio, se analizaron los patrones de isoenzimas AC en raíces de plantas de tomate (Solanum lycopersicum L.) inoculadas de forma individual con seis cepas de hongos micorrizógenos arbusculares (HMA) diferentes. Tomándose las muestras en dos momentos de la simbiosis y, posteriormente se compararon entre sí. Los resultados revelaron que la presencia del hongo MA provocó la aparición de isoenzimas con actividad AC en las raíces de tomate cv. ‘AMALIA’. Los patrones isoenzimáticos obtenidos mostraron una respuesta diferencial en dependencia de la cepa inoculada, principalmente en estadios tempranos de la simbiosis. Se discute el posible origen fúngico de las isoenzimas observadas. Este trabajo constituye el primer informe de isoenzimas AC en raíces colonizadas por HMA.
Palabras clave: anhidrasa carbónica, isoenzimas, mycorrhizae, tomate.
ABSTRACT
The action of the metalloenzyme carbonic anhydrase (AC) in plants has been mainly associated to increase the CO2 concentration inside chloroplast to enhance the carboxylation rate of Rubisco enzyme, being this reaction that integrates the CO2 in carbohydrates during photosynthesis. However, the AC activity has been found in non-green tissues also, like roots, nodules, etiolated leaves, seeds, as well as in bacteria and fungi, which plays diverse and specific rolls. In the present study, the isoenzyme patterns of AC were analyzed in tomato (Solanum lycopersicum L.) roots inoculated in individual way with six different arbuscular mycorrhizal fungi (AMF) strains, taking the samples at two moments of symbiosis, and afterward they were compared among them. Results revealed that the AM fungus presence provoked the appearance of isoenzymes with AC activity in tomato roots cv. ‘AMALIA’, and the obtained isoenzymatic patterns showed a differential response dependent on inoculated strain, principally at early stages of symbiosis. The possible fungal origin of observed isoenzymes is discussed. The present work constitutes the first report about AC isoenzymes in AMF- colonized roots.
Key words: carbonic anhydrase, isoenzymes, mycorrhizae, tomato.
INTRODUCCIÓN
Las anhidrasas carbónicas (AC, E.C. 4.2.1.1) forman una familia altamente diversa de enzimas que están distribuidas en los tres dominios de vida (bacterias, arqueas y eucariotas). Se han descrito cinco clases distintas de AC (α, β, γ, δ y ε), cuyas isoenzimas se localizan en diferentes compartimentos celulares como citosol, mitocondria y cloroplastos. Algunas son secretadas y otras aparecen asociadas a membranas (1).
Esta enzima cataliza la interconversión rápida de dióxido de carbono y bicarbonato: CO2 + H20 ---> H2CO3 ---> HCO3- + (H+). El dióxido de carbono es una molécula gaseosa ubicua y el producto final de la respiración celular.
El bicarbonato representa un sustrato biológico importante que está involucrado en múltiples reacciones metabólicas, como la biosíntesis de arginina, uracilo y lípidos (2).
Las ACs están involucradas en diversos procesos fisiológicos como el intercambio iónico, el balance ácido/base, reacciones de carboxilación/descarboxilación y la difusión de carbono inorgánico entre la célula y su medio así como dentro de la célula (3). Particularmente en raíces de Flaveria bidentis (L.) Kuntze, se detectaron dos transcriptos de AC y se propone que una isoforma provee bicarbonato para reacciones anapleróticas que involucran formas no fotosintéticas de fosfoenol-piruvato carboxilasa (PEPC); mientras la otra, encontrada también en flores, se relaciona con la biosíntesis de lípidos y la actividad antioxidante (4).
En nódulos jóvenes de soya (Glycine max (L.) Merrill.), la actividad AC observada puede facilitar el reciclado de CO2, mientras que en los maduros puede facilitar la difusión del CO2 hacia afuera del sistema del nódulo (5); por lo que, además de su participación en el metabolismo del carbono, se ha sugerido una función para esta enzima en la fijación simbiótica del nitrógeno. Siendo informada su expresión tanto en nódulos como en la bacteria de vida libre en el modelo Lotus japonicus-Mesorhizobium loti (6).
En plantas micorrizadas la actividad AC se ha determinado principalmente en hojas (7–9), como indicador de la menor afectación de estas plantas en comparación con las no inoculadas, ante condiciones de estrés salino y toxicidad por metales, entre otros.
A partir de lo antes expuesto, el objetivo del presente estudio fue determinar los patrones de isoenzimas AC en raíces de tomate (S. lycopersicum) micorrizadas con seis cepas de HMA diferentes, en dos momentos de la simbiosis.
MATERIALES Y MÉTODOS
Material vegetal: se utilizaron como hospedero plantas de tomate (S. lycopersicum) cv. ‘AMALIA’ (obtenido por el Departamento de Mejoramiento Genético del Instituto Nacional de Ciencias Agrícolas (INCA) de Cuba). Las semillas fueron desinfectadas utilizando una solución de hipoclorito de sodio al 10 % por 10 min, seguido de lavados sucesivos con abundante agua destilada. La siembra se efectuó en macetas de 300 mL de capacidad, en un sustrato estéril compuesto por suelo Ferralítico Rojo Lixiviado y cachaza, en la proporción 3:1 (v/v) y esterilizado en autoclave a 121 ºC durante dos horas, en ciclos de tres días seguidos .
Las plantas crecieron en casa de cristal, a una temperatura promedio de 25±3 ºC, humedad relativa de 75-80 % y fotoperiodo natural.
Material fúngico: se utilizaron seis cepas de HMA de la colección del INCA como inóculo: dos ecotipos de Funneliformis mosseae (Nicol. & Gerd.) Walker & Schüßler (10, 11), Rhizoglomus intraradices (Schenck & Smith) Sieverding et al. (12), Acaulospora scrobiculata Trappe, Glomus cubense (Y. Rodr. & Dalpé) (13) y Glomus sp. Los inóculos fueron producidos en condiciones controladas usando Sorghum bicolor L. como planta trampa. Las esporas se vertieron en placa Petri para su conteo y selección con el uso del microscopio estéreo 70x (Stemi 2000-C) (14). Luego se desinfectaron utilizando soluciones de Cloramina T al 2 y 5 %, sucesivamente, por 10 min cada una. La inoculación de las plantas de tomate se realizó añadiendo 200 esporas por maceta, en el momento de la siembra. Se utilizó un diseño completamente aleatorizado con diez réplicas y dos repeticiones.
Muestreo y evaluación: la toma de muestras se efectuó a los 18 y 32 días después de la germinación, procesándose cinco plantas por tratamiento en cada periodo. Las raíces fueron lavadas cuidadosamente, una porción se empleó para la determinación de la colonización micorrízica y la otra para la determinación de los patrones isoenzimáticos mediante electroforesis en geles de poliacrilamida (PAGE).
Colonización micorrízica: para la determinación de esta variable se tomaron aproximadamente 200 mg de raíces secundarias en cada muestra, las cuales fueron secadas en estufa a 70 ºC y teñidas según la metodología modificada por Rodríguez et al. (15). La evaluación se realizó en microscopio estéreo 70x (Stemi 2000-C) y se determinó el porcentaje de colonización micorrízica. Los datos obtenidos fueron transformados por la función arcsen√x y procesados estadísticamente mediante un ANOVA de Clasificación Simple, donde se compararon las medias según Tukey para p<0,05.
Preparación de los extractos de proteínas y condiciones de separación: la extracción de proteínas en raíces se realizó según la metodología propuesta por SolórzanoA con la modificación de la solución amortiguadora de extracción por Tris-HCl 50 mmol L-1 (pH 7,2) y se procesaron cinco réplicas para cada caso. Los extractos de proteínas obtenidos se liofilizaron y luego fueron resuspendidos en una solución que contenía Tris-HCl 50 mmol L-1 (pH 6,8), glicerol y azul de bromofenol, para ajustar las concentraciones de proteínas a 1 µg µL-1. Para la separación de las proteínas por PAGE se utilizó un gel concentrador al 4 % de poliacrilamida y el gel separador a 8,5 % y se aplicaron 20 µL de cada muestra, repitiéndose tres veces el procesoA.
Las electroforesis se desarrollaron en un equipo de electroforesis vertical minigel (BIORAD), con la solución amortiguadora Tris -Glicina 19 mmol L-1 (pH 8,3). Las corridas se realizaron con una intensidad de 25 mA, durante 90 min a 4 ºC.
Tinción de AC: la tinción de las bandas se realizó con el uso de β naftil acetato (0,5 mg), sal RR azul rápida y solución amortiguadora Tris-HCl 0,5 mol L-1 (pH 7,19). El gel se incubó en la oscuridad a 37 ºC durante cuatro horas, hasta la aparición de bandas rojizasB.
En los geles obtenidos se estableció la posición relativa de cada banda según su movilidad relativa (Rf), que se obtuvo al dividir la distancia media de migración entre la distancia de migración del frente de corrida, según la cual cada banda se caracterizó por un valor numérico. Se empleó una cámara Nikon F90X para tomar evidencia documental de los patrones isoenzimáticos.
RESULTADOS Y DISCUSIÓN
Colonización micorrízica: en las raíces de las plantas control no se observó presencia fúngica (Figura 1). Las raíces de tomate (S. lycopersicum) inoculadas mostraron porcentajes de colonización micorrízica entre 7 y 14 %, a los 18 días, y entre 13 y 29 % a los 32 días, con diferencias significativas entre algunos tratamientos en ambos periodos. Sobresalió el tratamiento con G. cubense con los valores superiores estadísticamente, mientras que las cepas Glomus sp y R. intraradices mostraron los valores inferiores de colonización, aunque sin diferencias significativas de las cepas F. mosseae.
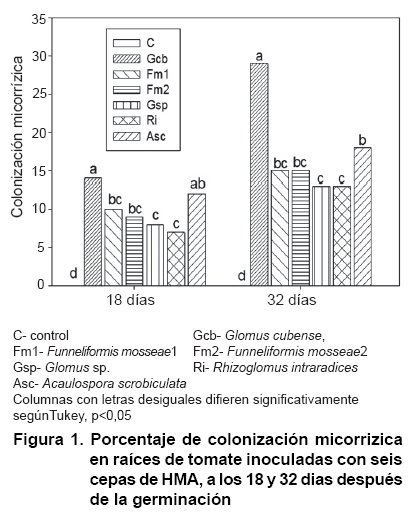
En trabajos previos se ha demostrado el funcionamiento eficiente de la cepa G. cubense para las condiciones edáficas estudiadas (16), lo que se confirma en el presente estudio. Cabe destacar los valores bajos de colonización micorrízica obtenidos y las escasas diferencias entre las cepas analizadas, lo cual puede atribuirse al corto periodo de experimentación (un mes), donde se evaluaron plantas jóvenes.
Isoenzimas de AC: en las raíces de las plantas de tomate controles no se apreció actividad AC (Figura 2). En los tratamientos micorrizados, a los 18 días, se observaron tres isoformas, de las cuales la No. 2 con Rf 0,33 apareció en todos aunque con muy baja intensidad en el tratamiento con R. intraradices, la No. 1 con Rf 0,35 se detectó en las raíces inoculadas con Glomus sp. y A. scrobiculata, mientras que en las colonizadas por las cepas G. cubense y ambos F. mosseae se observó la isoenzima No. 3 con Rf 0,25.
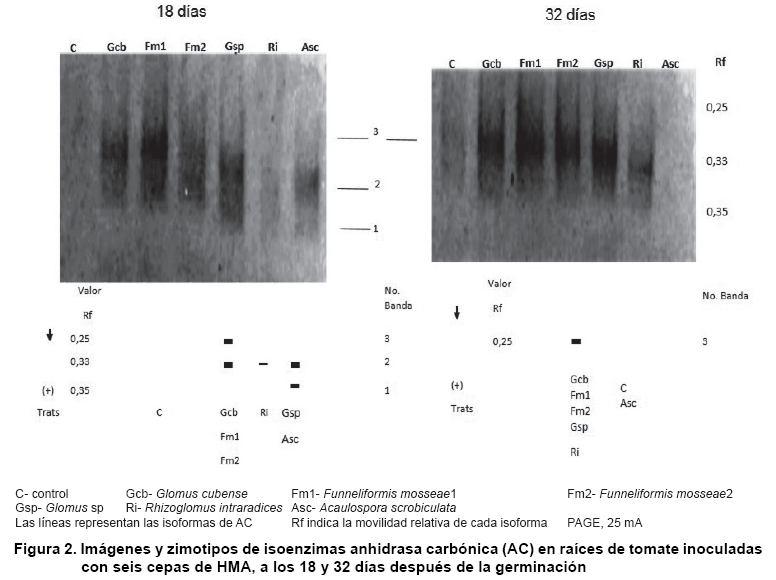
A los 32 días, sólo se detectó la isoenzima No. 3 en todos los tratamientos micorrizados, excepto en el inoculado con A. scrobiculata.
Al respecto, en el tubo germinativo de R. intraradices se observó fijación de CO2 altamente eficiente en la oscuridad (17), la cual se asoció con los ciclos de la urea y de los ácidos tricarboxílicos. Sin embargo, los autores no relacionaron este proceso con la acción de la enzima AC. A continuación, se realizaron numerosos trabajos que informan una elevada actividad metabólica respecto al carbono y al nitrógeno en las estructuras de los HMA (18–20), la que al parecer está relacionada directamente con el intercambio de nutrientes planta-hongo.
Recientemente, en un estudio del genoma de R. irregularis se identificaron genes que codifican para AC (21). Además, se descubrieron transcriptos con función putativa AC en la simbiosis Rhizoglomus-Medicago, cuya expresión es superior en micelio intrarradical en comparación con las esporas; siendo caracterizadas como proteínas secretadas inducidas por el hongo (22).
Los resultados de esta investigación revelan dos aspectos fundamentales: 1) las raíces de tomate cv. ‘AMALIA’ manifiestan actividad AC sólo en respuesta a la colonización por el hongo MA; 2) la aparición de isoenzimas AC mostró un patrón diferencial en dependencia de la cepa de HMA inoculada, principalmente en estadios tempranos de la simbiosis.
Si bien estos aspectos no permiten establecer la naturaleza fúngica o vegetal de las isoenzimas detectadas , las evidencias antes expuestas, unido al hecho que no se observó banda de actividad en las raíces controles en los momentos analizados, sugieren el origen fúngico de las mismas. Aunque no se debe descartar que pudieran ser de origen vegetal, inducidas de forma particular o específica por las distintas cepas de HMA, como respuesta de las plantas de tomate al diálogo molecular o intercambio de señales que se establece entre los simbiontes. Este hecho refleja la complejidad de la interacción planta-hongo, la cual determina la compatibilidad y fundamentalmente, la eficiencia de la simbiosis.
Las isoenzimas AC detectadas en las raíces micorrizadas pudieran estar involucradas en diversos procesos bioquímicos y fisiológicos como la fijación/asimilación del nitrógeno y el metabolismo del CO2, similar a lo informado para la interacción Rhizobium-leguminosa (6, 23). También es importante destacar la participación de esta enzima en la regulación del pH y en el balance ácido-base en las células, por lo que probablemente su actividad en raíces micorrizadas, de alguna manera, influye en el funcionamiento del HMA implicado, teniendo en cuenta la relación encontrada entre el pH del suelo y un funcionamiento eficiente o no del hongo (24), así como la mejor respuesta antioxidante observada en las plantas inoculadas (25, 26).
En este sentido, cabe resaltar que el aumento de la respiración del suelo y la producción de CO2 por los HMA resulta en una solución débilmente ácida del ácido carbónico, reacción que puede involucrar la acción de la enzima AC y conlleva a la acidificación de la rizósfera (27).
CONCLUSIONES
Este trabajo constituye el primer estudio donde se aborda la actividad de este sistema enzimático en raíces micorrizadas, por lo que consideramos de interés profundizar en investigaciones futuras para esclarecer su relación con el proceso simbiótico, así como dilucidar la naturaleza fúngica o vegetal de las isoenzimas encontradas.
AGRADECIMIENTOS
A la técnico Aida Medina Carmona del laboratorio Micorrizas del INCA por su asistencia técnica.
Notas al pie
ASolórzano, E. Proteínas de defensa y estudio enzimático en la interacción tomate-Alternaria solani. [Tesis de Doctorado], Universidad Agraria de La Habana, La Habana, Cuba, 2002, 100 p.
BIglesias, L. Estudio de la variabilidad morfoagronómica y bioquímica en soya (Glycine max L. Merrill). [Tesis de Doctorado], INCA, La Habana, Cuba, 1986, 100 p.
BIBLIOGRAFÍA
1. Elleuche, S. ‘‘Carbonic Anhydrases in Fungi and Fungal-Like Organisms – Functional Distribution and Evolution of a Gene Family’’ [en línea]. En: eds. Pöggeler S. y Wöstemeyer J., Evolution of Fungi and Fungal-Like Organisms, edit. Springer, Berlin, 2011, pp. 257-274, ISBN 978-3-642-19973-8, [Consultado: 22 de marzo de 2016], Disponible en: <http://link.springer.com/chapter/10.1007/978-3-642-19974-5_11>.
2. Mogensen, E. G. y Mühlschlegel, F. A. ‘‘CO2 sensing and virulence in Candida albicans’’. En: Brakhage A. A. y Zipfel P. F., Human and Animal Relationships, edit. Springer Science & Business Media, Berlin, 20 de julio de 2008, pp. 83-94, ISBN 978-3-540-79307-6.
3. Moroney, J. V.; Bartlett, S. G. y Samuelsson, G. ‘‘Carbonic anhydrases in plants and algae’’. Plant, Cell & Environment, vol. 24, no. 2, 1 de febrero de 2001, pp. 141-153, ISSN 1365-3040, DOI 10.1111/j.1365-3040.2001.00669.x.
4. Tetu, S. G.; Tanz, S. K.; Vella, N.; Burnell, J. N. y Ludwig, M. ‘‘The Flaveria bidentis β -Carbonic Anhydrase Gene Family Encodes Cytosolic and Chloroplastic Isoforms Demonstrating Distinct Organ-Specific Expression Patterns’’. Plant Physiology, vol. 144, no. 3, 7 de enero de 2007, pp. 1316-1327, ISSN 1532-2548, DOI 10.1104/pp.107.098152.
5. Kavroulakis, N.; Flemetakis, E.; Aivalakis, G. y Katinakis, P. ‘‘Carbon Metabolism in Developing Soybean Root Nodules: The Role of Carbonic Anhydrase’’. Molecular Plant-Microbe Interactions, vol. 13, no. 1, 1 de enero de 2000, pp. 14-22, ISSN 0894-0282, DOI 10.1094/MPMI.2000.13.1.14.
6. Kalloniati, C.; Tsikou, D.; Lampiri, V.; Fotelli, M. N.; Rennenberg, H.; Chatzipavlidis, I.; Fasseas, C.; Katinakis, P. y Flemetakis, E. ‘‘Characterization of a Mesorhizobium loti α -Type Carbonic Anhydrase and Its Role in Symbiotic Nitrogen Fixation’’. Journal of Bacteriology, vol. 191, no. 8, 15 de abril de 2009, pp. 2593-2600, ISSN 0021-9193, 1098-5530, DOI 10.1128/JB.01456-08.
7. Subramanian, K. S.; Balakrishnan, N. y Senthil, N. ‘‘Mycorrhizal symbiosis to increase the grain micronutrient content in maize’’. Australian Journal of Crop Science, vol. 7, no. 7, 2013, p. 900, ISSN 1835-2693.
8. Haneef, I.; Faizan, S.; Perveen, R. y Kausar, S. ‘‘Impact of bio-fertilizers and different levels of cadmium on the growth, biochemical contents and lipid peroxidation of Plantago ovata Forsk’’. Saudi Journal of Biological Sciences, vol. 21, no. 4, septiembre de 2014, pp. 305-310, ISSN 1319-562X, DOI 10.1016/j.sjbs.2013.12.005.
9. Talaat, N. B. y Shawky, B. T. ‘‘Protective effects of arbuscular mycorrhizal fungi on wheat (Triticum aestivum L.) plants exposed to salinity’’. Environmental and Experimental Botany, vol. 98, febrero de 2014, pp. 20-31, ISSN 0098-8472, DOI 10.1016/j.envexpbot.2013.10.005.
10. Schüßler, A. y Walker, C. The Glomeromycota: A species list with new families and new genera. edit. Create Space Independent Publishing Platform, 17 de octubre de 2011, 58 p., ISBN 978-1-4663-8804-8.
11. Rodríguez, Y.; Dalpé, Y. y Séguin, S. ‘‘Clasificación taxonómica de la cepa de hongo micorrizógeno arbuscular INCAM-2 como Funneliformis mosseae, syn. Glomus mosseae’’. Cultivos Tropicales, vol. 35, no. 2, junio de 2014, pp. 27-33, ISSN 0258-5936.
12. Sieverding, E.; Alves, da S. G.; Berndt, R. y Oehl, F. ‘‘Rhizoglomus , a new genus of the Glomeraceae’’. Mycotaxon, vol. 129, no. 2, 2014, pp. 373-386, ISSN 0093-4666, DOI 10.5248/129.373.
13. Rodríguez, Y.; Dalpé, Y.; Séguin, S.; Fernández, K.; Fernández, F. y Rivera, R. A. ‘‘Glomus cubense sp. nov., an arbuscular mycorrhizal fungus from Cuba’’. Mycotaxon, vol. 118, no. 1, 2011, pp. 337-347, ISSN 0093-4666, DOI 10.5248/118.337.
14. Gerdemann, J. W. y Nicolson, T. H. ‘‘Spores of mycorrhizal Endogone species extracted from soil by wet sieving and decanting’’. Transactions of the British Mycological Society, vol. 46, no. 2, junio de 1963, pp. 235-244, ISSN 0007-1536, DOI 10.1016/S0007-1536(63)80079-0.
15. Rodríguez, Y. Y.; Arias, P. L.; Medina, C. A.; Mujica, Y.; Medina, G. L. R.; Fernández, S. K. y Mena, E. A. ‘‘Alternativa de la técnica de tinción para determinar la colonización micorrízica’’. Cultivos Tropicales, vol. 36, no. 2, junio de 2015, pp. 18-21, ISSN 0258-5936.
16. Rivera, R.; Fernández, F.; Fernández, K.; Ruiz, L.; Sánchez, C. y Riera, M. ‘‘Advances in the Management of Effective Arbuscular Mycorrhizal Symbiosis in Tropical Ecosystems’’. En: eds. Hamel C. y Plenchette C., Mycorrhizae in Crop Production, edit. Haworth Food & Agricultural Products Press, 10 de julio de 2006, pp. 151-195, ISBN 978-1-56022-307-8.
17. Bago, B.; Pfeffer, P. E.; Zipfel, W.; Lammers, P. y Shachar-Hill, Y. ‘‘Tracking metabolism and imaging transport in arbuscular mycorrhizal fungi’’ [en línea]. En: eds. Smith S. E. y Smith F. A., Diversity and Integration in Mycorrhizas, edit. Springer, Netherlands, 2002, pp. 189-197, ISBN 978-90-481-5933-8, [Consultado: 22 de marzo de 2016], Disponible en: <http://link.springer.com/chapter/10.1007/978-94-017-1284-2_18>.
18. Kobae, Y.; Tamura, Y.; Takai, S.; Banba, M. y Hata, S. ‘‘Localized Expression of Arbuscular Mycorrhiza-Inducible Ammonium Transporters in Soybean’’. Plant and Cell Physiology, vol. 51, no. 9, 9 de enero de 2010, pp. 1411-1415, ISSN 0032-0781, 1471-9053, DOI 10.1093/pcp/pcq099.
19. Tian, C.; Kasiborski, B.; Koul, R.; Lammers, P. J.; Bücking, H. y Shachar-Hill, Y. ‘‘Regulation of the Nitrogen Transfer Pathway in the Arbuscular Mycorrhizal Symbiosis: Gene Characterization and the Coordination of Expression with Nitrogen Flux1, [W][OA]’’. Plant Physiology, vol. 153, no. 3, 1 de julio de 2010, pp. 1175-1187, ISSN 1532-2548, DOI 10.1104/pp.110.156430.
20. Pérez, T. J.; Testillano, P. S.; Balestrini, R.; Fiorilli, V.; Azcón, A. C. y Ferrol, N. ‘‘GintAMT2, a new member of the ammonium transporter family in the arbuscular mycorrhizal fungus Glomus intraradices’’. Fungal Genetics and Biology, vol. 48, no. 11, noviembre de 2011, pp. 1044-1055, ISSN 1087-1845, DOI 10.1016/j.fgb.2011.08.003.
21. Tisserant, E.; Malbreil, M.; Kuo, A.; Kohler, A.; Symeonidi, A.; Balestrini, R.; Charron, P.; Duensing, N.; Frey, N. F. dit; Gianinazzi-Pearson, V.; Gilbert, L. B.; Handa, Y.; Herr, J. R.; Hijri, M.; Koul, R.; Kawaguchi, M.; Krajinski, F.; Lammers, P. J.; Masclaux, F. G.; Murat, C.; Morin, E.; Ndikumana, S.; Pagni, M.; Petitpierre, D.; Requena, N.; Rosikiewicz, P.; Riley, R.; Saito, K.; Clemente, H. S.; Shapiro, H.; Tuinen, D. van; Bécard, G.; Bonfante, P.; Paszkowski, U.; Shachar-Hill, Y. Y.; Tuskan, G. A.; Young, J. P. W.; Sanders, I. R.; Henrissat, B.; Rensing, S. A.; Grigoriev, I. V.; Corradi, N.; Roux, C. y Martin, F. ‘‘Genome of an arbuscular mycorrhizal fungus provides insight into the oldest plant symbiosis’’. Proceedings of the National Academy of Sciences, vol. 110, no. 50, 12 de octubre de 2013, pp. 20117-20122, ISSN 0027-8424, 1091-6490, DOI 10.1073/pnas.1313452110.
22. Tisserant, E.; Kohler, A.; Dozolme, S. P.; Balestrini, R.; Benabdellah, K.; Colard, A.; Croll, D.; Da Silva, C.; Gomez, S. K.; Koul, R.; Ferrol, N.; Fiorilli, V.; Formey, D.; Franken, P.; Helber, N.; Hijri, M.; Lanfranco, L.; Lindquist, E.; Liu, Y.; Malbreil, M.; Morin, E.; Poulain, J.; Shapiro, H.; van Tuinen, D.; Waschke, A.; Azcón, C.; Bécard, G.; Bonfante, P.; Harrison, M. J.; Küster, H.; Lammers, P.; Paszkowski, U.; Requena, N.; Rensing, S. A.; Roux, C.; Sanders, I. R.; Shachar-Hill, Y.; Tuskan, G.; Young, J. P. W.; Gianinazzi-Pearson, V. y Martin, F. ‘‘The transcriptome of the arbuscular mycorrhizal fungus Glomus intraradices (DAOM 197198) reveals functional tradeoffs in an obligate symbiont’’. New Phytologist, vol. 193, no. 3, 1 de febrero de 2012, pp. 755-769, ISSN 1469-8137, DOI 10.1111/j.1469-8137.2011.03948.x.
23. Tsikou, D.; Stedel, C.; Kouri, E. D.; Udvardi, M. K.; Wang, T. L.; Katinakis, P.; Labrou, N. E. y Flemetakis, E. ‘‘Characterization of two novel nodule-enhanced α -type carbonic anhydrases from Lotus japonicus’’. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics, vol. 1814, no. 4, abril de 2011, pp. 496-504, ISSN 1570-9639, DOI 10.1016/j.bbapap.2011.01.007.
24. Herrera, P. R. A.; Hamel, C.; Fernández, F.; Ferrer, R. L. y Furrazola, E. ‘‘Soil–strain compatibility: the key to effective use of arbuscular mycorrhizal inoculants?’’. Mycorrhiza, vol. 21, no. 3, 16 de junio de 2010, pp. 183-193, ISSN 0940-6360, 1432-1890, DOI 10.1007/s00572-010-0322-6.
25. Rodríguez, Y.; Vierheilig, H. y Mazorra, L. M. ‘‘Alterations of the Antioxidant Enzyme Activities are not General Characteristics of the Colonization Process by Arbuscular Mycorrhizal Fungy’’. Chilean Journal of Agricultural Research, vol. 72, no. 3, 2012, pp. 411-418, ISSN 0718-5820, DOI 10.4067/S0718-58392012000300016.
26. Miransari, M. Use of microbes for the alleviation of soil stresses [en línea]. edit. Springer, 2014, 188 p., ISBN 978-1-4939-0720, [Consultado: 22 de marzo de 2016], Disponible en: <http://link.springer.com/content/pdf/10.1007/978-1-4939-0721-2.pdf>.
27. Thorley, R. M. S.; Taylor, L. L.; Banwart, S. A.; Leake, J. R. y Beerling, D. J. ‘‘The role of forest trees and their mycorrhizal fungi in carbonate rock weathering and its significance for global carbon cycling’’. Plant, Cell & Environment, vol. 38, no. 9, 1 de septiembre de 2015, pp. 1947-1961, ISSN 1365-3040, DOI 10.1111/pce.12444.
Recibido: 17/03/2015
Aceptado: 30/10/2015
Dra.C. Yakelin Rodríguez Yon, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700, Cuba. Email: yakelin@inca.edu.cu

