Efectividad
de cepas de Azotobacter sp. y Bacillus sp. para el control
de especies fúngicas asociadas a hortalizas
Efectivity
of strains Azotobacter sp. and Bacillus sp. for a control
the fungi species associated with vegetable
M.Cs. Janet
Rodríguez Sánchez,I M.Cs. Yoania Ríos Rocafull,I
M.Cs. Yamilé Baró RobainaII
IDepartamento
de Agrobiotecnología. Instituto de Investigaciones Fundamentales en Agricultura
Tropical “Alejandro de Humboldt” (INIFAT), La Habana, Cuba.
IILaboratorio de Producción de Medios Biológicos. Instituto
de Investigaciones en Sanidad Vegetal (ISV), La Habana, Cuba.
RESUMEN
Los géneros
Azotobacter y Bacillus tienen la potencialidad de fijar nitrógeno
atmosférico, solubilizar elementos minerales y producir un grupo de sustancias
estimuladoras del crecimiento vegetal. Bacillus se reconoce, además,
por su actividad antagonista. Estas razones justifican su selección como
principios activos de productos biofertilizantes. La presencia de enfermedades
causadas por hongos en los cultivos hortícolas, constituye un problema
en la agricultura cubana. El objetivo del presente trabajo fue evaluar la actividad
antagonista de cepas de los géneros Azotobacter y Bacillus
contra hongos que causan enfermedades a cultivos hortícolas. Para ello
se emplearon las especies Fusarium chlamydosporum, Corynespora cassiicola
y Cladosporium oxysporum. Todas las cepas pertenecen a las colecciones
del INIFAT. Para desarrollar este trabajo se utilizó el Método
de “Enfrentamiento de Cultivos Duales”, que permitió seleccionar aquellas
que poseen dicha actividad y describir, a la vez, las principales afectaciones
que provocan a las estructuras fúngicas. Los resultados arrojaron que
dentro de los dos géneros hay cepas que logran inhibir el crecimiento
micelial. Dentro de las cepas de Azotobacter cinco resultaron promisorias
contra Cladosporium oxysporum, dos responden frente a Fusarium
chlamydosporum y una sola resultó efectiva contra Corynespora
cassiicola. La actividad mostrada por el género Bacillus
fue mayor. En este caso, dos cepas muestran efectividad contra Corynespora casiicola;
seis contra Cladosporium oxysporum y ocho contra Fusarium chlamydosporum.
Se comprobó que existen cepas de Azotobacter capaces de inhibir
a más de una especie fúngica, lo que resulta novedoso por encontrarse
poco citada la actividad del género contra patógenos de hortalizas.
Palabras
clave: bacterias antagonistas, control biológico, enfermedades
fungosas.
ABSTRACT
The genus Azotobacter
and Bacillus have a potential to atmospheric nitrogen fixation, mineral
elements solubilization and producing a group of stimulator of vegetal growth
substances. In addition, Bacillus is recognizing by its antagonistic
activity. The reasons justify its selection with actives principles of biofertilizer
products. The presence of fungus diseases in vegetable cultures is a problem
for Cuban agriculture. The objective of the present work was to evaluate the
antagonistic activity of Azotobacter and Bacillus strains
against fungus that caused diseases in vegetables cultures. For those were employed
Fusarium chlamydosporum, Corynespora casiicola and Cladosporium
oxysporum. All strains belong at the INIFAT collections. For the development
of work, “Dual Culture Bring” Method was used with permitting the selections
those to possess previous activity and descript, in turn, principle affectations
caused to fungi structures. Results emit that inside of two genus exist strains
that inhibit the micelial growth. Among strains of Azotobacter, five
result promissory against Cladosporium oxysporum, two respond to Fusarium
chlamydosporum and only one was effective against Corynespora cassiicola.
The activity shows for Bacillus genus is major. In this case, two strains
show activity against Corynespora cassiicola, six against Cladosporium
oxysporum and eight against Fusarium chlamydosporum. Highlight
the finished that exists strains of Azotobactersp capable of inhibit
more than one fungi species, which results very new for being quoted few times
the genus activity against vegetable pathogens.
Key words:
antagonistic bacterias, biological control, fungus diseases.
INTRODUCCION
Las rizobacterias
promotoras del crecimiento vegetal (PGPR, según sus siglas en inglés)
son un grupo heterogéneo de microorganismos que habitan en la rizosfera,
en la superficie de las raíces o en asociación con ellas y ejercen
efectos beneficiosos sobre las plantas a través de mecanismos directos
e indirectos (1).
Entre los mecanismos directos se encuentran aquellos que influyen en el metabolismo
de los cultivos, a través de la incorporación y movilización
de nutrientes indispensables para su crecimiento y desarrollo. Entre ellos se
encuentran la fijación biológica del nitrógeno atmosférico,
la solubilización de nutrientes y la producción de sustancias
fisiológicamente activas. Por su parte, los mecanismos considerados indirectos
brindan protección a las plantas frente al ataque de organismos fitopatógenos.
Entre estos se incluyen la producción de antibióticos, la inducción
de resistencia sistémica y la competencia por nutrientes o nicho ecológico
(2, 3).
Azotobacter y Bacillus se reconocen como bacterias promotoras
del crecimiento vegetal. Los microorganismos pertenecientes al género
Azotobacter son bacterias asociativas de vida libre. Entre sus potencialidades
resaltan la fijación biológica del nitrógeno atmosférico
y la producción de fitohormonas. Bacillus se destaca por su
gran diversidad, por su resistencia ante condiciones ambientales adversas (4,
5) y por la producción de una amplia gama de compuestos con actividad
fungicida o fungistática (6).
Las enfermedades causadas por hongos fitopatógenos, ocasionan importantes
pérdidas de rendimiento bajo diferentes sistemas productivos. En Cuba,
son comunes las epizootias, debido a que las condiciones climáticas resultan
favorables para la reproducción de múltiples agentes causales
de enfermedades. Los tres géneros fúngicos utilizados en este
estudio se incluyen entre los que provocan severas afectaciones y dos de ellos
se consideran emergentes bajo cultivo protegido, por las pérdidas de
rendimiento que han originado sobre tomate (Solanum lycopersicum L.)
y pimiento (Capsicum annum L.) en regiones tropicales (7).
El presente trabajo se trazó como objetivo evaluar la actividad antagonista
de cepas de los géneros Azotobacter y Bacillus contra
hongos fitopatógenos de cultivos hortícolas.
MATERIALES
Y MÉTODOS
La investigación
se desarrolló en el Laboratorio de Biofertilizantes, perteneciente al
Grupo de Agrobiotecnología, del Instituto de Investigaciones Fundamentales
en Agricultura Tropical “Alejandro de Humboldt” (INIFAT) y en el laboratorio
de producción de medios biológicos del Instituto Nacional de Sanidad
Vegetal (INISAV).
Para el estudio se emplearon cepas de bacterias conservadas en la Colección
de Bacterias Beneficiosas del INIFAT. Los hongos fitopatógenos proceden
de la Colección de Hongos de la propia entidad (reconocida como la 853
de la Federación Mundial de Colecciones de Cultivos, WFCC según
sus siglas en inglés).
La actividad antagonista se evaluó contra los hongos Cladosporium
oxysporum (cepa 2133); Corynespora cassiicola y Fusarium chlamydosporum
(2022). Se empleó el método de “Enfrentamiento de Cultivos Duales”
(8), sobre placas Petri de 90 mm de diámetro. El método consistió
en la siembra de una estría de las bacterias de interés a 15 mm
del borde de la placa y en el otro extremo, a igual distancia se depositó
un pre-cultivo de los hongos fitopatógenos evaluados en forma de disco
de 7 mm de diámetro. Luego de realizar ambas siembras las placas fueron
incubadas a 28 ºC durante siete días para C. oxysporum
y F. chlamydosporum y 15 días para C.cassiicola. El pre-cultivo
de los hongos se efectuó por un período de siete días en
condiciones de incubación semejantes.
Para los hongos C. oxysporum y C. cassiicola se utilizó
medio sólido de Papa-Dextrosa-Agar (PDA) y para Fusarium chlamydosporum
el medio Agar-AvenaA.
Los ensayos contaron con tantos tratamientos (cepas) fueron evaluadas y con
diez réplicas por cada tratamiento.
Las evaluaciones se realizaron al finalizar el ensayo de forma cualitativa,
mediante la descripción de las afectaciones provocadas a las colonias
fúngicas.También se calculó el porcentaje de inhibición
micelial con el uso de la siguiente fórmula.
Inhibición micelial (%) = dc – dt/dc x 100
donde: dc = diámetro control y dt = diámetro tratamiento
El procesamiento estadístico de los datos se realizó con el programa
STATGRAPH Plus versión 5.0 (9), con el que se realizaron análisis
de varianza, previa comprobación de la normalidad y homogeneidad de las
mismas, según las pruebas de Kolmogorov-Smirnov, Cochran C, Hartley y
Bartlett. Cuando existieron diferencias significativas entre los tratamientos,
las medias se compararon según la prueba de Duncan al 5 % de significación.
RESULTADOS
Y DISCUSIÓN
C. oxysporum
CKr. es un hongo que no ha sido ampliamente utilizado para el desarrollo de
trabajos in vitro, pues no era urgente la necesidad de encontrar agentes de
biocontrol, al no constituir un peligro potencial para cultivos de interés
agrícola. Sin embargo, el hecho de ser considerada en los últimos
años como enfermedad emergente sobre los cultivos de tomate (Solanum
lycopersicum L.) y pimiento (Capsicum annum L.) en sistemas de
cultivo protegido, propicia la búsqueda de alternativas de carácter
biológico para su control.
La presencia del género Fusarium ha sido demostrada en gramíneas
y Fabaceaes (10, 11), en numerosas hortalizas, entre las que se destacan el
tomate y el pimiento, así como en frutales (7, 12); también ataca
especies de plantas ornamentales (13). Representantes del género Fusarium
provocan enfermedades severas en todos estos cultivos, ya que están asociados
a síntomas como la marchitez vascular y pertenece al complejo de hongos
causantes del damping-off (7).
De igual forma, C. cassiicola (Berk&Curt) Wei, afecta grandes extensiones
de tomate bajo cultivo protegido en el mundo, ya que induce la aparición
del “Tizón Foliar del Tomate”. En Cuba, en los últimos años
se ha convertido en una enfermedad emergente para este sistema de producción,
debido a las condiciones favorables de humedad y temperatura que imperan en
el mismo.
La actividad antagonista de las ocho cepas de Azotobacter evaluadas
frente a C. oxysporum (2133), arrojó que solo dos de ellas (A-12
y A-14) no mostraron ningún tipo de actividad contra el patógeno.
Estas permitieron el contacto con el hongo, el cual manifestó, además,
un abundante proceso de conidio génesis y no provocaron inhibición
de su crecimiento. En algunas réplicas ambos microorganismos se mezclaron
sin que se apreciara ningún daño a las estructuras fúngicas.
Otra mostró una actividad media (A-31) ya que deformó el micelio
hacia los bordes y provocó la ruptura de hifas, pero no limitó
la conidio génesis ni inhibió severamente el crecimiento fúngico.
Tres de las restantes cinco cepas (A-11, A-20 y A-22) no permitieron el contacto
con el hongo, inhibieron parcialmente el proceso de conidio génesis y
causaron la ruptura del micelio en algunas zonas. Sin embargo, las que más
se destacaron fueron A-29 y A-33, porque reprimieron totalmente la conidio génesis,
permitieron una pobre extensión del micelio, a partir del disco que sirvió
como inóculo y produjeron el hinchamiento de la colonia fúngica,
unido a fuertes cambios de coloración en el medio de cultivo y en la
propia colonia.
Estas manifestaciones están relacionadas con la producción de
metabolitos con características antifúngicas. El hinchamiento
de las colonias fúngicas y los cambios de coloración demuestran
la presencia de compuestos con características antibióticas o
la producción de enzimas hidrolíticas y quitinolíticas
que minimizan las posibilidades de crecimiento de los hongos al influir en su
capacidad de reproducción (14).
El comportamiento de la inhibición del crecimiento micelial causada por
las distintas cepas, se muestra en la Figura
1, en la que se observa que la tendencia se corresponde con los daños
provocados al patógeno. Sobresalen las cepas A-29 y A-33 que no presentan
diferencias significativas entre sí y alcanzan valores superiores al
98 % de disminución del crecimiento. Estas difieren significativamente
de todos los demás microorganismos empleados en el estudio.

Con respecto a F. chlamydosporum dos cepas no mostraron actividad (A-14
y A-29) y sí permitieron el contacto con el hongo sin causar daños
a la estructura del micelio fúngico, ni impedir el desarrollo del proceso
de conidio génesis; además, ambas cepas lograron porcentajes de
inhibición inferiores a 25 % (Figura
1).
Tres de los microorganismos deformaron la estructura del micelio, debido a la
ruptura de numerosas hifas en los bordes que se tornaron rectos y se enrollaron
hacia atrás pero no limitaron la esporulación. Los restantes (A-12,
A-22 y A-33) provocaron la limitación del proceso de conidiogénesis
y manifestaron indicios de producción de sustancias por la acumulación
en los bordes de la colonia de una sustancia de color amarillo oscuro brillante
que se oscurece con los días; sin embargo, entre estas tres cepas existen
diferencias significativas en el porcentaje de inhibición micelial alcanzado,
destacándose la cepa A-22.
Las diferencias alcanzadas respecto a este indicador, pueden atribuirse a la
producción de sustancias de diversa naturaleza y con un grado de eficiencia
variable sobre el patógeno. Se ha descrito la influencia de distintos
tipos de compuestos producidos por bacterias y los mecanismos de acción
que pueden estar involucrados en los resultados (15). Según estos autores
las fitohormonas, los sideróforos, los péptidos y ciertas enzimas
pueden interferir en el crecimiento de los hongos, lo que impide el desarrollo
de las enfermedades en plantas.
Contra C. cassiicola todas las cepas de Azotobacter evaluadas,
mostraron algún nivel de efectividad. A-11 deformó la estructura
micelial e impidió la formación de nuevas hifas. A-22 mostró
una conducta semejante e indicios de producción de sustancias, lo que
produjo la autolisis de hifas al interior de las colonias, que se evidencian
con la formación de zonas transparentes al envés. A-12, A-20,
A-29, A-31 y A-33 ocasionaron daños similares y limitaron la esporulación.
Iguales manifestaciones mostró la cepa A-14 (Figura
1). Sin embargo, solo las cepas A-12 y A-33 logran inhibir el crecimiento
micelial del patógeno sobre el 35 % y mantienen diferencias significativas
con el resto de las cepas estudiadas.
El comportamiento de las cepas de Azotobacter evaluadas sobre C.
cassiicola mostró valores de inhibición del crecimiento inferiores
a los alcanzados frente a C. oxysporum y F. chlamydosporum,
lo que puede estar vinculado al hábito y la velocidad de crecimiento
de este hongo.
Se debe señalar que es la primera vez que este grupo de microorganismos
se utiliza para estudiar su actividad antagonista contra patógenos de
hortalizas. Respecto al género Azotobacter se encontraron pocos
estudios en la literatura consultada acerca de la producción de metabolitos
con características enzimáticas o antifúngicas empleadas
para el control de organismos nocivos. Sin embargo, se menciona el papel de
cepas de este género, aisladas en asociación con cereales, con
potencialidades para producir una sustancia fungistática, soluble en
éter y termoestable, que redujo el crecimiento y la incidencia de hongos
de los géneros Fusarium, Alternaria y Helminthosporium
en trigo (Triticum aestivum) y millo (Sorghum bicolor) (10).
Se conoce, además, acerca de la producción de quistes, los cuales
son considerados estructuras de resistencia, por parte de la mayoría
de las cepas pertenecientes a este género. Las mismas se encuentran envueltas
en matrices de exopolisacáridos del tipo alginato y polihidroxibutiratos.
Ambos tipos de sustancias constituyen fuentes de carbono e intervienen en procesos,
tales como, la protección de la enzima nitrogenasa ante la presencia
de oxígeno y en su adaptación frente a condiciones de estrés;
participan en procesos bioquímicos que permiten la integridad de las
membranas celulares, así como en la formación de biopelículas.
A los polihidroxibutiratos se les concede también la propiedad de reprimir
la esporulación de algunos géneros fúngicos, por lo que
podrían estar implicados en esta respuesta (16). Para Azotobacter
ha sido reconocida recientemente la producción de polihidroxifenoles
y fenolatos que impiden los procesos de síntesis de las membranas en
hongos del género Fusarium (17).
En el caso del género Bacillus fueron evaluadas 11 cepas, de
las cuales dos no tuvieron actividad contra C. oxysporum, tres mostraron
valores medios y seis resultaron efectivas. La ausencia de actividad contra
el patógeno se manifestó en todas las réplicas evaluadas
de estos dos microorganismos (B-3 y B-75). En estos casos los crecimientos se
mezclaron y ambos lograron desarrollarse uno encima del otro, sin provocar daños
a la estructura fúngica. B-4, B-39 y B-61 muestran como principal comportamiento
que después de comenzar la extensión hifal, muchas esporas saltan
y se alejan del crecimiento, su germinación da lugar a la formación
de nuevas colonias. Al respecto se notó la muerte o lo que es igual,
la no germinación de las esporas más cercanas a la estría
bacteriana y la deformación total de la estructura de las mismas, debido
a la ruptura de grandes zonas del micelio, que a la vez provocaron el cambio
de coloración a blanco de las colonias al envés, lo que indica
que el proceso de conidio génesis se interrumpió parcialmente.
Por su parte, seis cepas demostraron efectividad (B-8, B-12, B-15, B-28, B-31
y B-51) fueron capaces de disminuir el crecimiento del micelio, debido a la
ruptura de numerosas hifas. Además, mostraron indicios de producción
de compuestos con actividad fungistática que cambiaron el color de las
colonias de verde olivo oscuro a tonos fluorescentes de amarillo o marrón.
Ellas crearon hinchazón en las colonias e impidieron totalmente que se
produjera la liberación de los primeros conidios.
En cuanto a la inhibición micelial, causada por estas cepas, se aprecian
diferencias (Figura 2).
Seis de ellas provocaron una inhibición micelial superior al 80 %, lo
cual puede considerarse un valor alto, una muestra aproximadamente un 60 % y
tres arrojan valores inferiores al 40 %. Solamente se puede considerar despreciable
la inhibición provocada por la cepa B-3.
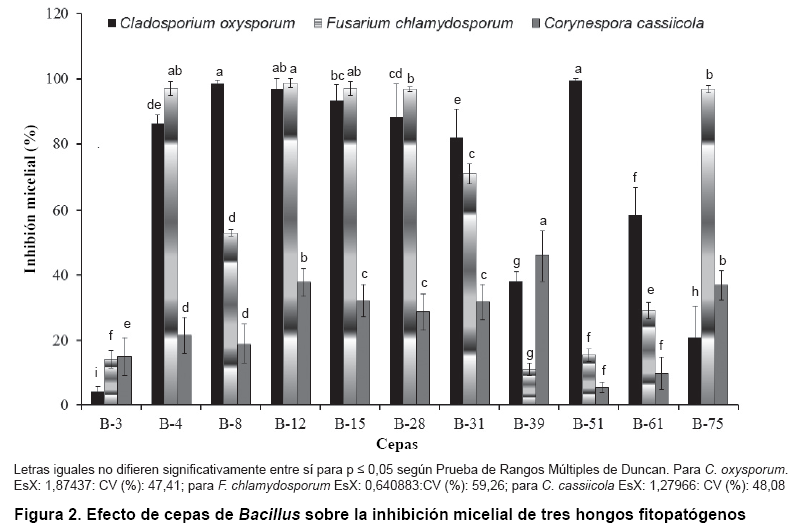
Las bacterias incluidas en el género Bacillus muestran una mayor
diversidad en las respuestas frente a F. chlamydosporum. B-3 y B-39
evidencian convivencia con el hongo, ya que los crecimientos se mezclaron entre
sí, sin provocar ningún daño a las estructuras fúngicas.
B-51 y B-61 deformaron los bordes de las colonias a formas rectas, sin causar
daños más severos a las estructuras del hongo. B-8 y B-31 deforman
los bordes a formas hundidas hacia adentro, donde se aprecia lisis de las hifas,
provocan la ruptura de muchas de ellas hacia el interior pero solo limitan parcialmente
la conidio génesis. Por su parte, B-4, B-12, B-15, B-28 y B-75 inhiben,
de forma severa, el crecimiento micelial del patógeno (Figura
2), sin diferencias significativas entre ellas. Además, provocan
la acumulación de sustancias de color amarillo oscura brillante alrededor
de la colonia e impidieron el desarrollo del proceso de conidio génesis.
Entre las cepas de Bacillus existieron varias tendencias frente a C.
cassiicola. B-3, B-51, B-61, B-4 y B-31 mostraron bajos niveles de inhibición
pues solo deformaron los bordes de las colonias a formas rectas e indujeron
la ruptura de algunas hifas, lo que no provocó daños sustanciales
al micelio. B-15, B-28 y B-8 muestran indicios de producción de compuestos
con actividad antifúngica, la que se manifestó por la aparición
de zonas de autolisis al envés de las colonias; además, se evidenciaron
cambios de coloración de las hifas a un tono de verde olivo que se torna
negruzco con los días o la acumulación de una sustancia rosada
en los bordes o alrededor del disco que sirvió como inóculo para
el montaje del método. B-12, B-39 y B-75 resultaron promisorias porque
además de las manifestaciones descritas, fueron capaces de inhibir, en
mayor medida, el crecimiento fúngico y de limitar el proceso de conidio
génesis.
Fue confirmado que la formación de zonas de autolisis en el envés
de colonias de Curvularia lunata cuando fueron enfrentadas a varias cepas, pertenecientes
a la clase Bacilli (18). Estos autores refieren que ese efecto es causado por
sustancias del tipo antibiótico que pueden ser producidos por estas.
En este caso pueden existir también cepas con la capacidad de producir
ciertos tipos de sustancias con una alta concentración o estabilidad
como para provocar daños a las especies fúngicas estudiadas.
Los resultados sugieren una cierta especificidad de los metabolitos involucrados
de acuerdo al hongo fitopatógeno al que se desea controlar. Contra C.
oxysporum muestran altos niveles de efectividad las cepas A-29 y A-33,
esta última se destacó también contra C. cassiicola
acompañada de la cepa A-12. Para el control de F. chlamydosporum
se destaca solo la cepa A-22.
En el caso del género Bacillus es válido este criterio,
aunque pudieran estar relacionados con esta actividad, un mayor número
de compuestos de naturaleza diferente, debido a la producción de antibióticos
como la iturina, la subtilina y otros reconocidos para el género (18),
señales de interferencia (17) o sustancias que inducen resistencia sistémica
en plantas (19). De cualquier modo, sobresalen las cepas B-8 y B-51 frente a
C. oxysporum, B-12 contra F. chlamydosporum y B-39 contra
C. cassiicola.
CONCLUSIONES
Cepas de los dos
géneros bacterianos poseen actividad antagonista contra una de las especies
fúngicas empleadas en el estudio.
Las cepas A-29 y A-33 muestran altos niveles de efectividad contra C. oxysporum;
las cepas A-33 y A-12 se destacan frente a C. cassiicola; mientras
que A-22 fue eficiente contra F. chlamydosporum.
En el caso del género Bacillus sobresalen las cepas B-8 y B-51
frente a C. oxysporum, B-12 contra F. chlamydosporum y B-39
contra C. cassiicola.
RECOMENDACIONES
Continuar los
estudios para la cuantificación de la actividad mediante métodos
in vitro e in vivo, vinculados a la obtención de un producto con efecto
múltiple que pueda ser utilizado como principio activo de productos con
efecto biofertilizante.
Nota al
pie
ACentro
Nacional de Biopreparados. Catálogo de Medios de Cultivo [en línea].
BIOCEN, 2013, 44 p. [Consultado: 23 de enero de 2015], Disponible en:
<http://www.biocen.cu>.
BIBLIOGRAFíA
1. Ribeiro, C.
M. y Cardoso, E. J. B. N. ‘‘Isolation, selection and characterization of root-associated
growth promoting bacteria in Brazil Pine (Araucaria angustifolia)’’.
Microbiological Research, vol. 167, no. 2, 20 de enero de 2012, pp.
69-78, ISSN 0944-5013, DOI 10.1016/j.micres.2011.03.003.
2. Lugtenberg, B. y Kamilova, F. ‘‘Plant-Growth-Promoting Rhizobacteria’’. Annual
Review of Microbiology, vol. 63, no. 1, 2009, pp. 541-556, ISSN 0066-4227,
1545-3251, DOI 10.1146/annurev.micro.62.081307.162918, PMID: 19575558.
3. Madigan, M.; Martinko, J.; Stahl, D. y Clark, D. Brock Biology of Microorganisms.
13.a ed., edit. Pearson Prentice Hall, Illinois, 2012, 1155 p., ISBN
978-0-321-73551-5.
4. Larrea, J.; Rojas, M.; Heydrich, M. y Lugo, D. ‘‘Aislamiento y caracterización
de la comunidad bacteriana cultivable en el río Almendares Isolation
and characterization of cultivable bacterial community in Almendares river’’.
Revista CNIC Ciencias Biológicas, vol. 41, no. especial, 2010,
pp. 1-10, ISSN 2221-2450.
5. Sosa, L. A. I.; Pazos, Á.-R. V.; Torres, C. D. y Casadesús,
R. L. ‘‘Identificación y caracterización de seis aislados pertenecientes
al género Bacillus promisorios para el control de Rhizoctonia
solani Künh y Sclerotium rolfsii Sacc.’’. Fitosanidad,
vol. 15, no. 1, marzo de 2011,
pp. 39-44, ISSN 1562-3009.
6. Reyes, R. A.; Ruiz, S. E.; Yam, C. C. y Dzul, C. M. ‘‘Selección de
Bacillus spp. con actividad antagónica in vitro contra
Macrophomina phaseolina (Tassi) Goid. en diferentes medios de cultivo’’.
Fitosanidad, vol. 15, no. 2, 25 de abril de 2012, pp. 117-121, ISSN
1818-1686.
7. Agrios, G. N. Plant Pathology. 7.a ed., edit. Elsevier
Academic Press, London, 2013, 929 p., ISBN 0-12-044565-4.
8. Nelson, D.; Beattie, K.; McCollum, G.; Martin, T.; Sharma, S. y Rao, J. R.
‘‘Performance of Natural Antagonists and Commercial Microbiocides towards in
vitro Suppression of Flower Bed Soil-Borne Fusarium oxysporum’’.
Advances in Microbiology, vol. 4, no. 3, 12 de febrero de 2014, p.
151, ISSN 2165-3402, 2165-3410, DOI 10.4236/aim.2014.43020.
9. Statistical Graphics Crop. STATGRAPHICS® Plus
[en línea]. (ser. Profesional), versión 5.1, [Windows], 2000,
Disponible en: <http://www.statgraphics.com/statgraphics/statgraphics.nsf/pd/pdpricing>.
10. Burkhead, K. D.; Schisler, D. A. y Slininger, P. J. ‘‘Bioautography shows
antibiotic production by soil bacterial isolates antagonistic to fungal dry
rot of potatoes’’. Soil Biology and Biochemistry, vol. 27, no. 12,
diciembre de 1995, pp. 1611-1616, ISSN 0038-0717, DOI 10.1016/0038-0717(95)00095-V.
11. Lopes de Farias, N. A.; de Campos, D. A.; Rollemberg, S. M. y do Couto,
B. C. ‘‘Reaction of soybean cultivars to the sudden death syndrome pathogens
Fusarium tucumaniae and F. brasiliense’’. Revista Ceres,
vol. 60, no. 2, abril de 2013, pp. 215-220, ISSN 0034-737X, DOI 10.1590/S0034-737X2013000200009.
12. Campos, B. S. de C.; da Silveira, S. F.; da Silva, R. F. y Pio, V. A. ‘‘Chemical
treatment of papaya seeds aiming at long-term storage and control of Damping
off’’. Revista Ceres, vol. 61, no. 3, junio de 2014, pp. 384-391,
ISSN 0034-737X, DOI 10.1590/S0034-737X2014000300013.
13. Pérez, B. Y.; Gómez, I. G.; González, G. M.; Vaillant,
F. D.; Ramos, R. E.; Palacios, A. J. R.; Pérez, M. M. y Almándoz,
P. J. ‘‘Hongos patógenos en plantas ornamentales de importancia para
Cuba’’. Fitosanidad, vol. 15, no. 4, 29 de septiembre de 2012, pp.
205-214, ISSN 1818-1686.
14. Prapagdee, B.; Kuekulvong, C. y Mongkolsuk, S. ‘‘Antifungal potential of
extracellular metabolites produced by Streptomyces hygroscopicus against
phytopathogenic fungi’’. International Journal of Biological Sciences,
vol. 4, no. 5, 2008, p. 330.
15. Camelo, M. y others. ‘‘Mecanismos de acción de las rizobacterias
promotoras del crecimiento vegetal’’. Revista CORPOICA. Ciencia y Tecnología
Agropecuaria, vol. 12, no. 2, 2011, pp. 159-166, ISSN 0122-8706.
16. Gauri, S. S.; Mandal, S. M. y Pati, B. R. ‘‘Impact of Azotobacter
exopolysaccharides on sustainable agriculture’’. Applied Microbiology and
Biotechnology, vol. 95, no. 2, 22 de mayo de 2012, pp. 331-338, ISSN 0175-7598,
1432-0614, DOI 10.1007/s00253-012-4159-0.
17. Soto, S. J. C. y López, C. C. E. ‘‘RNA-seq: herramienta transcriptómica
útil para el estudio de interacciones planta-patógeno’’. Fitosanidad,
vol. 16, no. 2, 7 de enero de 2014, pp. 101-113, ISSN 1818-1686.
18. Orberá, R. T. de los M.; Serrat, D. M. de J. y González, G.
Z. ‘‘Potencialidades de bacterias aerobias formadoras de endosporas para el
biocontrol en plantas ornamentales’’. Fitosanidad, vol. 13, no. 2,
junio de 2009, pp. 95-100, ISSN 1562-3009.
19. Sun, J. B.; Peng, M.; Wang, Y. G.; Zhao, P. J. y Xia, Q. Y. ‘‘Isolation
and characterization of antagonistic bacteria against Fusarium wilt
and induction of defense related enzymes in banana’’. African Journal of
Microbiology Research, vol. 5, no. 5, 2011, pp. 509–515, ISSN 1996-0808.
Recibido: 15 de
mayo de 2015
Aceptado: 18 de enero de 2016
M.Cs.
Janet Rodríguez Sánchez, Departamento de Agrobiotecnología.
Instituto de Investigaciones Fundamentales en Agricultura Tropical “Alejandro
de Humboldt” (INIFAT), La Habana, Cuba. Email: bioferbiocontrol@inifat.co.cu

