Efecto agronómico del biosólido en cultivo de tomate (Solanum lycopersicum): control biológico de Rhizoctonia solani
Agronomic effect of the biosolid in tomato cultivation (Solanum lycopersicum): biological control of Rhizoctonia solani
M.Cs. Edelbis López Dávila,I M.Cs. Alexander Calero Hurtado,I Yamilet Gómez León,II Dra.C. Zuleiqui Gil Unday,I Dra.C. Deborah Henderson,III Dra.C. Janet JimenezI
IUniversidad de Sancti Spíritus. Ave de los Mártires #360. CP 60100 Santi Spíritus. Cuba.
IIDirección Provincial de Protección Fitosanitaria, Santi Spíritus. Carretera Sur del Jíbaro Km 2.5. CP 60100 Santi Spíritus. Cuba.
IIIInstituto para Horticultura Sustentable. Universidad Politécnica de Kwantlen, Columbia Británica, Canadá.
RESUMEN
En este trabajo se determinó el efecto agronómico del efluente de la digestión anaerobia de estiércol porcino en el cultivo de tomate (Solanum lycopersicum), y su efecto como control biológico del fitopatógeno Rhizoctonia solani. Para ello se realizó un estudio comparado con bioproductos y antagonistas reconocidos (lixiviado de humus de lombriz, microorganismos eficientes, Trichoderma harzianum y Lecanicillium lecanii). Los experimentos para determinar el efecto agronómico del efluente se realizaron a escala de laboratorio y de campo. Las propiedades del efluente como control bilógico fueron evaluadas in vitro utilizando tanto el efluente crudo como filtrado. Además en medio de cultivo PDA tratado superficialmente a diferentes concentraciones del efluente, se analizó la actividad restrictiva de posibles metabolitos, sobre el desarrollo del fitopatógeno Rhizoctonia solani. Los resultados mostraron un efecto significativo del efluente sobre el suelo y el desarrollo de las plantas de tomate, tanto a escala de laboratorio como de campo (mayor follaje, aumento en el número de flores, frutos y altura de la planta), sobre todo con la aplicación del efluente al 5 %. Respecto al efecto sobre el fitopatógeno Rhizoctonia solani se obtuvo una reducción significativa del diámetro de la colonia, respecto al testigo y a los demás antagonistas utilizados. El tratamiento de la superficie del medio de cultivo con efluente a concentraciones de 15, 20 y 25 % redujo el desarrollo del fitopatógeno en más de un 70 % en 24 h.
Palabras clave: biocontrol, biofertilizantes, Biogás, hortalizas.
ABSTRACT
In this paper the agronomic effect of effluent from the anaerobic digestion of pig manure in cultivating tomato(Solanum lycopersicum) and its effect as a biological control of plant pathogen Rhizoctonia solani are determined. For this, a study was conducted compared with bioproducts and recognized antagonists (vermicompost leachate, efficient microorganisms, Trichoderma harzianum and Lecanicillium lecanii). Experiments to determine the effect agronomic of the effluent were performed on a laboratory scale and field. The properties of the effluent as biological control were tested in vitro using both crude effluents as filtering. Also in PDA culture medium, superficially treated at different concentrations of the effluent, restrictive activity of possible metabolites on the development of plant pathogen Rhizoctonia solani was analyzed. The results showed a significant effect of effluent on soil and development of tomato plants, both laboratory scale and field (greater foliage, increase in the number of flowers, fruits and plant height), especially with application of the effluent 5 %. Regarding the effect on plant pathogens Rhizoctonia solani a significant reduction in the diameter of the colony, compared to the control and the other antagonists used was obtained. The surface treatment of the culture medium with concentrations digested 15, 20 and 25 % reduced the development of phytopathogen to over 70 % in only 24 h.
Keywords: biocontrol, biofertilizers, Biogas, vegetables.
INTRODUCCIÓN
El uso de fertilizantes químicos a gran escala ha contribuido a la pérdida de la calidad del suelo, provocando eutrofización, contaminación por metales pesados, y en general un efecto ambiental negativo (1, 2). Por tanto, el uso de biofertilizantes constituye una estrategia imprescindible para mejorar la calidad del suelo, aumentar los rendimientos y calidad de los productos agrícolas (3), contribuyendo así a la calidad ambiental, la salud animal y humana.
En este sentido, los efluentes de la digestión anaerobia de residuos orgánicos (agrícolas, forestales y agropecuarios), constituyen una alternativa para el uso de estos como biofertilizantes, cuyas propiedades han sido demostrados por varios autores. Estos efluentes de la digestión anaerobia contienen biomasa microbiana, materia orgánica semi-degradada y compuestos inorgánicos, que se pueden utilizar como acondicionadores del suelo en tierras de cultivo (4). La composición de la mayoría de los efluentes es, en promedio, 8,5 % de materia orgánica, 2,6 % de nitrógeno, 1,5 % de fósforo, 1,0 % de potasio y un pH de 7,5 (5). El uso del efluente como biofertilizante para la agricultura sostenible, sería uno de los componentes más importantes de la gestión integrada de nutrientes, ya que son más rentables y son fuentes renovables de nutrientes para las plantas (6).
El efluente suele contener microorganismos como Pseudomonas, Klebsiella, Samonella, Penicillium, Shigella, Bacteriodes, Aspergillus y Bacillus que potencian sus propiedades agronómicas. Klebsiella y Clostridium spp., son liberadores y fijadores de nitrógeno, mientras Bacillus y Pseudomonas spp., son solubilizadores de fosfato (7). Estos microorganismos aceleran los procesos microbianos en el suelo y aumentan la disponibilidad de nutrientes asimilables por las plantas (3). Otros autores han evaluado la calidad biofertilizante del efluente de la digestión de estiércol de vaca y gallinaza y provenientes del estiércol de conejillo de india (4,7,8).
Por otro lado, el control biológico de enfermedades está mucho menos generalizado que el de plagas y en particular el de enfermedades foliares (9), por lo que el consumo de fungicidas sigue siendo muy alto en algunos cultivos como el tomate en Cuba. Por ejemplo, se han empleado especies de Trichoderma para el manejo de múltiples enfermedades causadas por hongos del suelo (10) y se ha incursionado en el manejo de enfermedades foliares con resultados promisorios (10, 11). Lecanicillium (Verticillium) lecanii es uno de los agentes de control biológico que mayor potencial tiene para la agricultura sostenible, por la diversidad de organismos que puede regular (10). Además, se han aplicado otros productos orgánicos con potencialidades en el manejo de enfermedades, por ejemplo el humus de lombriz o vermicompost, LIPLANT, extracto líquido obtenido a partir del humus sólido (9), el compost, el té de compost y los microorganismos eficientes (ME).
En Cuba, la creciente producción porcina de forma descentralizada, ha favorecido la generación desmedida de estiércoles donde, la digestión anaerobia ha jugado un importante papel como tecnología de tratamiento, con el aprovechamiento energético del biogás y la obtención de efluente, que en la mayoría de los casos es subutilizado (12). Los biodigestores anaeróbicos se utilizan a pequeñas escala (pequeños productores), en el tratamiento de estiércoles (porcino, vacuno, caprino, ovino, etc.) para la producción de biogás, mayormente usado en la cocción de alimentos, pero hay pocas experiencias sobre la utilización de los efluentes (13). Además han sido limitados los estudios acerca de la aplicación de las propiedades benéficas del efluente y su efecto agronómico en cultivos nacionales (12). Por otro lado estos efluentes pueden contribuir también en el control biológico sobre todo de hongos del suelo, dado por su contenido de metabolitos secundarios. Estudios al respecto no se han informado hasta la fecha.
Por ello, el objetivo de este trabajo fue evaluar el efecto del efluente de la digestión de estiércol porcino sobre el crecimiento y desarrollo del cultivo de tomate (Solanum lycopersicum), así como su efecto como control biológico de Rhizoctonia solani.
MATERIALES Y MÉTODOS
Caracterización físico-química de los biofertilizantes y suelos utilizados
Para la caracterización de la composición físico-química inicial de los biofertilizantes empleados (efluente de estiércol porcino y lixiviado de humus de lombriz) y de los suelos empleados en el estudios, se emplearon los métodos descritos en los Métodos Estándares del 2012 (14). Los análisis realizados en la caracterización fueron: el porciento de materia seca (MS %) y materia orgánica (MO %) por el método gravimétrico. El calcio (Ca2+) y magnesio (Mg2+) por el método de valoración con EDTA. El fosforo como ortofosfato (PO43-) por colorimetría, y nitrógeno amoniacal (N-NH4+) por el método Kjendalh. El potasio (K) y sodio (Na) por fotometría de llama y la acidez (pH) por potenciometría.
Aplicación del efluente en plantas de tomate a escala de laboratorio
El experimento de la aplicación del efluente en plantas de tomate a escala de laboratorio, se desarrolló en el laboratorio de Biogás de la Universidad de Sancti Spíritus. Se sembraron 30 semillas variedad Rilia por tratamiento en bandejas de germinación (36x36x50). Se utilizaron dos tipos suelos; suelo1: pardo sialítico (mullido y cálcico) y suelo 2: pardo sialítico (eslítico y húmico), según la clasificación de suelos de Cuba 2015 (15), representativos de esta región. Para cada suelo se emplearon cinco tratamientos (testigo, efluente anaerobio de estiércol porcino al 5 y 10 % y Lixiviado de humus de lombriz roja californiana con estiércol caprino al 5 y 10 %, basado en un diseño factorial 22 (16). Se aplicaron cinco dosis de los biofertilizantes por aspersión foliar, durante la fase vegetativa evaluada (hasta inicio de floración), cada siete días. Cada tratamiento se ensayó por triplicado y los principales indicadores a evaluar fueron altura de la planta y número de hojas.
Aplicación del efluente en plantas de tomate a escala de campo
La investigación se llevó a cabo en la finca de un productor de la CCS “Celia Sánchez” situada en la localidad de Banao, provincia Sancti Spíritus. Se utilizó un diseño experimental de bloques al azar en un suelo tipo pardo con diferenciación de carbonato. El mismo estuvo conformado por siete tratamientos y tres réplicas con parcelas de tres metros cuadrados y un espacio entre bloques de un metro cuadrado, para un área total de 0,023 ha, donde se plantó la variedad Rilia a una distancia de 90 cm de camellón por 35 cm entre plantas. La preparación del suelo se realizó con las siguientes labores: rotura, cruce, mullido, surcado, contra surcado y surcado para la plantación. Se mantuvo la humedad empleando el riego (superficial por surcos e infiltración). Además se realizaron labores de limpieza según la necesidad del cultivo y arrope (manual) de las plantas durante la experimentación. Los tratamientos empleados fueron: A, B y C con aplicaciones foliares semanales de efluente al 5, 10 y 15 % respectivamente y D testigo (agua). Los principales indicadores a evaluar fueron: altura de las plantas, número de hojas, número de flores, rendimiento agrícola y componentes y peso de los frutos. Se midieron 30 plantas por tratamientos hasta el inicio de la cosecha.
Análisis de la actividad del efluente como control biológico
Para el análisis de la actividad del efluente como control biológico, se realizaron dos experimentos en los cuales se evaluó la capacidad de reducción del crecimiento del hongo del suelo Rhizoctonia solani
(R. solani),considerado fitopatógeno para el tomate. Se utilizó el efluente filtrado (por filtro biológico de 0,2 µm) y crudo, en comparación con bioproductos de efecto antagonista reconocidos (Trichoderma harzianum, Lecanicillium lecanii) y además microorganismos eficientes (ME), elaborados en el laboratorio de biofertilizantes de la Universidad de Sancti Spíritus, empleando como inóculo el consorcio microbiano IH-plus comercializado por la Estación de Pastos y Forraje “Indio Hatuey”.
Experimento 1: evaluación de la capacidad de los filtrados de varios bioproductos líquidos en la reducción del crecimiento del fitopatógeno, cuando se mezcla al 25 % (v/v) en medio agar papa dextrosa (PDA).
Los bioproductos evaluados fueron: el efluente, Trichoderma harzianum A-34 líquido con conidios (sin preservantes), Trichoderma harzianum A-34 líquido fermentado hasta fase micelial sin conidios (sin preservantes), Lecanicillium lecanii cepa LV-5 líquido con conidios (sin preservantes) y ME. Se utilizó como testigo una cepa de Rhizoctonia solani. Se sembró en el centro de las placas Petri, llenadas con el PDA y 25 % (v/v) de los diferentes filtrados respectivamente, un disco de 5 mm del fitopatógeno Rhizoctonia solani y se incubó a 26 ±1 ºC durante tres días. Se utilizaron cinco repeticiones por cada bioproducto evaluado y se midió diariamente el diámetro de la colonia de R. solani en cm.
Experimento 2: evaluación de la capacidad de desarrollo o invasión del fitopatógeno sobre la superficie del medio de cultivo agarizado tratado con los bioproductos completos (sin filtrar). Se evaluó el efecto del efluente y ME a concentraciones de 5, 10, 15, 20 y 25 % (v/v) en agua estéril aplicado por toda la superficie del medio PDA en placas Petri. Para ello, se utilizaron cinco repeticiones y se sembró el fitopatógeno en el centro de cada placa, colocándose en incubación a 26 ± 1 ºC durante 48 h. Se midió el diámetro de la colonia del hongo (cm) a las 24 y 48 h.
Análisis estadístico
Los datos experimentales fueron procesados para comprobar la normalidad mediante las pruebas no paramétricas de Kolmogorov-Smirnov (17) y Kruskal-Wallis con el test Mann-Whitney. En los casos en que no se cumplieron las premisas del ANOVA se realizaron las transformaciones apropiadas a la variable analizada. De verificarse las dos premisas anteriores, se empleó un análisis de varianza de clasificación simple y ANOVA bifactorial, para el diseño completamente aleatorizado y la Prueba de Rangos Múltiples de Duncan (18) para un nivel de probabilidad del error del 5 %, utilizando el paquete estadístico SPSS versión 18 (19). Además se determinó el coeficiente de variabilidad y el error estándar para las variables descritas.
RESULTADOS Y DISCUSIÓN
Resultados de la Caracterización físico-química de los biofertilizantes y suelos utilizados
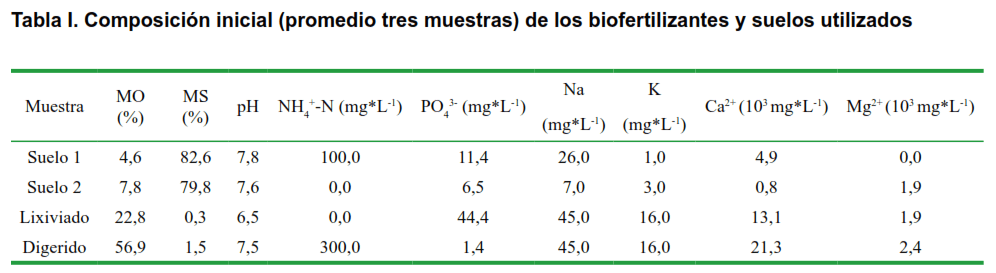
En la Tabla I, se pueden observar las características iniciales de los materiales empleados en el ensayo de la capacidad biofertilizante del efluente de la digestión anaerobia y lixiviado de humus de lombriz en dos tipos de suelos.
Según los procedimientos analíticos realizados, los suelos utilizados en el estudio mostraron variabilidad en su composición, siendo el suelo 1 más pobre en materia orgánica que el suelo 2 y ligeramente más alcalino, característico de este tipo de suelo. De forma general el suelo 1 presenta mayor contenido de nitrógeno, fósforo, favorable al crecimiento de los cultivos, sodio y calcio, manifestando una textura más arcillosa que el suelo 2, solo en los elementos potasio (de forma general bajo para ambos, siendo este elemento parte de los elementos esenciales para las plantas) y magnesio, el suelo 2 superó al suelo 1. Se puede decir que ambos suelos no son ricos en nutrientes (macro elementos) y que requieren de la incorporación de los mismos, para lograr potenciar sus capacidades agrícolas.
En el caso de los biofertilizantes escogidos para el estudio, también se observa variabilidad en los resultados. En cuanto al pH, el efluente presenta valores ligeramente alcalinos, los cuales pueden no ser favorables para algunos cultivos, que prefieren pH ligeramente ácidos, como el presente en el lixiviado. A excepción del contenido de fosforo, el efluente presentó valores superiores o iguales en los demás parámetros evaluados, sobre todo en contenido de nitrógeno asimilable, presentando así mejores características biofertilizantes que el lixiviado de humus de lombriz.
Después de la aplicación de los biofertilizantes y terminado el experimento, se analizó el suelo de cada tratamiento para ver en que se beneficiaron. En la Tabla II aparecen los valores de los parámetros evaluados a los suelos, observándose que en el suelo 1 la aplicación del lodo y el lixiviado en dosis mínimas no representaron ningún impacto en cuanto a materia orgánica respecto al control. En el caso del suelo 2 con menos dosis se logró mantener la materia orgánica superior al control. El valor de pH para ambos suelos tratados con los biofertilizantes, se mantuvo cercano a la neutralidad.
La determinación de fosfatos inorgánicos demostró que el lodo tuvo un aporte significativo, lo que era de esperar debido a su alta concentración inicial en fosfatos. Respecto a la determinación de sodio y potasio se obtuvo un aporte mayor por parte del lixiviado en el suelo 1. Para el suelo 2 fue significativa la concentración de Na que aportó el efluente y ambos biofertilizantes en sus dosis máximas aumentan la concentración de K. Respecto al calcio no se apreció un aporte significativo de los biofertilizantes, aunque se nota un significativo aporte de Magnesio por parte del efluente en el suelo 2.
Efecto de la aplicación del efluente en plantas de tomate a escala de laboratorio
En cuanto a la germinación de las semillas de tomate se obtuvo entre 75 y 98 % de germinación, en ambos tipos de suelo y no se observaron diferencias significativas respecto al control.
Respecto a la altura de las plantas y el número de hojas, se obtuvo que a los 19 días de germinación aún no se encontraron diferencias respecto al control; sin embargo, después de 61 días se hizo significativa esta diferencia (Figura 1). En el suelo 1 no hubo diferencias significativas en cuanto a la altura de las plantas, pero si en el número hojas, donde la aplicación de biofertilizantes favorecieron este parámetro respecto al control, siendo las más beneficiadas las plantas abonadas con el efluente (5 y 10 %), resultado que puede estar provocado por la mayor presencia de nutrientes en el efluente que en el lixiviado. En el suelo 2 si se observaron diferencias significativas en cuanto a la altura de las plantas, siendo las más favorables las fertilizadas con lixiviado y se obtuvo menores resultados para las plantas fertilizadas con efluente. En cuanto al número de hojas esta diferencia es significativa solo para la dosis mínima de efluente (5 %) siendo superior el valor.
De forma general el números de hojas por planta para todos los tratamientos resultó mayor que el control, destacando que el efluente 5 % mostro los mejores resultados, por lo que se confirma el beneficio foliar en las plantas que son tratadas con este tipo de biofertilizantes (20, 21). Estos resultados concuerdan con los publicados por otros autores (13), quienes utilizaron dos dosis de efluente que marcaron diferencias estadísticas para la altura a partir de los 32 días de establecido el cultivo del frijol (Phaseolus vulgaris L.), alcanzándose la mayor altura (0,65 m) y el mayor índice de crecimiento (0,27 m) en el último periodo, resultado que se corresponde además, con el incremento en el crecimiento de las plantas provocado por la aplicación del efluente al suelo (2).
A los 64 días (fin de la experimentación) el número de raíces, fue mejor con la aplicación de efluente 5 % en ambos suelos, por lo que se consideran más robustas (fuertes) estas plantas y adaptables a cambios ambientales y nutricionales. De forma general para ambos suelos la longitud de las raíces no presentó marcada diferencia significativa. Además se observó a los 64 días la floración parcial en el caso del tratamiento en el suelo 2 con lixiviado al 5 % y floración completa con efluente al 5 %. Esto sugiere que hay una influencia positiva (hormonal) en esta etapa vegetativa de la planta con la aplicación de los biofertilizantes.
Efecto de la aplicación del efluente a plantas de tomate (escala de campo)
En la Tabla III se muestran los resultados de la composición química del suelo y del biofertilizante utilizado en el experimento, observando que en los principales parámetros de interés agrícola, el suelo presenta valores inferiores al efluente. De forma general el efluente va aportar materia orgánica (MO), nitrógeno (N), fosforo (PO43-), potasio (K) y sodio (Na), que favorecerían e incrementarían las capacidades agroproductivas del suelo, elevando los valores de producción. Debido a la naturaleza líquida del efluente es lógico encontrar valores de materia seca y fija (MS y MF) superiores en el suelo que en el efluente, al igual que los valores de pH, siendo ligeramente ácidos para este tipo de suelo, y ligeramente básico para el efluente debido al proceso de producción del mismo.
Similar a lo obtenido en los experimentos a escala de laboratorio, respecto al follaje de la planta (número de hojas), a partir de la segunda aplicación se observaron diferencias significativas con respecto al testigo, aunque no entre las diferentes concentraciones del efluente ensayadas (Figura 2).
Las plantas de tomate fueron significativamente más altas a partir de la segunda aplicación del efluente (Figura 3). En cuanto al número de frutos por planta, después de la quinta aplicación se observaron diferencias significativas respecto al testigo, donde el efluente al 5 % mostró los mejores resultados (Figura 4). Resultados similares (22, 23), mostraron un incremento en la cantidad de frutos promedio por plantas con la utilización de Fitomas-E (fertilizante orgánico comercial). La cantidad de frutos por plantas, es un indicador directo del rendimiento del cultivo (22, 23).
La Tabla IV muestra la producción de cada una de las variantes en las diferentes evaluaciones realizadas con diferencias estadísticas entre estas y de estas con el control a partir de la semana cinco de muestreo, donde la mejor variante fue el efluente al 5 % con una media de 33,06 frutos por plantas la cual superó al control en más de 12 frutos, el tratamiento donde se aplicó el efluente al 10 % alcanzó una media superior al control en más de dos frutos promedios por plantas. No obstante, de manera general, estos valores son ligeramente inferiores a los reportados por diferentes investigadores (23), donde se logró un promedio de 40,55 frutos por plantas con la aplicación de Fitomas-E.
Efecto biofungicida del efluente
Experimento No. 1:
Se obtuvo que con excepción del filtrado de T. harzianum A-34 con conidios donde el fitopatógeno presentó un desarrollo superior al testigo no tratado, todos los restantes filtrados al 25 % de concentración en medio PDA redujeron el crecimiento de las colonias de R. solani, similar al resultado obtenido en diversas investigaciones (24), pero con el fitopatógeno fusarium. La aplicación de efluente fue la que tuvo el mejor efecto antagonista, ya que redujo en menos de 24 h el crecimiento de las colonias de R. solani (Figura 5), seguidos de L. lecanii y EM y por último T. harzianum sin conidios. El T. harzianum con conidios no presentó diferencia con el testigo de R. solani. En una investigación similar (25), se enmendó el medio PDA con el 50 % de un filtrado de un producto líquido de T. harzianum A-34 con conidios por vía estática obteniéndose una reducción del 28,4% del diámetro de la colonia de R. solani.
Los filtrados del efluente y ME cuyo uso se está iniciando en Cuba, redujeron el desarrollo de R. solani en un 84,9 % y un 57,8 %, respectivamente, demostrando sus potencialidades para su uso en el manejo de ese hongo. De esta forma se demuestra como indican algunas publicaciones los microorganismos presentes en el efluente y ME si tienen un efecto antagonista sobre fitopatógenos (26). Por otro lado, el filtrado de L. lecanii LV-5, utilizado en Cuba como hongo entomopatógeno llegó a reducir el desarrollo de R. solani hasta un 73,4 %, lo que indica que si bien no es un antagonista con marcada actividad competitiva con los fitopatógenos produce metabolitos que mostraron una actividad mucho más marcada que T. harzianum A-34 y podría evaluarse el posible uso de productos líquidos y de hecho sus metabolitos en el manejo de enfermedades.
Experimento No. 2:
El segundo experimento consistió en aplicar el efluente y los microorganismos eficientes (ME) como productos completos, o sea, sin filtrar, a las placas con medio PDA, donde posteriormente se sembró el fitopatógeno R. Solani. En este caso se cuantificó el crecimiento del fitopatógeno (dígase su capacidad de invasión) en las placas con diferentes concentraciones de ambos bioproductos (Tabla V). Los resultados mostraron que cuando se aplicó ME a concentraciones entre 5 y 25 % el crecimiento de las colonias del fitopatógeno se redujo significativamente, alcanzando valores superiores al 50 % a concentraciones del 10 al 20 % de ME y superior al 70 % a concentración del 25 % de ME. Cuando se evaluó la adición del efluente se obtuvieron resultados similares, solo que con este bioproducto, si bien a la concentración del 25 % se logra semejante reducción que con los ME, en el orden del 70 %, a las concentraciones inferiores del 15 y 20 %, se logran reducciones incluso superiores y que no difieren significativamente de los valores obtenidos con efluente al 25 %, pero si con relación a las más bajas del 5 y 10 %. Es de resaltar que en estos experimentos con los bioproductos completos, se observó el desarrollo de microorganismos en la superficie del medio, por lo que no solo se tuvo el efecto de los metabolitos sino además el efecto de competencia de los microorganismos provenientes de los bioproductos que contribuyeron a limitar el desarrollo del fitopatógeno.
CONCLUSIONES
El estudio comparado del efluente de la digestión anaerobia de estiércol porcino y lixiviado de humus de lombriz permitió discernir su efecto positivo en el cultivo de tomate en diferentes suelos, donde estos fueron mejorados en cuanto a la disponibilidad de materia orgánica y micronutrientes. Se obtuvo mejores resultados con el efluente a bajas concentraciones (5 %) cuando se dispone de suelos pardo sialítico (mullido y cálcico), pero pueden utilizarse indistintamente efluente o el lixiviado cuando se dispone de suelos pardos sialítico (eslítico y húmico). A escala de campo, también se obtuvo un efecto positivo de la aplicación del efluente, ya que favoreció el aumento del número de frutos por planta con solo un 5 % del efluente. El efluente también presentó propiedades biofungicida para el control biológico del fitopatógeno R. solani, pues reduce en más de un 70 % a concentraciones del 15 al 25 % el crecimiento de sus colonias en 24 h. Estos resultados abren un campo de investigación sobre su uso en el tratamiento de semillas, para la aplicación a suelos de semilleros o plantaciones, así como en su evaluación para el manejo de otras enfermedades originadas por microorganismos del suelo y particularmente para el manejo de patógenos foliares tan necesarios en Cuba para la reducción del empleo de fungicidas químicos.
BIBLIOGRAFÍA
1. Hong-Ji, Z.; Li-Fan, S.; Yan-Fei, Z.; Xiao-Li, Z. y Jian-Jun, Q. “Conversion of spent mushroom substrate to biofertilizer using a stress-tolerant phosphate-solubilizing Pichia farinose FL7”. Bioresource Technology, vol. 111, 2012, pp. 410-416, ISSN 0960-8524, DOI 10.1016/j.biortech.2012.02.042.
2. Owamah, H. I.; Dahunsi, S. O.; Oranusi, U. S. y Alfa, M. I. “Fertilizer and sanitary quality of digestate biofertilizer from the co-digestion of food waste and human excreta”. Waste Management, vol. 34, no. 4, 2014, pp. 747-752, ISSN 0956-053X, DOI 10.1016/j.wasman.2014.01.017.
3. Johansen, A.; Carter, M. S.; Jensen, E. S.; Hauggard-Nielsen, H. y Ambus, P. “Effects of digestate from anaerobically digested cattle slurry and plant materials on soil microbial community and emission of CO2 and N2O”. Applied Soil Ecology, vol. 63, 2013, pp. 36-44, ISSN 0929-1393, DOI 10.1016/j.apsoil.2012.09.003.
4. Alburquerque, J. A.; de la Fuente, C.; Campoy, M.; Carrasco, L.; Nájera, I.; Baixauli, C.; Caravaca, F.; Roldán, A.; Cegarra, J. y Bernal, M. P. “Agricultural use of digestate for horticultural crop production and improvement of soil properties”. European Journal of Agronomy, vol. 43, 2012, pp. 119-128, ISSN 1161-0301, DOI 10.1016/j.eja.2012.06.001.
5. NIEA. Anaerobic digestate: End of waste criteria for the production and use of quality outputs from anaerobic digestion of source-segregated biodegradable waste [en línea]. Ed. Northern Ireland Environment Agency (NIEA), 2014, England, 29 p., [Consultado: 18 de noviembre de 2016], Disponible en: <https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/292473/426765_EA_QP_Anaerobic_Digestate_web.pdf>.
6. Grigatti, M.; Di Girolamo, G.; Chincarini, R.; Ciavatta, C. y Barbanti, L. “Potential nitrogen mineralization, plant utilization efficiency and soil CO2 emissions following the addition of anaerobic digested slurries”. Biomass and Bioenergy, vol. 35, no. 11, 2011, pp. 4619-4629, ISSN 0961-9534, DOI 10.1016/j.biombioe.2011.09.007.
7. Alfa, M. I.; Adie, D. B.; Igboro, S. B.; Oranusi, U. S.; Dahunsi, S. O. y Akali, D. M. “Assessment of biofertilizer quality and health implications of anaerobic digestion effluent of cow dung and chicken droppings”. Renewable Energy, vol. 63, 2014, pp. 681-686, ISSN 0960-1481, DOI 10.1016/j.renene.2013.09.049.
8. Garfí, M.; Gelman, P.; Comas, J.; Carrasco, W. y Ferrer, I. “Agricultural reuse of the digestate from low-cost tubular digesters in rural Andean communities”. Waste Management, vol. 31, no. 12, 2011, pp. 2584-2589, ISSN 0956-053X, DOI 10.1016/j.wasman.2011.08.007.
9. Arteaga, M.; Garcés, N.; Novo, R.; Guridi, F.; Pino, J. A.; Acosta, M.; Pasos, M. y Besú, D. “Influencia de la aplicación foliar del bioestimulante liplant sobre algunos indicadores biológicos del suelo: influence of LIPLANT bioestimulant systematic application on some soil biological indicators”. Revista de Protección Vegetal, vol. 22, no. 2, 2007, pp. 110-117, ISSN 1010-2752.
10. Stefanova, N. M.; Rodríguez, M. F.; Muiño, G. B. L. y Villa, G. P. M. “Control biológico del moho azul (Peronospora tabacina Adam) en el cultivo del tabaco (Nicotiana tabacum L.)”. Fitosanidad, vol. 11, no. 4, 2007, pp. 31-36, ISSN 1818-1686.
11. Rodríguez, M. F. y Stefanova, N. M. “Control biológico del tizón temprano (Alternaria solani Sorauer) en el cultivo de la papa (Solanum tuberosum L.) en condiciones de campo”. Fitosanidad, vol. 9, no. 4, 2005, pp. 35-37, ISSN 1562-3009.
12. Sosa, R.; Díaz, Y. M.; Cruz, T. y de la Fuente, J. L. “Diversification and overviews of anaerobic digestion of Cuban pig breeding”. Cuban Journal of Agricultural Science, vol. 48, no. 1, 2014, pp. 67-72, ISSN 2079-3480.
13. Negrin, B. A. y Jiménez, P. Y. “Evaluación del efecto agronómico del biosólido procedente de una planta de tratamiento por digestión anaerobia de residuales pecuarios en el cultivo del frijol (Phaseolus vulgaris L.)”. Cultivos Tropicales, vol. 33, no. 2, 2012, pp. 13-19, ISSN 0258-5936.
14. Rice, E. W. y Bridgewater, L. Standard methods for the examination of water and wastewater. 22.a ed., Ed. American Public Health Association, 2012, Washington, D.C., 1496 p., ISBN 978-0-87553-013-0.
15. Hernández, J. A.; Pérez, J. J. M.; Bosch, I. D. y Castro, S. N. Clasificación de los suelos de Cuba 2015. Ed. Ediciones INCA, 2015, Mayabeque, Cuba, 93 p., ISBN 978-959-7023-77-7.
16. Montgomery, D. C. Design and analysis of experiments [en línea]. 7.a ed., Ed. Jhon Wiley & Sons, 2009, Hoboken, N.J., 656 p., ISBN 978-1-61583-461-7, [Consultado: 18 de noviembre de 2016], Disponible en: <http://books.google.com/books?id=ofnuAAAAMAAJ>.
17. Allen, M. E. Kolmogorov-Smirnov test for discrete distributions [en línea]. Master Thesis, Naval Postgraduate School, marzo de 1976, Monterey, California, 93 p., [Consultado: 26 de mayo de 2016], Disponible en: <http://calhoun.nps.edu/handle/10945/17830>.
18. Duncan, D. B. “Multiple Range and Multiple F Tests”. Biometrics, vol. 11, no. 1, 1955, pp. 1-42, ISSN 0006-341X, DOI 10.2307/3001478.
19. IBM Corporation. IBM SPSS Statistics [en línea]. versión 18.0, [Windows], Ed. IBM Corporation, 2009, U.S, Disponible en: <http://www.ibm.com>.
20. Alburquerque, J. A.; de la Fuente, C.; Ferrer-Costa, A.; Carrasco, L.; Cegarra, J.; Abad, M. y Bernal, M. P. “Assessment of the fertiliser potential of digestates from farm and agroindustrial residues”. Biomass and Bioenergy, vol. 40, 2012, pp. 181-189, ISSN 0961-9534, DOI 10.1016/j.biombioe.2012.02.018.
21. Andruschkewitsch, M.; Wachendorf, C. y Wachendorf, M. “Effects of digestates from different biogas production systems on above and belowground grass growth and the nitrogen status of the plant-soil-system”. Grassland Science, vol. 59, no. 4, 2013, pp. 183-195, ISSN 1744-6961, DOI 10.1111/grs.12028.
22. del Sol, N.; Hernández, M. y Rivas, C. “Effect of Fitomas on the growth and yield of tomato (Solanumly copersicum L.) Riliavariet”. Centro Agrícola, vol. 39, no. 3, 2012, pp. 25-30, ISSN 2072-2001.
23. Díaz-Martín, B. A.; Rodríguez-Pequeño, M. y Torrez-Hernández, L. J. “Respuesta en el crecimiento y rendimiento del tomate (Solanum lycopersicum L.) var. Vyta a la aplicación de diferentes dosis de FitoMas-E”. Centro Agrícola, vol. 40, no. 4, 2013, pp. 25–30, ISSN 2072-2001.
24. Segarra, G.; Casanova, E.; Avilés, M. y Trillas, I. “Trichoderma asperellum Strain T34 Controls Fusarium Wilt Disease in Tomato Plants in Soilless Culture Through Competition for Iron”. Microbial Ecology, vol. 59, no. 1, 2010, pp. 141-149, ISSN 0095-3628, 1432-184X, DOI 10.1007/s00248-009-9545-5.
25. Guigón-López, C.; Guerrero-Prieto, V.; Carvajal-Millán, E.; Ávila-Quezada, G. D.; Bravo-Luna, L.; Ruocco, M.; Lanzuise, S.; Woo, S. y Lorit, M. “Molecular identification of Trichoderma spp. strains, in vitro growth rate and antagonism against plant pathogen fungi”. Revista Mexicana de Fitopatología, vol. 28, no. 1, 2010, pp. 87–96, ISSN 2007-8080.
26. Higa, T. y Parr, J. F. Beneficial and effective microorganisms for a sustainable Agriculture and environment [en línea]. Ed. International Nature Farming Research Center, 1994, Atami, Japan, 16 p., [Consultado: 18 de noviembre de 2016], Disponible en: <http://www.emro-asia.com/data/66.pdf>.
Recibido: 25/11/2015
Aceptado: 09/06/2016
M.Cs. Edelbis López Dávila, Universidad de Sancti Spíritus. Ave de los Mártires #360. CP 60100 Santi Spíritus. Cuba. Email: eldavila@uniss.edu.cu