Efecto de oligosacarinas en el comportamiento de la papa (Solanum tuberosum L.) variedad Romano
Oligosaccharines effect on the behavior of potato (Solanum tuberosum L.) variety Romano
Dr.C. Eduardo Jerez Mompie, M.Cs. Roberqui Martín Martín, Dr.C. Donaldo Morales Guevara, Dr.C. Inés Reynaldo Escobar
Instituto Nacional de Ciencias Agrícolas (INCA), Gaveta postal No.1, San José de las Lajas. Mayabeque, Cuba. CP 32700.
RESUMEN
Para evaluar la influencia de dos oligosacarinas en el crecimiento y desarrollo de plantas de papa, se realizaron dos experimentos durante dos años, que consistieron en aplicar de forma foliar Pectimorf® a los 20, 25 y 30 días después de la plantación, a plantas que se desarrollaron en recipientes de seis litros de capacidad, para conocer su potencialidad en la posible inducción de la emisión de estolones, mientras que en condiciones de campo, se aplicaron de forma foliar dos concentraciones de Quitomax® en dos momentos del ciclo del cultivo: 30 y 50 días después de la plantación. En todos los casos se empleó semilla importada de la variedad Romano para la plantación. En el primer experimento la evaluación se realizó diez días después de la aplicación y en el segundo experimento la evaluación se realizó en la cosecha, para lo cual se determinó la masa de los tubérculos con la que se estimó el rendimiento y el número de los mismos por calibre, así como el total. Los resultados mostraron poca influencia del Pectimorf® en cuanto a la inducción de estolones, aunque sí un mayor número de tubérculos al comparar con las plantas que no se habían tratado. Las concentraciones de Quitomax® permitieron que las plantas alcanzaran un mayor desarrollo, que propició un mayor rendimiento en comparación con el testigo no tratado.
Palabras clave: crecimiento, quitosano, rendimiento, tubérculo.
ABSTRACT
To evaluate the influence of oligosaccharides in the growth and development of potato plants, two experiments for two years were conducted, one of then consisted in foliar application of Pectimorf® at 20, 25 and 30 days after planting. In these case plants were growing in containers of six liter to meet the potential of Pectimorf® in the possible stolon emission induction, whereas under field conditions, were applieding foliar way two concentrations of Quitomax® in two stages of the crop cycle: 30 and 50 days after planting. In all cases, the imported seeds of Roman variety to planting were used. In the first experiment, the evaluation was ten days after the last application, in the second the evaluation was conducted at harvest, for which the mass of the tubers to the yield and the number of them was determined by size, and the total. The results showed little influence in terms Pectimorf® induction runners, although a greater number of tubers when compared with plants had not been treated. Quitomax® concentrations allowed the plants reached a greater development, which led to a higher yield compared to the untreated control.
Key words: growth, chitosan, yield, tuber.
INTRODUCCIÓN
Las oligosacarinas son carbohidratos complejos capaces de modelar el crecimiento y desarrollo de las plantas a bajas concentraciones, algunos actúan como elicitores y son capaces de promover actividad de defensa en las plantas ante la presencia de patógenos (1). En la actualidad se trata incluso de explicar mediante modelos matemáticos la acción de estos compuestos biológicos en las plantas (2).
La papa (Solanum tuberosum L.) es un miembro de las Solanaceae, una familia importante económicamente que incluye otras especies. La papa ocupa un rango ecogeográfico amplio, y es uno de los cultivos más importantes entre los que producen estolones, que bajo condiciones ambientales apropiadas generan tubérculosA.
Considerando las experiencias en otras regiones, donde se busca incrementar la productividad de la papa a costo de una alta inversión en agroquímicos, que a la larga influye negativamente en la economía del productor y en el medio ambiente, es que la producción de papa debería tener un enfoque más ecológico (3), aspecto al cual se le presta una gran atención en los momentos actuales.
Por otra parte, hay que significar que el cultivo de la papa es capaz de producir una gran cantidad de alimento en un periodo corto de tiempo, pero esto dependerá de múltiples factores, tanto del ambiente como internos de la planta. Se ha comprobado que el tratamiento a la semilla para alcanzar un buen grelado del tubérculo garantiza un mayor número de tallos, con lo que a su vez aumentan las producciones si las condiciones post siembra no son adversas al cultivo (4).
La búsqueda de nuevas alternativas que permitan hacer un uso más racional de los recursos, disminuir los costos de producción sin afectar la calidad y los rendimientos de los cultivos, ha propiciado el uso de bioestimulantes del crecimiento de uso agrícola, estos entre otros beneficios, incrementan los rendimientos de los cultivos, la calidad de las cosechas, además de la resistencia a las condiciones de estrés hídrico, salino y altas temperaturas, a la vez que disminuyen el empleo de productos químicos (5).
Teniendo en cuenta estas premisas, el presente trabajo se realizó con el objetivo de evaluar la influencia de dos oligosacarinas (Pectimorf® y QuitoMax®) en el crecimiento y desarrollo de plantas de papa.
MATERIALES Y MÉTODOS
El trabajo se llevó a cabo en dos experimentos distintos durante los años 2014 y 2015, empleando tubérculos semilla de la variedad Romano de procedencia holandesa. Uno en condiciones semicontroladas (recipientes de seis litros de capacidad con dos plantas en cada uno), los que se llenaron con suelo Ferralítico Rojo Eútrico Compactado (6), colocados en medio ambiente, mientras que el otro se realizó en condiciones de campo, que cuenta con el mismo tipo de suelo, en las áreas experimentales del Instituto Nacional de Ciencias Agrícolas.
Las atenciones culturales se realizaron según lo recomendado en el Instructivo Técnico para el cultivo (7), mientras que el riego en condiciones de campo se realizó por aspersión con una máquina de Pivote Central y en el caso de los recipientes de forma manual, asegurando que no existiera falta de humedad. Durante el tiempo que se realizaron los experimentos en el campo se registraron las temperaturas máximas, mínimas y media en la Estación Meteorológica aledaña al área experimental, procesándose los datos de las tres variables de forma decenal.
Los recipientes se dividieron en cuatro grupos homogéneos (10 en cada uno), y se realizaron aplicaciones a las plantas de Pectomiorf® a una concentración de 10 mg L-1 a los 20, 25 y 30 días después de la plantación, mientras que el cuarto grupo correspondió al control sin aplicación, constituyendo estos los tratamientos empleados, los que se distribuyeron mediante un diseño completamente aleatorizado. Al cabo de los diez días de realizada la última aspersión, en cada tratamiento y en el control se evaluó el número de tallos por planta, el número de estolones por tallo y el número de tubérculos por planta. El experimento se plantó en enero del 2014.
El experimento en campo se realizó en el 2014 y 2015, mediante un diseño de Bloques al Azar con tres repeticiones y consistió en asperjar al follaje a los 30 y 50 días después de la plantación, dos preparados de Quitomax® de diferente masa molecular (Q1 de 66,4 Kd y Q2 de 124 Kd) a razón de 300 mL ha-1 y un control sin aplicación, los cuales constituyeron los tratamientos empleados. En el momento de la cosecha se estimó el rendimiento en cada tratamiento expresándose en t ha-1 y la composición por calibres del número de tubérculos (<28, 28-35, 35-45, 45-55 y >55 mm), expresados como porcentajes del total de tubérculos.
Las diferencias entre tratamientos del experimento realizado en recipientes se evaluaron mediante el cálculo del intervalo de confianza de las medias a partir de su error estándar y en el experimento en condiciones de campo mediante un ANOVA de clasificación doble y las medias se compararon por la prueba de rangos Múltiples de Duncan a p<0,05 (8). Todo el procesamiento estadístico de los datos se realizó con el empleo del Programa Statgraphics Plus v. 5.0 (9) y los gráficos se realizaron a través del Programa Sigmaplot v. 11.0.
RESULTADOS Y DISCUSIÓN
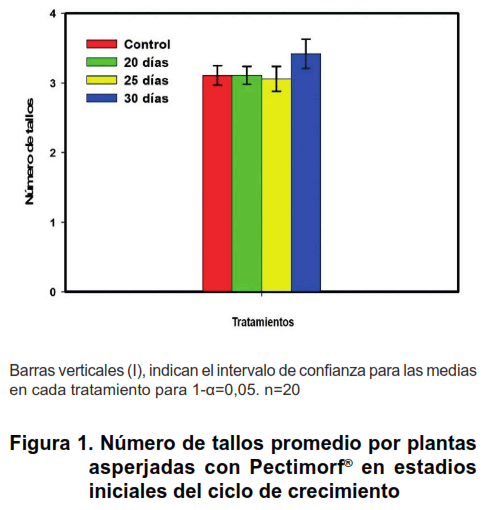
El comportamiento del número de tallos (Figura 1) no mostró diferencias significativas entre tratamientos, los valores estuvieron entre tres y cuatro tallos por planta, resultado que es lógico, si se tiene en cuenta que las aplicaciones se realizaron luego de los 20 días después de la plantación, cuando ya la bro tación había tenido lugar, por lo que el efecto en este sentido debe haber sido poco, como lo demuestran los resultados.
El número de tallos por planta en el cultivo de la papa es una variable que en gran medida está relacionada con el crecimiento en general de las plantas, tanto en superficie foliar y producción de masa seca, como con el rendimiento y si bien en algunos trabajos esto no ha quedado totalmente esclarecido, muchos autoresB lo han corroborado (5, 10, 11). Es de destacar que se debe lograr en todo momento una mayor eficiencia en este proceso, lo que está directamente relacionado con el balance hormonal entre citoquininas y giberelinas (12).
El número de estolones promedios por tallo (Figura 2) estuvo entre cuatro y cinco, fueron mayores en el tratamiento en que se realizó la aplicación foliar a los 30 días después de la plantación, sin diferencias con respecto al control, pero sí con los tratamientos en que se realizó dicha aplicación a los 20 y 25 días; estos dos últimos tratamientos, no mostraron diferencias con respecto al control.
Se destaca que la aplicación a los 30 días, estimuló en alguna medida la emisión de estolones, quizás porque es en ese periodo en el que las plantas se encuentran en dicha fase y por tanto dicha aplicación ejerce un efecto mayor que cuando las plantas son más jóvenes.
Entre las etapas de desarrollo del ciclo de la papa se encuentra el proceso de tuberización. Este es regulado por las características propias de la variedad, la edad de la semilla, los factores ambientales y la acción de fitorreguladores, entre otros. Se considera el inicio de la tuberización a partir del ensanchamiento de los estolones. Este proceso ocurre, dependiendo de la precocidad de la variedad, pero en nuestras condiciones climáticas se verifica en etapas iniciales del crecimiento, donde los asimilados producidos por el follaje son utilizados para el engrosamiento del ápice del estolón e iniciación de la tuberización (13).
El número de tubérculos por planta (Figura 3) mostró que la aplicación del Pectimorf® en los diferentes momentos en que se realizó, incrementó el número de los mismos, respecto al control, con diferencias significativas en relación con este, no así entre los momentos de las aplicaciones, pues entre 20 y 25 días después de la plantación no se encontraron diferencias, tampoco entre las realizadas a los 25 y 30 días, pero sí entre esta última y la primera.
Aun cuando el experimento no llegó hasta la etapa de cosecha, el hecho de mostrar las plantas tratadas respecto al control un mayor número de tubérculos promedio, sin dudas esto aseguraría un mayor rendimiento en esos tratamientos, aunque se denota por los resultados, que no fueron ellos los que mayor cantidad de estolones emitieron. Es de destacar que el engrosamiento de los estolones resultó mayor cuando la aplicación se realizó en estadios más jóvenes de las plantas, es decir, a los 20 y 25 días después de la plantación.
El proceso de la tuberización puede controlarse modificando el aporte de nitrógeno a la planta. Se sabe que este nutriente no afecta la inducción de la tuberización, pero si inhibe la formación del tubérculo después de que la inducción se ha producido, cuando este elemento está en falta, lo cual no debe haber ocurrido en este experimento, pues se siguió en la conducción del mismo lo establecido en los instructivos técnicos del cultivo (10). Por otra parte es conocido que la mayor cantidad de nitrógeno (más del 50 % del total) se absorbe antes del llenado de los tubérculos (14).
En cuanto a la aplicación de productos para la estimulación de la tuberización, se ha comprobado que el balance hormonal juega un papel fundamental en la formación de los tubérculos y en el crecimiento en general, pero resultan más efectivas cuando se hacen en estadios tempranos luego de la plantación, no al tubérculo semilla (15). Por otra parte, plantas de papa inoculadas con rhizobacterias que promueven el crecimiento, ejercen una fuerte influencia en la tuberización de las plantas (16).
El rendimiento estimado en t ha-1 se presenta en la Figura 4, en ambos años, el mayor rendimiento se alcanzó con la aplicación del preparado uno (Q1), la cual no mostró diferencias significativas el primer año con el preparado dos (Q2), pero sí en el segundo año. En ambos años el preparado dos, mostró valores similares al control, sin diferencias significativas entre los dos tratamientos.
Hay que significar que los rendimientos alcanzados en ambas plantaciones resultaron bajos, en el primer caso (plantación del 2014) producto de una siembra tardía, lo cual coincidió con temperaturas más elevadas en los periodos iniciales del crecimiento de las plantas (Figura 6), a pesar de ser una variedad de un potencial productivo elevadoC, mientras que en la segunda plantación (2015) se presentó un ataque de Phytophtora infestans, patógeno que es causante de pérdidas considerables en el rendimiento de la papa y aspecto al que se le presta una esmerada atención en los diferentes países productores de este tubérculoD basado en el control biológico del mismo y el uso de bioproductos.
La aplicación de bioproductos no solo se ha empleado para el control fitosanitario de diferentes patógeno, sino también, con el objetivo de obtener rendimientos aceptables, para lo cual se ha hecho uso de diferentes microorganismos benéficos que contribuyen a elevar la productividad del cultivo (3).
La composición por calibre del número de tubérculos (porcentaje respecto al total) se presenta en la Figura 5. Se denota, que en el tratamiento control, casi el 50 % de los tubérculos se encontraron en el tamaño de 35-45 mm, y no hubo tubérculos mayores de 55 mm, que sí estuvieron presentes en los tratamientos que fueron asperjados con los dos preparados de Quitomax®, lo cual justifica que en estos tratamientos los rendimientos fueran mayores respecto al control en las dos plantaciones realizadas.
El número y tamaño de los tubérculos es una variable importante en la composición del rendimiento de la papa, de ello depende en gran medida la magnitud del mismo, aún cuando de lo que se trate sea de la producción de semilla, entonces la productividad debe valorarse en la cantidad de tubérculos con la calidad necesaria para considerarlos como propágulos para la nueva plantación (17). Es necesario considerar también la nutrición del cultivo, aunque se ha demostrado que con diferentes aplicaciones de fertilizantes las extracciones han sido similares entre tratamientos, no afectándose la calidad de la producción (14), por lo que otros elementos deben ser tenidos en cuenta.
Las condiciones climáticas de la zona en que se desarrollaron los experimentos, resultan variables importantes a valorar para poder hacer una mejor integración de los resultados, más si se tiene en cuenta que la primera plantación, se desarrolló totalmente fuera de época, incluyendo el experimento realizado en condiciones semicontroladas. Por tal motivo se presenta en la Figura 6 el comportamiento de las temperaturas (mínimas, medias y máximas) de cada época en que se desarrollaron los experimentos.
Se destaca que en el momento de la plantación, las temperaturas medias y máximas resultaron más elevadas en el año 2014 y esta condición no favorece el desarrollo del cultivo en los primeros estadios. De igual manera, las mínimas en ese periodo también fueron más altas.
Se señala que temperaturas superiores a 23 0C retardan el inicio de la tuberización, mientras que mayores de 30 0C reducen la fotosíntesis y la tasa de asimilación de carbono, lo que limita la obtención de rendimientos elevados (18).
Por otra parte, independientemente de las exigencias climáticas del cultivo, también se ha comprobado su adaptabilidad a condiciones no óptimas, lo cual le confiere posibilidades para plantarse en diferentes ambientes (19). En sentido general se plantea que la papa es influenciada por los elementos del clima, siendo los más importantes las temperaturas del aire y del suelo, el fotoperiodo y la radiación solar (20). No obstante, las temperaturas durante el periodo inicial del proceso de tuberización resultaron bajas, lo cual favorece este proceso (18).
Desde el punto de vista genético, son importantes los estudios de respuesta genotipo-ambiente, con el objetivo de seleccionar nuevas variedades y conocer su comportamiento frente a diferentes condiciones climáticas (21, 22).
El biopolímero Quitosana ha contado con mucho interés de aplicación en la agricultura debido a su excelente biocompatibilidad, biodegradabilidad y bioactividad (23, 24), al igual que otros bioproductos. El uso de estos, es una estrategia en capacidad de incrementar productividad y calidad de órganos cosechables, siempre que se tenga información sobre los procesos fisiológicos y la demanda hormonal que definen los componentes de rendimiento de un cultivo, lo que permite realizar un estímulo exógeno sin generar un desequilibrio que desencadene respuestas negativas y limite el potencial de producción (25).
En general un factor determinante para la tuberización es la temperatura. Al aumentar esta se presenta mayor grado de inhibición, sobre todo en presencia de un fotoperíodo largo (26).
El efecto negativo de la temperatura sobre la tuberización es diferente de acuerdo a si el estímulo se aplica en el dosel o en el sustrato. Cuando únicamente el dosel se somete a incremento de temperatura la tuberización se ve severamente afectada asociándose a dicho resultado el aumento en el nivel de gas en las zonas meristemáticas. En cambio, cuando el estímulo de alta temperatura se aplica en el substrato no se previene la acción de la señal inductora de tuberización, pero sí se retrasa la formación del tubérculo. Aspecto que además de los señalados pudiera explicar los bajos rendimientos de la primera plantación respecto a la segunda.
CONCLUSIÓN
La aplicación de oligosacarinas estimula en alguna medida la producción de tubérculos y el rendimiento, como resultado del efecto positivo en el crecimiento en general de las plantas.
RECOMENDACIÓN
Para la estimulación del proceso de emisión de estolones se recomienda evaluar otras concentraciones de Pectimorf® y quizás también el momento de hacer las mismas.
NOTAS AL PIE
AGrandellis, C. Identificación de la proteína quinasa dependiente de calcio isoforma 3 de Solanum tuberosum (StCDPK3): estudio genómico, transcripcional y bioquímico. Tesis de Doctorado, Universidad de Buenos Aires, Facultad de Ciencias Exactas y Naturales, Instituto de Investigaciones en Ingeniería genética y Molecular, 2011, Buenos Aires, 100 p.
BMorales, F. S. D. Crecimiento, contenido de azúcares y capacidad de brotación en semilla tubérculo de papa (Solanum tuberosum L.). Tesis de Doctorado, Universidad Autónoma Chapingo, Departamento de Fitotecnia, Instituto de Horticultura, 2011, México, 102 p.
CMINAGRI. Informe técnico de campaña de papa 2014-2015. 2015, La Habana, Cuba, 60 p.
DBustamante, G. A. E. Control biológico del Tizón tardío Phytophthora infestans en papa Solanum tuberosum a través de consorcios microbianos formados por hongos nativos del género Trichoderma sp. Tesis de Maestría, Universidad Politécnica Saleciana, 2015, Cuenca, Ecuador, 59 p.
BIBLIOGRAFÍA
1. Creelman, R. A. y Mullet, J. E. “Oligosaccharins, brassinolides, and jasmonates: nontraditional regulators of plant growth, development, and gene expression”. The Plant Cell, vol. 9, no. 7, 1997, pp. 1211-1223, ISSN 1532-298X, DOI 10.1105/tpc.9.7.1211.
2. Goh, T.; Voβ, U.; Farcot, E.; Bennett, M. J. y Bishopp, A. “Systems biology approaches to understand the role of auxin in root growth and development”. Physiologia Plantarum, vol. 151, no. 1, 2014, pp. 73-82, ISSN 1399-3054, DOI 10.1111/ppl.12162.
3. Mamani-Rojas, P.; Limachi-Villalba, J. y Ortuño-Castro, N. “Uso de microorganismos nativos como promotores de crecimiento y supresores de patógenos en el cultivo de la papa en Bolivia”. Revista Latinoamericana de la Papa, vol. 17, no. 1, 2012, pp. 74-96, ISSN 1853-4961.
4. Torres, G. S.; Cabrera, M. J. L.; Hernández, A. M.; Portela, D. Y. y García, F. E. “El número de tallos por plantón afecta el crecimiento y rendimiento de la papa variedad Cal White”. Centro Agrícola, vol. 39, no. 1, 2012, pp. 11–16, ISSN 0253-5785, 2072-2001.
5. Rodríguez, R. R. C.; Villaverde, F. J. y González, S. P. O. “Influencia de la quitosana en tomate (Solanum lycopersicum, Mill) var. «Amalia»”. Centro Agrícola, vol. 40, no. 2, 2013, pp. 79-84, ISSN 0253-5785, 2072-2001.
6. Hernández, J. A.; Pérez, J. J. M.; Bosch, I. D. y Castro, S. N. Clasificación de los suelos de Cuba 2015. Ed. Ediciones INCA, 2015, Mayabeque, Cuba, 93 p., ISBN 978-959-7023-77-7.
7. Deroncelé, R. Guía técnica para la producción de papa en Cuba. Ed. Liliana, 2000, La Habana, Cuba, 42 p., ISBN 978-959-7111-05-4.
8. Duncan, D. B. “Multiple Range and Multiple F Tests”. Biometrics, vol. 11, no. 1, 1 de marzo de 1955, pp. 1-42, ISSN 0006-341X, DOI 10.2307/3001478.
9. Statistical Graphics Crop. STATGRAPHICS® Plus [en línea]. (ser. Profesional), versión 5.1, [Windows], 2000, Disponible en: <http://www.statgraphics.com/statgraphics/statgraphics.nsf/pd/pdpricing>.
10. Jerez, E. y Martín, R. “Comportamiento del crecimiento y el rendimiento de la variedad de papa (Solanum tuberosum L.) Spunta”. Cultivos Tropicales, vol. 33, no. 4, 2012, pp. 53-58, ISSN 0258-5936.
11. Rojas, L. P. y Seminario, J. F. “Productividad de diez cultivares promisorios de papa chaucha (Solanum tuberosum, grupo Phureja) de la región Cajamarca”. Scientia Agropecuaria, vol. 5, no. 4, 2014, pp. 165-175, ISSN 2077-9917.
12. Sonnewald, S. y Sonnewald, U. “Regulation of potato tuber sprouting”. Planta, vol. 239, no. 1, 2014, pp. 27-38, ISSN 1432-2048, DOI 10.1007/s00425-013-1968-z.
13. Ortiz, L. Y. y Flórez, V. J. “Comparación cuantitativa de ácido abscísico y citoquininas en la tuberización de Solanum tuberosum L. y Solanum phureja Juz. et Buk.”. Agronomía Colombiana, vol. 26, no. 1, 2008, pp. 32-39, ISSN 2357-3732.
14. Sifuentes, E.; Ojeda, W.; Mendoza, C.; Macías, J.; Rúelas, J. del R. y Inzunza, M. A. “Nutrición del cultivo de papa (Solanum tuberosum L.) considerando variabilidad climática en el «Valle del Fuerte», Sinaloa, México”. Revista Mexicana de Ciencias Agrícolas, vol. 4, no. 4, 2013, pp. 585-597, ISSN 2007-0934.
15. Pavlista, A. D. “Growth Regulators Increased Yield of Atlantic Potato”. American Journal of Potato Research, vol. 88, no. 6, 2011, pp. 479-484, ISSN 1099-209X, 1874-9380, DOI 10.1007/s12230-011-9214-3.
16. Anand, M.; Prakash, C.; Baskar, V.; Venkatesh, J.; Nookaraju, A. y Park, S. W. “Plant Growth-Promoting Rhizobacteria Enhance Abiotic Stress Tolerance in Solanum tuberosum Through Inducing Changes in the Expression of ROS-Scavenging Enzymes and Improved Photosynthetic Performance”. Journal of Plant Growth Regulation, vol. 32, no. 2, 1 de junio de 2013, pp. 245-258, ISSN 0721-7595, 1435-8107, DOI 10.1007/s00344-012-9292-6.
17. Pulido, M. S.; Contrera, G. E. y Perea, J. M. “Estudio de los componentes del rendimiento: tamaño de tubérculos y número de tubérculos por planta en cuatro variedades de papa andígena (Solanum tuberosum spp. Andígena)”. Biología en Agronomía, vol. 4, no. 1, 2014, pp. 7-16, ISSN 1853-5216.
18. Rodríguez-Pérez, L. “Ecofisiología del cultivo de la papa (Solanum tuberosum L.)”. Revista Colombiana de Ciencias Hortícolas, vol. 4, no. 1, 2010, pp. 97-108, ISSN 2011-2173, DOI 10.17584/rcch.2010v4i1.1229.
19. Solís, C. S.; Vanegas, L.; Méndez, J.; Cadenas, W.; Castro, M.; Pavón, W. y Alemán, B. “Comportamiento de tres variedades de papa (Solanum tuberosum L.) en zonas de poca altitud de clima cálido en Nicaragua”. Revista Latinoamericana de la Papa, vol. 18, no. 1, 2014, pp. 157-172, ISSN 1853-4961.
20. Roa, S.; Barboza, C. y Zambrano, A. “Estabilidad del rendimiento de variedades de papa (Solanum tuberosum L.) para procesamiento industrial en el estado Táchira, Venezuela”. Revista de la Facultad de Agronomía de la Universidad del Zulia, vol. 27, no. 2, 2010, pp. 173-192, ISSN 1690-9763.
21. Haynes, K. G.; Gergela, D. M.; Hutchinson, C. M.; Yencho, G. C.; Clough, M. E.; Henninger, M. R.; Halseth, D. E.; Sandsted, E.; Porter, G. A. y Ocaya, P. C. “Early generation selection at multiple locations may identify potato parents that produce more widely adapted progeny”. Euphytica, vol. 186, no. 2, 2012, pp. 573-583, ISSN 0014-2336, 1573-5060, DOI 10.1007/s10681-012-0685-1.
22. Salomón, J. L.; Castillo, J. G.; Arzuaga, J. A.; Torres, W.; Caballero, A.; Varela, M. y Hernández, V. M. “Análisis de la interacción progenie-ambiente con minitubérculos a partir de semilla sexual de papa (Solanum tuberosum, L.) en Cuba”. Cultivos Tropicales, vol. 36, no. 2, 2015, pp. 83-89, ISSN 0258-5936.
23. Ramos, L. R.; Montenegro, T. y Pereira, N. “Perspectivas para o uso da quitosana na agricultura”. Revista Iberoamericana de Polímeros, vol. 12, no. 4, 2011, pp. 195–215, ISSN 0121-6651.
24. Katiyar, D.; Hemantaranjan, A. y Singh, B. “Chitosan as a promising natural compound to enhance potential physiological responses in plant: a review”. Indian Journal of Plant Physiology, vol. 20, no. 1, 2015, pp. 1-9, ISSN 0019-5502, 0974-0252, DOI 10.1007/s40502-015-0139-6.
25. Germán, M. y Orozco, J. “Bioestimulación arysta lifescience. Mensaje hacia la productividad”. En: XXVI Congreso Latinoamericano de la Papa-ALAP. «Papa, alimento ayer, hoy y siempre», Mar del Plata, 2014, pp. 251-253, ISBN 978-987-45615-0-3.
26. Jackson, N. “Multiple signaling pathways control tuber induction in potato”. Plant Physiology, vol. 119, no. 1, 1999, pp. 1-8, ISSN 1532-2548.
Recibido: 04/11/2015
Aceptado: 04/08/2016
Dr.C. Eduardo Jerez Mompie, Instituto Nacional de Ciencias Agrícolas (INCA), Gaveta postal No.1, San José de las Lajas. Mayabeque, Cuba. CP 32700. Email: ejerez@inca.edu.cu