Cuantificación de la fijación biológica de nitrógeno en Canavalia ensiformis crecida en un suelo pardo mullido carbonatado mediante los métodos de abundancia natural de 15N y diferencia de N total
Quantification of the biological fixation of nitrogen in Canavalia ensiformis by the methods of natural abundance of 15N and difference of total N
Dra.C. Gloria M. Martín Alonso,I M.Cs. Yonger Tamayo Aguilar,II M.Cs. Ionel Hernández Forte,I Dr.C. Mario Varela Nualles,I Dr.C. Ednaldo da Silva AraujoIII
IInstituto Nacional de Ciencias Agrícolas. Gaveta Postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700.
IIFacultad Agroforestal de Montaña, Universidad de Guantánamo, Carretera a Santiago de Cuba, Km 2 ½ Guantánamo, Cuba.
IIIEmbrapa Agrobiología, BR 465, km 7, CEP 23.851-970, Seropédica, Río de Janeiro, Brasil. Caixa Postal 74505.
RESUMEN
En el presente trabajo, se trazaron como objetivos evaluar el crecimiento y acumulación de N en Canavalia ensiformis, crecida en un suelo Pardo mullido carbonatado del municipio El Salvador, provincia Guantánamo, coinoculada con cuatro aislados de Rhizobium y dos cepas de HMA, así como cuantificar el proceso de fijación simbiótica de nitrógeno de esta especie, mediante los métodos de la abundancia natural de 15N y la diferencia de N total. El crecimiento en masa seca y la absorción de N de la canavalia sembrada en monocultivo fue superior en presencia del aislado de Rhizobium Can 5, coinoculado con Rhizoglomus intraradices, plantas que realizaron una FBN que oscila de 59 a 72 kg ha-1 en el período poco lluvioso y lluvioso, respectivamente. Los métodos de cuantificación de la FBN, por la diferencia de N total y abundancia natural de 15N fueron semejantes entre sí, aunque la diferencia de N total sobreestima los valores de cuantificación respecto a la abundancia natural.
Palabras clave: abonos verdes, coinoculación, fijación biológica del nitrógeno, micorrizas, Rhizobium.
ABSTRACT
In this work were traced as objectives to evaluate the growth and N accumulation in Canavalia ensiformis, grown in a Cambisol soil of El Salvador municipality, county of Guantánamo, coinoculated with four isolated of Rhizobium and two strains of HMA, as well as to quantify the process of nitrogen simbiotic fixation of this species, by the methods of the natural abundance of 15N and the difference of total N. The dry mass growth and the N absorption of the jackbean sowed in monoculture were superior in presence of the isolated of Rhizobium Can 5, coinoculated with Rhizoglomus intraradices, in these plants, the BNF oscillated from 59 to 72 kg ha-1 in the dry and rainy period, respectively. The methods of BNF quantification, difference of total N and natural abundance of 15N were similar to each other, although the difference of total N overestimates the quantification values regarding the natural abundance.
Key words: green manures, coinoculation, biological fixation of the nitrogen, mycorrhizae, Rhizobium.
INTRODUCCIÓN
El nitrógeno (N) es frecuentemente el principal nutriente limitante para la mayoría de las especies cultivadas. La manipulación con éxito de la incorporación del N atmosférico (N2) a través del proceso de la fijación biológica del N (FBN) es una práctica agrícola económicamente viable y ambientalmente benéfica. El empleo de especies fijadoras de N en los sistemas agrícolas reduce la necesidad de fertilizantes nitrogenados y mejora las condiciones del suelo (1).
Una forma sostenible de incorporar N a los sistemas agrícolas es la inserción dentro de las rotaciones de cultivos de plantas que establezcan simbiosis con bacterias fijadoras de nitrógeno presentes en el suelo, capaces de realizar la fijación biológica de nitrógeno. Entre estos tipos de plantas se encuentran las leguminosas, que se emplean como abonos verdes y cultivos de cobertura, capaces de mantener o mejorar las características físicas, químicas y biológicas del suelo, lo cual es importante desde el punto de vista de ahorro de fertilizantes nitrogenados y de la reducción de los costos de producciones (2).
A pesar de la importancia de las leguminosas en la producción y en la economía del nitrógeno, en la cuantificación de la FBN se han utilizado diferentes metodologías; sin embargo, aún no se cuenta con un único método apropiado para la determinación de dicho proceso, debido a que no existe información precisa sobre cual es la real capacidad de fijación de dicho elemento. Cada uno de estos métodos tiene ventajas y limitaciones, los mismos pueden depender de la disponibilidad y la adecuada determinación de la FBN para cualquier especie de leguminosa cultivada bajo todas las posibles variantes de suelo y ambientesA. La evaluación y cuantificación de la FBN, se basa fundamentalmente en el incremento de la producción de materia seca, diferencias en el rendimiento de N total, la nodulación, los solutos en el xilema, la actividad enzimática (reducción de acetileno) y la utilización de 15N. La selección de uno de ellos, depende básicamente del objetivo experimental que se persigue (3).
La generalidad de los métodos desarrollados hasta el presente intenta un acercamiento para tener una idea aproximada del aporte de N procedente de la atmósfera. En todos los casos y sistemas agrícolas, se emplean plantas de referencias no fijadoras, con semejante capacidad de extracción de N del suelo, para diferenciar las diferentes fuentes del elemento en el sistema agrícola que se estudia.
En el presente trabajo, se trazaron como objetivos evaluar el crecimiento y acumulación de N en Canavalia ensiformis, crecida en un suelo Pardo mullido carbonatado del municipio El Salvador, provincia Guantánamo, coinoculada con cuatro aislados de Rhizobium y dos cepas de HMA; así como, cuantificar el proceso de fijación simbiótica de nitrógeno de esta especie, mediante los métodos de la abundancia natural de 15N y la diferencia de N total.
MATERIALES Y MÉTODOS
Se llevaron a cabo dos experimentos de campo en períodos diferentes (período lluvioso y período poco lluvioso) desde el 2010 a 2011, sobre un suelo Pardo Sialítico mullido carbonatado (4), en dos áreas productivas pertenecientes al municipio El Salvador, provincia Guantánamo.
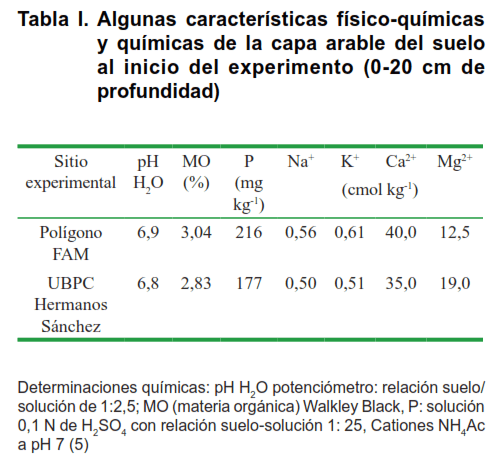
El primer experimento se desarrolló en el polígono docente de la Facultad Agroforestal de Montaña situado, en el km 6 ½, carretera Guantánamo - El Salvador, perteneciente a la Universidad de Guantánamo, en el período lluvioso (abril a julio de 2010). El segundo experimento se desarrolló en la UBPC “Hermanos Sánchez”, que se encuentra ubicada en la porción este, Km 4 ½ carretera Guantánamo – El Salvador, perteneciente a la Granja Agropecuaria Honduras, en el período poco lluvioso (noviembre de 2010 hasta febrero de 2011). Las características físico – químicas y químicas principales del suelo se resumen en la Tabla I.
Las características del suelo para los dos experimentos fueron similares, con el pH ligeramente ácido y contenido medio de materia orgánica (MO). El fósforo (P) fue alto y probablemente se debió al método analítico que se utilizó para su determinación; que contiene una solución extraente de ácido sulfúrico que al reaccionar con el carbonato y el calcio, se libera el mencionado elemento hacia la solución del suelo y por eso se sobreestima la cantidad del mismo. Los contenidos de potasio (K), calcio (Ca), magnesio (Mg) y sodio (Na) tuvieron valores altos para este suelo; sin embargo, el Na solo ocupó el 1% del complejo de intercambio, por lo que no manifiesta efectos adversos sobre los cultivos.
Diseño experimental
Se utilizó un área de 0,11 ha, distribuidas en 60 parcelas para ambas campañas, cada parcela experimental contó con cuatro surcos a una distancia de 0,70 m de camellón por 4 m de largo para un área de 11,2 m2. La canavalia se sembró de forma manual, a dos semillas por nido, a una distancia de narigón de 0,30 m. Las atenciones culturales se realizaron según las recomendaciones establecidas para Cuba (6).
Para la toma de las muestras se seleccionaron, en el área de cálculo (dos surcos centrales) tres plantas completas por metro lineal, incluyendo el suelo de la rizosfera y las raicillas de las plantas, por cada tratamiento y réplica, dejando los dos surcos externos como área de borde, a los 70 días después de la germinación, durante la etapa de floración. En el caso de las plantas de referencia se tomaron las plantas que crecían en 1 m2 a un costado de las parcelas de canavalia, tomándose cuatro réplicas.
En ambos períodos se empleó un diseño de bloques al azar con arreglo bifactorial y cuatro réplicas. Se estudiaron cinco niveles del factor inoculación de Rhizobium (cuatro aislados de Rhizobium más un tratamiento sin inoculación) y tres niveles del factor inoculación micorrízica (dos cepas y un testigo sin inoculación), para un total de quince tratamientos. Como planta de referencia se empleó Megathyrsus maximus, basónimo Panicum maximum (yerba de guinea), que crece como arvense en las áreas experimentales.
Métodos de inoculación de los biofertilizantes empleados
Como inoculantes micorrízicos se utilizaron las cepas Glomus cubense (Y. Rodr. y Dalpé), INCAM - 4 (7), y Rhizoglomus intraradices (Smith y Schenck), INCAM - 11 (8), procedentes de la colección de hongos micorrízicos arbusculares (HMA) del Departamento de Biofertilizantes y Nutrición de las Plantas, del Instituto Nacional de Ciencias Agrícolas (INCA). Las cepas se encontraban conservadas en un sustrato desarrollado para estos fines por el laboratorio de micorrizas del INCA (Registro de patente No. 2264) a 4 ºC. Los inóculos de HMA utilizados en los experimentos poseían un título promedio de 50 esporas g-1 de suelo inoculante, certificado en el Laboratorio de Micorrizas del INCA.
Como inoculante bacteriano se utilizaron cuatro aislados de Rhizobium (Can 2, Can 3, Can 4 y Can 5), provenientes de nódulos de canavalia y pertenecientes a la colección de cepas de rizobios del Departamento de Fisiología del Instituto Nacional de Ciencias Agrícolas (INCA), a una concentración de 107 a 108 UFC g-1 (9).
La coinoculación de estos biofertilizantes se realizó en el momento de la siembra, por el método de recubrimiento de las semillas (10), utilizando una dosis de 5,95 kg ha-1 del inoculante micorrízico, equivalente al 10 % del peso de las semillas y 100 g de cada inoculante bacteriano. Primeramente se hizo una pasta homogénea, en una proporción de 1 kg de inoculante micorrízico por cada 10 kg de semilla con las cepas de HMA separadas y posteriormente se les añadió cada aislado de Rhizobium. La inoculación simple del inóculo bacteriano se realizó mediante una solución azucarada, luego se recubrió la semilla hasta quedar cubierta completamente, se pusieron a secar en la sombra de 5 a 10 minutos y posteriormente se procedió a la siembra.
Evaluaciones realizadas y metodologías empleadas
Masa seca aérea
Para determinar la masa seca aérea (t ha-1), se tomaron los órganos de la parte aérea de las plantas (hojas y tallos). Se pesó cada órgano (g por planta) en conjunto y luego por separado en una balanza Sartorius digital METTLER, de ahí, se tomó una fracción de 100 gramos y se puso a secar en la estufa a 70 ºC hasta alcanzar masa constante, determinándose la masa seca de cada órgano y se expresó en t ha-1.
Contenido de N
La concentración de N se determinó como porcentaje de la masa seca de la parte aérea mediante la digestión húmeda con H2SO4 + Se y a través de la metodología de Nessler (5). La extracción de N (kg ha-1) se calculó a partir de los datos de la masa seca de la parte aérea y su correspondiente concentración del elemento (% N), por la siguiente fórmula:
Extracción de N = MS PA x Conc N
100
donde: MS PA = masa seca parte aérea (t ha-1)
Conc N = concentración (% N) del elemento en la masa seca de la parte aérea
A partir de estos datos, se calculó el porcentaje de FBN por el método de la diferencia de N total mediante la fórmula (3):
% FBN = Contenido N Fix – Contenido N Ref x 100
Contenido N Fix
donde: Fix = planta fijadora,
Ref = planta no fijadora
Cuantificación de la abundancia natural de 15N
La estimación del porcentaje de FBN se calculó a partir de la abundancia natural de 15N de la leguminosa y de la planta de referencia (yerba de guinea), mediante la siguiente ecuación (11):
% FBN = ( δ 15N ref – δ 15N fix) x 100
(δ 15N fix – B)
donde: δ 15N ref = abundancia natural de 15N de la planta de referencia
δ 15N fix = abundancia natural de 15N de la planta leguminosa
B = abundancia de 15N de la misma leguminosa crecida exclusivamente con N proveniente de la FBN. En el presente estudio el valor utilizado fue de -1,35 (12).
Análisis estadístico
Los resultados fueron procesados a través de un análisis de varianza (ANOVA) de clasificación doble, teniéndose en consideración el efecto de los factores y su interacción. Las medias fueron comparadas mediante la dócima de Duncan (13), para un 5 % de significación, después de verificarse que cumplían con el ajuste de distribución normal mediante la prueba de Kolmogorov-Smirnov (14), y de homogeneidad de varianza por la prueba de Levene (15).
Para el caso de los resultados de la cuantificación de la FBN (expresados en kg ha-1), se realizó un análisis de comparación de muestras pareadas, mediante la prueba t (α = 0,05), planteando como hipótesis nula que las muestras son iguales y como hipótesis alternativa que las muestras difieren entre sí. Todos los análisis estadísticos se realizaron mediante el paquete estadístico STATGRAPHICS Centurión XV (16).
RESULTADOS Y DISCUSIÓN
Al analizar el efecto de la coinoculación Rhizobium–HMA sobre la masa seca aérea de canavalia, se observó interacción entre los factores de estudio a los 70 días después de germinada. La inoculación de R. intraradices combinada con el aislado Can 5 propició un incremento del indicador anteriormente mencionado, el cual se manifestó de forma superior con respecto al resto de las demás cepas; ello permitió que se obtuvieran rendimientos de 7,12 y 6,2 t ha-1 de masa seca aérea para ambos períodos (Figura).
Por otra parte, se encontró que la cepa R. intraradices en los tratamientos sin inoculación bacteriana y combinada con el aislado Can 4, mostraron el segundo mejor efecto positivo en relación a los demás tratamientos en los dos momentos estudiados; mientras que con la aplicación simple y combinada de Rhizobium y G. cubense, disminuyó la producción de masa seca aérea a 4,57 y 4,27 t ha-1 respectivamente, lo que indica que esta cepa de HMA manifestó menor efecto simbiótico que R. intraradices.
De forma general, se observó que la mayor producción de masa seca aérea se obtuvo en el período lluvioso, resultados que están en correspondencia con días largos y con altas precipitaciones, en este caso osciló entre 164 y 190 mm en la región, lo que favoreció el incremento vegetativo de esta especie en un período menos prolongado. Sin embargo, en el período poco lluvioso en el que las precipitaciones oscilaron entre 65,9 a 96 mm, con días cortos y bajas temperaturas, hubo una disminución de producción del indicador antes mencionado. Este resultado era de esperar, ya que en resultados experimentales obtenidos en estudios con otras leguminosas se ha demostrado que las mismas crecen más rápido en el verano, al igual que acumulan más nutrientes, debido al aumento de la luz solar y de la humedad en esta época del año. Asimismo, se conoce que al aumentar las precipitaciones se propicia que se intensifique el crecimiento de las plantas empleadas como abono verde (17); por ende, a mayor producción de fitomasa, se incrementa el contenido de nutrientes.
De igual forma, se ha informado que la adecuada inoculación de una leguminosa con cepas efectivas, provoca un aumento de la masa aérea de las plantas (18), aunque numerosos reportes indican que canavalia es un género promiscuo que puede establecer simbiosis efectiva con varias cepas de Rhizobium (9).
En este sentido, se han reportado resultados positivos de la inoculación con G. cubense, –cepa INCAM-4–, sobre el funcionamiento micorrízico de canavalia y su efecto de permanencia en el cultivo del maíz para dos campañas diferentes – primavera y frío –. El crecimiento de las plantas de esta especie fue superior en primavera con relación al invierno, alcanzando entre 2,24 – 4,58 t ha-1 y 2,82 – 5,38 t ha-1 de masa seca sin y con inoculación micorrízica respectivamente, en presencia de un bajo número inicial de esporas nativas en el suelo y sin aplicaciones previas del inoculante micorrízico. En relación a la campaña de frío, la producción de masa seca disminuyó entre 1,34 – 1,35 t ha-1 y 1,60 – 1,70 t ha-1 respectivamente (19). No obstante, es válido señalar que los resultados informados por estos autores, son inferiores a los encontrados en esta investigación, debido a que las condiciones edafoclimáticas fueron diferentes y pudieron influir, tanto en el desarrollo de las plantas, como en las actividades simbióticas de los microorganismos.
En función de lo anteriormente mencionado, se ha reportado que en plantas de soya (Glycine max) los valores de masa seca de la parte aérea fueron superiores cuando se usó la coinoculación Bradyrhizobium elkanii – HMA, los mismos oscilaron entre 8,68 – 15,48 g por planta, aspecto este que demuestra la importancia agronómica de la práctica de la coinoculación Rhizobium-HMA en leguminosas (20).
Asimismo, en investigaciones realizadas en diferentes tipos de suelo y variadas combinaciones de coinoculación de aislados de Rhizobium y cepas de HMA en canavalia, se logran resultados significativos; por ejemplo en suelos Pardos sin carbonatos, se pudo constatar que se ve beneficiado su crecimiento y desarrollo, independientemente del indicador evaluado. En este sentido, el efecto de la coinoculación del aislado Can 5 y G. hoi – like propició un incremento en la altura de la planta, no siendo así para la combinación de la cepa Can 2003a con G. hoi – like,con la cual se alcanzó el menor valor. Para el caso de la masa fresca, el mayor aumento se alcanzó con la combinación Can 2003b - R. intraradices; sin embargo, este indicador se deprimió significativamente cuando se utilizó G. hoi – like y el aislado Can 5 (21). De igual forma ocurrió en el suelo Ferralítico Rojo, pero con la combinación del aislado Can 2 y G. cubense; mientras que para el caso del suelo Gley Nodular Ferruginoso, el mejor comportamiento se obtuvo con la coinoculación de los aislados Can 3, Can 4 y Can 5 y Funneliformis mosseae (22).
Estos mismos autores reportan resultados de masa seca de canavalia sembrada en verano, –época óptima–, en condiciones de altas temperaturas y humedad, en la cual tienen un crecimiento exuberante. Dichos valores oscilaron entre 2,5 a 10 t ha-1.
En la Tabla II se muestra el efecto de la coinoculación sobre el contenido de N de canavalia en las dos campañas. La combinación R. intraradices con el aislado Can 5 mostró de forma reiterada los mejores resultados sobre la extracción de nitrógeno de canavalia, existiendo interacción entre los factores en estudio, con valores de 136 kg ha-1 para el período lluvioso y de 93,44 kg ha-1 para el poco lluvioso, en correspondencia con los resultados obtenidos en la Figura.
Se debe destacar que se observó un incremento de este indicador en presencia de R. intraradices sin inoculación de rizobios, con respecto a los aislados Can 2, Can 3 y Can 4 para ambos períodos, debido a la aparente existencia de cepas residentes de Rhizobium, que probablemente fueron más efectivas en establecer la simbiosis en presencia de R. intraradices, que los aislados inoculados, exceptuando a Can 5. Asimismo, se refleja este incremento en los tratamientos sin inoculación bacteriana y sin HMA, posiblemente debido a la compatibilidad de cepas residentes, tanto de Rhizobium como de HMA, capaces de establecer simbiosis con el macrosimbionte, tan efectivas como las coinoculadas.
Otra de las causas que pudieron influir en estos resultados fue el efecto de la simbiosis HMA – leguminosa, especialmente el de la cepa R. intraradices, que ha sido la más recomendada para este tipo de suelo (23), ya que pudo haber incidido de forma tal que se beneficien los procesos de absorción de nutrientes, provocando el mayor crecimiento de la canavalia. En este sentido, se plantea que las asociaciones de Rhizobium – micorrizas arbusculares actúan sinérgicamente en los niveles de nutrición mineral y crecimiento de las plantas. El principal efecto de los HMA de realzar la actividad de Rhizobium es a través de una estimulación generalizada de la nutrición del hospedante, aunque pueden ocurrir algunos efectos más localizados a nivel de raíz o de nódulo (24), debido a que la doble inoculación elicita un efecto sinérgico con respecto a la colonización de ambos microorganismos (25).
También pudo haber influido en este comportamiento la fotoperiodicidad, característica propia de este cultivo, que le permite crecer más en condiciones de días largos, elevadas temperaturas y precipitaciones, aspecto peculiar de la campaña de primavera o época de lluvia del clima de Cuba.
En Cuba, se ha reportado un incremento en los contenidos de nutrientes en canavalia como respuesta directa a la inoculación con G. cubense en suelo Ferralítico Rojo, con respecto al testigo sin inoculación, dado a los efectos que tienen los HMA en la mejora de la absorción y el contenido de nutrientes por parte de la planta hospedera (19).
Con respecto a la extracción de nutrientes se conoce que las leguminosas presentan más N que cualquier otro cultivo de cobertura, lo que resulta en un importante aporte de este elemento al sistema suelo – planta después del corte de los abonos verdes (18).
Cuantificación de la fijación biológica del N por Canavalia ensiformis
En la Tabla III se presenta el resultado de la cuantificación del proceso de fijación biológica del nitrógeno, determinado por los métodos de la diferencia de N total y la abundancia natural de 15N.
El resultado de la cuantificación de la FBN en el período lluvioso se mantuvo por encima del 40 % en el grupo de tratamientos sin inoculación micorrízica, destacándose la cepa Can 5. En el grupo de tratamientos con inoculación micorrízica, se pudo evidenciar el mejor comportamiento y los mayores porcentajes de fijación con la especie R. intraradices; resultado esperado, considerándose que es la reportada como la más eficiente para estas condiciones edáficas (26). Similares resultados se encontraron al evaluar el proceso mediante el método de la abundancia natural de 15N. En la mayoría de los casos salvo algunas excepciones, el método cuantificó porcentajes de N fijado, superiores a los evaluados por el método de la diferencia de N total.
En ambos métodos, los valores más bajos de cuantificación se detectaron en los tratamientos sin inoculación de cepas de rizobios. Resultado que evidencia la baja eficiencia de los rizobios nativos del suelo en realizar este proceso en simbiosis con canavalia y reitera las ventajas de proceder a la inoculación con cepas eficientes de esta leguminosa, para garantizar así un mayor aporte del elemento al suelo. Al respecto se plantea que la inoculación de leguminosas con cepas eficientes de Rhizobium pueden incrementar el proceso de FBN hasta en un 30 % (18).
De igual forma ocurrió cuando se evaluó el proceso en el período poco lluvioso, aunque las cantidades cuantificadas fueron inferiores a las obtenidas en el período lluvioso, lo cual es un comportamiento lógico, si se tiene en cuenta la estacionalidad de canavalia. En el período poco lluvioso, con días cortos, el crecimiento disminuye en comparación al período lluvioso (17) y el proceso de fijación biológica se reduce por efecto de la disminución de la disponibilidad de aguaB.
En concordancia con estos resultados, se conoce que algunas especies de leguminosas tropicales utilizadas como abonos verdes en Brasil, pueden hacer un elevado aporte de N al sistema vía FBN, debido fundamentalmente a las altas densidades de plantación. En el caso de canavalia, hasta el 80 % de este N proveniente de la FBN, cuantificado por el método de la abundancia natural de 15N (18). Para las condiciones de Cuba, se ha reportado que esta especie cuando crece en suelo Ferralítico Rojo puede ser capaz de tener el 62 % del N foliar derivado del proceso de FBN, lo cual es el equivalente a más de 80 kg ha-1 de N derivado del aire, ratificando la importancia de esta leguminosa como sustituta de la fertilización nitrogenada en los sistemas agrícolas (27).
Al hacer un análisis de las muestras pareadas de la cuantificación de la FBN, expresada en kg ha-1, se observó un valor p superior a 0,05 lo que demuestra que las muestras son semejantes. Esto quiere decir que ambos métodos son válidos para determinar la cuantificación del proceso de la FBN, lo que valida el empleo del método de la diferencia de N total en las condiciones experimentales bajo las que se realizaron las determinaciones.
CONCLUSIONES
El crecimiento en masa seca y la absorción de N de la canavalia sembrada en monocultivo en un suelo Pardo Sialítico mullido carbonatado fue superior en presencia del aislado de Rhizobium Can 5, coinoculado con Rhizoglomus intraradices.
Las plantas de canavalia coinoculadas con el aislado de Rhizobium Can 5 y Rhizoglomus intraradices realizan una FBN que oscila de 59 a 72 kg ha-1 en el período poco lluvioso y lluvioso, respectivamente.
Los métodos de cuantificación de la FBN, por la diferencia de N total y abundancia natural de 15N son semejantes entre sí, aunque la diferencia de N total sobreestima los valores de cuantificación respecto a la abundancia natural.
NOTAS AL PIE
AZapata, H. I. Acumulación de materia seca y fijación biológica de Nitrógeno en diferentes especies del género Lupinus cultivadas en suelos de Zapopan, Jalisco [en línea]. Tesis de Maestría, Universidad de Guadalajara, 2015, Jalisco, México, 92 p., [Consultado: 31 de enero de 2015], Disponible en: http://biblioteca.cucba.udg.mx:8080/xmlui/bitstream/handle/123456789/5926/Zapata_Hernandez_Isidro.pdf?sequence=1
BFreixas, C. J. A. Influencia de los inoculantes a base de Bradyrhizobium elkanii ICA 8001, sobre la fijación biológica del nitrógeno en plantas de soya (Glycine max (L.) Merr.), con y sin déficit hídrico. Tesis de Maestría, Instituto Nacional de Ciencias Agrícolas, 2011, Mayabeque, Cuba, 55 p.
BIBLIOGRAFÍA
1. Rossi, G. y de Camargo, P. R. Ecofisiologia dos Adubos Verdes [en línea]. (ser. Produtor Rural, no. ser. 51), Ed. Universidade de São Paulo - Escola Superior de Agricultura «Luiz de Queiroz», 2012, Piracicaba, 70 p., ISSN 1414-4530, [Consultado: 31 de enero de 2017], Disponible en: <http://www4.esalq.usp.br/biblioteca/sites/www4.esalq.usp.br.biblioteca/files/publicacoes-a-venda/pdf/SPR51.pdf>.
2. Fernández, R.; Matías, S. M.; Uhaldegaray, A. Q. y Elke, N. “Estudio de la contribución de nitrógeno por parte de los cultivos de cobertura al cultivo de maíz”. Informaciones Agronómicas de Hispanoamérica, no. 9, 2013, pp. 12-16, ISSN 2222-0178.
3. de Resende, A. S.; Alves, B. J. R.; Boddey, R. M. y Urquiaga, S. “Técnicas utilizadas na quantificação da fixação biológica de nitrogênio”. Embrapa Agrobiología, Seropédica, no. 165, 2003, p. 26, ISSN 1517-8498.
4. Hernández, J. A.; Pérez, J. M.; Bosch, D.; Rivero, L.; Camacho, E.; Ruíz, J.; Salgado, E. J.; Marsán, R.; Obregón, A.; Torres, J. M.; Gonzáles, J. E.; Orellana, R.; Paneque, J.; Ruiz, J. M.; Mesa, A.; Fuentes, E.; Durán, J. L.; Pena, J.; Cid, G.; Ponce de León, D.; Hernández, M.; Frómeta, E.; Fernández, L.; Garcés, N.; Morales, M.; Suárez, E. y Martínez, E. Nueva versión de clasificación genética de los suelos de Cuba. Ed. AGROINFOR, 1999, La Habana, Cuba, 64 p., ISBN 959-246-022-1.
5. Paneque, P. V. M.; Calaña, N. J. M.; Calderón, V. M.; Borges, B. Y.; Hernández, G. T. C. y Caruncho, C. M. Manual de técnicas analíticas para análisis de suelo, foliar, abonos orgánicos y fertilizantes químicos [en línea]. Ed. Ediciones INCA, 2010, La Habana, Cuba, 157 p., ISBN 978-959-7023-51-7, [Consultado: 27 de enero de 2016], Disponible en: <http://mst.ama.cu/578/>.
6. García, M.; Treto, E. y Álvarez, M. “Época de siembra más adecuada para especies promisorias de abonos verdes en las condiciones de Cuba”. Cultivos Tropicales, vol. 23, no. 1, 2002, pp. 5-14, ISSN 1819-4087.
7. Rodríguez, Y.; Dalpé, Y.; Séguin, S.; Fernández, K.; Fernández, F. y Rivera, R. A. “Glomus cubense sp. nov., an arbuscular mycorrhizal fungus from Cuba”. Mycotaxon, vol. 118, no. 1, 2012, pp. 337-347, ISSN 0093-4666, 2154-8889, DOI 10.5248/118.337.
8. Sieverding, E.; da Silva, G. A.; Berndt, R. y Oehl, F. “Rhizoglomus, a new genus of the Glomeraceae”. Mycotaxon, vol. 129, no. 2, 2014, pp. 373-386, ISSN 0093-4666, 2154-8889, DOI 10.5248/129.373.
9. Hernández, I.; Nápoles, M. C.; Rosales, P. R.; Pérez, G.; Baños, R. y Ramírez, J. F. “Selección de aislados de rizobios provenientes de nódulos de la leguminosa forrajera Canavalia ensiformis”. Cultivos Tropicales, vol. 33, no. 3, 2012, pp. 27-33, ISSN 0258-5936.
10. Fernández, F.; Gómez, R.; Vanegas, L. F.; de la Noval, B. M. y Martínez, M. A. Producto inoculante micorrizógeno. no. 22641, Inst. Oficina Nacional de Propiedad Industrial, 2000, La Habana, Cuba.
11. Araújo, E. da S.; Guerra, J. G. M.; Espíndola, J. A. A.; da Cruz, L. C. J.; Alves, B. J. R. y Urquiaga, S. “Balanço de nitrogênio em área de produção de sementes de crotalária-juncea nas condições da Baixada Fluminense”. Embrapa Agrobiologia, Seropédica, Boletim de Pesquisa, no. 66, 2010, p. 14, ISSN 1676-6709.
12. Okito, A.; Alves, B. R. J.; Urquiaga, S. y Boddey, R. M. “Isotopic fractionation during N2 fixation by four tropical legumes”. Soil Biology and Biochemistry, vol. 36, no. 7, 2004, pp. 1179-1190, ISSN 0038-0717, DOI 10.1016/j.soilbio.2004.03.004.
13. Duncan, D. B. “Multiple Range and Multiple F Tests”. Biometrics, vol. 11, no. 1, 1955, pp. 1-42, ISSN 0006-341X, DOI 10.2307/3001478.
14. Massey, F. J. “The Kolmogorov-Smirnov Test for Goodness of Fit”. Journal of the American Statistical Association, vol. 46, no. 253, 1951, pp. 68-78, ISSN 0162-1459, 1537-274X, DOI 10.1080/01621459.1951.10500769.
15. Levene, H. “Robust tests for the equality of variance” [en línea]. En: Olkin I., Contributions to Probability and Statistics: Essays in Honor of Harold Hotelling, Ed. Stanford University Press, 1960, pp. 278-292, ISBN 978-0-8047-0596-7, [Consultado: 3 de junio de 2016], Disponible en: <https://books.google.com.cu/books?id=ZUSsAAAAIAAJ>.
16. StatPoint Technologies. Statgraphics Centurion [en línea]. (ser. Centurion), versión 16.1 (XV), [Windows], 21 de mayo de 2010, Disponible en: <http://statgraphics-centurion.software.informer.com/download/>.
17.Mateus, G. P. y Wutke, E. B. “Espécies de leguminosas utilizadas como adubos verdes”. Pesquisa & Tecnologia, vol. 8, no. 103, 2011, ISSN 2316-5146.
18. Partelli, F. L.; Duarte, V. H.; Petrônio de Brito, F. E.; Pio, V. A.; Azevedo, E. J. A.; Urquiaga, S. y Bodde, R. M. “Biologic dinitrogen fixation and nutrient cycling in cover crops and their effect on organic Conilon coffee”. Semina: Ciências Agrárias, vol. 32, no. 3, 2011, pp. 995-1005, ISSN 1676-546X.
19. Martín, G. M.; Rivera, R.; Arias, L. y Pérez, A. “Respuesta de la Canavalia ensiformis a la inoculación micorrízica con Glomus cubense (cepa INCAM-4), su efecto de permanencia en el cultivo del maiz”. Cultivos Tropicales, vol. 33, no. 2, 2012, pp. 20-28, ISSN 0258-5936.
20. Corbera, J. y Nápoles, M. C. “Efecto de la inoculación conjunta Bradyrhizobium elkanii-hongos MA y la aplicación de un bioestimulador del crecimiento vegetal en soya (Glycine max (L.) Merrill), cultivar INCASOY-27”. Cultivos Tropicales, vol. 34, no. 2, 2013, pp. 05-11, ISSN 0258-5936.
21. Bustamante, C.; Rivera, R.; Pérez, G. y Viñals, R. “Promoción del crecimiento de Canavalia ensiformis L. mediante la coinoculación de cepas de Rhizobium y hongos formadores de micorrizas en suelo pardo sin carbonatos”. Café y Cacao, vol. 9, no. 2, 2010, p. 5, ISSN 1680-7685.
22. Martín, G. M.; Reyes, R. y Ramírez, J. F. “Coinoculación de Canavalia ensiformis (L.) D.C. con Rhizobium y Hongos micorrÍzicos arbusculares en dos tipos de suelos de Cuba”. Cultivos Tropicales, vol. 36, no. 2, 2015, pp. 22-29, ISSN 0258-5936.
23. Rivera, R.; González, P. J.; Hernández, A.; Martín, G.; Ruíz, L.; Fernández, K.; Simó, J.; García, M.; Pérez, A.; Riera, M.; Bustamante, C.; Joao, J. P. y Ruiz, M. “La importancia del ambiente edáfico y del pH sobre la efectividad y la recomendación de cepas eficientes de HMA para la inoculación de los cultivos” [en línea]. En: VIII Congreso de la Sociedad Cubana de la Ciencia del Suelo, Ed. Instituto de Suelos, Ministerio de la Agricultura y Sociedad Cubana de la Ciencia del Suelo, Palacio de las Convenciones, La Habana, Cuba, 2015, ISBN 978-959-296-039-8, [Consultado: 31 de enero de 2017], Disponible en: <https://www.researchgate.net/publication/279193397>.
24. Spagnoletti, F. N.; Fernández, A.; Tobar, N. E. y Chiocchio, V. M. “Las micorrizas arbusculares y Rhizobium: una simbiosis dual de interés”. Revista Argentina de Microbiología, vol. 45, no. 2, 2013, pp. 131-132, ISSN 0325-7541.
25. Chalk, P. M.; Souza, R. de F.; Urquiaga, S.; Alves, B. J. R. y Boddey, R. M. “The role of arbuscular mycorrhiza in legume symbiotic performance”. Soil Biology and Biochemistry, vol. 38, no. 9, 2006, pp. 2944-2951, ISSN 0038-0717, DOI 10.1016/j.soilbio.2006.05.005.
26. Tamayo, A. Y.; Martín, A. G. M.; Corona, R. Y. y Barraza, A. F. V. “Respuesta de la Canavalia ensiformis (L) D.C. ante la coinoculación de Rhizobium y hongos micorrízicos arbusculares”. Hombre, Ciencia y Tecnología, vol. 19, no. 1, 2015, pp. 100-108, ISSN 1028-0871.
27. Martín, A. G. M.; Rivera, R. y Mujica, Y. “Estimación de la fijación biológica del nitrógeno de la Canavalia ensiformis por el método de la diferencia de N total”. Cultivos Tropicales, vol. 28, no. 4, 2007, pp. 75-78, ISSN 1819-4087.
Recibido: 09/12/2015
Aceptado: 26/09/2016
Dra.C. Gloria M. Martín Alonso, Instituto Nacional de Ciencias Agrícolas. Gaveta Postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700. Email: gloriam@inca.edu.cu