Influencia de quitosanas en la nodulación y el crecimiento vegetativo de soya (Glycine max L. Merrill)
Chitosans influence on soybean (Glycine max L. Merrill) nodulation and vegetative growth
M.Cs. Daimy Costales,I Dra.C. María C. Nápoles,I Dr.C. Alejandro B. Falcón,I Dr.C. Gustavo González Anta,II Dr.C. Alberto Ferreira,II Alejandro RossiII
IInstituto Nacional de Ciencias Agrícolas (INCA). Gaveta postal No.1, San José de las Lajas. Mayabeque, Cuba. CP 32700.
IIEmpresa Rizobacter S. A. Avda. Pte. Dr. Arturo Frondizi N0 1150- Calle N0 1- Parque Industrial, C.P. B2702HDA – Pergamino (Bs.As) – Argentina.
Resumen
El propósito de este trabajo fue estudiar la compatibilidad in vitro de un inoculante inducido que contiene la cepa de Bradyrhizobium japonicum E109 con quitosanas de diferentes características físico-químicas. Se evaluó la influencia de las quitosanas en la nodulación y el crecimiento in vivo de plantas de soya, al ser aplicadas a las semillas en el momento de la siembra (A), mediante aspersión foliar a los 15 días posteriores a la siembra (B) y la combinación de ambas formas de aplicación (C). La combinación de las quitosanas y el inoculante causó un efecto variable en el número de bacterias viables hasta los treinta días de su conservación, que dependió del tipo de quitosana, la concentración y del momento evaluado. La respuesta en las plantas estuvo influenciada por la forma de aplicación y las concentraciones de las quitosanas, pero no por la diferencias entre ellas en cuanto a masa molecular. Las concentraciones 100 y 500 mg L-1 del polímero y la quitosana hidrolizada, aplicadas por aspersión foliar, ejercieron mayor efecto benéfico en el número y la masa seca de los nódulos formados en raíces de soya, respectivamente. También, la longitud radical fue estimulada con las distintas concentraciones de la quitosana parcialmente hidrolizada, al ser asperjada foliarmente. Nuestros resultados sugieren que la combinación de quitosanas con inóculos de rizobios puede ser utilizada como fertilizantes biológicos para potenciar la nodulación y el crecimiento de soya y debe examinarse en trabajos futuros, la aplicación de las quitosanas en campo mediante las formas de aplicación estudiadas.
Palabras claves: Bradyrhizobium, leguminosas, polímero, simbiosis.
ABSTRACT
The purpose of this work was to study the in vitro compatibility of an induced inoculant containing of the Bradyrhizobium japonicum E109strain with chitosans of different physico-chemical characteristics. The influence of chitosan in vivo nodulation and growth of soybean plants, when applied to seeds at planting time (A), by foliar spraying to 15 days after seedling (B) and with the combination of both forms of application (C) was also evaluated. The chitosan and inoculant combination caused a variable effect in the number of viable bacteria until the thirty days of their conservation which depended on the chitosan type, the concentration, and the evaluation time. The response in plants was influenced by the application form and concentrations of chitosan assayed, but not for the differences between them in terms of molecular mass. The 100 and 500 mg L-1 polymer and hydrolyzed chitosan concentrations, applied by foliar spray, exerted beneficial effect on increased number and nodule dry mass formed in soybean roots, respectively. Also, the root length was stimulated with different concentrations of partially hydrolyzed chitosan, applied by foliar spray. Our results suggest that the combination of chitosan with rhizobia inoculants can be used as organic fertilizers to enhance of soybean nodulation and growth and must be examined in future work, the application of chitosan in the field using the application forms studied.
Key words: Bradyrhizobium, leguminous, polymer, symbiosis.
INTRODUCCIÓN
El grano de soya posee excelentes cualidades nutricionales por su contenido en proteínas, aminoácidos y aceite, por lo que constituye la oleaginosa más atractiva en la obtención de productos industriales para consumo animal y humano (1). Resulta un cultivo de fácil y bajo costo de producción, además de ser muy poco exigente en atenciones culturales, con requerimientos que oscilan entre 60 y 80 kg de N por tonelada de grano (2).
La demanda de nitrógeno en el cultivo es cubierta por su absorción desde el suelo y a través del mecanismo de Fijación Biológica del Nitrógeno (FBN), mediante su asociación simbiótica con bacterias del género Bradyrhizobium para su desarrollo (3). Con este propósito una práctica recomendable para garantizar el N en este cultivo es la inoculación de bacterias rizosféricas incorporadas mediante preparados comerciales que constituye una alternativa inocua al medio ambiente y viable en la productividad del cultivo (3).
Las quitosanas y sus derivados son oligosacarinas exógenas que ejercen probados efectos en el crecimiento y desarrollo de las plantas. El polímero de quitosana se obtiene por desacetilación básica de la quitina que forma parte del exoesqueleto de los crustáceos y sus derivados se obtienen, fundamentalmente, por hidrólisis química y enzimática del enlace glicosídico (4).
La heterogeneidad de las quitosanas depende de sus características físico-químicas como son la masa molecular, la viscosidad, el grado de acetilación, entre otras (5, 6). Algunas de las características mencionadas le confieren a estos compuestos potencialidades biológicas para su aplicación en la agricultura. Entre los efectos biológicos que resultan deseables en el contexto agrícola, se encuentran la inhibición del crecimiento y desarrollo de microorganismos patógenos que incluyen hongos, oomycetes y bacterias, así como la inducción de respuestas defensivas y de protección contra otros patógenos incluyendo las infecciones virales (4, 5, 7, 8). Es conocida además, la acción de estos compuestos como promotores del crecimiento y desarrollo de varias especies, en algunos casos relacionados a una actividad antitranspirante y mejoradora del rendimiento en algunos cultivos (8–10).
En soya, han sido estudiados diferentes compuestos de quitosana, de diferentes características químicas, en la interacción simbiótica Bradyrhizobium- soya, específicamente, en los procesos de nodulación y de crecimiento in vitro de plántulas inoculadas con B. elkanii. Los resultados con estos compuestos demostraron que el grado de polimerización y de acetilación son esenciales en el crecimiento y en la formación de nódulos radicales e incluso en la viabilidad de la bacteria. Se demostró por primera vez, que la reducción de la masa molecular del polímero mejora los indicadores antes mencionados, mientras que estos se ven afectados, al aumentar la concentración de la quitosana (11, 12). Sin embargo, no se conoce la influencia de las características físico-químicas de la quitosana en soya, cultivada en condiciones in vivo mediante otras formas de aplicación. Por tanto, el objetivo de este trabajo fue evaluar el efecto de dos quitosanas en la viabilidad de Bradyrhizobium, la nodulación y el crecimiento de soya inoculada con este microorganismo.
MATERIALES Y MÉTODOS
Inoculante empleado
Se utilizó la cepa Bradyrhizobium japonicum E-109, procedente del Instituto Nacional de Tecnología Agropecuaria (INTA, Castelar), cultivada a 28 °C en medio Jap (13) , inducido en la síntesis de factores de nodulación (nod ) (14), hasta una concentración final de 1x1010 UFC mL-1(unidades formadoras de colonias por mililitro de medio).
Características y preparación de las quitosanas empleadas
Se emplearon dos compuestos de quitosana con diferentes características físico-químicas. El polímero de quitosana (Sigma-Aldrich), de bajo peso molecular (32 kDa) y con grado de acetilación entre 15-25 %, fue preparado a partir de una solución madre (1 %) que fue disuelta en ácido acético (1 %) y agua, ajustada a pH= 5,6 con hidróxido de potasio (KOH, 2N). La quitosana parcialmente hidrolizada (10 % acetilada) se obtuvo de la hidrolisis enzimática del polímero, con 1,43 g de la enzima comercial papaína (Applichem), a 345 rpm y a temperatura entre 46 y 50 oC. Luego de ser disuelta la solución durante 20 horas, se autoclaveó durante 15 minutos.
Efecto de las quitosanas en la viabilidad de Bradyrhizobium japonicum
Para estudiar el efecto de la adición del polímero de quitosana y su hidrolizado, en la viabilidad de Bradyrhizobium japonicum, se utilizaron soluciones de 10, 100 y 500 mg L-1 de las quitosanas, previamente disueltas en 100 mL de agua y contenidas en Erlenmeyers de 250 mL, que fueron esterilizados durante 20 minutos en autoclave a 120 oC y 152 KPa. Se tomaron alícuotas de 0,4 mL de las soluciones de quitosanas y se adicionaron a 100 mL del inoculante obtenido en medio Jap, con una concentración final de 1x1010 UFC mL-1. Tres repeticiones fueron colocadas a 26 oC, en condiciones estáticas, durante 30 días. Se les determinó entonces el número de unidades formadoras de colonias por mililitro de medio (UFC mL-1), cada tres días, mediante la siembra por diseminación de 100 µL de cada muestra en placas con medio sólido Manitol extracto de levadura. Las placas fueron incubadas a 29,5 oC durante siete días, momento en que se realizó el conteo de colonias típicas.
Efecto de las quitosanas en la nodulación y el crecimiento de soya
Se determinó la influencia de la quitosana polímero y la quitosana parcialmente hidrolizada en la nodulación y el crecimiento in vivo de plantas de soya, mediante tres formas de aplicación: a semillas previo a la siembra (A), por aspersión foliar (1,5 mL por planta) a los quince días posteriores a la siembra (B) y la combinación de ambas formas A+B, (C).
100 g de semillas de soya, variedad DM 3810, procedentes de Semilleros Don Mario fueron tratadas con 0,4 mL del inóculo bacteriano y posteriormente se les aplicó 0,4 mL de las soluciones de quitosanas (10, 100 y 500 mg L-1). Se empleó como tratamiento control semillas de soya inoculadas sin adición de quitosanas.
Las semillas tratadas se sembraron en macetas de 330 g, a razón de una semilla por maceta. El suelo utilizado estaba libre de rizobios, con pH= 6,50; 2,58 ppm de contenido de nitratos (N-NO3-ácido fenoldisulfónico) (15); 19,35 ppm de fósforo asimilable (Fósforo disponible-extractable a pH<7) (16); 0,91 % de materia orgánica (17); 0,045 ppm de nitrógeno total y 0,63 % de carbono.
Las plantas fueron cultivadas en cámara de crecimiento con un fotoperíodo de 16/8 horas de luz/oscuridad a 28 oC y con 60 % de humedad relativa, durante 35 días. El riego fue realizado por capilaridad con agua desionizada, manteniendo el régimen hídrico en aproximadamente el 90 % de la capacidad de campo.
Se emplearon diez plantas por tratamiento para evaluar las variables de nodulación (número, masa seca (mg) y porcentaje (%) de los nódulos totales formados en las raíces) y de crecimiento (altura (cm), longitud radical (cm), masa seca aérea y de raíces (g) por planta). La concentración de nitrógeno total de la parte aérea seca (%) por planta fue determinada por el método de Kjeldah, y con la multiplicación por 6,25 de esta variable, se estimó el porcentaje de proteínas totales (%) de la parte aérea.
Diseño y procesamiento estadístico
Los experimentos fueron repetidos dos veces, se utilizó un Diseño Completamente Aleatorizado y los datos se sometieron a la prueba de normalidad y homogeneidad de varianza. En el experimento en plantas el análisis se realizó mediante el método factorial con los factores: forma de aplicación de las quitosanas y concentraciones, con tres niveles cada factor. En todos los casos se empleó la Prueba de Rangos Múltiples de Tukey HSD (p≤ 0,05) para discriminar diferencias entre las medias (18), en el paquete de programas Statgraphics Plus, versión 5.1 (19).
RESULTADOS
Efecto de las quitosanas en la viabilidad de Bradyrhizobium japonicum
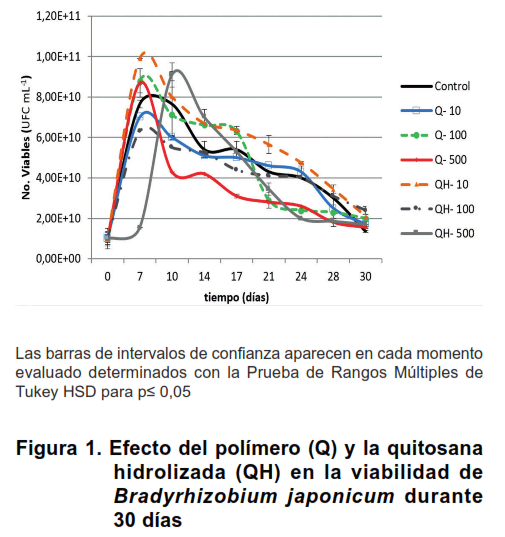
El ensayo de compatibilidad de las quitosanas con el inóculo de Bradyrhizobium japonicum, demostró, que la presencia de ambas quitosanas en el volumen y concentraciones ensayadas, afectó positiva o negativamente la viabilidad de la bacteria en el tiempo evaluado (Figura 1).
Durante los treinta días, se obtuvieron los mayores valores de unidades formadoras de colonias por mililitro (UFC mL-1) con la quitosana hidrolizada a la concentración de 10 mg L-1 en casi todos los momentos evaluados, mientras que la quitosana polímero de 500 mg L-1, redujo significativamente el número de viables de B. japonicum, a partir de los siete y hasta los veintiocho días de su adición al inóculo, respecto al control sin producto. Todos los tratamientos, a los treinta días, se igualaron al tratamiento control que tuvo la menor concentración bacteriana (Figura 1).
El resto de las concentraciones de ambas quitosanas no modificaron la viabilidad del inoculante, por tanto pueden ser empleadas de conjunto.
Efecto de las quitosanas en la nodulación y el crecimiento de plantas de soya
El suelo empleado se caracterizó por presentar un pH casi neutro que es adecuado para el desarrollo del cultivo y el establecimiento de la población de Bradyrhizobium. El contenido de materia orgánica y de nitrógeno total es muy bajo, mientras que los niveles de fósforo asimilable y el porcentaje de carbono son altos.
Los resultados del análisis estadístico del experimento en plantas demostraron que hubo interacción entre la forma de aplicación y la concentración de las quitosanas empleadas, en los procesos de nodulación y la mayoría de las variables de crecimiento de la soya (Figuras 2, 3, 4, 5, 6 y 8).
El número de nódulos en plantas de soya estuvo estimulado por las concentraciones 100 y 500 mg L-1 de ambas quitosanas asperjadas foliarmente a los quince días de la siembra (B), con valores superiores al tratamiento control (Figura 2). Todos los nódulos fueron efectivos.
La masa seca de los nódulos formados sólo estuvo beneficiada con la aspersión foliar de 100 y 500 mg L-1 de la quitosana hidrolizada (Figura 3).
La altura de las plantas no estuvo influenciada positivamente con ninguno de los tratamientos al no diferenciarse del tratamiento control (Figura 4).
Los mayores valores de longitud radical se obtuvieron con la aspersión foliar de las quitosanas (B) en las diferentes concentraciones, excepto con el polímero a la concentración de 100 mg L-1. Sin embargo, este tratamiento sí benefició la variable en cuestión cuando se utilizó combinado sobre semillas y luego foliar (C) (Figura 5).
No se observaron diferencias significativas de las quitosanas y sus concentraciones respecto al control, pero sí entre la forma de aplicación de la quitosana hidrolizada a la concentración de 10 mg L-1, que aplicada por aspersión foliar (B) difirió de la adicionada a semillas (A) (Figura 6).
En la masa seca radical no se presentó interacción de los factores evaluados (formas de aplicación y concentración de las quitosanas), ni influyeron de forma independiente. Los valores de esta variable oscilaron desde 0, 35 hasta 0, 44 g por planta.
La concentración de nitrógeno total en la parte aérea de la soya dependió de la forma de aplicación de las quitosanas y no por la concentración de cada una de ellas (Figura 7). La aplicación a la semilla (A) y foliarmente (B) no mostraron diferencias; sin embargo, la combinación de ambas formas de aplicación (C) disminuyó el contenido de nitrógeno total. Los valores de contenido de nitrógeno total fueron bajos en todos los tratamientos, si se compara con otros resultados obtenidos en esta oleaginosa.
El porcentaje de proteínas estimado a partir de la concentración de nitrógeno de la parte aérea estuvo influenciado por la interacción de los factores forma de aplicación y concentración de las quitosanas (Figura 8). Las quitosanas aplicadas de forma combinada sobre semillas y por aspersión foliar (C) disminuyeron drásticamente esta variable que cuando se aplicaron de forma individual, con un comportamiento similar al control no tratado. Las diferencias con respecto al control se deben a las concentraciones empleadas, donde se destacan las dosis de 100 y 500 mg L-1 asperjadas en plantas y 100 mg L-1 sobre semillas de la quitosana hidrolizada (Figura 8).
DISCUSIÓN
La actividad antimicrobiana de la quitosana ha sido inferida por varios mecanismos revisados anteriormente, pero en su mayoría es atribuido al carácter policatiónico de la quitosana a pH≤ 6, que acentúa la presencia de cargas positivas en la cadena del biopolímero (4, 17, 20). Por tanto, los polímeros tienen mayor posibilidad de interaccionar con las cargas negativas de los fosfolípidos en la membrana celular de los microorganismos, comparados con sus derivados, porque presentan mayor número de grupos aminos no acetilados en la molécula de quitosana y por ende, mayor será su actividad antimicrobiana. En este sentido, se ha informado que a diferencia de los oligómeros de quitosana, los polímeros pueden rodear las células microbianas y causar su muerte, además por inanición al interaccionar y quelatar los metales necesarios en procesos enzimáticos de la bacteria e inhibir el crecimiento bacteriano (7, 20).
Los resultados obtenidos en el presente trabajo, con la combinación de una quitosana polímero y su derivado, en la viabilidad de un inoculante a base de B. japonicum constata que las propiedades antibacterianas de la quitosana están determinadas en gran medida por la masa molecular (Figura 1). En general, la quitosana parcialmente hidrolizada perjudico en menor medida la viabilidad de la cepa, en comparación con el polímero.
Las quitosanas tuvieron un efecto variable en el número de viables de la bacteria hasta los treinta días de su conservación que además de depender del tipo de quitosana, también estuvo influenciado por la concentración y el momento evaluado. Existen numerosos trabajos que refieren a la quitosana como sustancia antimicrobiana por inhibición directa de microorganismos y la inducción indirecta de enzimas relacionadas con la defensa de la planta (6, 21), que dependen de los factores antes mencionados, entre otros (22–24).
Las concentraciones empleadas en el ensayo de compatibilidad de las quitosanas con el inoculante se encuentran en el rango de concentraciones mínimas inhibitorias de quitosana estudiadas en bacterias, que varía entre 0,01 % y 1 % (25). En este sentido, la concentración mayor (500 mg L-1) de las quitosanas representa el 0,05 %, y fue esta concentración del polímero, quién redujo significativamente el número de unidades formadoras de colonias por mililitro de Bradyrhizobium en casi todo el período evaluado (Figura 1). Este resultado concuerda con el obtenido en estudios de viabilidad de la cepa B. elkanii, que demostró actividad bacteriostática de un polímero con una masa molecular de 81,3 kDa y grado de acetilación de 12 % con dicha concentración. Sin embargo, la reducción de su masa molecular hasta oligómeros (5-9 kDa), disminuyó la acción inhibitoria sobre el microorganismo cuando las quitosanas se adicionaron al medio de cultivo microbiano (12). Otro resultado apunta que, la aplicación de esta concentración, disminuyó la tasa de crecimiento de cepas de Escherichia coli incubadas en microparticulas de quitosana (26).
A pesar de la acción inhibitoria y de protección ante diversos fitopatógenos ejercida por la quitosana (4, 7, 8), se han establecido estudios comparativos de formulaciones basadas en la combinación de quitosana y bacterias promotoras del crecimiento vegetal (BPCV), en el crecimiento de plantas (27) y en la supresión de enfermedades (28). Sin embargo, en la utilización de inoculantes para leguminosas no existen resultados al respecto.
Los resultados de la aplicación de estos productos en plantas de soya inoculada, demostraron que de forma general, la forma de aplicación que más influyó en la nodulación y en algunas variables de crecimiento fue la aspersión foliar (B), seguido de la adición a las semillas previo a la siembra (A), y la que menos lo hizo fue la combinación de ambas formas de aplicación de las quitosanas (C).
La aspersión foliar del polímero y su derivado (B) a las distintas concentraciones (10, 100 y 500 mg L-1), beneficiaron la nodulación y algunas variables de crecimiento, respecto a las otras dos formas de aplicación de las quitosanas: adición a semillas (A) y la combinación de ambas (C). La respuesta en la activación de ambos procesos varió en dependencia de la concentración de las quitosanas; sin embargo, no estuvo influenciada por la diferencia de su masa molecular, ya que se comportaron de forma similar.
En la nodulación de plantas de soya, las concentraciones 100 y 500 mg L-1 asperjadas foliarmente se destacaron en el número y la masa seca de los nódulos, con el polímero y el hidrolizado, respectivamente (Figura 2 y 3). Sin embargo, se informó en nodulación de soya y maní (Arachis hypogaea) un mayor efecto positivo al combinarse las formas imbibición de semillas antes de la siembra y aspersión foliar de quitosana (29). Otros autores lograron estimular la nodulación, la actividad de reducción de acetileno (ARA) y el rendimiento de soya, suplementando el suelo con quitina y quitosana, a la concentración de 1 g L-1 (30). Los resultados de este trabajo y los citados anteriormente confirman que, la aplicación de quitosanas en leguminosas puede estimular la nodulación de las plantas, en dependencia del modo de aplicación, de la concentración y del tipo de quitosana, además de la especie vegetal, entre otros factores.
Existen resultados en soya con la aplicación de diferentes concentraciones, masas moleculares, formas y momentos de aplicación de quitosanas en la germinación de las semillas, calidad de los brotes, crecimiento, fisiología y bioquímica de las plantas y el rendimiento del cultivo (4, 29, 31). Sin embargo, apenas existen resultados del empleo de quitosana y sus derivados en la interacción simbiótica de la soya con su microsimbionte.
En soya, el crecimiento y los rendimientos del cultivo han sido estimulados con aplicaciones diversas de quitosanas (8, 29, 31). Nuestros resultados sólo mostraron una acción reguladora de las quitosanas, sin mostrar diferencias por sus características estructurales, en la concentración de nitrógeno, en la longitud radical y en el porcentaje de proteínas de las plantas. Las dos últimas variables fueron afectadas con la interacción de los factores estudiados, destacándose la quitosana parcialmente hidrolizada cuando se asperjó foliarmente en la longitud radical y por las formas A y B en el porcentaje de proteínas (Figura 5, 7 y 8).
Autores anteriores han informado la acción positiva de la aspersión foliar, por su influencia en el crecimiento, la fisiología y los rendimientos de leguminosas cultivadas en condiciones normales y bajo estrés hídrico en campo (32-34). Resultados similares a los de este trabajo respecto a un mayor efecto con la aspersión foliar comparada a la imbibición de semillas fueron informados previamente en diferentes genotipos de lenteja en cuanto al aumento de los rendimientos del cultivo (35).
Recientemente se ha informado el aumento en la absorción de nutrientes en plantas con la aplicación de quitosanas (29). En la investigación el aumento de la concentración de nitrógeno (N) de la parte aérea de soya (Figura 7) fue dependiente de la forma de aplicación, destacándose la adición a semillas (A) y la aspersión foliar (B). Sin embargo, la concentración de nitrógeno total en la parte aérea de las plantas no fue elevada con las tres formas de aplicación de las quitosanas, ya que otros autores han encontrado valores superiores al 2 % con la inoculación de cepas de Bradyrhizobium en soya (36). Por consiguiente, el porcentaje de proteína estimado a partir del N también es bajo (Figura 8), si se compara con valores de proteína en plantas completas de soya que informan hasta 20 % de proteína cruda (37).
Lo anterior podría deberse a que las determinaciones de este trabajo se hicieron a los 35 días de efectuada la siembra y se plantea que la etapa de máxima acumulación de nitrógeno ocurre en la madurez fisiológica con 330 kg ha-1 (38). En adición, el suelo empleado para el cultivo de las plantas tuvo un contenido bajo en N (0,045 ppm), aunque las plantas no mostraron síntomas visuales de deficiencia de este nutriente, ya que las plantas nodularon y crecieron adecuadamente durante la fase vegetativa, por lo que el aporte de N pudo ser cubierto con la fijación simbiótica del dinitrógeno atmosférico (FBN) de forma eficiente. Trabajos previos corroboran el efecto positivo de la inoculación con Bradyrhizobium; no sólo porque aumenta significativamente la disponibilidad y absorción de N y otros macronutrientes en plantas, sino porque también contribuye al aumento del crecimiento y los rendimientos de soya (39).
El polímero y el hidrolizado de quitosana pudieran ser empleados como complementos o aditivos del inoculante a base de Bradyrhizobium, para el cultivo de la soya; siempre que se tenga en cuenta la concentración adecuada de ellos, que no afecte el crecimiento microbiano. En consecuencia, aquellas concentraciones de los compuestos de quitosana (Q- 500 mg L-1 y QH- 100 mg L-1) que influyeron negativamente en la viabilidad de la bacteria, no afectaron del mismo modo la nodulación de las plantas. Ello se debe, quizás, al hecho de que se aplicaron foliarmente. De modo, que la influencia beneficiosa que tuvo esta forma de aplicación (B) de las quitosanas pudiera deberse a que no interactúa directamente sobre la bacteria pero sí estimula quizás el proceso de FBN.
La aplicación de biofertilizantes y bioestimulantes a los cultivos constituye una estrategia interesante para mejorar o preservar las condiciones físico-químicas y biológicas de los suelos y a la vez, elevar la protección y el potencial agroproductivo. Es importante tener en cuenta la forma de aplicación más conveniente de estos productos. Por tanto, resulta válida la utilización de oligosacarinas u otros compuestos bioactivos, como complementos o aditivos de inoculantes, para incrementar el proceso de fijación del nitrógeno en la soya.
Estudios futuros en relación al empleo de quitosanas, sus concentraciones y formas de aplicación, en el cultivo de soya son necesarios para verificar los resultados encontrados. En adición, se sugiere para próximos trabajos evaluar las características físico-químicas de las quitosanas, fundamentalmente, la diferenciación en su masa molecular, así como el efecto de este bioproducto en el tiempo, su incidencia en los componentes del rendimiento además de la nodulación y el crecimiento en condiciones de campo.
CONCLUSIÓN
El presente estudio demostró la influencia de un polímero de quitosana y su hidrolizado en la interacción simbiótica Bradyrhizobium-soya. El efecto de ambas quitosanas sobre la viabilidad de la cepa E109 dependió de la masa molecular y de la concentración de estos compuestos; resultando negativo el empleo del polímero a 500 mg L-1. La aspersión foliar resultó la mejor forma de aplicación, con resultados positivos en la nodulación y el crecimiento vegetativo de las plantas de soya.
BIBLIOGRAFÍA
1. Ainsworth, E. A.; Yendrek, C. R.; Skoneczka, J. A. y Long, S. P. “Accelerating yield potential in soybean: potential targets for biotechnological improvement: Targets to improve soybean yields”. Plant, Cell & Environment, vol. 35, no. 1, 2012, pp. 38-52, ISSN 0140-7791, DOI 10.1111/j.1365-3040.2011.02378.x.
2. Oikawa, S.; Okada, M. y Hikosaka, K. “Effects of elevated CO2 on leaf area dynamics in nodulating and non-nodulating soybean stands”. Plant and Soil, vol. 373, no. 1-2, 2013, pp. 627-639, ISSN 0032-079X, 1573-5036, DOI 10.1007/s11104-013-1826-6.
3. Nápoles, M. C.; Gómez, G.; Costales, D.; Freixas, J. A.; Guevara, E.; Meira, S.; González-Anta, G. y Ferreira, A. “Signals in Soybean´s Inoculants”. En: Soybean: biochemistry, chemistry and physiology, Ed. InTech, Rijeka, 2011, ISBN 978-953-307-219-7.
4. Katiyar, D.; Hemantaranjan, A.; Singh, B. y Bhanu, A. N. “A Future Perspective in Crop Protection: Chitosan and its Oligosaccharides”. Advances in Plants & Agriculture Research, vol. 1, no. 1, 2014, pp. 1-8, ISSN 2373-6402, DOI 10.15406/apar.2014.1.00006.
5. Falcón-Rodríguez, A. B.; Costales, D.; Cabrera, J. C. y Martínez-Téllez, M. Á. “Chitosan physico–chemical properties modulate defense responses and resistance in tobacco plants against the oomycete Phytophthora nicotianae”. Pesticide Biochemistry and Physiology, vol. 100, no. 3, 2011, pp. 221-228, ISSN 0048-3575, DOI 10.1016/j.pestbp.2011.04.005.
6. Sharp, R. “A Review of the Applications of Chitin and Its Derivatives in Agriculture to Modify Plant-Microbial Interactions and Improve Crop Yields”. Agronomy, vol. 3, no. 4, 2013, pp. 757-793, ISSN 2073-4395, DOI 10.3390/agronomy3040757.
7. Badawy, M. E. I. y Rabea, E. I. “A Biopolymer Chitosan and Its Derivatives as Promising Antimicrobial Agents against Plant Pathogens and Their Applications in Crop Protection”. International Journal of Carbohydrate Chemistry, vol. 2011, 2011, pp. 1-29, ISSN 1687-9341, 1687-935X, DOI 10.1155/2011/460381.
8. Se-Kwon, K. Chitin, chitosan, oligosaccharides and their derivatives: biological activities and applications. Ed. Taylor & Francis, 2011, Boca Raton, 643 p., ISBN 978-1-4398-1603-5.
9. Iriti, M.; Picchi, V.; Rossoni, M.; Gomarasca, S.; Ludwig, N.; Gargano, M. y Faoro, F. “Chitosan antitranspirant activity is due to abscisic acid-dependent stomatal closure”. Environmental and Experimental Botany, vol. 66, no. 3, 2009, pp. 493-500, ISSN 0098-8472, DOI 10.1016/j.envexpbot.2009.01.004.
10. Salachna, P. y Zawadzińska, A. “Effect of chitosan on plant growth, flowering and corms yield of Potted freesia”. Journal of Ecological Engineering, vol. 15, no. 3, 2014, pp. 97–102, ISSN 2299-8993, DOI 10.12911/22998993.1110223.
11. Costales, D.; Nápoles, M. C. y Falcón, A. “Efecto de derivados de quitosana en la simbiosis Bradyrhizobium-soya”. Cultivos Tropicales, vol. 26, no. 1, 2005, pp. 83–88, ISSN 0258-5936.
12. Falcón, A. B.; Costales, D.; González-Peña, D. y Nápoles, M. C. “Nuevos productos naturales para la agricultura: las oligosacarinas”. Cultivos Tropicales, vol. 36, no. supl.1, 2015, pp. 111-129, ISSN 0258-5936.
13. Cozzi, J. G. y Benintende, G. B. “Influencia de la esterilización de la turba en la supervivencia de Bradyrhizobium japonicum”. Revista Latinoamericana de Microbiología, vol. 31, no. 4, 1989, pp. 275–278, ISSN 0187-4640, 0034-9771.
14. Nápoles, M. C. Medio de cultivo para Bradyrhizobium japonicum. Biopreparado resultante. no. 22797, Inst. OCPI, 2002, Cuba, Resolución 556/2002.
15. Bray, R. H. y Kurtz, L. T. “Determination of total, organic, and available forms of phosphorus in soils”. Soil science, vol. 59, no. 1, 1945, pp. 39–46, ISSN 0038-075X, 1538-9243.
16. Walkley, A. y Black, I. A. “An examination of the Degtjareff method for determining soil organic matter, and a proposed modification of the chromic acid titration method”. Soil science, vol. 37, no. 1, 1934, pp. 29–38, ISSN 0038-075X, 1538-9243.
17. Harper, H. J. “The Accurate Determination of Nitrates in Soils”. Industrial & Engineering Chemistry, vol. 16, no. 2, 1924, pp. 180-183, ISSN 0019-7866, 1541-5724, DOI 10.1021/ie50170a037.
18. Tukey, J. W. “Bias and confidence in not quite large samples”. The Annals of Mathematical Statistics, vol. 29, no. 2, junio de 1958, pp. 614-623, ISSN 0003-4851, DOI 10.1214/aoms/1177706647.
19. Statistical Graphics Crop. STATGRAPHICS ® Plus [en línea]. (ser. Profesional), versión 5.1, [Windows], 2000, Disponible en: <http://www.statgraphics.com/statgraphics/statgraphics.nsf/pd/pdpricing>.
20. Tan, H.; Ma, R.; Lin, C.; Liu, Z. y Tang, T. “Quaternized Chitosan as an Antimicrobial Agent: Antimicrobial Activity, Mechanism of Action and Biomedical Applications in Orthopedics”. International Journal of Molecular Sciences, vol. 14, no. 1, 2013, pp. 1854-1869, ISSN 1422-0067, DOI 10.3390/ijms14011854.
21. Liu, R.; Wang, Z.-Y.; Li, T.-T.; Wang, F. y An, J. “The role of chitosan in polyphenols accumulation and induction of defense enzymes in Pinus koraiensis seedlings”. Chinese Journal of Plant Ecology, vol. 38, no. 7, 2014, pp. 749-756, ISSN 1005-264X.
22. Goy, R. C.; Britto, D. de y Assis, O. B. G. “A review of the antimicrobial activity of chitosan”. Polímeros, vol. 19, no. 3, 2009, pp. 241-247, ISSN 0104-1428, DOI 10.1590/S0104-14282009000300013.
23. Ing, L. Y.; Zin, N. M.; Sarwar, A. y Katas, H. “Antifungal Activity of Chitosan Nanoparticles and Correlation with Their Physical Properties”. International Journal of Biomaterials, vol. 2012, 2012, pp. 1-9, ISSN 1687-8787, 1687-8795, DOI 10.1155/2012/632698.
24. Alfaro-Gutiérrez, I. C.; Guerra-Sánchez, M. G.; Hernández-Lauzardo, A. N. y Velázquez-del Valle, M. G. “Morphological and Physiological Changes on Rhizopus stolonifer by Effect of Chitosan, Oligochitosan or Essential Oils”. Journal of Phytopathology, vol. 162, no. 11-12, 2014, pp. 723-730, ISSN 0931-1785, DOI 10.1111/jph.12252.
25. Kraśniewska, K. y Gniewosz, M. “Substances with antibacterial activity in edible films–a review”. Polish Journal of Food and Nutrition Sciences, vol. 62, no. 4, 2012, pp. 199–206, ISSN 1230-0322.
26. Jeon, S. J.; Oh, M.; Yeo, W.-S.; Galvão, K. N. y Jeong, K. C. “Underlying Mechanism of Antimicrobial Activity of Chitosan Microparticles and Implications for the Treatment of Infectious Diseases”. PLoS ONE, vol. 9, no. 3, 2014, p. e92723, ISSN 1932-6203, DOI 10.1371/journal.pone.0092723.
27. Agbodjato, N. A.; Noumavo, P. A.; Adjanohoun, A.; Agbessi, L. y Baba-Moussa, L. “Synergistic Effects of Plant Growth Promoting Rhizobacteria and Chitosan on In Vitro Seeds Germination, Greenhouse Growth, and Nutrient Uptake of Maize (Zea mays L.)”. Biotechnology Research International, vol. 2016, 2016, pp. 1-11, ISSN 2090-3138, 2090-3146, DOI 10.1155/2016/7830182.
28. Murphy, J. F.; Reddy, M. S.; Ryu, C.-M.; Kloepper, J. W. y Li, R. “Rhizobacteria-Mediated Growth Promotion of Tomato Leads to Protection Against Cucumber mosaic virus”. Phytopathology, vol. 93, no. 10, 2003, pp. 1301-1307, ISSN 0031-949X, DOI 10.1094/PHYTO.2003.93.10.1301.
29. Dzung, N. A. “Enhancing crop production with chitosan and its derivatives”. En: ed. Se-Kwon K., Chitin, chitosan, oligosaccharides and their derivatives: biological activities and applications, Ed. Taylor & Francis, Boca Raton, 2011, pp. 619-631, ISBN 978-1-4398-1603-5.
30. Ali, Mu.; Horiuchi, T. y Miyagawa, S. “Nodulation, Nitrogen Fixation and Growth of Soybean Plants (Clycine max Merr.) in Soil Supplemented with Chitin or Chitosan”. Japanese Journal of Crop Science, vol. 66, no. 1, 1997, pp. 100-107, ISSN 0011-1848, 1349-0990, DOI 10.1626/jcs.66.100.
31. Zeng, D.; Luo, X. y Tu, R. “Application of Bioactive Coatings Based on Chitosan for Soybean Seed Protection”. International Journal of Carbohydrate Chemistry, vol. 2012, 2012, pp. 1-5, ISSN 1687-9341, 1687-935X, DOI 10.1155/2012/104565.
32. Farouk, S. y Amany, A. R. “Improving growth and yield of cowpea by foliar application of chitosan under water stress”. Egyptian Journal of Biology, vol. 14, no. 1, 2012, pp. 14-16, ISSN 1110-6859, DOI 10.4314/ejb.v14i1.2.
33. Abu-Muriefah, S. S. “Effect of chitosan on common bean (Phaseolus vulgaris L.) plants grown under water stress conditions”. International Research Journal of Agricultural Science and Soil Science, vol. 3, no. 6, 2013, pp. 192–199, ISSN 2251-0044.
34. Mondal, M. M. A.; Malek, M. A.; Puteh, A. B. y Ismail, M. R. “Foliar application of chitosan on growth and yield attributes of mungbean (Vigna radiata (L.) Wilczek)”. Bangladesh Journal of Botany, vol. 42, no. 1, 2013, pp. 179-183, ISSN 2079-9926, DOI 10.3329/bjb.v42i1.15910.
35. Javan, M.; Tajbakhsh, M. y Mandoulakani, B. A. “Effect of antitranspirants application on yield and yield components in soybean (Glycine max L.) under limited irrigation”. Journal of Applied Biological Sciences, vol. 7, no. 1, 2013, pp. 70–74, ISSN 1307-1130, 2146-0108.
36. Corbera, J. y Nápoles, M. C. “Evaluación agronómica de la coinoculación de Bradyrhizobium japonicum y hongos micorrizógenos arbusculares en el cultivo de la soya sobre suelo ferralítico rojo compactado”. Cultivos Tropicales, vol. 21, no. 1, 2000, pp. 21-25, ISSN 0258-5936.
37. Tobía, C. y Villalobos, E. “Producción y valor nutricional del forraje de soya en condiciones tropicales adversas”. Agronomía Costarricense, vol. 28, no. 1, 2004, pp. 17–25, ISSN 0377-9424.
38. Andrade, F.; Echeverría, H.; González, N.; Uhart, S. y Darwich, N. “Requerimientos de nitrógeno y fósforo de los cultivos de maíz, girasol y soja”. Boletín Técnico, INTA-EEA Balcarce, vol. 134, 1996, pp. 1-17, ISSN 0522-0548.
39. Nápoles, M. C.; Cabrera, J. C.; Varela, M.; González-Anta, G.; Nogueras, F.; Cricco, J.; Guevara, E. y Meira, S. “Influencia de inoculantes y factores edáficos en el rendimiento de la soya”. Cultivos Tropicales, vol. 30, no. 3, 2009, pp. 18-22, ISSN 0258-5936.
Recibido: 07/07/2015
Aceptado: 01/07/2016
M.Cs. Daimy Costales, Instituto Nacional de Ciencias Agrícolas (INCA). Gaveta postal No.1, San José de las Lajas. Mayabeque, Cuba. CP 32700. Email: daimy@inca.edu.cu