Desarrollo en etapa de vivero de Gmelina arbórea Roxb. ex Sm sometida a tres dosis de fertilización y dos sustratos
Nursery stage development of Gmelina arbórea Roxb. ex Sm subjected to three doses of fertilization and two substrates
M.Cs. Joaquín Guillermo-Ramírez
Estudiante de doctorado Universidad Nacional de Colombia Sede Medellín.
RESUMEN
Gmelina arbórea es una especie forestal utilizada en el establecimiento y manejo de bosques comerciales en Colombia, pero se carece de alternativas tecnológicas que ayuden a su sostenibilidad. Esta investigación tuvo como objetivo conocer el desarrollo vegetativo en la fase de vivero, con tres niveles de NPK (nitrógeno, fosforo y potasio) y dos sustratos. Las dosis evaluadas por planta fueron D1: 100 mg N, 75 mg P, 50 mg K; D2: 200 mg N, 150 mg P, 100 mg K y D3:300 mg N, 225 mg P, 150 mg K. Por su parte los sustratos estuvieron compuestos de suelo-cascarilla de arroz-arena en relación 1-1-1 (S1) y suelo-enmienda mineral completa (P2O5: 13 %; CaO: 25 %; MgO:7 %; S:10 %;SiO2:6 %)-cascarilla de arroz-arena, en relación 1-0,05-1-0,95 (S2). Los tratamientos evaluados fueron los sustratos combinados con las tres dosis de fertilizantes, los dos sustratos de forma individual y un testigo absoluto. El diseño experimental fue completamente al azar y cada tratamiento contó con cinco repeticiones y dos en el tiempo. Se determinó la altura, la biomasa seca, el área foliar y la concentración foliar de N, P y K. Los sustratos, de forma individual, no presentaron ningún efecto sobre el crecimiento y desarrollo de G. arbórea, pero el sustrato dos presentó mejores resultados cuando se utilizó en combinación con las dosis de NPK. Por su parte el mejor tratamiento fue la dosis dos y el sustrato dos, incrementando la altura, el área foliar y la biomasa en 33,9; 45,2 y 52,7 %, respectivamente.
Palabras clave: altura, área foliar, desarrollo de plantas.
ABSTRACT
Gmelina arborea is a forest species used in the establishment and management of commercial forests in Colombia, but lacks alternative technologies that help sustainability. This research was aims to determine the vegetative development in the nursery stage, with three levels of NPK (nitrogen, phosphorus and potassium) and two substrates. The doses evaluated by plant were D1: 100 mg N, 75 mg P, 50 mg K; D2: 200 mg N, 150 mg P, 100 mg K and D3:300 mg N, 225 mg P, 150 mg K. Meanwhile substrates were composed of soil-rice husk-sand in relation 1-1-1 (S1) and soil-complete mineral amendment (P2O5: 13 %; CaO: 25 %; MgO: 7 %; S:10 %; SiO2:6 %)-rice hush-sand in relation 1-0,05-1-0,95 (S2). The treatments evaluated were the substrates combined with three doses of fertilizers, the two substrates individually and absolute control. The experimental design was completely random and each treatment had five replications and two in time. Height, dry biomass, leaf area and leaf concentration of N, P and K was determined. Substrates individually showed no effect on the growth and development of melina, but the two substrate had better results when used in combination with doses of NPK. Meanwhile the best treatment was dose two and substrate two increasing height, leaf area and biomass in 33,9; 45,2 and 52,7 % respectively.
Key words: height, leaf area, development plants.
INTRODUCCIÓN
Gmelina arbórea Roxb. ex Sm es una especie forestal que se desarrolla naturalmente en habitas que varían desde húmedos hasta secos. Es originaria de Asia, desde donde se introdujo a muchos países tropicales, incluyendo Colombia, convirtiéndose en una importante fuente maderera en las regiones tropicales y subtropicales de Asia, África y América (1). En Colombia se siembra en la Costa Norte, donde se ha convertido en una opción para la reforestación comercial, además de su papel en la conservación y recuperación de suelos.
Esta especie es conocida comúnmente como Melina. Al ser de ciclo largo, requiere de la producción de plántulas de excelente calidad, por lo cual unas buenas prácticas agrícolas y de manejo en la etapa de vivero garantizarán un adecuado desarrollo en campo. Es así como se ha recurrido a distintas estrategias de manejo de la nutrición de la planta, con el fin de mejorar su vigor, dentro de estas se destaca la inoculación con bacterias y hongos micorrízicos arbusculares (HMA) (2–4) y las adiciones de fertilizantes nitrogenados de origen químico (5).
En ambas estrategias se reporta una mejora en las variables biométricas con respecto a los tratamientos testigo, pero son pocos los trabajos en los cuales se habla del efecto sobre esta especie vegetal de distintas dosis de NPK, además su interacción con sustratos de composición diferente.
Las condiciones de crecimiento de las plantas jóvenes en los viveros forestales son diferentes a las que se presentan en los bosques plantados o naturales, donde en estos últimos puede haber un mayor aporte de materia orgánica y, por ende, un mejor desarrollo, dado el reciclaje de nutrientes (6). Es por esta razón que se busca, mediante las adiciones de fertilizantes de origen químico y mineral, lograr un aporte de nutrimentos para el adecuado desarrollo de las plántulas en esta etapa de su ciclo productivo.
Los nutrientes en las plantas cumplen múltiples funciones, lo que hace que la ausencia de uno de estos, provoque cambios metabólicos, los cuales se pueden ver reflejados en un inadecuado desarrollo de la planta (7). Es por esto que las adiciones de nutrimentos en la etapa de vivero ayudan a mejorar la calidad de las plantas, además de otras ventajas comparativas, como la obtención de plantas en cortos periodos de tiempo, más homogéneas y de mejor capacidad de adaptación a condiciones de campo (8).
Al igual que los nutrientes, los sustratos de crecimiento en las primeras etapas de producción de plántulas en vivero cumplen un papel muy importante, desempeñando múltiples funciones, dentro de las cuales se destaca como acondicionador de la parte física, permitiendo la mejora de muchas variables como la porosidad y el drenaje. Por otra parte, también pueden tener un papel en el aporte de nutrientes, lo cual estará relacionado con la composición química de este. Al respecto se reporta que la especie Pinus greggii Engelm presenta incrementos significativos en variables asociados al desarrollo de las plántulas, cuando estas fueron crecidas en sustratos compuestos por corteza y aserrín, la cual fue muy dependiente del contenido de humedad (9).
Los trabajos reportados en Melina, en aspectos asociados a la fertilización en etapa de vivero, además del uso de sustratos de enraizamientos, son escasos, es por esto que este trabajo tuvo como objetivo conocer el desarrollo vegetativo en la fase de vivero (80 días) de plántulas de Melina, con tres niveles de fertilización con NPK (nitrógeno, fosforo y potasio) y dos sustratos.
MATERIALES Y MÉTODOS
Localización
El crecimiento de las plántulas de Melina y la evaluación de los tratamientos se realizó en el invernadero de la Universidad Nacional de Colombia sede Medellín (6° 15’ N; 75° 34’ O; 1,496 ms.n.m.), sobre zona de vida denominada Bosque Húmedo Pre-Montano (bh-P-M). Las condiciones ambientales del invernadero fueron temperatura de 18-22 °C, humedad relativa en el rango de 75-95 % y radiación fotosintéticamente activa de 650- 1920 μmol fotones m-2 s-1.
Obtención de plántulas
Las plántulas de G. arbórea, se obtuvieron de semillas de árboles sobresalientes en porte y vigor y de apariencia sana, provenientes del centro experimental Cotové de la Universidad Nacional de Colombia sede Medellín (6º 33´ 32´´N, 77º 04´ 51´O, 540 m). A estas semillas se les realizó un proceso de desinfección superficial con hipoclorito de sodio (3 % v:v) por 30 segundos, lavado con agua por 30 segundos, posterior lavado en alcohol (76 % v:v) por 30 segundos y enjuague con agua por 30 segundos.
Las semillas se sumergieron en agua destilada estéril por 48 horas, después se colocaron en bandejas germinadoras, sobre toallas absorbentes, en las cuales se les garantizó un mínimo de 90 % de humedad ambiental. Cuando las semillas germinaron se trasplantaron a potes plásticos de dos kilogramos de capacidad para la evaluación de cada uno de los tratamientos.
Preparación de los sustratos y condiciones del experimento
El suelo que se utilizó para la conformación de los sustratos evaluados fue un Oxisol, perteneciente a la colección de suelos del Laboratorio de Microbiología Ambiental de la Universidad Nacional de Colombia de Medellín, el cual fue colectado del centro experimental Carimagua de CORPOICA, Vichada-Colombia. Por su parte, la cascarilla de arroz fue obtenida de los subproductos de esta industria, la cual fue lavada con abundante agua de acueducto, con el fin de eliminar residuos de herbicidas y, posteriormente, fue secada mediante acción directa de los rayos solares.
La arena utilizada fue del tipo gruesa con tamaño de partículas mayores a 1 mm de diámetro.
Estos tres materiales fueron autoclavados (0,1 MPa y 121 ºC, por dos ciclos de 1 h cada uno), con el fin de eliminar la acción de microorganismos benéficos o perjudiciales, que pudieran alterar los resultados del experimento.
Para la enmienda se utilizó una de origen mineral y comercial con las siguientes proporciones de nutrientes: fosforo total: P2O5: 13 %; calcio total: CaO: 25 %; magnesio total: MgO: 7 %; azufre total: S: 10 %;
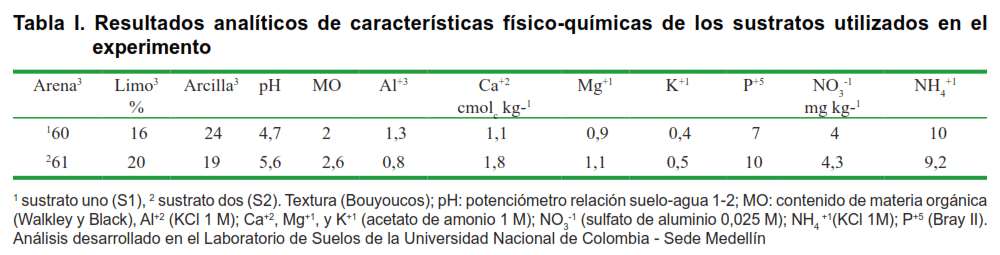
silicio total: SiO2: 6 % y Zinc: Zn: 0,35 %. Con estos elementos se prepararon los sustratos cuya caracterización química se presenta en la Tabla I.
Para el caso del sustrato uno y con el objetivo de mejorar el desarrollo del trabajo, el pH fue ajustado a 5,6 con la adición de CaO, previa curva de incubación de cal, mientras que la humedad en cada una de las unidades experimentales, durante el tiempo de duración del experimento, se mantuvo en condiciones de 40-50 % de la máxima capacidad de retención de humedad del sustrato. Cada planta se sembró en una maceta de dos kilogramos de capacidad (base seca).
Tratamientos evaluados
Se evaluaron ocho tratamientos y un control, los cuales se describen en la Tabla II. El suelo, la enmienda mineral y la cascarilla de arroz se adicionaron al principio de la evaluación. Por su parte, las tres dosis de fertilizantes se aplicaron al suelo de una forma constante repartidas homogéneamente en cuatro aplicaciones, a los 0, 20, 40 y 60 días después de la siembra de las plántulas en los potes. Como fuente de nitrógeno (N) se utilizó Urea y DAP (fosfato de diamónico), como fuente de potasio (K) se usó KCl (cloruro de potasio) y como fuente de fosforo (P) se utilizó DAP. Las dosis seleccionadas para la evaluación se determinaron según la composición base del sustrato uno (Tabla II) y a partir del criterio personal para lograr una relación 1-0,75-0,5 de NPK.
Variables evaluadas
Se determinó la altura de las plantas a los 0, 10, 20, 40, 60 y 80 días después de iniciado el tratamiento, la cual se cuantificó mediante un pie de rey digital (Mitutoyo Digimatic Caliper ®), desde la parte inferior del tallo, ubicada sobre el sustrato hasta la última yema apical desarrollada. Por su parte, al final del experimento (80 días), se evaluó el área foliar utilizando un medidor de área foliar Portable Area Meter Model LI-3000A (LI-COR ®) y la biomasa seca total de la planta, para lo cual se colectaron todas las partes de las plantas, se empacaron en bolsas de papel y fueron llevadas a estufa (Binder ®) a una temperatura constante de 60 ºC por 72 h.
Se cuantificó la concetración foliar de N (Kjeldhal), P (colorimétrico, complejo fosfo-monolíbdico)
y K (absorción atómica), previa descomposición de la muestra vía seca a 550 ºC y digestión ácida con ácido sulfúrico al 96 %, según la metodología estándar utilizada en el laboratorio de análisis de suelos de la Universidad Nacional de Colombia sede Medellín. Esta variable se representó como g Kg-1, para lo cual se tomó como relación la cantidad de materia seca tomada en la muestra para el análisis y se realizó la relación existente para un kilogramo de la hoja en materia seca.
Unidades experimentales y análisis estadístico
Las unidades experimentales consistieron en el sistema pote-planta. El diseño experimental fue completamente al azar y cada tratamiento contó con cinco repeticiones y dos en el tiempo. A las variables evaluadas en cada uno de los tratamientos se les analizó la homocedasticidad y normalidad de los datos, utilizando los criterios de Levene (10) y Kolmogorov-Smirnov (11) respectivamente. Posteriormente se sometieron a análisis de varianza de un factor (Anova) y las medias se compararon con la prueba de Tukey (P<0,05) (12); además, del intervalo de confianza de las medias para las variables determinadas en el tiempo (P<0,05).
RESULTADOS Y DISCUSIÓN
Altura de las plantas en el tiempo
La altura de las plantas mostró que para los periodos de evaluación 0, 10, 20 y 30 días después de la siembra de las plántulas no se presentaron diferencias estadísticas en ninguno de los tratamientos evaluados (Figura 1A). A partir de este periodo los tratamientos S2D2 (sustrato dos y dosis dos) y S1D2 (sustrato uno y dosis dos) presentaron una mayor altura, la cual fue más marcada con el trascurso del tiempo. En un lugar intermedio, se ubicaron los tratamientos S1D1 (sustrato uno y dosis uno) y S2D1 (sustrato dos y dosis uno), mientras que los tratamientos S1 (sustrato uno), S2 (sustrato dos), S1D3 (sustrato uno y dosis tres) y S2D3 (sustrato dos y dosis tres) presentaron la menor altura, la cual no difiere estadísticamente con respecto al control (C) (Figura 1A). Las diferencias encontradas para los tratamientos superiores (S2D2 y S1D2) presentan aumentos en la altura del 33,9 y 31,4 %, respectivamente, con respecto al control absoluto (C) (Figura 1A).
Área foliar y biomasa
Para la variable área foliar la prueba estadística Tukey (Figura 1B), arrojó que había diferencias estadísticas entre los tratamientos. Con los valores más altos asociados a esta variable se encontraron los tratamientos S1D2 y S2D2, cuyos aumentos fueron del 53 y 56 %, respectivamente, con respecto al control (C). En un lugar intermedio, los tratamientos S1D1, S2D1, S1D3 y S2D3, con aumentos del 39,6, 45,2, 41,5 y 43 % respectivamente al realizar su comparación con el control (C). En un nivel inferior con respecto a los tratamientos anteriores, se ubicaron los tratamientos S1 y S2, en los cuales los aumentos en el área foliar no fueron estadísticamente significativos al hacer su comparación con el control (C) (Figura 1B).
En lo que respecta a la biomasa seca total, el tratamiento que mayor biomasa acumuló fue el S2D2, siendo 52,7 % mayor con respecto al control (C). Le siguieron en importancia los tratamientos S2D1
y S1D2, con valores de biomasa del 37,5 y 44,7 % superiores al control (C). Para el caso de los tratamientos S1, S2, S1+D1, S1+D3 y S2+D3, la biomasa total fue inferior a los anteriores tratamientos y estadísticamente iguales al control (C) (Figura 1C).
La mayor altura, área foliar y biomasa encontrada se dio bajo la acción de los tratamientos, en los cuales se utilizó la dosis que hace referencia a la aplicación por plántula de 200 mg de N, 150 mg de P y 100 mg de K, lo cual indica que la especie Melina, en la etapa de vivero, responde a la adición de NPK, donde además influyo el sustrato, con mejores resultados (α <0,05) para altura y biomasa total cuando se usó el sustrato dos (S2), en comparación con el sustrato uno (S1) (Figura 1A y C).
Por otra parte, es importante resaltar que la respuesta de las plántulas de Melina a las adiciones de NPK, dependió de la dosis a utilizar, ya que bajo los niveles de 100 mg de N, 75 mg de P y 50 mg de K y 300 mg de N, 225 mg de P y 150 mg de K no hubo una respuesta favorable y por el contrario la dosis más alta fue la que presentó los resultados más bajos a nivel de crecimiento y desarrollo en las plántulas. Además, los datos sugieren también que esta respuesta estuvo influenciada por el tipo de sustrato, donde para la dosis uno de NPK la biomasa total fue superior (α <0,05), cuando se utilizó el sustrato dos (S2) (Figura 1C).
La respuesta de una planta a una práctica agronómica determinada es muy compleja y para el caso de los tratamientos evaluados la sola adición de fertilizantes ricos en NPK y los dos sustratos, pudieron dar lugar a múltiples condiciones, pero a partir de las variables evaluadas se vio como la especie Melina mostró una tendencia, la cual indica que hay una respuesta diferenciada hacia la dosis de NPK y el tipo de sustrato aplicado.
Es claro que las adiciones de NPK presentan un efecto positivo en el crecimiento de las plantas, dado su papel en múltiples procesos asociados al metabolismo de estas (13). Por su parte, el sustrato dos, al presentar la adición de una enmienda mineral compuesta, aporta otros nutrientes como calcio, magnesio, azufre y silicio, ayudando a mejorar la composición base de este sustrato (Tabla I), además de lograr con estos nutrientes una fertilización más balanceada (14, 15).
Los trabajos realizados hasta el momento en lo referente a la fertilización de Melina en la etapa de vivero, han estado más enfocados a determinar la dinámica de la absorción y determinar los niveles críticos foliares (14), pero pocos han evaluado la respuesta de esta planta a dosis de fertilizantes de origen químico y el efecto de distintos tipos de sustratos. Al respecto se ha determinado qué plántulas en vivero de G. arbórea responden adecuadamente a las adiciones de nitrógeno (5).
En lo que respecta a plantaciones en campo, se han realizado distintos estudios, en especial en las primeras etapas de desarrollo, donde se sugiere que el N y el P son los nutrientes más limitantes en la productividad de esta especie (16).
Por su parte, en un trabajo donde evaluaron la fertilización con N-P-K en Melina bajo condiciones de la costa colombiana, los resultados arrojaron que existe un respuesta positiva a dosis altas de N y K, siendo no significativo el uso de fertilizantes que contenían fosforo (17). Estos hallazgos concuerdan con el hecho de que adiciones por planta de 60 g de N, 30 g de P205, 120 g de K2O y 60 g de Mg, logran incrementos periódicos anuales del 29 % en el diámetro del tallo, 15 % en altura total, 30 % en área basal y 15 % en volumen total sin corteza de esta especie comparado con las parcelas testigo (18).
La adición de fertilizantes en etapas tempranas, como en vivero, es de suma importancia, ya que ayuda a mejorar la calidad de las plántulas, dando lugar a que bajo estas condiciones se puedan obtener altas tasas de sobrevivencia y crecimiento rápido en altura y diámetro, donde se considera que el nutriente más limitante es el nitrógeno (15).
Por otra parte, hay que tener en cuenta que muchas especies forestales en los estados iniciales de desarrollo son un poco recalcitrantes en la respuesta a distintas estrategias de fertilización, ya sea porque las necesidades en esta etapa es suplida por la cantidad de nutrientes que hay en el suelo (19) o por las características de la especie, las cuales pueden presentar alguna asociación simbiótica positiva con HMA (20–22) o bien pueden tolerar suelos pobres en nutrientes (13).
Concentración foliar de nutrientes
En la Tabla III se reporta las concentraciones foliares de nitrógeno (N), fósforo (P) y potasio (K) en plántulas de Melina, observándose diferencias estadísticas entre los tratamientos. Las concentraciones más altas (α<0,05) de NPK se encontraron en los tratamientos S1D3 y S2D3, con valores intermedios (α<0,05) los tratamientos S1D2 y S2D2, por su parte los tratamientos S1D1 y S2D1, presentaron concentraciones foliares de N y P estadísticamente superiores (α<0,05) al control (C) y los sustratos en forma individual (S1 y S2), pero no para K (α>0,05). Por su parte los sustratos (S1 y S2) y el control (C) presentaron concentraciones iguales de N y P.
A partir de los datos encontrados en este trabajo (Tabla III) y según lo reportado para los niveles foliares en etapa de vivero (14), se determinó que las concentraciones foliares en los tratamientos S1D3 y S2D3 estuvieron dentro del rango considerado como alto, indicando que muy posiblemente este elemento está siendo absorbido en cantidades mayores a las necesarias por la planta, dando lugar a que se presente un exceso de fertilización o un sustrato con contenidos muy altos de nutrientes.
Por su parte, los tratamientos S1D2 y S2D2 presentaron niveles foliares para NPK en el rango medio o adecuado, al igual que los tratamientos S1D1 y S2D1 para las concentraciones de N y P, pero para K, se ubicó en el rango considerado como bajo.
El contenido foliar en el rango medio o adecuado puede indicar que la planta está absorbiendo los nutrientes de una manera eficiente y que los niveles que hay en el sustrato y las adiciones realizadas son las necesarias para un apropiado crecimiento, sin que la ausencia de nutrientes como el N, P y K sea un limitante para la especie.
En el rango de la concentración foliar de NPK, considerado como bajo, se ubicaron los tratamientos S1, S2 y el control (C), además del S1D1 y S1D1 para el K, lo que podría indicar que bajo estas circunstancias la planta no está absorbiendo los nutrientes de una forma adecuada, por lo cual la ausencia de estos nutrientes puede afectar el desarrollo de la planta.
En trabajos desarrollados bajo condiciones de campo en los cuales se compara el desarrollo de las plantas de Melina, con base en la adición de fertilizantes y la evaluación de los niveles foliares,
se reporta que concentraciones de N por encima del 2,25 %, son los ideales, pero para este trabajo se carece de información sobre los niveles de otros nutrientes como P y K (23).
La concentración foliar de NPK en el rango optimo (Tabla II), coincidió con la mejor respuesta de Melina a nivel de altura, área foliar y biomasa (Figura 1), en los tratamientos S1D2 y S2D2. Por su parte para los tratamientos en los cuales se utilizó las dosis más altas (dosis 3), dieron lugar a concentraciones dentro de los niveles considerados como altos.
Para los sustratos (S1 y S2), las concentraciones de ubicaron en el rango bajo. Para ambos casos la respuesta en el desarrollo de las plantas se vio afectada.
La cantidad de nutrientes absorbidos desde la solución del suelo o sustrato y su respuesta en una especie, está directamente relacionado con su tasa de crecimiento y rendimiento, considerándose como alto en las primeras etapas y un poco más bajo en la senescencia (24). A partir de esto se puede sugerir que un aspecto importante a tener en cuenta en la fertilización de Melina en la etapa de vivero, es la dosis, ya que como se encontró en este trabajo, esta especie responde diferencialmente a esta, además del efecto encontrado del tipo de sustrato.
Por otra parte, es importante entender que las distintas especies responden diferencialmente a la fertilización con NPK en la etapa de vivero (25), ya que se tienen reportes en algunas especies, donde las adiciones de estos nutrientes no presentan efecto sobre parámetros de crecimiento, como el caso Vitellaria paradoxa (26). Por el contrario, hay reportes que indican que dosis crecientes de fertilizantes conducen a un mejor desarrollo, en especial si el fertilizante utilizado es una fuente de nitrógeno (27).
Este trabajo ratifica la importancia de realizar el análisis foliar de nutrientes en una especie cultivada,
el cual es un indicativo de los niveles de dichos nutrientes en la planta, y ser la base para definir parámetros asociados a la fertilización como la dosis, además de dar información indirecta del consumo de nutrientes e identificar problemas de disponibilidad de estos. Es por esto que esta estrategia debe estar asociada a una adecuada toma y análisis de los contenidos de nutrientes en la matriz del suelo, con el fin de contribuir a un programa de manejo integrado de la fertilidad del suelo.
Otro parámetro de suma importancia en el manejo de la fertilidad del suelo es la definición de la dosis adecuada, la cual está dada por factores como la fertilidad natural del suelo o sustrato, la disponibilidad e interacción de los iones en la matriz del suelo, las propiedades físicas de este, las condiciones climáticas, el genotipo de la especie objetivo, el estado de desarrollo de la planta y sus necesidades, las interacciones que la especie posea con la microbiota del suelo, los aportes que realiza la planta en los procesos de reciclaje de nutrientes, la eficiencia del fertilizante, entre otras (4, 13, 20).
Es por esto que la definición de la dosis adecuada es bastante compleja y requiere que se realice de una forma holística, buscando integrarla con las relaciones simbióticas entre especies vegetales y microorganismos que pueden favorecer la toma y eficiencia de un determinado nutriente como lo es el papel de los HMA en la absorción del P, los cuales han demostrado efectos positivos en muchas especies vegetales (14, 20, 22), e igualmente en el desarrollo de plántulas de Melina (4, 28).
CONCLUSIONES
El tratamiento de fertilización que mejor favoreció el crecimiento y desarrollo de Melina, en etapa de vivero, fue la aplicación de la dosis dos, la cual estuvo asociada a 200 mg de N, 150 mg de P y 100 mg de K, el cual logro también unas concentraciones foliares ubicadas en el rango medio o adecuado para esta especie.
El sustrato que mejor efecto presentó fue el dos, logrando mejorar la altura, área foliar y biomasa cuando se usó en combinación con las distintas dosis de NPK.
Las plantas sometidas a la dosis más alta de fertilizante (dosis tres), presentaron concentraciones foliares ubicadas en el rango denominada superior o en exceso, la cual no favoreció el desarrollo de las plantas.
AGRADECIMIENTOS
En este trabajo se quiere agradecer al profesor Nelson Walter Osorio, docente de la Universidad Nacional de Colombia por su ayuda en el proceso de definición de las dosis de NPK utilizadas en el ensayo. Además, se quiere agradecer todo el apoyo recibido por el personal técnico del laboratorio de Microbiología Ambiental y Fisiología Vegetal de la misma institución.
BIBLIOGRAFÍA
1. Dvorak, W. S. “World view of Gmelina arborea: opportunities and challenges”. New Forests, vol. 28,
no. 2-3, 2004, pp. 111-126, ISSN 0169-4286, 1573-5095, DOI 10.1023/B:NEFO.0000040940.32574.22.
2. Zambrano, J. A. y Díaz, L. A. “Efecto de la inoculación de Azospirillum brasilense y Glomus sp. en Gmelina arborea durante su germinación y manejo en vivero”. Universitas Scientiarum, vol. 13, no. 2, 2008, pp. 162-170, ISSN 2027-1352.
3. Hernández, W. y Salas, E. “La inoculación con Glomus fasciculatum en el crecimiento de cuatro especies forestales en vivero y campo”. Agronomía Costarricense, vol. 33, no. 1, 2009, ISSN 2215-2202, [Consultado: 31 de enero de 2017], Disponible en: <http://revistas.ucr.ac.cr/index.php/agrocost/article/view/6732>.
4. Ramírez, J.; Morales, J. y Osorio, W. “Desarrollo de Gmelina arbórea Roxb. inoculada con cinco cepas de hongos formadores de micorriza arbuscular (HMA) en etapa de vivero”. Colombia Forestal, vol. 15, no. 1, 2012, p. 49, ISSN 0120-0739.
5. Ogbonnaya, C. I. y Kinako, P. D. “Growth and mineral nutrition of Gmelina arborea Roxb. seedlings fertilized with four sources of nitrogen on a latosolic soil”. Tree Physiology, vol. 12, no. 3, 1993, pp. 291-299, ISSN 1758-4469.
6. Klimek, R.; Rolbiecki, S. y Rolbiecki, R. “Effect of irrigation and organic fertilization on oribatid mites (Acari, Oribatida) in forest nursery”. Scientific Research and Essays, vol. 8, no. 5, 2013, pp. 227-237, ISSN 1992-2248, DOI 10.5897/SRE12.680.
7. Carpanezzi, A. A.; Brito, J. O.; Fernandes, P. y Filho, J. “Teor de macro e micronutrientes em folhas de diferentes idades de algumas essências florestais nativas”. Anais da Escola Superior de Agricultura Luiz de Queiroz, vol. 33, 1976, pp. 225-232, ISSN 0071-1276, DOI 10.1590/S0071-12761976000100018.
8. Martínez, D. B.; Barroetaveña, C. y Rajchenberg, M. “Influencia del régimen de fertilización y del momento de inoculación en la micorrización de Pinus ponderosa en la etapa de vivero”. Bosque (Valdivia), vol. 28, no. 3, 2007, pp. 226-233, ISSN 0717-9200, DOI 10.4067/S0717-92002007000300007.
9. Maldonado-Benítez, K. R.; Aldrete, A.; López-Upton, J.; Vaquera-Huerta, H. y Cetina-Alcalá, V. M. “Producción de Pinus greggii Engelm. En mezclas de sustrato con hidrogel y riego, en vivero”. Agrociencia, vol. 45, no. 3, 2011, pp. 389-398, ISSN 1405-3195.
10. Levene, H. “Robust tests for the equality of variance” [en línea]. En: Olkin I., Contributions to Probability and Statistics: Essays in Honor of Harold Hotelling, Ed. Stanford University Press, 1960, pp. 278-292, ISBN 978-0-8047-0596-7, [Consultado: 3 de junio de 2016], Disponible en: <https://books.google.com.cu/books?id=ZUSsAAAAIAAJ>.
11. Massey, F. J. “The Kolmogorov-Smirnov Test for Goodness of Fit”. Journal of the American Statistical Association, vol. 46, no. 253, 1951, pp. 68-78, ISSN 0162-1459, 1537-274X, DOI 10.1080/01621459.1951.10500769.
12. Tukey, J. W. “Bias and confidence in not quite large samples”. The Annals of Mathematical Statistics, vol. 29, no. 2, junio de 1958, pp. 614-623, ISSN 0003-4851, DOI 10.1214/aoms/1177706647.
13. Marschner, H. Marschner’s Mineral Nutrition of Higher Plants [en línea]. 3.a ed., Ed. Academic Press, 2011, London, 672 p., ISBN 978-0-12-384905-2, [Consultado: 31 de enero de 2017], Disponible en: <https://www.amazon.com/Marschners-Mineral-Nutrition-Higher-Plants/dp/0123849055>.
14. Zuluaga, J.; Osorio, V.; Gutiérrez, B.; Romero, J.; Rodríguez, M.; Pérez, D.; Solipa, F.; Martínez, J.; Baquero, C.; Ramírez, M. y Roveda, G. Niveles nutricionales en vivero y en establecimiento de plantaciones de dos especies forestales (Gmelina arbórea y Pachira quinata) en el Caribe colombiano. Ed. Corpoica, 2011, Colombia, 40 p., ISBN 978-958-740-047-2.
15. Sepúlveda, Y. L.; Diez, M. C.; Moreno, F. H.; León, J. D. y Osorio, N. W. “Effects of Light Intensity and Fertilization on the Growth of Andean Oak Seedlings at Nursery”. Acta Biológica Colombiana, vol. 19, no. 2, 2014, pp. 211-220, ISSN 0120-548X, DOI 10.15446/abc.v19n2.40091.
16. Agus, C.; Karyanto, O.; Kita, S.; Haibara, K.; Toda, H.; Hardiwinoto, S.; Supriyo, H.; Na’iem, M.; Wardana, W.; Sipayung, M. S.; Khomsatun y Wijoyo, S. “Sustainable site productivity and nutrient management in a short rotation plantation of Gmelina arborea in East Kalimantan, Indonesia”. New Forests, vol. 28, no. 2-3, 2004, pp. 277-285, ISSN 0169-4286, 1573-5095, DOI 10.1023/B:NEFO.0000040954.27630.2f.
17. Cadena, M. y Guauque, G. “Respuesta a la fertilización N: P: K en plantación de Gmelina arborea. Bosque Seco Tropical (Bajo Magdalena-Colombia)” [en línea]. En: XIII World Forestry Congress, Ed. FAO, Buenos Aires, Argentina, 2009, pp. 18–23, [Consultado: 10 de febrero de 2017], Disponible en: <http://www.fao.org/forestry/37076/es/>.
18. Barrios, A.; López, A. M.; Nieto, V.; Burgos, N.; Yaya, M. y González, I. “Efecto del control de malezas y fertilización sobre el crecimiento inicial de una plantación de Gmelina arborea Roxb. en el departamento del Tolima, Colombia”. Colombia Forestal, vol. 14, no. 1, 2011, pp. 31-40, ISSN 0120-0739.
19. Bubb, K. A.; Xu, Z. H.; Simpson, J. A. y Safligna, P. G. “Growth response to fertilisation and recovery of 15N-labelled fertiliser by young hoop pine plantations of subtropical Australia”. Nutrient Cycling in Agroecosystems, vol. 54, no. 1, 1999, pp. 81-92, ISSN 1385-1314, 1573-0867, DOI 10.1023/A:1009725514807.
20. Ramírez, J. G.; Osorno, L.; Osorio, N. W. y Morales, J. G. “Alternativas Microbiológicas para Mejorar el Crecimiento del Caupí”. Revista Facultad Nacional de Agronomía, vol. 66, no. 2, 2013, pp. 7035-7044, ISSN 2248-7026.
21. Ramírez, J. G.; Castañeda, D. A. y Morales, J. G. “Alternativas microbiológicas para el manejo de Phytophthora cinnamomi Rands., en Persea americana Mill. bajo condiciones de casa-malla”. Cultivos Tropicales, vol. 35, no. 4, 2014, pp. 19-27, ISSN 0258-5936.
22. Ramírez, J. G.; Muñoz, M.; Osorno, L.; Osorio, N. W. y Morales, J. G. “Germination and growth of purple passion fruit seedlings under pre-germination treatments and mycorrhizal inoculation”. Pesquisa Agropecuaria Tropical, vol. 45, no. 3, 2015, pp. 257-265, ISSN 1983-4063, DOI 10.1590/1983-40632015v4533273.
23. Rojas, F.; Arias, D.; Moya, R.; Meza, A.; Murillo, O. y Arguedas, M. Manual para productores de melina Gmelina arborea en Costa Rica [en línea]. Ed. Instituto Técnico de Costa Rica, 2004, Cartago, 314 p., [Consultado: 31 de enero de 2017], Disponible en: <http://www.sirefor.go.cr/Documentos/Especies_plantaciones/MELINA/Manual%20para%20los%20productores%20de%20melina.pdf>.
24. Rengel, M.; Gil, F. y Montaño, J. “Crecimiento y dinámica de acumulación de nutrientes en caña de azúcar. I. Macronutrientes”. Bioagro, vol. 23, no. 1, 2011, pp. 43-50, ISSN 1316-3361.
25. del Campo, A. D.; Hermoso, J.; Ceacero, C. J. y Navarro-Cerrillo, R. M. “Nursery location and potassium enrichment in Aleppo pine stock 1. Effect on nursery culture, growth, allometry and seedling quality”. Forestry: An International Journal of Forest Research, vol. 84,
no. 3, 2011, pp. 221-234, ISSN 0015-752X, DOI 10.1093/forestry/cpr008.
26. Yakubu, F. B.; Asinwa, I. O.; Shodeke, D. K. A.; Williams, O. A. y Obekpa, N. B. “Effects of NPK fertilizer on the shoot growth of Vitellaria paradoxa C.F. Gaertn”. African Journal of Environmental Science and Technology, vol. 9, no. 1, 2015, pp. 8-11, ISSN 1996-0786,
DOI 10.5897/AJEST09.171.
27. Jackson, D. P.; Dumroese, R. K. y Barnett, J. P. “Nursery response of container Pinus palustris seedlings to nitrogen supply and subsequent effects on outplanting performance”. Forest Ecology and Management, vol. 265, 2012, pp. 1-12, ISSN 0378-1127, DOI 10.1016/j.foreco.2011.10.018.
28. Ramírez, J.; Osorio, W. y Morales, J. “Determinación de la dependencia y colonización micorrizal de cinco cepas de HMA en Gmelina arbórea roxb”. Colombia Forestal, vol. 15, no. Suppl. 1, 2012, p. 48, ISSN 0120-0739.
Recibido: 17/02/2016
Aceptado: 13/10/2016
M.Cs. Joaquín Guillermo Ramírez, Estudiante de doctorado Universidad Nacional de Colombia Sede Medellín. Email: jgramireg@unal.edu.co