Respuesta de la planta de arroz (Oryza sativa L.) a la suspensión de la lámina de agua en tres momentos de su desarrollo. Parte I
Response of rice (Oryza sativa L.) plant to suspension of the water lamina in three moments of its development. Part I
Dr.C. Michel Ruiz-Sánchez,I Yaumara Muños-Hernández,II Dr.C. José M. Dell'Ámico-Rodríguez,I Dr.C. Juan A. Cabrera-Rodríguez,I Ricardo Aroca,III Juan M. Ruiz-LozanoIII
IInstituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32 700.
IIUniversidad Hermanos Saiz Montes de Oca.
IIIEstación Experimental del Zaidín, Granada, España.
RESUMEN
El uso eficiente del agua de riego en el cultivo del arroz es prioritario, debido a los volúmenes de agua que consume este cereal; por tal motivo se hace necesario la aplicación de alternativas que disminuyan los volúmenes de agua a utilizar, sin que se afecte el rendimiento agrícola. La investigación se realizó en la Estación Experimental del Zaidín, Granada, España, en condiciones semi-controladas en macetas plásticas, con plantas de arroz `INCA LP-5´, que se cultivaron en condiciones de anaerobiosis y fueron expuestas a déficit hídrico, mediante la suspensión de la lámina de agua en tres momentos, a los 30, 40 y 50 DDT por un periodo de 15 días. Se evidenció que la suspensión de la lámina de agua provocó un estrés hídrico en la planta, que se manifestó a través de la disminución del desarrollo aéreo de la planta, el potencial hídrico foliar y la conductancia estomática. Por el contrario, se incrementó la masa radical de la planta, el contenido de prolina, de peróxido de hidrógeno, el daño oxidativo y el contenido del antioxidante glutation, a la vez que disminuyó el ascorbato reducido. En sentido general, el déficit hídrico en la planta se agudizó cuando se aplicó a los 50 DDT, respecto a la suspensión de la lámina de agua a los 30 DDT.
Palabras clave: antioxidante, conductancia estomática, inundado, irrigación, potencial hídrico.
ABSTRACT
The efficient use of irrigation water in rice cultivation is a priority, due to the volume of water consumed this grain; for this reason the application of alternatives that reduce the volumes of water to use is necessary, without it affecting the agricultural performance. The research was conducted at the Experimental Station of Zaidín, Granada, Spain, in semi-controlled plastic flowerpots conditions with rice plants `INCA LP-5’, which were cultured under anaerobic conditions and were exposed to water deficit by the suspension of the water lamina in three stages, at 30, 40 and 50 DAT for a period of 15 days. It was evident that the suspension of the lamina of water caused water stress on the plant, which manifested itself through decreased air plant growth, leaf water potential and stomatal conductance. On the contrary, the plant root mass, the content of proline, hydrogen peroxide, oxidative damage and antioxidant glutathione content increased, while the reduced ascorbate decreased. In general, the water deficit worsened in the plant when applied to the 50 DAT, regarding the suspension of the water level at 30 DAT.
Key words: antioxidant, stomatal conductance, floow, water, potential hydric.
INTRODUCCIÓN
En Cuba, el arroz se cultiva en tres condiciones diferentes en función del agua que se aplica.
La primera condición es con riego o aniego, que necesita suficiente disponibilidad de agua para garantizarle al cultivo, en todo o en gran parte de su ciclo, con una lámina de agua de 10 cm aproximadamente. La segunda, se conoce como arroz de secano, dependiente de las precipitaciones durante todo su ciclo biológico, que exige como aproximado 200 mm de lluvia por mes y es importante, tanto la cantidad, como la frecuencia de las lluvias. En estas condiciones, este cereal sufre serias afectaciones por la falta de agua a lo largo de su ciclo, cuando no existen precipitaciones abundantes, ni fuentes estables de abastecimiento. Por último, el cultivo de arroz en condiciones de secano favorecido, también es dependiente de las lluvias, pero en ocasiones recibe abastecimiento de agua por riego (1). A pesar de que el arroz se cultiva en las tres condiciones antes mencionadas, el aniego permanente representa la superficie mayor (2) y los rendimientos aun no superan las 3,5 t ha-1 como promedio nacional (1).
Desde la década de los 90` se realizaron investigaciones relacionadas con el manejo del agua, a través de la aplicación de un déficit hídrico (estrés hídrico) en la fase vegetativa en el cultivo del arroz por siembra directa, las cuales demostraron el incremento del rendimiento agrícolaA; resultados que se incluyeron en las Normas Técnicas del Cultivo del 2005. No obstante, estas investigaciones no profundizaron en la respuesta fisiológico y bioquímico a nivel de la planta y no incluyeron la forma de producción de arroz por la tecnología de trasplante. El arroz cultivado por esta tecnología consume menos agua que el arroz que se cultiva por siembra directa (3), aun así, no se ha informado para esta tecnología el momento que se puede aplicar un déficit hídrico, como alternativa para ahorrar agua de riego e incrementar el rendimiento agrícola.
En Cuba han realizado varios estudios que profundizaron en el efecto del déficit hídrico inducido en estadios tempranos del crecimiento en el arroz, para identificar variables fisiológicas que faciliten la selección de variedades tolerantes y conocer la contribución de los carbohidratos del tallo en el llenado de los granos por siembra directa (4).
Una forma posible de aumentar el rendimiento agrícola del arroz, con una eficiencia mayor en el uso del agua, pudiera ser la aplicación del estrés hídrico durante la fase vegetativa. El objetivo de esta primera parte es evaluar la respuesta fisiológica y bioquímica del arroz cultivado en condiciones de anaerobiosis y expuestos a suspensión de la lámina de agua por un periodo de 15 días en la fase vegetativa.
MATERIALES Y MÉTODOS
La investigación se realizó en la Estación Experimental del Zaidín, Granada, España (EEZ) en el año 2010 en condiciones de invernadero, con plantas de arroz cv. INCA LP-5.
Inicialmente se estableció un semillero de arroz en bandejas plásticas de 0,40 x 0,80 x 0,08 m con arena estéril. Para lograr la germinación del arroz, se regaron las bandejas hasta lograr una lámina de agua de 5 cm por encima de la superficie de la arena por un periodo de 24 horas, momento a partir del cual se desaguó la bandeja, manteniendo la arena a máxima capacidad de retención de agua, hasta que brotaron dos hojas por planta. Con posterioridad, se restableció la lámina de agua de 3 cm hasta
los 30 días después de la emergencia (DDE).
A los 30 DDE se trasplantó una planta en cada maceta de 1 kg de capacidad (0,18 m de alto
y 0,13 m de diámetro), que contenían un sustrato compuesto por arena (granulometría <1 mm) y suelo (granulometría <5 mm) en proporción 1:1 (v:v). Previamente se esterilizó la arena a 120 ºC durante 20 min, en una autoclave Selecta, modelo PRESOCLAVE-II 75 L, y el suelo a 95-100 ºC,
durante 60 min diarios por tres días consecutivos. El suelo que se utilizó, se clasificó como Fluvisol Háplico Calcáreo (5), el que presentó un pH de 8,1 (medido por potenciometría), 1,81 % de materia orgánica (6), fósforo asimilable 6,2 mg kg-1 (P-Olsen) y potasio intercambiable 0,34 cmol kg-1 (extracción con NH4OAc 1 mol L-1 a pH 7).
Las macetas se colocaron en el invernadero donde se estableció el semillero, con temperaturas
de 26 y 22 ºC (día/noche, respectivamente). La humedad relativa entre 50-70 %, fotoperiodo de 16 horas de luz y 8 horas de oscuridad y radiación fotosintéticamente activa de 850 µmol m-2 s-1, medida con un LICOR portátil (Lincoln, NE, EE.UU., modelo LI-188B); siguiendo un diseño experimental Completamente Aleatorizado, con arreglo bifactorial y cinco repeticiones. Se emplearon 15 macetas por tratamiento, que permitieron realizar las evaluaciones después de cada periodo sin lámina de agua.
El suministro de agua consistió, en mantener una lámina de agua de 5 cm sobre la superficie del sustrato en todos los tratamientos. Al 50 % de las macetas se le suspendió la misma a los 30, 40 y 50 días antes del trasplante (DDT), por un periodo de 15 días. Momento en el cual se repuso la lámina de agua que permaneció hasta los 15 días antes de efectuar la cosecha. El grupo de macetas a las que no se les suspendió la lámina de agua quedaron como tratamientos testigos.
La aplicación total de nutrientes, correspondiente a 0,123 g de N; 0,050 g de P2O5 y 0,059 g de K2O por maceta, se realizó a los 20, 35 y 60 DDT, aplicando en cada momento el 30, 40 y 30 %, respectivamente, utilizando como portadores Urea (46 % de N), Superfosfato Triple (46 % de P2O5) y Cloruro de Potasio (60 % de K2O), respectivamente.
Muestreo y evaluaciones realizadas
Se tomaron cinco plantas por tratamiento a los 15 días después de la suspensión de la lámina de agua (45, 55 y 65 DDT), para evaluar la altura de las plantas (AP), la masa fresca aérea (MFA)
y de las raíces (MFR), el rendimiento agrícola y sus componentes, el potencial hídrico foliar (Ψh),
la conductancia estomática (CE), los contenidos foliares de prolina (PRO), peróxido de hidrógeno (H2O2), de daño oxidativo a lípidos (DOL), el contenido de ascorbato reducido (ASC), el glutation reducido (GSH), además de la colonización micorrízica en la raíz.
La AP se midió desde la superficie del sustrato hasta el extremo superior de la hoja más larga proyectada en la misma dirección del tallo. La MFA y la MFR se determinaron por separado, a través de un corte que se realizó en la base del tallo, las masas de ambos se midieron en una Balanza Técnica (Denver Instrument PK-601, con margen de error de 0,01 g) y se expresó en g planta-1.
El Ψh se determinó por el método Psicrométrico (7), dos horas después de iniciarse el fotoperiodo diurno (entre las 9:00 y 10:00), para lo cual se utilizó un sistema integrado por el microvoltímetro HR-33T conectado a una cámara psicrométrica C52 (Wescor Inc, Logan, UT, USA). Se tomaron 10 discos (0,005 m de diámetro) por tratamiento, de la parte central de las hojas de la planta y se colocaron en la cámara durante 15 min, para estabilizar la temperatura y el vapor de agua del disco, antes de realizar la lectura del Ψh, el cual se expresó en MPa.
La CE se midió utilizando un Porómetro AP4 (Delta-T Devices Ltd, Cambridge, Reino Unido), en las mismas horas en las que se determinó el Ψh y se expresó en mmol H2O m-2 s-1. Ambas variables se midieron en las hojas bien desarrolladas del tercio superior de la planta.
Para los análisis bioquímicos de PRO, H2O2, DOL y GSH, se tomaron tres muestras cada una de 0,5 g por planta y de 0,2 g por planta para el ASC, que se congelaron en el momento de los muestreos con nitrógeno líquido y se conservaron a -80 ºC.
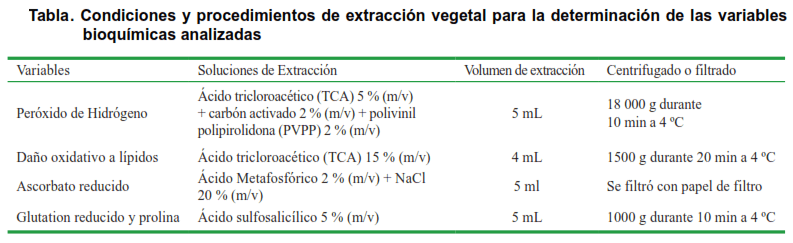
Después de macerar las muestras en nitrógeno líquido y añadido solución de extracción específica para cada variable (Tabla), se centrifugó o filtró según correspondió y se extrajo el sobrenadante (extracto). El precipitado de cada extracción, se colectó en Eppendorf estériles, previamente pesados para determinar la masa seca (MS). En todos los casos se midió la absorbancia por espectrofotometría de absorción molecular (Hitachi, modelo U-1900, Japón).
La PRO se determinó a 530 nm de absorbancia (8), utilizando reactivo de ninhidrina. Se realizó una curva patrón a partir de una solución de prolina (1 mM) con las siguientes concentraciones: 0, 25, 50,100, 200 y 300 µM) de prolina.
El contenido de peróxido de hidrógeno se determinó en las hojas (9), a 508 nm absorbancia. Como blanco se utilizó TCA 5 % en lugar de extracto y la curva patrón se preparó con H2O2 disuelto en solución de extracción (Tabla). El contenido de H2O2 se expresó en nmol g-1 MS.
El daño oxidativo a lípidos se determinó mediante la lectura de la absorbancia a 532 y 600 nm (10), este parámetro se estimó a partir del contenido de sustancias reactivas de ácido tiobarbitúrico y se expresó como equivalentes de MDA (11). Como blanco se utilizó solución de extracción en lugar de extracto (Tabla) y para la curva patrón se preparó con malondialdehído (MDA) disuelto en solución de extracción, en el rango de 0,1-10 nmol. El DOL se expresó en nmol MDA g-1 MS.
El contenido de ASC se cuantificó a 524 nm (12). Como blanco se utilizó solución de extracción en lugar de extracto (Tabla). El contenido de ascorbato reducido se expresó en nmol g-1 MS.
El contenido de GSH se determinó, a 412 nm durante 5 min con un intervalo de 1 min (13). Como blanco se utilizó solución de extracción en lugar de extracto (Tabla) y para la curva patrón se utilizó glutation oxidado (GSSG) disuelto en solución de extracción. El contenido de glutation reducido se expresó en nmol g-1 MS.
Las medias de los tratamientos se compararon a partir de los intervalos de confianza para α=0,05.
RESULTADOS Y DISCUSIÓN
La suspensión de la lámina de agua (Con E) condicionó el agrietamiento del sustrato en la maceta, además del enrollamiento y erección de las hojas, evidenciando un déficit hídrico en la planta, en los tres momentos que se suspendió la lámina de agua (Figura 1).
Comportamiento de otros indicadores fisiológicos en las plantas
En la Figura 2 se presenta el efecto en la altura (AP), la acumulación de masa fresca de la parte aérea (MFA) y de las raíces (MFR) de plantas de arroz que permanecieron con una lámina de agua desde el momento del trasplante (Sin E) y que fueron expuestas a suspensión de la lámina de agua (Con E) por un periodo de 15 días, a los 30, 40 y 50 DDT.
Las plantas expuestas a suspensión de la lámina de agua mostraron menor AP (Figura 2A) y MFA (Figura 2B). En el caso de la MFR se presentaron los valores mayores en las plantas expuestas a suspensión de la lámina de agua en los tres momentos que se impuso esta condición (Figura 2C).
La variable potencial hídrico foliar (Ψh) y conductancia estomática (CE) se muestran en la Figura 3. El periodo sin lámina de agua provocó un estrés hídrico en la planta, que se incrementó en la medida en que el estrés se impuso más tardíamente, reflejado esto en una disminución del Ψh (Figura 3A).
Las plantas que se expusieron a suspensión de la lámina de agua en los tres momentos, evidenciaron déficit hídrico, reflejado esto en una disminución de la CE (Figura 3B). La CE, siempre fue mayor en las plantas testigos (Sin E), encontrándose los valores mayores en aquellas evaluadas a los 45 DDT. Bajo estas condiciones, no se apreciaron diferencias a los 45 y 55 DDT.
La disminución del Ψh y la CE indicaron un déficit hídrico en las plantas provocado por la reducción del suministro de agua, variables que se han utilizado como indicadores de estrés por déficit hídrico en otros cultivos, como en tomate (14), Sorghum bicolor L. Moench (15), en maíz (16) y en el arroz (3, 17).
En la medida que el estrés hídrico se impuso más tardíamente, se correspondió con la limitación del crecimiento y desarrollo de la planta de arroz, lo que pudiera atribuirse a una disminución de la entrada de CO2 en las células y una baja eficiencia en el uso de la luz; a la vez que pudo provocar la inactivación del sistema fotosintético y por lo tanto, las plantas no produjeron asimilados suficientes que contribuyeran con la división celular del tejido meristemático para el crecimiento de la planta (18).
Resultados similares se informaron al cultivar arroz en condiciones no inundadas e inundadas (19).
Estos mismos autores destacaron que el arroz es sensible a potenciales hídricos en el suelo inferiores a -30 KPa y además de que, el estrés hídrico estimula el crecimiento radical. Aunque, a este nivel de potencial no se reduce la transpiración en otros cultivos de secano, en arroz sí ocurre (19), por presentar una elevada sensibilidad en los estomas, lo que está relacionado con los mecanismos de señalización de la raíz a través del ABA para evitar las pérdidas de agua (20, 21).
Todo lo anterior indicó que la respuesta encontrada en cuanto al Ψh y CE, también se relaciona con la capacidad de absorción de agua de las plantas y presumiblemente con la conductividad hidráulica de la raíz; lo que al parecer disminuyó la resistencia al paso del agua, a pesar de un crecimiento mayor de las raíces, respecto al tratamiento testigo (Sin E).
Los rangos de Ψh encontrados con la imposición del estrés hídrico por un periodo de 15 días, indicaron que este fue severo para aquellas plantas que fueron expuestas al mismo a los 40 y 50 DDT y de moderado a los 30 DDT, según los rangos propuestos desde el año 1973 (22). Propuesta que se realizó a partir de un análisis de los resultados publicados sobre el efecto del estrés hídrico en las plantas y definió tres grados de estrés para categorizar el estado hídrico de la planta, teniendo en cuenta los valores de Ψh y el contenido relativo de agua (CRA):
Déficit hídrico ligero: cuando el Ψh es mayor de -5 bar (-0,5 MPa) y el CRA se reduce en un 8-10 %.
Déficit hídrico moderado: el Ψh está entre -5 bar (-0,5 MPa) a -12 o -15 bar (-1,2 MPa o -1,5 MPa) y el CRA decrece entre 10 y 20 %.
Déficit hídrico severo: el Ψh es menor de -15 bar (-1,5 MPa) y el CRA disminuye en más de 20 %.
Teniendo como referente la categorización propuesta se corrobora que, para los tratamientos expuestos a déficit hídrico a los 40 y 50 DDT el estrés hídrico fue severo, dado probablemente por modificaciones bioquímicas durante la exposición al estrés (9), como se analizará a continuación.
Comportamiento de indicadores bioquímicos en las plantas
En la Figura 4, se muestra el contenido de prolina (PRO), de peróxido de hidrógeno (H2O2), el daño oxidativo a lípidos (DOL), contenido de ascorbato reducido (ASC) y de glutation reducido (GLT) en las plantas de arroz.
En cada momento de evaluación se encontró que en los tratamientos sin estresar (Testigo) las plantas presentaron los contenidos menores de PRO, dicho contenido disminuyó cuando estas tuvieron un crecimiento y desarrollo mayor (Figura 4A).
Los contenidos de H2O2 a los 30, 40 y 50 DDT fueron bajos en las plantas testigos (Sin E) (Figura 4A), respecto a los tratamientos expuestos a estrés hídrico (Con E), en estos se incrementó el contenido de H2O2 en la medida que más tardíamente se aplicó el estrés (50 DDT).
El DOL (Figura 4C) fue menor en las plantas que no se expusieron a estrés por déficit de agua (Sin E) y entre estas, fue superior al evaluar este indicador a los 45 DDT. Los valores mayores de DOL se encontraron en las plantas expuestas a estrés hídrico y dentro de estos tratamientos la imposición de esta condición a los 30 DDT presentó valores superiores.
Al analizar los contenidos de la molécula antioxidante no enzimática ASC (Figura 4D), se encontraron incrementos de la misma en los tratamientos testigos en los tres momentos en que fueron evaluados (45, 55 y 65 DDT) y entre estos los contenidos más altos correspondieron a las plantas evaluadas a los 45 DDT.
Por otra parte, en los tratamientos expuestos a estrés hídrico los contenidos de ASC disminuyeron en la medida en que el estrés se impuso más tardíamente.
En cuanto al contenido de GSH (Figura 4E), los valores mayores se encontraron en las plantas de los tratamientos estresados, correspondiendo los valores superiores a las plantas evaluadas a los 45 DDT (el estrés se impuso a los 30 DDT).
Varios autores refieren una acumulación elevada e incrementos de la síntesis de PRO ante condiciones de estrés, como mecanismo osmoregulador y de ajuste osmótico en las plantas expuestas a estrés abiótico (20, 23), además de que el incremento de la PRO está directamente relacionado con la producción de H2O2 (24).
Los resultados encontrados en cuanto a la PRO, al finalizar el periodo de estrés hídrico (45 DDT) indicaron que, la PRO puede que esté expresado como señalizador de la condición a las que fueron expuestas las plantas, aun cuando se expresara como agente osmoprotector (19), o incluso haciendo las dos funciones. Estos dos mecanismos se informaron por varios autores (23, 24). La PRO es un indicador eficiente que se usa con frecuencia para valorar la tolerancia de las plantas ante una condición de estrés biótico o abiótico (4, 8, 16, 17, 23) y en la selección de cultivares tolerantes al estrés hídrico o la sequía (24).
El incremento del contenido de GSH se correspondió con la disminución del DOL y del contenido de H2O2 encontrados en las plantas de arroz, por lo que, se puede sugerir su relación directa en la reducción del H2O2 a H2O. En la eliminación del H2O2 participan otras enzimas antioxidantes tales como, peroxidasa (PRX), ascorbato peroxidasa (APX), glutation reductasa (GR), superóxido dismutasa (SOD) y catalasa (CAT), de conjunto con el ciclo ascorbato-glutation, dentro del mecanismo de defensa de la planta ante un déficit hídrico (25).
Al parecer dado los niveles de GSH encontrados, su acumulación en las plantas está relacionada con señales que regulan esta reacción, debido a que este contribuye con la regeneración del ASC (26, 27).
Resultados similares se informaron por otros autores (17, 20), coincidiendo con una reducción del DOL y del contenido de H2O2, cuando se incrementó el contenido de GSH, pero en plantas de arroz cultivadas en condiciones de aerobiosis expuestas a déficit hídrico por un periodo de 15 días. Diversos autores han utilizado el DOL como un indicador en las plantas expuestas a estrés biótico o abiótico, así como el contenido de peróxido de hidrógeno (25, 27–31).
Lo anterior permite interpretar que, en las condiciones de anaerobiosis el ASC es posible que realice funciones como la disminución de los excesos de ROS superior al GSH o viceversa, dentro del mecanismo ascorbato-glutation. Otra interpretación puede ser que, en estas condiciones se manifestó un aumento en la actividad enzimática, a partir de la oxidación o reducción de estas dos moléculas (ASC y GSH), aspecto no evaluado en este trabajo y resulta de interés continuar investigando este mecanismo de oxidación-reducción. Al respecto se informó la necesidad de cuantificar con exactitud las modificaciones del estado redox dentro de la célula, durante tensiones relativamente leves de estrés oxidativo (27), con la finalidad de cuantificar las trasformaciones reconocidas por las ROS que escapan del sistema antioxidante y cuantos se modulan por la vía del sistema de señales (28).
La acumulación del ASC y el GSH, además de contrarrestar la producción de H2O2 en la planta, pudieran estar participando en la eliminación de otras ROS, como es el caso de los radicales libres el superóxido (O2-), el hidroxilo (OH-) y el oxígeno singlete (1O2).
CONCLUSIONES
La suspensión de la lámina de agua por un periodo de 15 días provocó un estrés hídrico en la planta, que se manifestó a través de la disminución del crecimiento y desarrollo aéreo de la planta, el potencial hídrico foliar y la conductancia estomática, por el contrario, se incrementó la masa radical de la planta.
Desde el punto de vista bioquímico se incrementó el contenido de prolina, de peróxido de hidrógeno, el daño oxidativo y el contenido del antioxidante glutation, a la vez que disminuyó el ascorbato reducido.
En sentido general, el déficit hídrico en la planta se agudizó cuando se aplicó más tardíamente el mismo (50 DDT), respecto a la suspensión de la lámina de agua a los 30 DDT.
NOTAS AL PIE
APolón, R. “Impacto nacional en el incremento del rendimiento agrícola, economizar agua de riego y energía en el cultivo del arroz (Oryza sativa L.) como consecuencia del estrés hídrico” [en línea]. En: XVI Fórum de Ciencia y Técnica, 2007, Código: 0109604 02, [Consultado: 1 de diciembre de 2007], Disponible en: <http://www.forumcyt.cu/UserFiles/forum/Textos/0109604.pdf>.
BIBLIOGRAFÍA
1. Rivero, L. E. y Suárez, C. E. Instructivo Técnico Cultivo de Arroz. Ed. Asociación Cubana de Técnicos Agrícolas y Forestales, 2015, La Habana, Cuba, 73 p., ISBN 978-959-7210-86-3.
2. FAO. Cuba [en línea]. AQUASTAT - Sistema de Información sobre el Uso del Agua en la Agricultura de la FAO, 2016, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.fao.org/nr/water/aquastat/countries_regions/cub/indexesp.stm>.
3. García, A. “Efecto del déficit hídrico sobre la distribución de fotoasimilados en plantas de arroz (Orysa sativa L.)”. Interciencia, vol. 35, no. 1, 2010, pp. 47–54, ISSN 0378-1844, [Consultado: 14 de febrero de 2017], Disponible en: <http://search.proquest.com/openview/af060b488c17e5fc7cf9b4c21b12a543/1?pq-origsite=gscholar&cbl=21011>.
4. Anup, D.; Patel, D. P.; Ramkrushna, G. I.; Munda, G. C.; Ngachan, S. V.; Choudhury, B. U.; Mohapatra, K. P.; Rajkhowa, R.; Kumar, D. J. y Panwar, A. S. Improved Rice Production Technology – for resource conservation and climate resilience (Farmers’ Guide). Extension Bulletin, no. 78, Inst. ICAR Research Complex for NEH Region, 2012, Meghalaya, 33 p., ISBN 978-81-920769-5-9.
5. IUSS Working Group WRB. World Reference Base for soil resources 2014: international soil classification system for naming soils and creating legends for soil maps. (ser. World Soil Reports, no. ser. 106), Ed. Food and Agriculture Organization of the United Nations, 2014, Rome, 191 p., ISBN 978-92-5-108370-3.
6. Walkley, A. y Black, I. A. “An examination of the Degtjareff method for determining soil organic matter, and a proposed modification of the chromic acid titration method”. Soil science, vol. 37, no. 1, 1934, pp. 29–38, ISSN 0038-075X, 1538-9243, [Consultado: 22 de septiembre de 2016], Disponible en: <http://journals.lww.com/soilsci/citation/1934/01000/an_examination_of_the_degtjareff_method_for.3.aspx>.
7. Porcel, R. y Ruiz-Lozano, J. M. “Arbuscular mycorrhizal influence on leaf water potential, solute accumulation, and oxidative stress in soybean plants subjected to drought stress”. Journal of Experimental Botany, vol. 55, no. 403, 2004, pp. 1743-1750, ISSN 0022-0957, DOI 10.1093/jxb/erh188, [Consultado: 14 de febrero de 2017], Disponible en: <https://academic.oup.com/jxb/article/55/403/1743/531390/Arbuscular-mycorrhizal-influence-on-leaf-water>.
8. Bates, L. S.; Waldren, R. P. y Teare, I. D. “Rapid determination of free proline for water-stress studies”. Plant and Soil, vol. 39, no. 1, 1973, pp. 205-207, ISSN 0032-079X, 1573-5036, DOI 10.1007/BF00018060, [Consultado: 14 de febrero de 2017], Disponible en: <http://link.springer.com/article/10.1007/BF00018060>.
9. Aroca, R.; Irigoyen, J. J. y Sánchez-Díaz, M. “Drought enhances maize chilling tolerance. II. Photosynthetic traits and protective mechanisms against oxidative stress”. Physiologia Plantarum, vol. 117, no. 4, 2003, pp. 540-549, ISSN 1399-3054, DOI 10.1034/j.1399-3054.2003.00065.x, [Consultado: 14 de febrero de 2017], Disponible en: <http://onlinelibrary.wiley.com/doi/10.1034/j.1399-3054.2003.00065.x/full>.
10. Dhindsa, R. S.; Plumb-Dhindsa, P. y Thorpe, T. A. “Leaf Senescence: Correlated with Increased Levels of Membrane Permeability and Lipid Peroxidation, and Decreased Levels of Superoxide Dismutase and Catalase”. Journal of Experimental Botany, vol. 32, no. 1, 1981, pp. 93-101, ISSN 0022-0957, DOI 10.1093/jxb/32.1.93, [Consultado: 14 de febrero de 2017], Disponible en: <https://academic.oup.com/jxb/article-abstract/32/1/93/746156/Leaf-Senescence-Correlated-with-Increased-Levels>.
11. Halliwell, B. y Gutteridge, J. M. C. Free radicals in biology and medicine [en línea]. 2.a ed., Ed. Clarendon Press, 1989, Oxford, 568 p., ISBN 978-0-19-855294-9, Google-Books-ID: Eok5AQAAIAAJ, [Consultado: 14 de febrero de 2017], Disponible en: <https://books.google.co.in/books?id=Eok5AQAAIAAJ>.
12. Leipner, J.; Fracheboud, Y. y Stamp, P. “Acclimation by suboptimal growth temperature diminishes photooxidative damage in maize leaves”. Plant, Cell & Environment, vol. 20, no. 3, 1997, pp. 366-372, ISSN 1365-3040, DOI 10.1046/j.1365-3040.1997.d01-76.x, [Consultado: 14 de febrero de 2017], Disponible en: <http://onlinelibrary.wiley.com/doi/10.1046/j.1365-3040.1997.d01-76.x/full>.
13. Smith, I. K. “Stimulation of Glutathione Synthesis in Photorespiring Plants by Catalase Inhibitors”. Plant Physiology, vol. 79, no. 4, 1985, pp. 1044-1047, ISSN 1532-2548, DOI 10.1104/pp.79.4.1044, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.plantphysiol.org/content/79/4/1044>.
14. Fundora, L. R.; Mena, A.; Rodríguez, Y.; González, P. J.; Rodríguez, P. y González-Peña, D. “Estabilidad de la eficiencia de la cepa Glomus mosseae en la respuesta del tomate a condiciones de estrés hídrico fuera de su periodo óptimo”. Cultivos Tropicales, vol. 29, no. 4, 2008, pp. 47-53, ISSN 0258-5936, [Consultado: 14 de febrero de 2017], Disponible en: <http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0258-59362008000400007&lng=es&nrm=iso&tlng=es>.
15. Bárzana, G.; Aroca, R.; Paz, J. A.; Chaumont, F.; Martinez-Ballesta, M. C.; Carvajal, M. y Ruiz-Lozano, J. M. “Arbuscular mycorrhizal symbiosis increases relative apoplastic water flow in roots of the host plant under both well-watered and drought stress conditions”. Annals of Botany, vol. 109, no. 5, 2012, pp. 1009-1017, ISSN 0305-7364, DOI 10.1093/aob/mcs007, [Consultado: 14 de febrero de 2017], Disponible en: <https://academic.oup.com/aob/article/109/5/1009/140064/Arbuscular-mycorrhizal-symbiosis-increases>.
16. Bárzana, G.; Aroca, R. y Ruiz-Lozano, J. M. “Localized and non-localized effects of arbuscular mycorrhizal symbiosis on accumulation of osmolytes and aquaporins and on antioxidant systems in maize plants subjected to total or partial root drying”. Plant, Cell & Environment,
vol. 38, no. 8, 2015, pp. 1613-1627, ISSN 1365-3040, DOI 10.1111/pce.12507, [Consultado: 14 de febrero de 2017], Disponible en: <http://onlinelibrary.wiley.com/doi/10.1111/pce.12507/full>.
17. Ruiz-Sánchez, M.; Geada, D.; Muñoz, H. Y.; Martínez, A.; Santana, Y.; Benítez, M.; Aroca, R. y Ruiz-Lozano, J. M. “La simbiosis micorrízica arbuscular en plantas de arroz (Oryza sativa L.) sometidas a estrés hídrico. Parte II Respuesta bioquímica”. Cultivos Tropicales, vol. 36, no. 3, 2015, pp. 88-95, ISSN 0258-5936, [Consultado: 14 de febrero de 2017], Disponible en: <http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0258-59362015000300014&lng=es&nrm=iso&tlng=es>.
18. Zubaer, M. A.; Chowdhury, A. K. M. M. B.; Islam, M. Z.; Ahmed, T. y Hasan, M. A. “Effects of water stress on growth and yield attributes of aman rice genotypes”. International Journal of Sustainable Crop Production, vol. 2, no. 6, 2007, pp. 25-30, ISSN 1991-3036, [Consultado: 14 de febrero de 2017], Disponible en: <https://www.cabdirect.org/cabdirect/abstract/20083185007>.
19. Kato, Y. y Okami, M. “Root growth dynamics and stomatal behaviour of rice (Oryza sativa L.) grown under aerobic and flooded conditions”. Field Crops Research, vol. 117, no. 1, 2010, pp. 9-17, ISSN 0378-4290, DOI 10.1016/j.fcr.2009.12.003, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.sciencedirect.com/science/article/pii/S0378429009003335>.
20. Tseng, I.-C.; Hong, C.-Y.; Yu, S.-M. y Ho, T.-H. D. “Abscisic Acid- and Stress-Induced Highly Proline-Rich Glycoproteins Regulate Root Growth in Rice”. Plant Physiology, vol. 163, no. 1, 2013, pp. 118-134, ISSN 1532-2548, DOI 10.1104/pp.113.217547, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.plantphysiol.org/content/163/1/118>.
21. Augé, R. M.; Toler, H. D. y Saxton, A. M. “Arbuscular mycorrhizal symbiosis alters stomatal conductance of host plants more under drought than under amply watered conditions: a meta-analysis”. Mycorrhiza, vol. 25, no. 1, 2015, pp. 13-24, ISSN 0940-6360, 1432-1890, DOI 10.1007/s00572-014-0585-4, [Consultado: 14 de febrero de 2017], Disponible en: <http://link.springer.com/article/10.1007/s00572-014-0585-4>.
22. Hsiao, T. C. “Plant Responses to Water Stress”. Annual Review of Plant Physiology, vol. 24, no. 1, 1973, pp. 519-570, ISSN 1543-5008, DOI 10.1146/annurev.pp.24.060173.002511, [Consultado: 14 de febrero de 2017], Disponible en: <http://dx.doi.org/10.1146/annurev.pp.24.060173.002511>.
23. Ben-Rejeb, K.; Abdelly, C. y Savouré, A. “How reactive oxygen species and proline face stress together”. Plant Physiology and Biochemistry, vol. 80, 2014, pp. 278-284, ISSN 0981-9428, DOI 10.1016/j.plaphy.2014.04.007, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.sciencedirect.com/science/article/pii/S0981942814001417>.
24. Bunnag, S. y Pongthai, P. “Selection of Rice (Oryza sativa L.) Cultivars Tolerant to Drought Stress at the Vegetative Stage under Field Conditions”. American Journal of Plant Sciences, vol. 04, no. 09, 2013, pp. 1701-1708, ISSN 2158-2742, DOI 10.4236/ajps.2013.49207, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.scirp.org/journal/PaperInformation.aspx?PaperID=36114&#abstract>.
25. Florido, B. M. y Bao, F. L. “Tolerancia a estrés por déficit hídrico en tomate (Solanum lycopersicum L.)”. Cultivos Tropicales, vol. 35, no. 3, 2014, pp. 70-88, ISSN 0258-5936, [Consultado: 14 de febrero de 2017], Disponible en: <http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0258-59362014000300008&lng=es&nrm=iso&tlng=es>.
26. Noctor, G.; Mhamdi, A.; Chaouch, S.; Han, Y.; Neukermans, J.; Marquez-Garcia, B.; Queval, G. y Foyer, C. H. “Glutathione in plants: an integrated overview”. Plant, Cell & Environment, vol. 35, no. 2, 2012, pp. 454-484, ISSN 1365-3040, DOI 10.1111/j.1365-3040.2011.02400.x, [Consultado: 14 de febrero de 2017], Disponible en: <http://onlinelibrary.wiley.com/doi/10.1111/j.1365-3040.2011.02400.x/full>.
27. Noctor, G.; Mhamdi, A. y Foyer, C. H. “The Roles of Reactive Oxygen Metabolism in Drought: Not So Cut and Dried”. Plant Physiology, vol. 164, no. 4, 2014, pp. 1636-1648, ISSN 1532-2548, DOI 10.1104/pp.113.233478, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.plantphysiol.org/content/164/4/1636>.
28. Lamz, P. A.; Reyes, G. Y. y González, C. M. C. “Indicadores bioquímicos para la selección temprana de genotipos de arroz (Oryza sativa L.) con tolerancia a la salinidad”. Cultivos Tropicales, vol. 34, no. 1, 2013, pp. 11-17, ISSN 0258-5936, [Consultado: 14 de febrero de 2017], Disponible en: <http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0258-59362013000100002&lng=es&nrm=iso&tlng=es>.
29. Çelik, Ö. y Atak, Ç. “The effect of salt stress on antioxidative enzymes and proline content of two Turkish tobacco varieties”. Turkish Journal of Biology, vol. 36, no. 3, 2012, pp. 339-356, ISSN 1300-0152, [Consultado: 14 de febrero de 2017], Disponible en: <http://journals.tubitak.gov.tr/biology/abstract.htm?id=12700>.
30. Caverzan, A.; Passaia, G.; Barcellos, R. S.; Werner, R. C.; Lazzarotto, F. y Margis-Pinheiro, M. “Plant responses to stresses: role of ascorbate peroxidase in the antioxidant protection”. Genetics and Molecular Biology, vol. 35, no. 4, 2012, pp. 1011-1019, ISSN 1415-4757, DOI 10.1590/S1415-47572012000600016, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.scielo.br/scielo.php?script=sci_abstract&pid=S1415-47572012000600016&lng=en&nrm=iso&tlng=en>.
31. Aranjuelo, I.; Doustaly, F.; Cela, J.; Porcel, R.; Müller, M.; Aroca, R.; Munné-Bosch, S. y Bourguignon, J. “Glutathione and transpiration as key factors conditioning oxidative stress in Arabidopsis thaliana exposed to uranium”. Planta, vol. 239, no. 4, 2014, pp. 817-830, ISSN 0032-0935, 1432-2048, DOI 10.1007/s00425-013-2014-x, [Consultado: 14 de febrero de 2017], Disponible en: <http://link.springer.com/article/10.1007/s00425-013-2014-x>.
Recibido: 06/06/2016
Aceptado: 16/12/2016
Dr.C. Michel Ruiz-Sánchez, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32 700. Email: mich@inca.edu.cu