Caracterización morfoagronómica en líneas de tomate (Solanum lycopersicum L.) Con resistencia a begomovirus
Morphoagronomic characterization of tomato lines (Solanum lycopersicum L.) resistant to begomovirus
M.Cs. Aliannys Rodríguez-Valdés,I Dra.C. Marilyn Florido-Bacallao,II Dr.C. Francisco Dueñas-Hurtado,II Lázaro Julio Muñoz-Calvo,III Dr.C. Peter Hanson,IV Dra.C. Marta Álvarez-GilII
IFacultad de Biología, Universidad de La Habana, Cuba.
IIInstituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32 700.
IIIUniversidad Agraria de la Habana (UNAH).
IVAsian Vegetable Research and Development Center (AVRDC).
RESUMEN
El presente trabajo se realizó con el objetivo de caracterizar morfoagronómicamente la variabilidad fenotípica existente en 16 cultivares de tomate, de ellos 15 son cultivares con resistencia a begomovirus procedentes de Taiwán y el análisis del comportamiento de estos cultivares ante el aislado viral circulante en Cuba. Para ello se evaluaron 20 caracteres morfoagronómicos relacionados con la planta, el fruto y las fases fenológicas del cultivo. Se estudió asimismo, la resistencia a begomovirus, mediante la evaluación de la severidad de la enfermedad provocada por la infección de TYLCV-IL en condiciones no controladas. Se pudo detectar la existencia de variabilidad genética dentro de la colección en cuanto a características morfoagronómicas, lo que permitió agrupar a los cultivares en cuatro grupos fundamentales. A excepción del control susceptible, los cultivares evaluados fueron asintomáticos ante el virus, lo que confirma las perspectivas de su utilización en los programas de mejoramiento del cultivo para la obtención de híbridos y nuevos cultivares resistentes a begomovirus.
Palabras clave: características agronómicas, geminivirus, rendimiento, resistencia a la enfermedad.
ABSTRACT
The present work was developed to evaluate the in order to characterize morphoagronomically the phenotypic variability in 16 tomato cultivars, including 15 cultivars are resistant to begomovirus from Taiwan and the analysis of these cultivars to the circulating virus isolated in Cuba. For this, 20 morphoagronomic characters related to the plant were evaluated, the fruit and the phonological stages. In addition, begomovirus resistance was evaluated by the severity of the disease caused by infection of TYLCV-IL under uncontrolled conditions. For the morphoagronomic viewpoint, a phenotypical variability regarding morphoagronomic characteristic was detected, grouping the cultivars into four main groups. Except for the susceptible control, all the evaluated cultivars were asymptomatic to the virus, confirming the prospects for their use in plant breeding programs for obtaining new hybrids and cultivars resistant to begomovirus.
Key words: agronomic characteristics, geminivirus, yield, disease resistance.
INTRODUCCIÓN
El tomate (Solanum lycopersicum L.) es muy común en todo el mundo y se ha convertido en un cultivo de gran importancia económica (1). El cultivo ha logrado popularidad, especialmente en los años recientes con el descubrimiento de la actividad antioxidante y anticancerígena del licopeno (2, 3). Por lo tanto, su producción y consumo se incrementan constantemente, siendo el séptimo cultivo en importancia mundial, alcanzando en el 2013 una producción de más de 163 millones de toneladas y un área cultivada de casi 5,1 millones de hectáreas (4).
En Cuba los rendimientos alcanzados son bajos, al igual que en la gran mayoría de los países tropicales. Esto se debe al efecto negativo que ejercen los factores climáticos y la alta incidencia de plagas en el cultivo (5, 6).
Entre las principales plagas que afectan al tomate en Cuba y que ocasionan pérdidas en el rendimiento, de hasta un 100 %, están los comúnmente denominados “geminivirus” (7). La familia Geminiviridae constituye una de las familias de virus que infectan vegetales, con ADN como material genético. Entre los géneros que la conforman, el que más afectaciones provoca es el Begomovirus, transmitido por la mosca blanca Bemisia tabacci (Genn.) (8–10).
La utilización de cultivares resistentes, combinado con la lucha biológica en la estrategia del Manejo Integrado de Plagas, podría contribuir a reducir los porcentajes de plantas infectadas y, consecuentemente, la incidencia de la enfermedad (11, 12). En este sentido, la identificación de nuevas fuentes de resistencia al patógeno y su incorporación en cultivares comerciales, son investigaciones que merecen ser priorizadas (13–15).
Teniendo en cuenta las tendencias actuales del mejoramiento genético para la enfermedad y al contar en Cuba con pocos cultivares resistentes a begomovirus, se impone la necesidad de identificar nuevos cultivares con genes y mecanismos de resistencia, que puedan ser aprovechados por el programa de mejoramiento genético del cultivo, en el posterior desarrollo de híbridos, líneas y cultivares comerciales con una resistencia más duradera. Esto, además, permitirá trazar estrategias de una mayor durabilidad ante la amenaza de aparición de mutantes del virus, recombinaciones entre especies virales y emergencias de nuevas especies.
Es por ello que, a partir del aprovechamiento de fuentes naturales de resistencia y considerando la elevada incidencia y prevalencia de begomovirus en el país, se desarrolló el presente trabajo con el objetivo de caracterizar morfoagronomicamente la variabilidad fenotípica existente en 15 cultivares de tomate con resistencia a begomovirus procedentes de Taiwán y el análisis del comportamiento de estos cultivares ante el TLCVL circulante en Cuba, en condiciones no controladas.
MATERIALES Y MÉTODOS
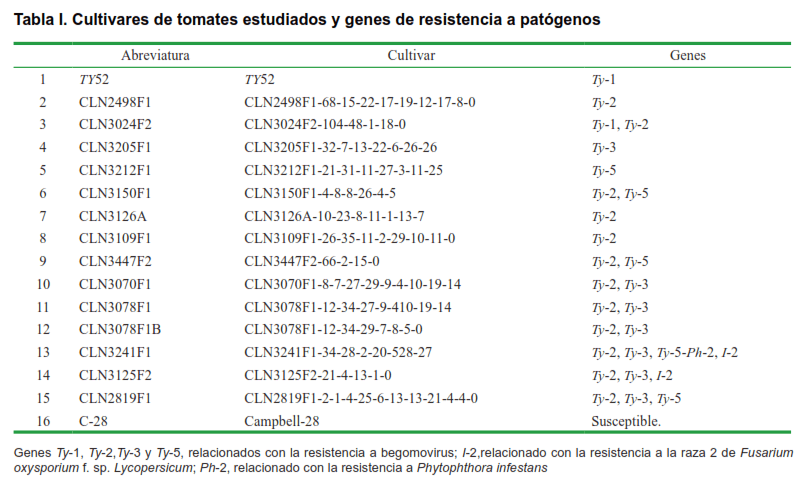
La caracterización morfoagronómica de 16 cultivares de tomate (Tabla I) se realizó en el área central del Instituto Nacional de Ciencias Agrícolas (INCA), situado en el km. 3 ½ de la carretera San José a Tapaste, municipio San José de las Lajas, provincia Mayabeque, ubicado a los 23°00’ de latitud norte y 82°12’ de longitud oeste a 138 m.s.n.m.
El comportamiento de las variables climáticas de temperatura máxima, media y mínima, así como de la humedad relativa y las precipitaciones que incidieron durante el desarrollo del experimento se tomaron de la Estación Meteorológica de Tapaste. Las atenciones culturales en todos los casos se efectuaron según el Instructivo Técnico para Organopónicos y Huertos Intensivos, establecido para el tomate (16).
El estudio se realizó con 16 cultivares; 15 cultivares de tomate con diferentes fuentes de resistencia a begomovirus provenientes de Taiwán, pertenecientes al Banco de Germoplasma del Instituto de investigaciones fundamentales de Agricultura tropical (INIFAT) y el cultivar Campbell-28, testigo susceptible a begomovirus (Tabla I).
Para ello se sembraron semillas de los 16 cultivares, en un cepellón de 196 alveolos, que contenía un sustrato compuesto por suelo Ferralítico Rojo Compactado, cachaza: zeolita, en proporción 1:2:1, siendo la capacidad de cada alveolo de 30 cm3. A los 21 días después de germinadas las plántulas se sembraron, a razón de 10 plantas por cultivar, en canteros de asbesto cemento al aire libre, que contenían una mezcla de suelo Ferralítico Rojo compactado (Ferralsol éutrico ) , según la nueva Clasificación Genética de los Suelos (17) y cachaza en proporción 3:1. Se utilizó una distancia de plantación de 0,90 x 0,25 m y un Diseño Completamente Aleatorizado. La siembra se realizó en el período óptimo del cultivo, el 10 de diciembre de 2014, mientras que el trasplante se efectuó el 6 de enero de 2015.
Los caracteres morfoagronómicos se evaluaron en 10 plantas, las flores o frutos por accesión, en diferentes momentos de su desarrollo, atendiendo a la caracterización propuesta por el descriptor del Instituto Internacional de Recursos Fitogenéticos (18), según el cual los caracteres relacionados con el fruto maduro se evalúan cuando estos presentan madurez comercial. Las evaluaciones fueron las siguientes: días a la floración y a la maduración; capa de abscisión; tipo de crecimiento y de inflorescencia; densidad del follaje; acostillado y compacidad de los frutos; cicatriz peduncular y pistilar; color del fruto inmaduro y maduro; diámetros longitudinal y ecuatorial; forma del fruto, del hombro del fruto y forma terminal de la floración del fruto; masa promedio de los frutos; número de lóculos y rendimiento por planta.
Para el análisis de los caracteres cuantitativos se le realizó un ANOVA de clasificación simple, modelo efectos fijos y se docimaron las medias por la prueba de Rangos Múltiples de Duncan para un 5 % de significación estadística (19).
Los datos se sometieron a Análisis Estadístico de Componentes Principales, donde se seleccionaron los autovectores con valores iguales o superiores a 0,50 en los ejes principales. Previo a realizar los análisis multivariados, las determinaciones cualitativas y cuantitativas se estandarizaron para garantizar que todas las variables tuvieran el mismo peso estadístico (20).
De esta forma a los caracteres cualitativos codificados en forma binaria se le asignaron valores de 0 y 1, donde generalmente el cero coincidió con la ausencia del carácter y 1 con la presencia;
los caracteres cualitativos que suponen diversos grados de expresión, se codificaron dando el valor cero al menor grado de expresión y uno al mayor y valores fraccionarios a los grados intermedios (ejemplo: cicatriz peduncular: pequeña 0, media ½, grande 1).
Por último los caracteres cuantitativos se trataron de forma similar, con puntuación de cero al valor mínimo y uno al máximo, siendo los valores intermedios codificados utilizando la siguiente fórmula: V (0-1)= (V(real)- V(mínimo))/ (Rango), donde: V(0-1): es el nuevo valor comprendido entre 0-1; V(real) y V(mínimo) son los valores del carácter cuantitativo y su valor mínimo, respectivamente; (Rango) es el rango de variación del carácter. Se efectuó, además un Análisis de agrupamiento (Conglomerados jerárquicos), a partir de una matriz de distancias euclidianas. Los análisis se efectuaron mediante el paquete estadístico SPSS versión 21.0, sobre Windows (21).
Evaluación de la severidad de la enfermedad provocada por TYLCV
Para evaluar la severidad de la enfermedad en los 16 cultivares estudiados se utilizó la escala de cuatro grados (22), siguiendo una dinámica de muestreo de las plantas a los 15 y 30 días posteriores al trasplante (dDt). Las observaciones se realizaron durante las primeras horas de la mañana (8:00-9:00 am).
Según la escala de severidad para TYLCV empleada, 0: planta sin síntoma; 1: planta con síntomas de amarilleamiento ligero en el margen de los foliolos de las hojas apicales; 2: planta con síntomas de amarilleamiento y encrespamiento menor de los foliolos apicales; 3: planta con gran rango de síntomas de amarilleamiento de las hojas, encrespamiento y acucharamiento, con alguna reducción del tamaño, pero la planta sigue creciendo; 4: planta con síntomas de amarilleamiento severo y retraso del crecimiento, encrespamiento y acucharamiento, se detiene el crecimiento de la planta.
RESULTADOS Y DISCUSIÓN
Caracterización morfoagronómica de los cultivares estudiados
Los resultados de la caracterización morfoagronómica, teniendo en cuenta los 20 caracteres analizados, permitió constatar la variabilidad fenotípica existente en los 16 cultivares de tomate evaluados en cuanto a caracteres relacionados con la planta, el fruto y las fases fenológicas (Tablas II, III, IV y V).
En la Tabla II se observan las diferencias fenotípicas relacionadas con las características vegetativo–florales, encontrándose que casi todos los cultivares tuvieron crecimiento determinado, a excepción de ‘CLN3205F1’, ‘CLN3447F2’, ‘CLN3241F1’, ‘CLN3125F2’ y ‘CLN2819F1’, que presentaron crecimiento semideterminado. En dependencia del tipo de crecimiento los tomates cultivados se utilizan para uno u otros fines (23). Así mismo, se observó un predominio de las inflorescencias simples, no obstante, el cultivar CLN2498F1 presentó inflorescencias dobles.
La mayoría de los cultivares presentaron densidad de follaje intermedia (10 cultivares), aunque dos cultivares (‘CLN3078F1’ y ‘CLN3078F1B’) presentaron una densidad de follaje abundante, mientras que otros cuatro presentaron follajes escasos y sus frutos, por lo tanto, estaban más expuestos a condiciones medioambientales adversas. De igual forma predominó la presencia de capa de abscisión en los frutos, excepto en los cultivares ‘CLN3078F1B’ y ‘CLN3241F1, que tuvieron ausencia de este carácter, asociado a la presencia del gen j-2, de unión del pedicelo, el que le confiere a estos cultivares características muy favorables para la industria (24, 25).
En la Tabla III se presenta la duración de las fases fenológicas, días a la floración y días a la maduración. El cultivar más precoz fue ‘TY52’, pues presentó un período de germinación-maduración menor (85 días). Por el contrario ‘CLN3212F1’ y ‘CLN3126A’ resultaron ser las más tardías, con períodos de 96 y 95 días, respectivamente. Similar comportamiento se observó en el período de germinación-floración.
Diversidad en la duración de las diferentes fases fenológicas en el cultivo se han informado, además, por diferentes autores (6, 26, 27).
En la Tabla IV, aparece detallada algunas de las evaluaciones realizadas en los frutos. Solamente dos cultivares de los estudiados presentaron hombros verdes en sus frutos ‘CLN3024F2’ y ‘CLN3126A’. En la actualidad, las plantas con estas características tienen cierta aceptación en el mercado, siempre y cuando no sea muy pronunciado, como en estos casos, y no esté ligado a otros genes presentes en muchas especies silvestres, que le transmiten sabores desagradables al tomate cultivado (23). Sin embargo, la ausencia de hombro verde en los frutos, está relacionada con una distribución uniforme del color en el fruto, lo cual es de gran importancia por la gran aceptación que presentan en el mercado, los cultivares con estas características para consumo en fresco (28).
Se distinguieron diferentes formas del fruto: aplastados, redondo alargado, cordiforme cilíndrico y elipsoide. Los frutos presentaron, en general, superficies lisas, con excepción de ‘CLN3212F1’ y ‘C-28’ que presentaron acostillado ligero. Hoy en día existe una preferencia por los frutos lisos en el mercado (29).
Del mismo modo, otros indicadores, como la forma de la cicatriz pistilar, la cicatriz peduncular y la forma terminal de los frutos, se mostraron variables. En general, predominaron los frutos con base aplanada y cicatrices pistilar y peduncular en punta y mediana, respectivamente. Aunque predominaron los frutos de compacidad media y blanda, se presentaron cultivares como CLN3109F1 y CLN3447F2, con frutos compactos, característica muy útil para la industria (Tabla IV). Es de destacar que el único carácter que se mantuvo homogéneo fue el color de los frutos maduros.
En la Tabla V de manera general, se aprecia una alta variabilidad en los caracteres cuantitativos analizados, lo cual se evidencia por las diferencias altamente significativas encontradas en la masa promedio de los frutos, el diámetro ecuatorial, polar y el rendimiento por planta (Tabla V). La masa promedio de los frutos estuvo comprendida entre 47,5 y 123,5 g, mientras que el rendimiento varió entre 0,62 y 1,92 kg planta-1, siendo el cultivar CLN3109F1, el de mayor rendimiento. Similares diferencias en la masa promedio y el rendimiento fueron encontrados al evaluar diversos cultivares de tomate introducidos en Ghana (6, 11) y Cuba (26); así como en cultivares locales de Turquía e Irán (27). Es de destacar que los bajos rendimientos encontrados en TY52, CLN3447F2, pudieron deberse, entre otros factores a su susceptibilidad a Phytophthora infestans (datos no mostrados).
El Análisis de Componentes Principales (ACP) (Tabla VI a y b), efectuado sobre la base de la divergencia encontrada, permitió constatar que en la formación de los grupos se extrae un 54 % de la variabilidad total en los tres ejes principales.
Según este análisis (Tabla VI b), en el eje 1 tienen un peso mayor las modalidades de variables correspondientes a la masa promedio de los frutos, diámetro ecuatorial, densidad del follaje, acostillado de los frutos, formas del fruto y de las cicatrices pistilar y peduncular, así como los días a la floración y la maduración; mientras que en el eje 2 está explicado por las modalidades correspondientes al rendimiento, diámetro longitudinal, capa de abscisión, color del fruto inmaduro y forma terminal de la floración del fruto. Asimismo, la tercera componente se explica por los caracteres tipo de crecimiento y de inflorescencia.
El análisis de agrupamiento, utilizando una matriz de distancias euclidianas mostró la formación de cuatro grupos bien diferenciados (Figura).
El grupo I estuvo conformado por los cultivares, CLN3205F1, CLN3241F1, CLN3125F2 y CLN2819F1. Estos presentaron crecimiento semideterminado, inflorescencias simples y frutos lisos, sin hombros, con 2-3 lóculos en su interior generalmente y altos valores de diámetros ecuatoriales. En estado inmaduro sus frutos fueron verde medio y presentaron cicatriz pistilar en forma de punto.
Los cultivares que integraron el grupo II (CLN2498F1, CLN3024F2; CLN3126A, CLN3109F1, CLN3078F1 y CLN3078F1B) mostraron follajes intermedios o densos, tipo de crecimiento determinado, capa de abscisión. Presentaron frutos lisos, de color verde medio en estado inmaduro, con 2-3 lóculos y tamaño mediano.
Los tres cultivares que integraron el grupo III (TY52, CLN3447F2 y CLN3070F1) presentaron inflorescencias simples y densidad del follaje intermedia. Los frutos inmaduros fueron de color verde claro, sin hombros, con DE media y DP en punta. Los rendimientos de estos cultivares presentaron porcentajes bajos.
Por su parte, el grupo IV quedó integrado por los cultivares CLN3212F1, CLN3150F1 y C-28 que presentaron crecimiento determinado, frutos sin hombros, ligeramente acostillados, con diámetros longitudinales medios. Estos cultivares mostraron rendimientos cercanos al valor medio.
A pesar de que los resultados indican que los 16 cultivares pudieron ser clasificados, la naturaleza continua de la variabilidad presente, no permitió una definición clara de las características de los diferentes grupos, de manera tal que aunque predominó una característica determinada en un grupo, en ocasiones existieron cultivares que no la presentaron, ejemplo de ello en el grupo I lo constituye el tipo de crecimiento que aunque predomina frutos con 2-3 lóculos, el cultivar CLN3125F2, presentó entre 4-7 lóculos. Estos resultados se corresponden con lo informado por diversos autores (28), quienes al evaluar morfoagronómicamente una colección de tomate en Kenya mediante Análisis de Componentes Principales, no lograron una definición precisa de los diferentes grupos, y atribuyen este resultado a la alta variabilidad presente en el germoplasma en estudio.
Estos resultados permitieron evidenciar que los cultivares de tomate introducidos de Taiwán se adaptaron a las condiciones edafoclimáticas de Cuba, siendo capaces de producir frutos en las cantidades deseadas en estas condiciones. Asimismo, se corroboró la existencia de una amplia variabilidad genética desde el punto de vista morfoagronómico en los cultivares evaluados. De este modo resulta conveniente emplear estos cultivares, para un mejor aprovechamiento de la variabilidad genética, en especial como fuentes de tolerancia a begomovirus, ya que las mismas presentan introgresado, al menos un gen de resistencia a TYLCV, proveniente de especies silvestres. Estos cultivares pudieran ser utilizados como posibles progenitores en los programas de mejoramiento genético de esta hortaliza.
Evaluación de la severidad de la enfermedad provocada por TYLCV
La Tabla VII muestra los valores promedio de severidad detectado en los cultivares, a partir de la dinámica del muestreo realizada en el período óptimo de siembra del cultivo (15-30 DDT ). Como se aprecia en la Tabla las plantas de los 15 cultivares, procedentes de Taiwán fueron asintomáticas. Sus foliolos apicales mantuvieron el color verde oscuro, característico de las hojas de las plantas sanas. Esta ausencia de síntomas se mantuvo durante toda la dinámica del muestreo.
Sin embargo, transcurridos solo 15 DDT, el cultivar ‘Campbell 28’ empleado como control susceptible, mostró síntomas de la infección, amarilleamientos ligeros, casi imperceptibles, en los márgenes de los foliolos de las hojas apicales, lo cual se correspondió con un valor máximo de 1 en la escala de severidad. Estos síntomas resultaron más intensos y mostraron un aumento progresivo hasta alcanzar el grado 3 (valor de severidad), a los 30 DDT. La rapidez en la aparición de los síntomas confirmó la ausencia de barreras para la resistencia a TYLCV en este cultivar, el cual se activa en los momentos tempranos de la inoculación y actúan a diferentes niveles en la célula, entre células y a larga distancia, por los tejidos conductores (30).
En cuanto al control susceptible, los resultados obtenidos en ‘Campbell 28’ corroboraron la alta susceptibilidad de este, durante la evaluación-selección de híbridos y nuevas líneas resistentes a TYLCV-IL [CU], adaptadas a las condiciones del trópico cubano (14, 31).
Los resultados obtenidos en las evaluaciones de ‘TY52’ se correspondieron con los descritos por otros autores en los diferentes estudios realizados (14, 30), encaminados a la búsqueda de resistencia a los aislados de TYLCV de Cerdeña e Israel. El carácter resistente de ‘TY52’ fue expuesto por Hurtado (14), describiendo la presencia del gen Ty-1, y su relación con el impedimento del movimiento del virus a corta distancia (célula-célula).
Resulta interesante que de los 16 cultivares estudiados, dos de ellos (CLN3241F1, CLN2819F1) presenten tres genes de resistencia, Ty-2, Ty-3, Ty-5; mientras otros seis (CLN3024F2, CLN3150F1, CLN3447F2, CLN3070F1, CLN3078F1, CLN3078F1B) presenten dos genes de resistencia a TYLCV. Y es debido a la gran variabilidad de especies virales existentes, la incorporación de varios genes/alelos ha sido reconocida como una de las estrategias más interesantes y apropiadas en la búsqueda de una resistencia amplia y estable a estas enfermedades. De hecho, hoy en día, la piramidación de genes de resistencia en una línea o cultivar ha devenido como una estrategia potente que permite incrementar la durabilidad y estabilidad de la resistencia a begomovirus (15, 31, 32).
Preferiblemente, estos genes de resistencia deben operar en diferentes etapas del proceso infectivo y, de esta forma, solo la ocurrencia de varias mutaciones simultáneas hará que se quiebre la resistencia (33, 34). Esta diversificación provocaría que el patógeno se enfrente simultáneamente con varios genes de resistencia, siendo más efectivo sembrar en una misma región, cultivares con distintos genes de resistencia, o separarlos en el tiempo, sembrándolos durante períodos diferentesA.
No obstante, se debe señalar que las evaluaciones de severidad a TYLCV se realizaron en el período óptimo, donde la incidencia de la plaga es menor. Sin embargo, la mayoría de los cultivares clasificados como resistentes durante el período óptimo de siembra mantienen esta condición en el período de siembra primavera-verano, lo que demuestra, en general, la estabilidad de la resistencia frente al aislado cubano de TYLCV (14). En este sentido, se señalan diferencias en la sintomatología de las plantas de tomate cuando los ensayos o pruebas de resistencia se realizan en diferentes épocas del año (22), observando una agresividad mayor durante el período de siembra primavera-verano. Es de destacar que en este período, las poblaciones del insecto vector son más altas, las condiciones para el desarrollo del cultivo son menos favorables y las afectaciones, en general, más evidentes (7).
En la actualidad, existen pocas fuentes de resistencia utilizadas en cultivares comerciales para el control de TYLCV. En un estudio dialélico realizado a partir de la combinación entre diversas fuentes de resistencia a begomovirus, se evidenció que los programas de mejoramiento genético de tomate, para resistencia a estos patógenos, se han apoyado en el aprovechamiento de la resistencia que proviene de las especies silvestres S. chilense, S. peruvianumy S. habrochaites por presentar los niveles más elevados de resistencia ya que existen pocas fuentes de resistencia en cultivares comerciales para el control de TYLCV (35). Sin embargo, se continúan en la búsqueda de nuevas fuentes de resistencia a TYLCV (31, 36, 37).
Por otro lado, la identificación de cultivares resistentes en la que estén involucrados varios genes de resistencia, permitirá trazar estrategias para su introducción en cultivares élite susceptibles a begomovirus (14, 15), lo que condicionará impactos epidemiológicos positivos en el manejo de las especies virales presentes en Cuba, limitando así las dispersiones de estas en condiciones de campo. El empleo de estos cultivares en los programas de mejora para resistencia a begomovirus representa un avance considerable pues se podría en futuros trabajos con estos cultivares implementar la selección para la resistencia asistida por marcadores de ADN, a partir de la técnica de RCP, en lugar de inoculaciones sostenidas con el patógeno. También, con estos cultivares se podría explotar las ventajas en la piramidación de genes para garantizar una resistencia más duradera (15, 31).
CONCLUSIONES
En los cultivares evaluados existe variabilidad morfoagronómica, lo que permitió diferenciarlos en cuatro grupos fundamentales. Los caracteres más variables fueron: la masa promedio de los frutos; los diámetros ecuatorial y longitudinal y rendimiento por planta.
Los cultivares de tomate procedentes de Taiwán fueron asintomáticas ante el virus, lo que confirma las perspectivas de su utilización en los programas de mejoramiento del cultivo para la obtención de híbridos y nuevos cultivares resistentes a begomovirus.
NOTA AL PIE
ADueñas, H. F. Identificación y aprovechamiento de fuentes de resistencia en tomate (Solanum lycopersicum L.), frente a begomovirus que afectan al cultivo. Tesis de Doctorado, Instituto Nacional de Ciencias Agrícolas, 2012, Mayabeque, Cuba, 100 p.
BIBLIOGRAFÍA
1. Gerszberg, A.; Hnatuszko-Konka, K.; Kowalczyk, T. y Kononowicz, A. K. “Tomato (Solanum lycopersicum L.) in the service of biotechnology”. Plant Cell, Tissue and Organ Culture (PCTOC), vol. 120, no. 3, 2015, pp. 881-902, ISSN 0167-6857, 1573-5044, DOI 10.1007/s11240-014-0664-4.
2. Wu, Z.; Sun, S.; Wang, F. y Guo, D. “Establishment of Regeneration and Transformation System of Lycopersicon esculentum MicroTom”. British Biotechnology Journal, vol. 1, no. 3, 2011, pp. 53-60, ISSN 2231-2927, DOI 10.9734/BBJ/2011/356.
3. Raiola, A.; Rigano, M. M.; Calafiore, R.; Frusciante, L. y Barone, A. “Enhancing the Health-Promoting Effects of Tomato Fruit for Biofortified Food”. Mediators of Inflammation, vol. 2014, no. 139873, 2014, p. 16, ISSN 0962-9351, DOI 10.1155/2014/139873.
4. FAO Statistics Division. Anuario Estadístico de la FAO. Datos 2013 de producción [en línea]. FAOSTAT, 2013, [Consultado: 12 de febrero de 2017], Disponible en: <http://faostat.fao.org/site/339/defalt.aspx>.
5. Morales, F. J. “Distribution and Dissemination of Begomoviruses in Latin America and the Caribbean” [en línea]. En: eds. Stansly P. A. y Naranjo S. E., Bemisia: Bionomics and Management of a Global Pest, Ed. Springer Netherlands, 2010, pp. 283-318, ISBN 978-90-481-2459-6, [Consultado: 2 de febrero de 2017], Disponible en: <http://link.springer.com/chapter/10.1007/978-90-481-2460-2_9>.
6. Gongolee, G.; Osei, M. K.; Akromah, R.; Nyadanu, D. y Aboagye, L. M. “Evaluation of Some Introduced Tomato Cultivars”. Horizon Journal of Agriculture and Food Science, vol. 1, no. 1, 2015, pp. 1-4, ISSN 1836-3644.
7. Navas-Castillo, J.; Fiallo-Olivé, E. y Sánchez-Campos, S. “Emerging Virus Diseases Transmitted by Whiteflies”. Annual Review of Phytopathology, vol. 49, no. 1, 2011, pp. 219-248, ISSN 0066-4286, 1545-2107, DOI 10.1146/annurev-phyto-072910-095235.
8. Tsai, W. S.; Shih, S. L.; Kenyon, L.; Green, S. K. y Jan, F.-J. “Temporal distribution and pathogenicity of the predominant tomato-infecting begomoviruses in Taiwan”. Plant Pathology, vol. 60, no. 4, 2011, pp. 787-799, ISSN 1365-3059, DOI 10.1111/j.1365-3059.2011.02424.x.
9. Ammara, U.; Mansoor, S.; Saeed, M.; Amin, I.; Briddon, R. W. y Al-Sadi, A. M. “RNA interference-based resistance in transgenic tomato plants against Tomato yellow leaf curl virus-Oman (TYLCV-OM) and its associated betasatellite”. Virology Journal, vol. 12, 2015, p. 38, ISSN 1743-422X, DOI 10.1186/s12985-015-0263-y.
10. Santos, J. C.; Siqueira, W. J.; Melo, P. C.; Colariccio, A.; Lourenção, A. L. y Melo, A. M. “Selection of tomato breeding lines with resistance to Tomato yellow vein streak virus”. Horticultura Brasileira, vol. 33, no. 3, 2015, pp. 345-351, ISSN 0102-0536, DOI 10.1590/S0102-053620150000300011.
11. Osei, M. K.; Akromah, R.; Lamptey, J. N. L. y Quain, M. D. “Phenotypic and molecular screening of some tomato germplasm for resistance to tomato yellow leaf curl virus disease in Ghana”. African Journal of Agricultural Research, vol. 7, no. 33, 2012, pp. 4675-4684, ISSN 1991-637X, DOI 10.5897/AJAR12.672.
12. Ha, T. M. “Developing an Integrated Pest Management Program for Tomatoes in The Red River Delta of Vietnam: A mini review”. Aceh International Journal of Science and Technology, vol. 4, no. 2, 2015, pp. 41-53, ISSN 2088-9860, DOI 10.13170/aijst.4.2.2488.
13. Chirinos, D. T.; Geraud-Pouey, F.; Romay, G.; Güerere, P.; Franco, M. A. y Galindo-Castro, I. “Evaluación de genotipos comerciales de tomate por su resistencia a Begomovirus”. Interciencia, vol. 37, no. 6, 2012, pp. 451–456, ISSN 0378-1844.
14. Hurtado, F. D.; Gil, M. A.; Zubiaur, Y. M.; Aguilera, J. G.; Xavier, C. A. D.; Junior, F. M. Z. y da Silva, D. J. H. “Fontes de resistência em tomateiro a os begomovirus bissegmentados Tomato yellow spot virus e Tomato severe rugose virus”. Horticultura Brasileira, vol. 30, no. 4, 2012, pp. 639-644, ISSN 0102-0536.
15. Shamprasad, P.; Sadashiva, A. T. y Ravishankar, K. V. “Validation of molecular markers linked to ToLCV resistance in tomato varieties/hybrids/lines”. International Journal of Research in Applied, vol. 3, no. 4, 2015, pp. 9-16, ISSN 2321-8851, 2347-4580.
16. Rodríguez, A.; Companioni, N.; Peña, E.; Cañet, F.; Fresneda, J.; Estrada, J.; Rey, R.; Fernández, E.; Vázquez, L. L.; Avilés, R.; Arozarena, N.; Dibut, B.; González, R.; Pozo, J. L.; Cun, R. y Martínez, F. Manual Técnico de Organopónicos, Huertos Intensivos y Organoponía Semiprotegida [en línea]. 6.a ed.,
Ed. ACTAF - INIFAT, 2007, La Habana, Cuba, 184 p., ISBN 978-959-246-030-2, [Consultado: 10 de febrero de 2017], Disponible en: <https://es.scribd.com/doc/84987671/Manual-Tecnico-para-Organoponicos-Huertos-Intensivos-y-Organoponia-Semiprotegida>.
17. Hernández, J. A.; Pérez, J. M.; Bosch, D.; Rivero, L.; Camacho, E.; Ruíz, J.; Salgado, E. J.; Marsán, R.; Obregón, A.; Torres, J. M.; Gonzáles, J. E.; Orellana, R.; Paneque, J.; Ruiz, J. M.; Mesa, A.; Fuentes, E.; Durán, J. L.; Pena, J.; Cid, G.; Ponce de León, D.; Hernández, M.; Frómeta, E.; Fernández, L.; Garcés, N.; Morales, M.; Suárez, E. y Martínez, E. Nueva versión de clasificación genética de los suelos de Cuba. Ed. AGROINFOR, 1999, La Habana, Cuba, 64 p., ISBN 959-246-022-1.
18. International Plant Genetic Resources Institute (IPGRI). Descriptors for Tomato (Lycopersicon spp.) [en línea]. Ed. Bioversity International, 1996, Roma, Italia, 47 p., ISBN 978-92-9043-294-4, [Consultado: 10 de febrero de 2017], Disponible en: <https://books.google.com.cu/books?id=sTBnSOFWILsC>.
19. Duncan, D. B. “Multiple Range and Multiple F Tests”. Biometrics, vol. 11, no. 1, 1955, pp. 1-42, ISSN 0006-341X, DOI 10.2307/3001478.
20. Fernández-Muñoz, R.; Báguena, M.; Cuartero, J. y Álvarez, M. “Caracterización de cultivares de tomate en diferentes ambientes”. En: Floris E. y Montaner C., XII Jornadas de Selección y Mejora de Plantas Hortícolas, Ed. Universidad de Zaragoza, Zaragoza, 2000.
21. IBM Corporation. IBM SPSS Statistics [en línea]. versión 21.0, [Windows], Ed. IBM Corporation, 2012, U.S, Disponible en: <http://www.ibm.com>.
22. Lapidot, M.; Ben-Joseph, R.; Cohen, L.; Machbash, Z. y Levy, D. “Development of a Scale for Evaluation of Tomato yellow leaf curl virus Resistance Level in Tomato Plants”. Phytopathology, vol. 96, no. 12, 2006, pp. 1404-1408, ISSN 0031-949X, DOI 10.1094/PHYTO-96-1404.
23. Moya, C.; Oliva, A.; Álvarez, M.; Morales, C.; Florido, M. y Plana, D. “Evaluación de nuevos cultivares de tomate (Lycopersicon esculentum MILL.) En los períodos temprano y óptimo de siembra en el occidente de Cuba”. Cultivos Tropicales, vol. 22, no. 3, 2001, pp. 67-73, ISSN 0258-5936.
24. Quinet, M.; Kinet, J.-M. y Lutts, S. “Flowering response of the uniflora:blind:self-pruning and jointless:uniflora:self-pruning tomato (Solanum lycopersicum) triple mutants”. Physiologia Plantarum, vol. 141, no. 2, 2011, pp. 166-176, ISSN 1399-3054, DOI 10.1111/j.1399-3054.2010.01426.x.
25. Bauchet, G. y Causse, M. “Genetic Diversity in Tomato (Solanum lycopersicum) and Its Wild Relatives” [en línea]. En: ed. Caliskan M., Genetic Diversity in Plants, Ed. InTech, 14 de marzo de 2012, pp. 133-162, ISBN 978-953-51-0185-7, [Consultado: 10 de febrero de 2017], Disponible en: <http://www.intechopen.com/books/genetic-diversity-in-plants/genetic-diversity-in-tomato-solanum-lycopersicum-and-its-wild-relatives>.
26. Dueñas, F.; Álvarez, M.; Moya, C.; Martínez, Y.; Peteira, B.; Arias, Y.; Diez, M. J.; Hanson, P. y Shagarodski, T. “Caracterización agromorfológica y evaluación de la resistencia al TYCLV en nuevos genotipos de tomate (Solanum lycopersicum L.) como apoyo al programa de mejoramiento genético de la hortaliza para la enfermedad”. Cultivos Tropicales, vol. 29, no. 1, 2008, pp. 53-60, ISSN 0258-5936.
27. Henareh, M.; Dursun, A. y Mandoulakani, B. A. “Genetic diversity in tomato landraces collected from Turkey and Iran revealed by morphological characters”. Acta Scientiarum Polonorum-Hortorum Cultus, vol. 14, no. 2, 2015, pp. 87–96, ISSN 1644-0692.
28. Cantwell, M. Produce Fact Sheets [en línea]. Postharvest Technology Center - UC Davis, 2017, [Consultado: 10 de febrero de 2017], Disponible en: <http://postharvest.ucdavis.edu/Commodity_Resources/Fact_Sheets/>.
29. Moya, C.; Álvarez, M.; Florido, M. y Plana, D. “Caracterización morfoagronómicas de una colección de variedades, líneas e híbridos de tomate (Lycopersicon esculentum Mill) en condiciones de organopónicos”. Cultivos Tropicales, vol. 24, no. 3, 2003, pp. 51–58, ISSN 0258-5936.
30. Gómez, P.; Rodríguez-Hernández, A. M.; Moury, B. y Aranda, M. A. “Genetic resistance for the sustainable control of plant virus diseases: breeding, mechanisms and durability”. European Journal of Plant Pathology, vol. 125, no. 1, 2009, pp. 1-22, ISSN 0929-1873, 1573-8469, DOI 10.1007/s10658-009-9468-5.
31. Gómez, O.; Piñón, M. y Martínez, Y. “Pirimidación de genes de resistencia a TYLCV y TSWV en genotipos de tomate”. Revista de Protección Vegetal, vol. 30,no. 2, 2015, pp. 161-164, ISSN 1010-2752.
32. Chen, H.-M.; Lin, C.-Y.; Yoshida, M.; Hanson, P. y Schafleitn, R. “Multiplex PCR for Detection of Tomato Yellow Leaf Curl Disease and Root-Knot Nematode Resistance Genes in Tomato (Solanum lycopersicum L.)”. International Journal of Plant Breeding and Genetics, vol. 9, no. 2, 2015, pp. 44-56, ISSN 1819-3595, DOI 10.3923/ijpbg.2015.44.56.
33. Piron, F.; Nicolaï, M.; Minoïa, S.; Piednoir, E.; Moretti, A.; Salgues, A.; Zamir, D.; Caranta, C. y Bendahmane, A. “An Induced Mutation in Tomato eIF4E Leads to Immunity to Two Potyviruses”. PLoS ONE, vol. 5, no. 6, 2010, ISSN 1932-6203, DOI 10.1371/journal.pone.0011313, [Consultado: 10 de febrero de 2017], Disponible en: <http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2892489/>.
34. Chaparro-Garcia, A.; Kamoun, S. y Nekrasov, V. “Boosting plant immunity with CRISPR/Cas”. Genome Biology, vol. 16, no. 1, 2015, pp. 254-257, ISSN 1474-7596, DOI 10.1186/s13059-015-0829-4.
35. Vidavsky, F.; Leviatov, S.; Milo, J.; Rabinowitch, H. D.; Kedar, N. y Czosnek, H. “Response of tolerant breeding lines of tomato, Lycopersicon esculentum, originating from three different sources (L. peruvianum, L. pimpinellifolium and L. chilense) to early controlled inoculation by tomato yellow leaf curl virus (TYLCV)”. Plant Breeding, vol. 117, no. 2, 1998, pp. 165-169, ISSN 1439-0523,
DOI 10.1111/j.1439-0523.1998.tb01472.x.
36. Menda, N.; Strickler, S. R.; Edwards, J. D.; Bombarely, A.; Dunham, D. M.; Martin, G. B.; Mejia, L.; Hutton, S. F.; Havey, M. J.; Maxwell, D. P. y Mueller, L. A. “Analysis of wild-species introgressions in tomato inbreds uncovers ancestral origins”. BMC Plant Biology, vol. 14, 2014,
p. 287, ISSN 1471-2229, DOI 10.1186/s12870-014-0287-2.
37. Leke, W. N.; Mignouna, D. B.; Brown, J. K. y Kvarnheden, A. “Begomovirus disease complex: emerging threat to vegetable production systems of West and Central Africa”. Agriculture & Food Security, vol. 4, no. 1, 2015, p. 1, ISSN 2048-7010, DOI 10.1186/s40066-014-0020-2.
Recibido: 07/12/2015
Aceptado: 25/10/2016
M.Cs. Aliannys Rodríguez Valdé, Facultad de Biología, Universidad de La Habana, Cuba. Email: alianny@inca.edu.cu