Efecto de bioestimulantes en el rendimiento de dos cultivares de frijol (Phaseolus vulgaris L.) Biofertilizados
Biostimulant effect on yield of two biofertilized bean (Phaseolus vulgaris L.) cultivars
Lisbel Martínez-González, Dr.C. Lázaro Maqueira-López, Dra.C. María C. Nápoles-García, Dra.C. Miriam Núñez-Vázquez
Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal No.1, San José de las Lajas, Mayaquebe, Cuba, CP 32 700.
RESUMEN
El frijol, dentro de las leguminosas, se destaca por su alto consumo humano, en Cuba, forma parte de la alimentación básica de la población. De ahí, la necesidad de buscar alternativas que posibiliten estimular la producción de sus granos y por ende, incrementar la satisfacción de la demanda de consumo. El objetivo del presente trabajo fue determinar si la aplicación de los productos Quitomax® o Biobras-16® a las semillas, estimulaba el rendimiento de plantas de dos cultivares de frijol biofertilizadas. Para ésto se ejecutó un experimento en la Unidad de Ciencia y Tecnología de Base “Los Palacios” donde se realizaron aspersiones a las semillas con Quitomax®, Qm (500 mg L-1) ó Biobras-16®, BB-16 (0,05 mg L-1), previo a la inoculación con el biofertilizante Azofert®, Az. Las semillas se depositaron en un suelo Hidromórfico Gley Nodular Ferruginoso Petroférrico y se conformaron cuatro tratamientos por cultivar (100 % N, control, Az+30 % N, Qm+Az+30 % N y BB-16+Az+30 % N). En el momento de la cosecha se realizaron las siguientes evaluaciones: masa seca de tallos, vainas y granos, número de vainas y granos por planta, número de granos por vaina, masa fresca de 1000 granos y el rendimiento práctico. Los resultados demostraron que la inoculación con Azofert® fue capaz de sustituir el 70 % de la fertilización nitrogenada que se utiliza en el cultivo, sin afectar el rendimiento agrícola. Además, la aspersión de las semillas con Biobras-16®, previo a la inoculación con Azofert®, estimuló el rendimiento de las plantas, superando significativamente al tratamiento control con el
100 % de la fertilización nitrogenada en ambos cultivares.
Palabras clave: brasinoesteroides, leguminosas, producción, quitosana, Rhizobium.
ABSTRACT
Beans, inside legumes, stands out for the high human consumption and, in Cuba, this legume is part of the population basic diet. Hence, to look for alternatives that allow stimulating grain production and therefore, increase the satisfaction of consumer demand, constitute a necessity. The aim of this paper was to determine whether seed application of Quitomax® or Biobras-16® products, increases the plant yield of two biofertilized beans cultivars. The experiment was performed at Unit of Basis Science and Technology “Los Palacios”. Seed sprayings with Quitomax®, Qm (500 mg L-1) or Biobras-16®, BB-16 (0,05 mg L-1), before inoculation with Azofert® biofertilizer, Az, were made. Seeds were placed to Hydromorfic Gley Nodule Ferruginose Petroferric soil and four treatments (100 % N, control, Az+30 % N, Qm+Az+30 % N y BB-16+Az+30 % N) by cultivar were constituted. At the harvest time, the following evaluations: shoot, legume and grain dry weights, legume and grain number per plant, grain number per legume, fresh weight of 1 000 grains and practice yield, were made. Results showed Azofert® inoculation substituted 70 % of nitrogen fertilizer used without affecting crop yield. Besides, seed sprayings with Biobras-16®, before Azofert® inoculation, increased significantly crop yield, in both cultivars, compared to control treatment with 100 % nitrogen fertilizer.
Key words: brassinosteroids, legumes, production, chitosan, Rhizobium.
INTRODUCCIÓN
El frijol es una de las especies de leguminosas que posee un lugar preferencial, por su composición nutricional al ser una fuente rica en proteínas, minerales como calcio, hierro, fósforo, magnesio y zinc y las vitaminas tiamina, niacina y ácido fólico (1). En Cuba, esta leguminosa tiene gran importancia; sin embargo, la producción nacional satisface solo el 3 % de la demanda de consumo, por lo que es necesario importar alrededor de 110 000 toneladas del grano cada año (2). Por tal motivo, una de las prioridades de la agricultura cubana, en la actualidad, es incrementar la producción de este cultivo utilizando tecnologías que sean amigables con el medio ambiente.
El frijol común es capaz de llevar a cabo el proceso de fijación biológica de nitrógeno (FBN), a través de la simbiosis con bacterias del suelo conocidas comúnmente como rizobios (3). El nitrógeno fijado biológicamente por estos microorganismos en simbiosis garantiza una fuente directa de este elemento a ser utilizado por la planta (4) y sustituir, en parte, la importación de fertilizante mineral. Azofert® es un inoculante compuesto por bacterias del género Rhizobium y metabolitos esenciales en esta interacción (5).
Por otra parte, existe una gama de productos bioestimulantes (Fitomas-E®, Biobras-16® y Quitomax®) que han sido utilizados satisfactoriamente en la agricultura (6–8) y su aplicación en combinación con los biofertilizantes constituye una estrategia priorizada en la búsqueda para mejorar y preservar las condiciones físicas, químicas y biológicas de los suelos, elevar el potencial agroproductivo y sustituir importaciones (9, 10). Sin embargo, en la mayoría de los casos, los bioestimulantes han sido asperjados foliarmente a las plantas y no existen apenas referencias de la utilización de estos bioestimulantes previo a la inoculación, lo cual puede ser también una alternativa viable para incrementar la producción en el caso del frijol. Por ese motivo, el objetivo central de este trabajo fue determinar si el tratamiento a las semillas con Quitomax® o Biobras-16®, previo a la inoculación con Azofert®, estimulaba el rendimiento de las plantas de dos cultivares de frijol.
MATERIALES Y MÉTODOS
El experimento se llevó a cabo en enero de 2015, en áreas de la Unidad Científico Tecnológica de Base, Los Palacios, Pinar del Río, perteneciente al Instituto Nacional de Ciencias Agrícolas. Para ello, se utilizaron dos cultivares de frijol (Cuba C-25-9-N y CUL 156), procedentes del Instituto de Investigaciones en Granos del Ministerio de la Agricultura. Las semillas fueron asperjadas (3x10-3 L por cada 50 semillas) con Biobras-16®, BB-16 (0,05 mg L-1) o Quitomax®, Qm (500 mg L-1), secadas a temperatura ambiente y al día siguiente, al momento de la siembra, se inocularon con Azofert® a razón de 200x10-3 L de inóculo por 46 kg de semilla.
Las semillas se depositaron en un suelo Hidromórfico Gley Nodular Ferruginoso Petroférrico (11), mediante la tecnología de siembra directa manual a una distancia de 0,70 m entre hileras y 0,07 m entre plantas con una norma de 50 kg ha-1 de semillas.
Las actividades fitotécnicas se desarrollaron según lo recomendado por la Guía Técnica del cultivo del frijol (12), excepto la fertilización, la que se efectuó mediante la aplicación, en el momento de la siembra, de superfosfato triple (46 % de P2O5) y cloruro de potasio (60 % de K2O), a razón de 75 y 65 kg ha-1, respectivamente. A los 15 días después de germinado el cultivo, se realizó una fertilización nitrogenada con urea (46 % de N), a razón de 70 kg ha-1, en el caso de los tratamientos donde se aplicó el 100 % (controles); mientras que en el resto se aplicó solamente el 30 % de la dosis.
Los tratamientos estudiados, en cada uno de los cultivares, fueron: 100 % N (Control), Azofert®+30 % N, Qm+Azofert®+30 % N y BB-16+Azofert®+30 % N, lo que hace un total de ocho tratamientos y se utilizó un diseño de bloques al azar con cuatro réplicas. Las parcelas experimentales estuvieron conformadas por ocho hileras de 5 m cada una.
En el momento de la cosecha, en las dos hileras centrales de cada parcela experimental se seleccionaron diez plantas al azar para evaluar: la masa seca de tallos, vainas y granos; el número de vainas y de granos por planta; el número de granos por vaina y la masa fresca de 1 000 granos. Para el rendimiento agrícola se cosecharon 8 m2 del centro en cada parcela experimental, se trillaron las plantas y se secaron los granos hasta el 14 % de humedad.
Se realizó un análisis de varianza de clasificación doble para cada una de las variables estudiadas y se compararon las medias de los tratamientos según la Prueba de Rangos Múltiples de Duncan a p ≤ 0,05 (13). El Programa estadístico utilizado fue Statgraphics plus 5.1 (14).
RESULTADOS Y DISCUSIÓN
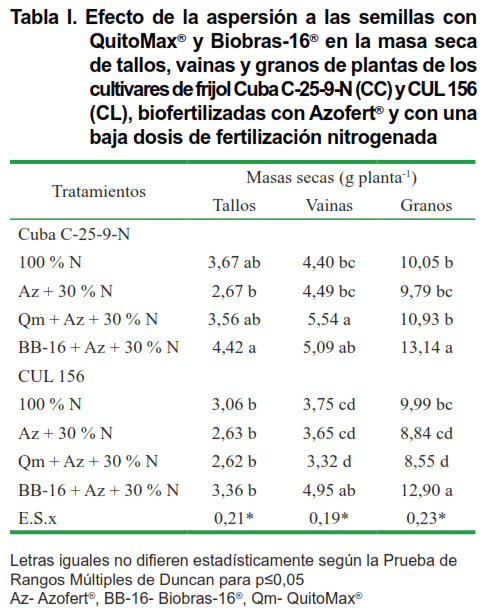
La masa seca de los tallos, vainas y granos, de las plantas que recibieron la inoculación bacteriana con la adición del 30 % de la fertilización nitrogenada, no difirieron significativamente de aquellas que recibieron el 100 % de la fertilización en ninguno de los dos cultivares en estudio (Tabla I). Esto significa que la inoculación pudiera estar ejerciendo un efecto similar al 70 % del N restante.
Sin embargo, la aspersión a las semillas con Biobras-16® o Quitomax® influyeron de forma diferente en cada órgano y para cada cultivar. Por ejemplo, no tuvieron influencia en la masa seca de los tallos en ninguno de los dos cultivares estudiados; mientras que, la aspersión a las semillas con Quitomax® y Biobras-16® incrementaron significativamente la masa seca de las vainas de los cultivares Cuba C-25-9-N y CUL 156, respectivamente, alcanzándose valores superiores a los obtenidos con la fertilización mineral.
En el caso de la masa seca de los granos, el tratamiento con Biobras-16® fue el mejor en ambos cultivares, superando significativamente al resto de los tratamientos estudiados.
El número de vainas por planta (Tabla II) mostró un comportamiento diferente en cada uno de los cultivares en estudio, ya que mientras que la sustitución del 70 % de la fertilización nitrogenada por la inoculación bacteriana no afectó este indicador en el caso del cv. Cuba C-25-9-N, sí provocó una disminución significativa en las plantas del cv. CUL 156. No obstante, la inoculación bacteriana incrementó significativamente el número de granos por vaina de las plantas de ambos cultivares,
por lo que no se modificó el número de granos por planta, sobre todo en el cultivar CUL 156.
En cuanto al efecto de los bioestimulantes, se debe destacar que, en el cultivar Cuba C-25-9-N, el tratamiento con Biobras-16® solamente incrementó significativamente el número de granos por planta; mientras que en el cv. CUL 156; además, este tratamiento incrementó el número de vainas por planta. Por otra parte, la aspersión de las semillas con Quitomax® no influyó en estos indicadores en ninguno de los dos cultivares evaluados.
Los tratamientos no modificaron la masa de 1000 granos, lo que indica que la influencia en el rendimiento del cultivo debe estar asociada al efecto que los tratamientos ejercieron en el número de granos por planta en cada uno de los cultivares estudiados.
En cuanto al rendimiento práctico del cultivo, que se presenta en la Figura, se destaca que la sustitución del 70 % de la fertilización nitrogenada por la inoculación bacteriana no provocó disminución significativa del rendimiento en ninguno de los dos cultivares en estudio. Por otra parte, se debe señalar que solamente la aspersión de las semillas con Biobras-16®, previo a la inoculación con Azofert®, estimuló el rendimiento de las plantas de ambos cultivares, de tal manera que superó significativamente (29-30 %) al obtenido en las plantas del tratamiento control (100 % N).
Hay que especificar, que en el caso del cv. Cuba C-25-9-N, este incremento en el rendimiento estuvo asociado con un aumento significativo en el número de granos por planta; mientras que en CUL 156 estuvo asociado al incremento del número de vainas y de granos por planta.
La aspersión a las semillas con Biobras-16®, previo a la inoculación con Azofert®, al parecer, desencadenó una serie de eventos fisiológicos y bioquímicos en las plantas que repercutieron en un incremento de la producción de granos de ambos cultivares, independientemente de las diferencias existentes en la duración del ciclo del cultivo.
La efectividad de la fertilización biológica en este cultivo, en nuestro país, ha sido estudiada con anterioridad. Así, en una investigación realizada en tres genotipos de frijol común (BAT-304, Velasco Largo y BAT-93), se estudió el efecto de la fertilización mineral y la biofertilización en el rendimiento de las plantas. Se encontró que la fertilización biológica superó a la mineral en 10,4 y 6,0 %, en los genotipos BAT-304 y Velasco, respectivamente. Sin embargo, en el genotipo BAT-93, la fertilización mineral incrementó el rendimiento en 18,45 %, con relación a la biofertilización (15). Esto quiere decir que la respuesta no sólo depende del microorganismo, sino también del cultivar y su capacidad para asociarse en simbiosis.
En San Luis de Potosí, México (16), se demostró que la biofertilización con Rhizobium u hongos micorrízicos arbusculares, así como la aplicación de brasinoesteroides produjo rendimientos del cultivo del frijol similares a los obtenidos con la fertilización mineral recomendada para el cultivo, en las condiciones donde se efectuó el estudio.
Comparado con otras leguminosas, el frijol común es de las legumbres con menor capacidad para fijar nitrógeno, aunque existen algunas variedades de Phaseolus vulgaris L. y cepas de rizobios que exhiben altos rangos de fijación (17). Nuevas investigaciones intentan incrementar esa capacidad (18). Estas nuevas intenciones por mejorar la fijación biológica del nitrógeno en frijol incluyen desde el empleo de cepas más competitivas y eficientes (19), hasta el desarrollo de inoculantes y formulaciones más complejas. En este trabajo se utilizó el Azofert®, un biofertilizante caracterizado por su calidad al inducir en las bacterias la síntesis y excreción de metabolitos de especial interés y función en esta interacción (5).
A pesar de lo anterior, el uso de los biofertilizantes en leguminosas constituye una alternativa promisoria frente a los fertilizantes minerales. De esta forma, se ha venido trabajando no sólo en la inoculación de rizobios, sino también en las inoculaciones conjuntas de rizobios con otros microorganismos como hongos micorrizógenos, lográndose estimulaciones del crecimiento e incrementos en el rendimiento de los cultivos (20–23). En este trabajo se demostró que la inoculación con Azofert® logró sustituir el 70 % de la fertilización nitrogenada; resultado de gran interés para la producción de este cultivo en nuestro país.
En soya, se ha demostrado la posibilidad de poder emplear las inoculaciones simples con Bradyrhizobium elkanii y la coinoculación con hongos micorrizógenos arbusculares, para suplir las necesidades de nutrientes, fundamentalmente nitrógeno y fósforo, permitiendo que se logren rendimientos similares a los obtenidos cuando se utiliza solamente el fertilizante mineral (24).
En cuanto al incremento en el rendimiento obtenido con la aspersión de Biobras-16® a las semillas previo a la inoculación con el biofertilizante, se puede plantear que, diversas investigaciones han demostrado el efecto que la aplicación de los análogos de brasinoesteroides tiene en el rendimiento de plantas que han sido biofertilizadas. Así, en soya (25), se demostró la efectividad de la aspersión foliar del Biobras-6® en la fase de floración en plantas cuyas semillas fueron inoculadas con Bradyrhizobium elkanii y hongos micorrízicos arbusculares (HMA). Por otra parte, se ha informado que la coinoculación de semillas de frijol con Azofert® y Ecomic® (HMA) y la aspersión foliar de las plantas con bioestimulantes tales como Fitomas®, Biobras-16® ó Quitomax® estimula significativamente el rendimiento del cultivoA.
En hortalizas tales como lechuga, habichuela y tomate, se han informado, también, incrementos en el rendimiento con la inoculación de HMA en combinación con la aspersión foliar de Biobras-16® (26).
Aunque estos resultados tienen un carácter preliminar, un aspecto novedoso de este trabajo radica en el modo de aplicación del Biobras-16®, ya que en este caso el producto se asperjó a las semillas previo a la inoculación con Azofert® y no se asperjó foliarmente, como generalmente se ha aplicado. Hay que señalar, que un estudio preliminar realizado en un área de producción de la provincia Villa Clara demostró que la aspersión a las semillas, previo a la siembra, estimuló significativamente la masa de granos promedio por planta del cultivar de frijol Tomeguín 93 (27).
Esto demuestra que como estrategia para incrementar la producción de frijol, tan importante en el consumo de la dieta de los cubanos y de otros países, el empleo de biofertilizantes y bioestimulantes pudiera ser una alternativa racional y sostenible, al demostrarse que en este experimento con un 70 % menos de fertilizante nitrogenado se pueden alcanzar rendimientos superiores con la misma calidad que cuando se emplea el 100 % del fertilizante mineral recomendado para este cultivo. Además, se debe tener en cuenta, que el Biobras-16® no sólo incrementa la producción del cultivo sino que lo hace de forma amigable con el medio ambiente, por lo que este resultado debe confirmarse posteriormente.
En cuanto al Quitomax®, se debe continuar profundizando en este modo de aplicación, ya que es posible que la dosis empleada no sea la adecuada para este propósito ó que, considerando las propiedades antimicrobianas que posee la quitosana, no sea conveniente su aplicación antes de la inoculación con Azofert®.
CONCLUSIÓN
La inoculación de las semillas con Azofert® sustituyó el 70 % de la fertilización nitrogenada a aplicar en el cultivo del frijol, sin afectar los rendimientos, y la aspersión a las semillas con Biobras-16® (0,05 mg L-1), previo a la inoculación, estimuló significativamente el rendimiento de las plantas de los cultivares de frijol Cuba C-25-9-N y CUL 156, en comparación con las plantas controles que recibieron el 100 % del fertilizante nitrogenado.
NOTA AL PIE
ARivera, R.; Calderón, A.; Nápoles, M. C.; Falcón, A.; Martin, J. V.; Marrero, Y.; Lara, D.; Calaña, J. M.; Mederos, J. D.; Coll, Y. y Núñez, M. La factibilidad de la aplicación conjunta de biofertilizantes y bioestimiulantes en el cultivo del frijol. Impacto ambiental de bioproductos en la agricultura, Inst. Instituto Nacional de Ciencias Agrícolas - Ministerio de Educación Superior, 2015, Cuba, 62 p., Premio MES al Resultado ya aplicado de Mayor Contribución a la protección del Medio Ambiente en Cuba.
BIBLIOGRAFÍA
1. Ulloa, J. A.; Ulloa, P. R.; Ramírez, J. C. y Ulloa, B. E. “El frijol (Phaseolus vulgaris): su importancia nutricional y como fuente de fitoquímicos”. Revista Fuente, vol. 3, no. 8, 2011, pp. 5-9, ISSN 2007-0713, [Consultado: 14 de febrero de 2017], Disponible en: <http://fuente.uan.edu.mx/publicaciones/03-08/1.pdf>.
2. Sueiro, A.; Rodríguez, M. y de la Cruz, S. “El uso de biofertilizantes en el cultivo del frijol: una alternativa para la agricultura sostenible en Sagua la Grande”. Observatorio de la Economía Latinoamericana, no. 159, 2011, ISSN 1696-8352, [Consultado: 14 de febrero de 2017], Disponible en: <https://www.eumed.net/eumednet/cursecon/ecolat/cu/2011/gpm.zip>.
3. Zaccardell, M.; Pentangelo, A. y Tripodi, P. “Characterization of Bean (Phaseolus vulgaris L.) Ecotype «Fagiolo Occhio Nero Di Oliveto Citra» Using Agronomic, Biochemical and Molecular Approaches”. Pakistan Journal of Biological Sciences, vol. 16, no. 18, 2013, pp. 901-910, ISSN 1028-8880, DOI 10.3923/pjbs.2013.901.910, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.scialert.net/abstract/?doi=pjbs.2013.901.910>.
4. Ribeiro, R. A.; Ormeño-Orrillo, E.; Dall’Agnol, R. F.; Graham, P. H.; Martinez-Romero, E. y Hungria, M. “Novel Rhizobium lineages isolated from root nodules of the common bean (Phaseolus vulgaris L.) in Andean and Mesoamerican areas”. Research in Microbiology, vol. 164, no. 7, 2013, pp. 740-748, ISSN 0923-2508, DOI 10.1016/j.resmic.2013.05.002, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.sciencedirect.com/science/article/pii/S0923250813000995>.
5. Nápoles, M. C.; Cabrera, J. C.; Onderwater, R.; Wattiez, R.; Hernández, I.; Martínez, L. y Núñez, M. “Señales en la interacción Rhizobium leguminosarum-frijol común (Phaseolus vulgaris L.)”. Cultivos Tropicales, vol. 37, no. 2, 2016, ISSN 1819-4087.
6. Serna, M.; Hernández, F.; Coll, F. y Amorós, A. “Brassinosteroid analogues effect on yield and quality parameters of field-grown lettuce (Lactuca sativa L.)”. Scientia Horticulturae, vol. 143, 2012, pp. 29-37, ISSN 0304-4238, DOI 10.1016/j.scienta.2012.05.019, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.sciencedirect.com/science/article/pii/S0304423812002506>.
7. Guevara, E.; Méndez, J. C.; Vega, J.; González, O. S.; Puertas, A. y Fonseca, J. “Influencia de diferentes dosis de FitoMas-E en el frijol común”. Centro Agrícola, vol. 40, no. 1, 2013, pp. 39-44, ISSN 0253-5785, 2072-2001.
8. Pichyangkura, R. y Chadchawan, S. “Biostimulant activity of chitosan in horticulture”. Scientia Horticulturae, vol. 196, 2015, (ser. Biostimulants in Horticulture), pp. 49-65, ISSN 0304-4238, DOI 10.1016/j.scienta.2015.09.031, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.sciencedirect.com/science/article/pii/S0304423815301953>.
9. Rodríguez, A.; Martínez, F.; Ramos, L. H.; Cabrera, M. y Borrero, Y. “Efecto del bioestimulante (fitomas) y el biofertilizante (bioplasma) en el rendimiento de la lechuga variedad Anaida bajo condi-ciones de organoponía semi-protegida”. Agrotecnia de Cuba, vol. 35, no. 1, 2011, pp. 54–60, ISSN 0568-3114.
10. Barroso, F. L.; Abad, M. M.; Rodríguez, H. P. y Jerez, M. E. “Aplicación de FitoMas-E y EcoMic® para la reducción del consumo de fertilizante mineral en la producción de posturas de cafeto”. Cultivos Tropicales, vol. 36, no. 4, 2015, pp. 158-167, ISSN 0258-5936, [Consultado: 14 de febrero de 2017], Disponible en: <http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0258-59362015000400021&lng=es&nrm=iso&tlng=pt>.
11. Hernández, J. A.; Pérez, J. J. M.; Bosch, I. D. y Castro, S. N. Clasificación de los suelos de Cuba 2015. Ed. Ediciones INCA, 2015, Mayabeque, Cuba, 93 p., ISBN 978-959-7023-77-7.
12. Faure, B.; Benítez, R.; Rodríguez, E.; Grande, O.; Torres, M. y Pérez, P. Guía Técnica para la producción de frijol común y maíz. Ed. Instituto de Investigaciones en Fruticultura Tropical, 2014, La Habana, Cuba, 39 p., ISBN 978-959-296-036-7.
13. Duncan, D. B. “Multiple Range and Multiple F Tests”. Biometrics, vol. 11, no. 1, 1955, pp. 1-42, ISSN 0006-341X, DOI 10.2307/3001478, [Consultado: 4 de abril de 2015], Disponible en: <http://www.jstor.org/stable/3001478>.
14. Statistical Graphics Crop. STATGRAPHICS® Plus [en línea]. (ser. Profesional), versión 5.1, [Windows], 2000, Disponible en: <http://www.statgraphics.com/statgraphics/statgraphics.nsf/pd/pdpricing>.
15. Esquivel, L. A.; Lamadrid, M. L. J.; Díaz, M. B.; Torres, R. y Pérez, A. E. “Efecto de la fertilización mineral y biológica sobre tres genotipos de frijol común en un suelo Ferralítico Rojo Típico”. Centro Agrícola, vol. 41, no. 1, 2014, pp. 19–23, ISSN 0253-5785, 2072-2001.
16. Jasso, C.; Martínez, M. A. y Cruz, M. “Biofertilización en el cultivo del frijol en el estado de San Luis Potosí”. En: eds. Martínez M. A., Osuna E., Padilla J. S., Acosta J. A., y Loredo C., Tecnología para la producción de frijol en el Norte Centro de México, (ser. Técnica, no. ser. 4), Ed. INIFAP, 2008, pp. 131-147, ISBN 978-607-425-030-5.
17. Hardarson, G. y Atkins, C. “Optimising biological N2 fixation by legumes in farming systems”. Plant and Soil, vol. 252, no. 1, 2003, pp. 41-54, ISSN 0032-079X, 1573-5036, DOI 10.1023/A:1024103818971, [Consultado: 14 de febrero de 2017], Disponible en: <http://link.springer.com/article/10.1023/A:1024103818971>.
18. Devi, M. J.; Sinclair, T. R.; Beebe, S. E. y Rao, I. M. “Comparison of common bean (Phaseolus vulgaris L.) genotypes for nitrogen fixation tolerance to soil drying”. Plant and Soil, vol. 364, no. 1-2, 2013, pp. 29-37, ISSN 0032-079X, 1573-5036, DOI 10.1007/s11104-012-1330-4, [Consultado: 14 de febrero de 2017], Disponible en: <http://link.springer.com/article/10.1007/s11104-012-1330-4>.
19. Abd-Alla, M. H. “Nodulation and nitrogen fixation in interspecies grafts of soybean and common bean is controlled by isoflavonoid signal molecules translocated from shoot”. Plant Soil Environ, vol. 57, 2011, pp. 453–458, ISSN 1214-1178, 1805-9368, [Consultado: 14 de febrero de 2017], Disponible en: <https://www.researchgate.net/profile/Mohamed_Abd-Alla3/publication/259225684_Nodulation_and_nitrogen_fixation_in_interspecies_grafts_of_soybean_and_common_bean_is_controlled_by_isoflavonoid_signal_molecules_translocated_from_shoot/links/53fc73950cf2364ccc049d12.pdf>.
20. Erman, M.; Demir, S.; Ocak, E.; Tüfenkçi, Ş.; Oğuz, F. y Akköprü, A. “Effects of Rhizobium, arbuscular mycorrhiza and whey applications on some properties in chickpea (Cicer arietinum L.) under irrigated and rainfed conditions 1—Yield, yield components, nodulation and AMF colonization”. Field Crops Research, vol. 122, no. 1, 2011, pp. 14-24, ISSN 0378-4290, DOI 10.1016/j.fcr.2011.02.002, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.sciencedirect.com/science/article/pii/S037842901100044X>.
21. Tavasolee, A.; Aliasgharzad, N.; SalehiJouzani, G.; Mardi, M. y Asgharzadeh, A. “Interactive effects of Arbuscular mycorrhizal fungi and rhizobial strains on chickpea growth and nutrient content in plant”. African Journal of Biotechnology, vol. 10, no. 39, 2011, pp. 7585-7591, ISSN 1684-5315, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.ajol.info/index.php/ajb/article/view/94816>.
22. Tajini, F.; Trabelsi, M. y Drevon, J.-J. “Combined inoculation with Glomus intraradices and Rhizobium tropici CIAT899 increases phosphorus use efficiency for symbiotic nitrogen fixation in common bean (Phaseolus vulgaris L.)”. Saudi Journal of Biological Sciences, vol. 19, no. 2, 2012, pp. 157-163, ISSN 1319-562X, DOI 10.1016/j.sjbs.2011.11.003, [Consultado: 14 de febrero de 2017], Disponible en: <http://www.sciencedirect.com/science/article/pii/S1319562X11000726>.
23. Gong, M.; Tang, M.; Chen, H.; Zhang, Q.; Xu, H. y Zheng, C. “Effects of Glomus mosseae and Rhizobium on the growth of black locust seedlings and the quality of weathered soft rock soils in the Loess Plateau, China”. Annals of Microbiology, vol. 62, no. 4, 2012, pp. 1579-1586, ISSN 1590-4261, 1869-2044, DOI 10.1007/s13213-011-0413-4, [Consultado: 14 de febrero de 2017], Disponible en: <http://link.springer.com/article/10.1007/s13213-011-0413-4>.
24. Corbera, J. y Nápoles, M. C. “Evaluación de la inoculación conjunta Bradyrhizobium japonicum - hongos MA y la aplicación de un bioestimulador del crecimiento vegetal en soya, cultivada en época de primavera”. Cultivos Tropicales, vol. 32, no. 4, 2011, pp. 13-19, ISSN 0258-5936, [Consultado: 14 de febrero de 2017], Disponible en: <http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0258-59362011000400002&lng=es&nrm=iso&tlng=pt>.
25. Corbera, J. y Núñez, M. “Evaluación agronómica del análogo de brasinoesteroides BB-6 en soya, inoculada con Bradyrhizobium japonicum y HMA, cultivada en invierno sobre un suelo Ferralsol”. Cultivos Tropicales, vol. 25, no. 3, 2004, pp. 9–13, ISSN 0258-5936.
26. Terry-Alfonso, E.; Ruiz-Padrón, J.; Tejeda-Peraza, T.; Reynaldo-Escobar, I.; Carrillo-Sosa, Y. y Morales-Morales, H. A. “Interacción de bioproductos como alternativas para la producción horticultura cubana”. Tecnociencia Chihuahua, vol. 8, no. 3, 2014, pp. 163–174, ISSN 1870-6606, [Consultado: 14 de febrero de 2017], Disponible en: <http://tecnociencia.uach.mx/numeros/v8n3/Data/Interaccion_de_bioproductos_como_alternativas_para_la_produccion_horticultura_cubana.pdf>.
27. Rosabal, A. L.; Martínez, G. L.; Reyes, G. Y. y Núñez, V. M. “Resultados preliminares del efecto de la aplicación de Biobras-16 en el cultivo del frijol (Phaseolus vulgaris L.)”. Cultivos Tropicales, vol. 34, no. 3, 2013, pp. 71-75, ISSN 0258-5936, [Consultado: 14 de febrero de 2017], Disponible en: <http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0258-59362013000300011&lng=es&nrm=iso&tlng=es>.
Recibido: 29/06/2016
Aceptado: 18/11/2016
Lisbel Martínez-González, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal No.1, San José de las Lajas, Mayaquebe, Cuba, CP 32 700. Email: mnunez@inca.edu.cu