Respuesta de plantas in vitro de ñame clon ‘blanco de guinea’ al uso del pectimorf®
In vitro plants response of yam clone ‘Blanco de guinea’ to Pectimorf® use
Misterbino Borges-García, Orlando González-Paneque, Diana M. Reyes-Avalos, Miguel Rodríguez-González, Aracelis Villavicencio-Ramírez, Edil Estrada- Abeal
Universidad de Granma, Cuba.
RESUMEN
Los nuevos biorreguladores del crecimiento, como el Pectimorf®, se han utilizado en la propagación in vitro de diferentes cultivos. No obstante, el efecto de esta sustancia no se ha evaluado en la propagación in vitro del ñame; por ello, esta investigación tuvo como objetivo determinar la influencia del Pectimorf® en el medio de cultivo in vitro y su posterior efecto en la aclimatización de las plántulas del ñame (Dioscorea rotundata Poir) clon "Blanco de guinea". Se utilizó el medio de cultivo MS al 75 %, que contenía distintas concentraciones de Pectimorf® (3,0; 6,0; 9,0; 12,0; 15,0 mg L-1) y un tratamiento control (sin adición de Pectimorf®). También se evaluó el ulterior efecto residual del mejor tratamiento (6,0 mg L-1) en la aclimatización de las plántulas. A los 35 días se tomaron aleatoriamente 25 plantas in vitro a las cuales se les determinaron las siguientes variables: número de raíces; longitud de la raíz de mayor tamaño (cm), número de hojas; número de nudos de novo y la longitud del vástago (cm). Al cabo de 45 días de aclimatización, se evaluó la supervivencia (%) en 70 plántulas por tratamiento, y se tomaron aleatoriamente 40 plántulas a las cuales se les determinaron las siguientes variables: número de brotes; longitud del tallo (cm) y número de hojas. La adición de Pectimorf®a razón de 6,0 mg L-1 en el medio de cultivo in vitro fue la concentración más adecuada con una influencia significativa en el desarrollo vegetativo de las plantas in vitro y un efecto residual favorable en las plántulas aclimatizadas de ñame clon "Blanco de guinea".
Palabras clave: biorregulador del crecimiento, Dioscorea rotundata, micropropagación, oligosacáridos.
ABSTRACT
The new growth bioregulators, as Pectimorf®, they have been used in the in vitro propagation of different cultivations. Nevertheless, the effect of this substance has not been evaluated in the yam in vitro propagation, therefore, this investigation had as objective to determine the influence of the Pectimorf® in the in vitro culture medium and its further effect in the plantlets acclimatization of yam (Dioscorea rotundata Poir) clone "Blanco de guinea". The MS culture medium to 75 % with different concentrations of Pectimorf® (3,0; 6,0; 9,0; 12,0; 15,0 mg L-1) and a control treatment (without Pectimorf®) were used. The further residual effect of the best treatment (6,0 mg L-1) was also evaluated in the plantlets acclimatization. To the 35 days it is selected 25 in vitro plants aleatorily to which were determined the following variables: roots number; greatest root length (cm), leaves number, bud novo number and shoot length (cm). After 45 days survival (%) in 70 plantlets is evaluated by treatment and it is selected in 40 plantlets by treatment to which were determined the following variables: buds number; shoot length (cm) and leaves number. The addition of Pectimorf® 6,0 mg L-1 in the in vitro culture medium was the most appropriate with a significant influence in the in vitro plants vegetative development and a favorable residual effect in the acclimatized plantlets of yam clone "Blanco of guinea".
Key words: growth bioregulators, Dioscorea rotundata, micropropagation, oligosaccharides.
INTRODUCCIÓN
La producción de ñame posee como principales inconvenientes la escasez de semillas sanas libres de plagas, y su plantación en suelos de baja fertilidad, aspectos que provocan una pérdida de hasta un 90 % de los rendimientos de este cultivo (1). La principal meta del cultivo del ñame a nivel mundial lo constituye la obtención de material de plantación de buena calidad (2).
En Cuba la producción de ñame, ha disminuido en los últimos años. Esto ha sido debido principalmente al hecho que su cultivo ha estado limitado a pequeños productores y a la indisponibilidad de semilla de buena calidad (3). Por otro lado, los tubérculos, que constituyen la parte útil de la planta para la alimentación, también tienen que ser utilizados como material vegetal de plantación.
El clon de ñame ‘Blanco de guinea’ (Dioscorea rotundata Poir) se caracteriza por su adaptabilidad a las condiciones edafoclimáticas de las principales áreas agrícolas en el país. Tiene alto valor nutritivo y es uno de los clones de mayor aceptación por la población para su consumo fresco y en forma procesada.
A diferencia de los clones comerciales que pertenecen a la especie D. alata, este cultivar de la especie D.rotundata, no produce bulbillos aéreos por lo que entre un 35 y 40 % de los tubérculos producidos deben ser conservados como “semilla” para la próxima plantación (4).
Los bajos índices de multiplicación que presenta este clon mediante la propagación convencional determinaron que se desarrollaran protocolos para su propagación in vitro y su introducción en las biofábricas del país, lo que ha permitido contar con material de partida para iniciar los programas de producción de semillas de calidad en este cultivo (5). Recientemente se evaluó la respuesta en campo de plantas in vitro de D. alata en diferentes momentos de plantación en el año, lo que ha contribuido al diseño de estrategias para la producción de semilla en el país (6).
Son numerosas las investigaciones de un grupo de sustancias bioactivas o estimuladoras del crecimiento en Cuba y otros países, las cuales pueden utilizarse como sustitutos parciales o totales de los reguladores del crecimiento comúnmente empleados en los medios de cultivo de los esquemas de micropropagación en el campo de la Biotecnología Vegetal; dentro de este grupo está el Pectimorf®, que ha sido empleado para promover diferentes procesos en plantas, tanto in vitro como ex vitro (7).
El Pectimorf® es un producto natural e inocuo, constituido por una mezcla de oligosacáridos biológicamente activos, obtenidos a partir de la pectina cítrica, cuyo principio activo es una mezcla de α-1,4-oligogalacturónidos con grado de polimerización (GP) entre 9 y 16. Es considerado un potente elicitor de defensa en plantas y estimulante del crecimiento y diferenciación celular de distintos especies vegetales (8).
El clon de ñame ‘Blanco de guinea’ (D. rotundata) representa uno de los clones comerciales de mayor importancia y demanda por los productores de este cultivo, debido a la excelente calidad nutritiva, culinaria y de aceptabilidad por los consumidores.
Existen protocolos que emplean la bencilaminopurina (BAP) sola o combinada con ácido naftalenacético (ANA) en la propagación in vitro por vía organogénica a partir de segmentos nodales en las especies D.cayenensis-rotundata y D.alata, con una baja eficiencia (9). Sin embargo, no se han realizado investigaciones sobre el efecto de diferentes concentraciones de Pectimorf® en el medio de cultivo sobre el desarrollo vegetativo de las plantas in vitro y las plántulas aclimatizadas en ñame (Dioscorea spp.) y en particular en la especie D.rotundata clon ‘Blanco de guinea’.
MATERIALES Y MÉTODOS
El trabajo se desarrolló en el Laboratorio del Centro de Estudios de Biotecnología Vegetal (CEBVEG) de la Facultad de Ciencias Agrícolas perteneciente a la Universidad de Granma, Bayamo, Granma, Cuba.
Material vegetal
Se emplearon segmentos uninodales del clon de ñame ‘Blanco de guinea’ (D. rotundata) con una longitud de 12 a 15 mm, obtenidos de plantas in vitro en tercer subcultivo, procedentes del Banco de Germoplasma de semilla categorizada de ñame del CEBVEG.
Características del clon ‘Blanco de guinea’
Se caracteriza por presentar hojas acorazonadas-abarquilladas, enteras, paralelinervias, opuestas, verdes. Peciolos cilíndricos, PILP (punto de inserción limbo peciolo) y PIPT (punto de inserción pecíolo tallo) verdes, tanto en las hojas jóvenes como adultas. Tallos cilíndricos con espinas verdes y se arrollan en sentido de las manecillas del reloj. Rizomas cilíndricos, castaños, piel rugosa, sub-epidermis crema, masa blanca, susceptible a la antracnosis. Es necesario cultivarlo con tutores (10).
Medios y condiciones de cultivo in vitro
Se utilizó el medio de cultivo basal compuesto por las sales de Murashige y Skoog (MS) al 75 % de su concentración (10), vitaminas MS (11), sacarosa 30 g L-1, cisteína 10 mg L-1 y agar E (Biocen) 7,5 g L-1 (2). El pH del medio de cultivo se ajustó a 5,8 antes de la esterilización en autoclave. El medio de cultivo se distribuyó en tubos de ensayos de 24x150 mm con 5 mL por tubo. Finalmente, se esterilizó en autoclave vertical (BK-75) a 121 ºC de temperatura y 1,2 kgf cm-2 durante 25 minutos.
Los medios de cultivo se mantuvieron en reposo tres días antes de su uso, para detectar cualquier contaminación de los mismos. La siembra del material vegetal en los recipientes de cultivo se efectuó bajo cabina de flujo laminar horizontal. Las condiciones de cultivo en las cámaras de crecimiento de luz solar fueron: temperatura, 25±2 °C; humedad relativa, 70-80 %; intensidad luminosa de 40 µE m-2s-1, y una duración del fotoperíodo de 12 horas luz.
Influencia del Pectimorf® en el medio de cultivo “in vitro” de segmentos uninodales del ñame clon ‘Blanco de guinea’
El experimento tuvo como propósito determinar el efecto de diferentes concentraciones de Pectimorf® en el en el medio de cultivo “in vitro” de segmentos uninodales del ñame clon ‘Blanco de guinea’.
Se aplicó un diseño completamente aleatorizado con 50 explantes por tratamiento (tres repeticiones en el tiempo), los cuales consistieron en la utilización de distintas concentraciones de Pectimorf® (3,0; 6,0; 9,0; 12,0; 15,0 mg L-1) en el medio de cultivo MS al 75%, y un tratamiento control (sin adición de Pectimorf®). A los 35 días se tomaron aleatoriamente 25 plantas in vitro por tratamiento a los cuales se les determinaron las siguientes variables: número de raíces; longitud de la raíz de mayor tamaño (cm), número de hojas por planta, número de nudos de novo por planta y la longitud del vástago (cm) por planta.
Efecto residual del Pectimorf® durante la aclimatización de las plantas in vitro del ñame clon ‘Blanco de guinea’
Este experimento se realizó con la finalidad de determinar el efecto residual del Pectimorf® sobre los indicadores fundamentales de desarrollo de las plántulas en la fase de aclimatización.
Como material vegetal se emplearon plantas in vitro procedentes del quinto subcultivo en medio de cultivo MS al 75 % con la concentración de Pectimorf® más apropiada por su efecto biológico y ahorro de dicho bioregulador obtenida en la fase in vitro (6 mg L-1) y sin adición de Pectimorf® (control).
Se utilizó un diseño completamente aleatorizado formado por dos tratamientos con 70 plantas in vitro cada uno (cuatro repeticiones en el tiempo), las cuales fueron sembradas en bandejas de poliuretano de 70 pocillos con 100 cm3 de capacidad sobre un sustrato compuesto de humus de lombriz (50 %)+ zeolita (50 %). Se colocó una planta por alvéolo.
Las bandejas fueron colocadas en casa de cultivo protegida con una malla zarán negra (70 % de reducción de la luz solar). El fotoperíodo fue de 12 horas luz y la temperatura de 33 ± 2°C.
El riego se realizó por nebulización con microjet y una frecuencia diaria a plena capacidad del sustrato (90-95 % humedad relativa).Al cabo de los 45 días, se evaluó el porcentaje de supervivencia en 70 plantas y a 40 plantas por tratamiento, se les determinaron las siguientes variables: número de brotes; longitud del vástago mayor (cm) y número de hojas.
ANÁLISIS ESTADÍSTICO
Se aplicó un análisis de varianza de clasificación simple con prueba de comparación de medias de Tukey al 5 % de probabilidad del error para evaluar la influencia del Pectimorf® en el medio de cultivo “in vitro” de segmentos uninodales del ñame clon ‘Blanco de guinea’. Para comprobar la normalidad de los datos se utilizó la prueba de Kolmogorov – Smirnov y para la homogeneidad de varianzas la prueba de Barttlet. Se utilizó una prueba t de student para determinar el efecto residual del Pectimorf® durante la aclimatización de las plantas in vitro del ñame clon ‘Blanco de guinea’.
Todos los análisis estadísticos se realizaron con el programa Statistica para WINDOWS, versión 10.0 (12).
RESULTADOS Y DISCUSIÓN
Efecto del Pectimorf® en el medio de cultivo “in vitro” de segmentos uninodales del ñame clon ‘Blanco de guinea’
El cultivo in vitro de ñame tanto en D. alata como en D. rotundata posee como característica que durante la fase de multiplicación in vitro las plantas enraízan de manera satisfactoria, de modo que se considera una fase de propagación in vitro que contempla tanto la etapa de multiplicación como enraizamiento sin adición de reguladores del crecimiento.
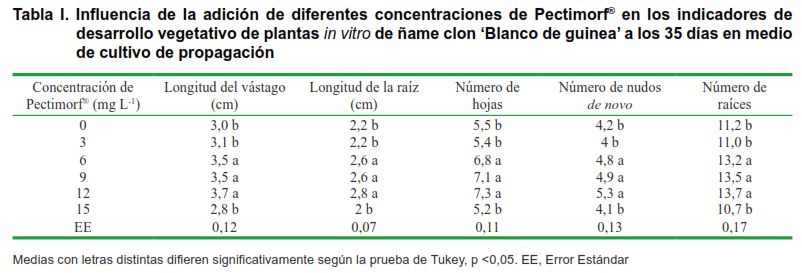
Al analizar el efecto de la adición del Pectimorf® en el medio de propagación in vitro del ñame ‘Blanco de guinea’ (Tabla I), se aprecia un incremento significativo sobre el desarrollo vegetativo de las plantas in vitro (longitud del vástago, longitud de la raíz de mayor tamaño, número de hojas, número de nudos de novo y número de raíces) con el uso de 6, 9 y 12 mg L-1, los cuales se diferencian de los tratamientos compuestos por 3, 15 mgL-1 de Pectimorf® y el control (sin adición de Pectimorf®).
Estos resultados demuestran un efecto auxinico/citoquininico del Pectimorf® a partir de las concentraciones de 6 hasta 12 mg L-1. El papel auxínico ejerce un mayor alargamiento celular, lo que se pone de manifiesto claramente en los aumentos significativos de los indicadores vegetativos: longitud del vástago, longitud de la raíz de mayor tamaño y número de raíces.Son numerosos los trabajos que corroboran que el Pectimorf® ejerce un efecto similar al de las auxinas, en el cultivo in vitro de plantas (7).
Al evaluar el efecto del Pectimorf® en el cultivo de ápices de plantas in vitro de yuca (Manihot esculenta Crantz), clones `CMC-40´ y `Señorita´ (8), se determinò que la altura de las plantas in vitro, en el clon ´CMC- 40´con 5 mg L-1 de Pectimorf® en sustitución de ANA, mostró el mayor valor de altura (2,88 cm),
sin diferencias significativas con el control ( ANA y BAP), y los tratamientos donde se añadió el Pectimorf® a 5 y 10 mg L-1 respectivamente, en presencia de ANA y sustitución del BAP.
Los resultados indicaron que el producto logró compensar el efecto de la auxina (ANA) en ausencia de esta en el medio; sin embargo, no se produjo un efecto depresivo (antagónico) marcado cuando estuvo presente.
No obstante (8), en el clon ´Señorita´ obtuvieron los máximos valores de altura,donde se empleó el Pectimorf® en presencia de ANA y GA3 a las concentraciones de 5 y 10 mg L-1, los cuales no difirieron estadísticamente entre ellos y alcanzaron valores por encima de los 2 cm de altura. Ambos tratamientos no difirieron del tratamiento control, tratamiento con 6-BAP + 5 mg L-1 Pectimorf® y del tratamiento donde se empleó el Pectimorf® en presencia de ANA a la concentración de 15 mg L-1. En este caso fue necesaria la presencia de ANA + Pectimorf®, donde el producto tuvo un efecto similar a las citoquininas al suplir la ausencia de BAP y estimular el crecimiento de los ápices de yuca.También este clon requirió la presencia de la auxina y concentraciones de 5 y 10 mg L-1 de Pectimorf®, lo que demostró que el contenido endógeno de auxinas en este clon es inferior, por lo que se necesita su adición exógena para lograr el balance apropiado para el crecimiento de los ápices.
Respuesta semejante fue descrita en un rango similar del uso del Pectimorf® en Nicotiana tabacum y Arabidopsis thaliana (L.) Heynh (13), utilizando 10 mg L-1 de Pectimorf®en el medio de cultivo in vitro donde se alcanzaron los mejores resultados en la elongación de la raíz.
Estudios han demostrado un efecto auxínico sinérgico de esta sustancia con el ácido indol butírico (AIB) en el enraizamiento en plantas de papaya (Carica papaya L.), donde el mayor número de plantas con raíces así como el mayor porcentaje de supervivencia, se obtuvo en el tratamiento con
9 mg L-1 de Pectimorf® combinado con 2 mg L-1 de AIB, en ausencia de sacarosa en el medio de cultivo y utilizando la zeolita como soporte (14).
El efecto citoquininico del Pectimorf® a las concentraciones de 6 hasta 12 mg L-1 se expresó en una mayor actividad de división celular lo que se evidenció en los incrementos significativos de los indicadores vegetativos número de hojas, nudos de novo y raíces de las plantas in vitro de ñame clon ‘Blanco de guinea’ (Tabla I). Con relación a ello, al evaluar la propagación in vitro de segmentos de escamas de lirio (15), se alcanzaron resultados similares al comprobar el efecto estimulante de esta mezcla de oligogalacturónidos en la concentración de 10 mg L-1 en la regeneración de plantas con un mayor número de bulbos, hojas y raíces.
Por otro lado, estos resultados no coinciden con los obtenidos al evaluar el efecto del Pectimorf® en el cultivo de ápices de plantas in vitro de yuca (Manihot esculenta Crantz) (8), para el número de hojas, en el clon ´CMC-40´, donde alcanzaron los mayores valores significativos (5,5 hojas) cuando se utilizó el Pectimorf® en la concentración de 15 mg L-1, en presencia de ambos reguladores, sin diferenciarse estadísticamente del tratamiento en ausencia de ANA y 5 mg L-1 de Pectimorf®, pero sí del resto de los tratamientos.
Estos resultados coinciden con los alcanzados al incorporar el Pectimorf® en el medio de cultivo in vitro de la yuca (Manihot esculenta L.) donde se obtuvo los mejores resultados con 9 mg L-1 de Pectimorf® tanto en el enraizamiento de los brotes in vitro de yuca como su posterior aclimatización (16). Sin embargo, en tabaco (Nicotiana tabacum) y Arabidopsis thaliana (L.) Heynh, se alcanzaron los mejores resultados utilizando 10 mg L-1 de Pectimorf® en el medio de cultivo in vitro (13).
Los resultados obtenidos en la fase de propagación in vitro indica que la adición de Pectimorf® (6 mg L-1) en el medio de cultivo (Figura 1) son adecuados para el desarrollo vegetativo de las plantas in vitro y en particular para incrementar la eficiencia de la micropropagación in vitro del ñame clon ‘Blanco de guinea’.
En el cultivo in vitro, el Pectimorf® ha sido ampliamente estudiado, demostrándose su capacidad como sustituto de los reguladores de crecimiento tradicionales, auxinas y citoquininas, en diferentes estadios y en diversos cultivos como la caña de azúcar, el café, los cítricos, la papa, el tomate, el tabaco, el banano, el arroz, el ajo, entre otros. También se han observado beneficios al cultivo como la promoción del enraizamiento, el incremento de brotes, así como resultados beneficiosos en el estadio de adaptación ex vitro (7).
El Pectimorf® promueve el desarrollo de raíces en plantas a concentraciones entre 5 y 20 mg L-1, lo que ha sido demostrado en diferentes cultivos (7).
Los resultados obtenidos en esta investigación en D.rotundata clon ‘Blanco de guinea’ con las mejores concentraciones de Pectimorf® (6 hasta 12 mg L-1) a los 35 días de cultivo, al compararse con los alcanzados por otros autores (9) en la micropropagación a partir de segmentos nodales de D.cayenensis-rotundata clon Kratsi en el medio MS con los reguladores del crecimiento ANA/BAP(0,5-0,5 mg L-1) a los 60 días de cultivo (a pesar de casi duplicarse el tiempo), son similares para el número de nudos de novo (5), superiores para el número de hojas (5) y raíces (3,9) y ligeramente inferiores para la longitud del vástago (4,55). Esto evidencia el marcado efecto auxínico/citoquinínico del Pectimorf® en la propagación in vitro del ñame (D. rotundata) clon ‘Blanco de guinea’ a partir de 6 hasta 12 mg L-1 en el medio MS al 75 % y sus potencialidades como sustituto de los reguladores del crecimiento tradicionalmente empleados en la propagación de este cultivo.
Efecto residual del Pectimorf® durante la aclimatización de las plantas in vitro del ñame clon ‘Blanco de guinea’
En la Figura 2 se presentan los resultados sobre el efecto de la concentración de Pectimorf® más apropiada (6 mg L-1) obtenida en el medio de cultivo in vitro sobre la supervivencia de las plántulas de ñame clon ‘Blanco de guinea’ a los 45 días de aclimatización en un sustrato compuesto por humus de lombriz (50 %) + zeolita (50 %). Como se aprecia, se produjo un incremento significativo (7 %) de la supervivencia de las plantas en el tratamiento con 6 mg L-1 de Pectimorf®, lo que pudiera ser atribuido a un efecto residual de este bioregulador debido a una mayor acumulación de sustancias de reservas en la fase in vitro, lo que propicia una mayor resistencia y tolerancia a las condiciones del estrés durante esta fase de aclimatización, se recuperan más rápido y presentan mejores condiciones para su trasplante definitivo a campo.
Resultados similares han sido logrados al evaluar la influencia del Pectimorf® en la aclimatización de plantas in vitro de banano (Musa spp.) del clon FHIA 18 durante la inmersión de las raíces de las plantas in vitro durante 15 minutos antes de su plantación y la aspersión foliar con el oligogalacturónido a diferentes concentraciones (1, 5 y 10 mg L-1); 15 días después de la plantación se incrementó la supervivencia de las plantas en un 8 % aproximadamente con respecto al controlA.
En la Tabla II se muestran los resultados del efecto de la concentración de Pectimorf® más apropiada
(6 mg L-1) obtenida en el medio de cultivo in vitro sobre el número de brotes, longitud del tallo y número de hojas durante su aclimatización en un sustrato compuesto por 1:1 de humus de lombriz y zeolita. Se observa en todos los casos una influencia significativa del Pectimorf® en todos los indicadores evaluados, indicando la potente acción de esta sustancia en el ulterior desarrollo vegetativo de las plántulas durante la aclimatización y adaptación a las condiciones naturales ex vitro.
En este sentido, en el cultivo del plátano clon FHIA 18 se obtuvieron resultados semejantes a la influencia de la adición de Pectimorf® en el medio de cultivo MS sobre la altura de la planta, el número de hojas y grosor del tallo en la fase de aclimatización, donde observaron un incremento significativo de estos parámetros y una disminución del estrés abiótico inducido por las técnicas de cultivo in vitro (menor contenido de prolina foliar) con adición de Pectimorf® en el medio de cultivo de enraizamiento a partir de 5 mg L-1 y un efecto favorable en esta etapa de micropropagación.
De forma general se observó que a las concentraciones de Pectimorf® 3 mg L-1 (más baja)
y 15 mg L-1 (más alta) se obtuvieron los valores significativos más bajos en los indicadores morfológicos evaluados. Esto pudo estar dado para la concentración menor a que no se alcanzó el balance hormonal adecuado, para inducir el incremento significativo de los procesos de desarrollo vegetativo de las plantas in vitro, de modo que resultó necesario una mayor adición exógena del Pectimorf® a partir de 6 mg L-1. Esto confirma que generalmente la respuesta del Pectimorf® como biorregulador en el cultivo in vitro de muchas plantas se logra a partir de 5 mg L-1, mientras que la concentración más alta (15 mg L-1) no tuvo un efecto favorable, lo que indica que su adición sobrepasa el balance hormonal óptimo del explante, resultando dicha concentración inapropiada para estimular la propagación de plantas in vitro de D.rotundata clon ‘Blanco de guinea’ (7).
Finalmente los resultados de esta investigación arrojaron un efecto biológico significativo y más apropiado con la adición de 6 mg L-1 del Pectimorf® en el medio de cultivo in vitro del ñame clon ‘Blanco de guinea’ tanto en la fase de micropropagación (Figura 3) como en la fase de aclimatización de las plántulas (Figura 4), lo cual puede ser atribuido a su marcado efecto biorregulador de los procesos de desarrollo vegetativo de las plantas en condiciones in vitro y ex vitro.
Resultados semejantes fueron alcanzados por otros investigadores (17), quienes demostraron que el Pectimorf® a la concentración de 10 mg L-1, aceleran e incrementan el proceso de embriogénesis somática in vitro de Citrus macrophylla Wester y también se emplean en diferentes procesos biotecnológicos como: crecimiento de plántulas de yuca (Manihot esculenta C.) durante su fase de aclimatización (18).
Recientemente también se ha declarado que la respuesta de esta mezcla de oligogalacturónidos (7, 8), cuyo efecto es similar al de las auxinas o citoquininas, puede estar dada principalmente al balance hormonal del explante y de la composición de reguladores del crecimiento en el medio de cultivo; además, regulan entre otros procesos, la interacción entre auxinas, citoquininas, giberelinas y etileno, lo cual valida al Pectimorf® como una alternativa promisoria en la biotecnología vegetal cubana.
CONCLUSIÓN
Los resultados obtenidos demuestran, las potencialidades del Pectimorf® como promotor de procesos morfogenéticos en especies vegetales; se evidencia que la incorporación de 6 mg L-1 de Pectimorf® en el medio de cultivo in vitro del ñame (D. rotundata) clon ‘Blanco de guinea’ tiene un efecto significativo en el desarrollo vegetativo de las plantas in vitro y una influencia residual favorable en las plántulas aclimatizadas.
AGRADECIMIENTOS
Agradecemos el apoyo brindado por el proyecto Nacional del Instituto Nacional de Ciencias Agrícolas (INCA), "Desarrollo de bioestimulantes para la protección y beneficio de cultivos de interés económico", en especial a su coordinador, Dr.C. Alejandro Falcón Rodríguez y al proyecto universitario de la Universidad de Granma "Sistema de producción de semilla categorizada de ñame en la Provincia Granma".
NOTA AL PIE
AIzquierdo, H. I. Empleo de nuevas sustancias como reguladores del crecimiento en la micropropagación del banano (Musa spp.) clon «FHIA- 18» (AAAB). Tesis de Doctorado, Instituto Nacional de Ciencias Agrícolas, 2013, Mayabeque, Cuba, 102 p.
BIBLIOGRAFÍA
1. Balogun, M. O. y Maroya, N. “Status and prospects for improving yam seed systems using temporary immersion bioreactors”. African Journal of Biotechnology, vol. 13, no. 15, 2014, pp. 1614-1622, ISSN 1684-5315, DOI 10.5897/AJBX2013.13522.
2. Aighewi, B. A.; Asiedu, R.; Maroya, N. y Balogun, M. “Improved propagation methods to raise the productivity of yam (Dioscorea rotundata Poir.)”. Food Security, vol. 7, no. 4, 2015, pp. 823-834, ISSN 1876-4517, 1876-4525, DOI 10.1007/s12571-015-0481-6.
3. Misterbino, B. G.; Malaurie, B.; Hannah, S. L.; Abeal, E.; Reyes, A. y Kosky, R. G. “Use of distinct culture media with different mineral strength on the in vitro multiplication of Dioscorea alata L.”. Cameroon Journal of Biological and Biochemical Sciences, vol. 20, 2012, pp. 1-9,
ISSN 1011-6451.
4. Rodríguez, D.; Galvéz, D.; Cabrera, M.; Beovides, Y.; Rodríguez, Y. y Robaina, A. “Respuesta agronómica de plantas de Dioscorea rotundata Point cv. `Blanco de Guinea’ obtenidas de minitubérculos producidos en casa de cultivo”. Biotecnología Vegetal, vol. 15, no. 1, 2015, pp. 53-58, ISSN 2074-8647.
5. Cabrera, M.; Gómez, R.; Espinosa, E. y Espinosa, A. “Efficiency of semi-automated culture systems on microtubers formation of yam (Dioscorea alata L.)”. Biotechnologie, Agronomie, Société et Environnement, vol. 16, no. 1, 2012, pp. 45-47, ISSN 1780-4507.
6. Borges, M.; Gómez-Kosky, R.; Estrada, E.; Reyes, D.; Malaurie, B. y Destrada, R. “Respuesta en campo de plantas in vitro de Dioscorea alata L. clon `Caraqueño’ en distintos momentos de plantación”. Biotecnología Vegetal, vol. 15, no. 3, 2015, pp. 137-142,
ISSN 2074-8647.
7. Falcón, A. B.; Costales, D.; González-Peña, D. y Nápoles, M. C. “Nuevos productos naturales para la agricultura: las oligosacarinas”. Cultivos Tropicales, vol. 36, no. supl.1, 2015, pp. 111-129, ISSN 0258-5936.
8. Suárez, L. y Hernández, M. M. “Efecto del Pectimorf® en el cultivo de ápices de plantas in vitro de yuca (Manihot esculenta Crantz), clones `CMC-40´ y `Señorita´”. Cultivos Tropicales, vol. 36, no. 4, 2015, pp. 55-62, ISSN 0258-5936.
9. Odah, K.; Tozo, K.; Akogo, Y.; Akpavi, S.; Aïdam, A.; Akpagana, K.; Gumedzoe, Y. M.; Kenny, L.; Du Jardin, P. y Zinsou, C. “Effect of benzylaminopurine (BAP) and alpha-naphthalene acetic acid (NAA) on the micropropagation and the production of seeds in yams cultivated in Togo”. Access International Journal of Agricultural Sciences, vol. 1, no. 4, 2013, pp. 37-45.
10. Castellanos, P. Instructivo Técnico del Cultivo del Ñame. Ed. SEDGRI - AGRINFOR, 2008, La Habana, Cuba, 18 p.
11. Murashige, T. y Skoog, F. “A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures”. Physiologia Plantarum, vol. 15, no. 3, 1962, pp. 473-497, ISSN 1399-3054, DOI 10.1111/j.1399-3054.1962.tb08052.x.
12. StatSoft. STATISTICA (data analysis software system) [en línea]. versión 10, [Windows], Ed. StatSoft, Inc., 2011, US, Disponible en: <http://www.statsoft.com>.
13. González-Pérez, L.; Vázquez-Glaría, A.; Perrotta, L.; Acosta, A.; Scriven, S. A.; Herbert, R.; Cabrera, J. C.; Francis, D. y Rogers, H. J. “Oligosaccharins and Pectimorf® stimulate root elongation and shorten the cell cycle in higher plants”. Plant Growth Regulation, vol. 68, no. 2, 2012, pp. 211-221, ISSN 0167-6903, 1573-5087, DOI 10.1007/s10725-012-9709-z.
14. Posada-Pérez, L.; Padrón-Montesinos, Y.; González-Olmedo, J.; Rodríguez-Sánchez, R.; Barbón-Rodriguez, R.; Norman-Montenegro, O.; Rodríguez-Escriba, R. C. y Gómez-Kosky, R. “Efecto del Pectimorf® en el enraizamiento y la aclimatización in vitro de brotes de papaya (Carica papaya L.) cultivar Maradol Roja”. Cultivos Tropicales, vol. 37, no. 3, 2016, pp. 50-59,
ISSN 0258-5936, DOI 10.13140/RG.2.1.1642.2642.
15. Lara, R. M.; Álvarez, M.; Florido, M.; Plana, D. y Cabrera, J. C. “Influencia del Pectimorf sobre la morfogénesis in vitro del Easter lily” [en línea]. En: III Taller de Productos Bioactivos, XIV Congreso Científico del INCA, Ed. Edicciones INCA, La Habana, Cuba, 2004, [Consultado: 6 de marzo de 2017], Disponible en: <http://bibliotecasibe.ecosur.mx/sibe/book/000042087>.
16. Hernández, M.; Suárez, L.; Valcárcel, M. y López, M. “Empleo de una mezcla de oligogalacturónidos (Pectimorf) en la propagación de Yuca (Manihot sculenta, Crantz) y Malanga (Colocasia sp) BV-O.10”. En: II Simposio Internacional de Raíces, Rizomas, Tubérculos, Plátano, Bananos y Papaya, Ed. INIVIT, Cayo Santa Maria, Cuba, 2013, ISBN 978-959-295-008-5.
17. Bao, L.; Hernández, R. M.; Diosdado, E.; Román, M. I.; González, C.; Rojas, A. y Rodríguez, A. “Embriogénesis somática de Citrus macrophylla Wester con el empleo del Pectimorf® y análogos de brasinoesteroides”. Revista Colombiana de Biotecnología, vol. 15, no. 1, 2013,
pp. 189-194, ISSN 1909-8758.
18. Suárez, L.; Cervone, F.; Hernández, M. M. y Sánchez, M. “Aclimatización de plántulas de yuca (Manihot esculenta). Aporte al estudio de los mecanismos de acción de Pectimorf”. En: IX Congreso Internacional de Biotecnología Vegetal, Ed. Centro de Bioplantas de Ciego de Avila, Cuba, 2013, ISBN 978-959-16-2045-3.
Recibido: 27/09/2016
Aceptado: 20/01/2017
Misterbino Borges-García, Universidad de Granma, Cuba. Email: mborgesg@udg.co.cu