Comportamiento de la conductancia estomática de dos variedades de tomate cubanas en condiciones de campo y riego limitado
Stomatal conductance behavior of two Cuban tomato varieties in field conditions and limited irrigation
Dr.C. José M. Dell’Amico-Rodríguez, Dr.C. Donaldo M. Morales-Guevara
Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32 700.
RESUMEN
Se estudió el comportamiento de la conductancia estomática (gs) en plantas de las variedades de tomate Inca-17 y Amalia, cultivadas en condiciones de campo. Se realizaron perfiles de humedad a dos profundidades de 0–15 cm y de 15-30 cm, mediante el método gravimétrico. Los datos climáticos durante el ensayo se tomaron de una estación meteorológica ubicada a 1 500 m del área experimental. La climatología fue típica de los meses en que se realizó el estudio (enero-marzo) y solamente se registraron tres precipitaciones (60 mm). La gs abaxial se midió en diferentes horas del día y en hojas similares se evaluó el potencial osmótico actual (ΨOs Act.) y el potencial osmótico a máxima saturación (ΨOs Sat.). Los valores de humedad del suelo fueron casi siempre superiores o iguales en el bloque INCA-17 que en el correspondiente a la variedad Amalia. Los valores mayores de gs se obtuvieron a las 11:00 am y a los 36 DDT en plantas de Inca-17 y los menores a las 14:00 horas a los 49 DDT en ambas variedades. En cuanto al ΨOs Act., los valores más negativos correspondieron a las plantas de la variedad Amalia y alcanzó a los 49 DDT valores de -1,1 MPa. La correlación de Pearson realizada evidenció que las variables que más correlacionaron con la gs en horas de la mañana fueron la humedad del suelo, la radiación solar diaria (RSD) y evaporación diaria y en la tarde fueron los valores de las temperaturas máximas y medias.
Palabras clave: humedad del suelo, relaciones agua planta, sequía, tomate.
ABSTRACT
It was studied the stomatal conductance (gs) behavior in tomato plants varieties Inca-17 and Amalia, cultivated in field conditions. Moisture profiles were performed at two depths 0-15 cm and 15-30 cm, using the gravimetric method. Climatic data during the test were taken from a meteorological station located 1,500 m from the experimental area. The climatology was typical of the months in which the study was conducted (January-March) and only three precipitations (60 mm) were recorded. Abaxial gs were measured at different times of day and similar leaves evaluated the current osmotic potential (ΨOs Act.) and the osmotic potential at maximum saturation (ΨOs Sat). Soil moisture values were almost always higher or equal in the INCA-17 block than in the Amalia variety. The gs highest values were obtained at 11:00 am and 36 DAT in Inca-17 plants and the smaller ones at 14:00 hours at 49 DAT in both varieties. As for ΨOs Act, the most negative values corresponded to Amalia variety and reached 49 DAT values of -1.1 MPa. The Pearson correlation showed that the variables that correlated most with the gs in the morning hours were soil moisture, daily solar radiation (RSD according its acronymsin) and daily evaporation, and in the afternoon were the maximum values and average temperatures.
Key words: soil moisture, plant water relations, drought, tomato.
INTRODUCCIÓN
La sequía es uno de los estreses abióticos más importante que limita la productividad de los cultivos en todo el mundo (1). Se espera que su incidencia aumente en frecuencia e intensidad (2, 3) en algunas regiones, debido a los efectos del cambio climático (4). Esto podría traer profundas implicaciones en países de las regiones afectadas en sus sistemas socio-económicos y en las regiones tropicales, donde se encuentran muchos países en desarrollo y en los cuales la pobreza y la desnutrición ya son problemas graves (5).
Disímiles condiciones ambientales pueden provocar un déficit de agua en las plantas. No sólo períodos de escasa o nula pluviometría, también la presencia de altas concentraciones de sales en el suelo o bajas temperaturas inducen deficiencia hídrica (6, 7).
A nivel mundial en muchas áreas agrícolas, la escasez de agua limita significativamente el crecimiento y la productividad de las plantas. Por tanto, mejorar el uso eficiente de la misma constituye una prioridad fundamental, por ser un rasgo importante para el fitomejoramiento.
Las estrategias de las plantas para hacer frente a la escasez de agua implican un conjunto complejo de rasgos relacionados con el agua y el carbono. Estos rasgos muestran fuertes interacciones que pueden ser relevantes a diferentes niveles de organización y escalas de tiempo (8). A escala corta de tiempo y a nivel de tejidos y órganos entre los procesos involucrados se incluye el comportamiento estomático (8).
Para soportar el estrés por sequía, las plantas cierran sus estomas para garantizar la turgencia y mantener el metabolismo celular. En la medida que estos se cierran, se reduce la tasa fotosintética, las plantas deben ajustar de forma constante su conductancia estomática para permitir suficiente entrada de CO2 y evitar pérdidas de agua innecesarias durante el estrés. Por lo tanto, las plantas deben sentir permanentemente el déficit hídrico (9).
La mayoría de los cultivos, incluyendo el tomate (Solanum lycopersium L.), son sensibles al estrés hídrico en diferentes fases de desarrollo, desde la germinación hasta el cuajado de los frutos (10). Como el agua, es uno de los factores ambientales más importantes que afectan el crecimiento de los frutos y la producción del cultivo del tomate, la programación del riego es decisiva para incrementar los rendimientos y la calidad de la cosecha (11).
Por otra parte, una explotación inadecuada de las técnicas de riego ocasiona pérdidas y provoca daños irreparables al medio ambiente como la salinización de los suelos, la contaminación de los acuíferos, o la degradación de las mejores tierras, las que por lo general están bajo riego (12).
Aunque el crecimiento de las plantas es controlado por una multitud de procesos fisiológicos, bioquímicos y moleculares, la fotosíntesis es un fenómeno clave, el cual contribuye sustancialmente a su crecimiento y desarrollo (13); por ello, el estudio del estado interno y flujo del agua en las plantas es importante para el entendimiento de su adaptación a los ambientes desfavorables y los estomas son de vital importancia para esa función. Ellos regulan el intercambio de gas principalmente de CO2 y vapor de agua con el ambiente permitiendo a las plantas optimizar y balancear el rendimiento fotosintético con la disponibilidad y uso del agua (14).
En Cuba, no existe mucha información disponible de trabajos realizados con el cultivo del tomate en condiciones de campo acerca de procesos fisiológicos como, el intercambio gaseoso y menos aún en condiciones de abastecimiento hídrico limitado.
El comportamiento de las plantas en condiciones de campo, es diferente casi siempre, a las cultivadas en condiciones controladas (cámaras de crecimiento) debido a una variedad de factores, entre los que se pueden señalar: mayor demanda evaporativa y por tanto, tasa de transpiración elevada; suelos con diferentes conductividades hidráulicas a la de los sustratos empleados en el laboratorio; condiciones ambientales que fluctúan constantemente en una escala de tiempo que va desde minutos a días (15).
Atendiendo a lo anteriormente expuesto, el trabajo tiene como objetivo estudiar el comportamiento de la conductancia estomática de dos variedades de tomate cubanas en condiciones de campo y con riego limitado.
MATERIALES Y MÉTODOS
El trabajo se realizó en condiciones de campo, en el Departamento de Servicios Agrícolas del Instituto Nacional de Ciencias Agrícolas. La especie estudiada fue Solanum lycopersicon, variedades INCA 17 y Amalia. Para la ejecución del trabajo se seleccionaron dos áreas de aproximadamente 1 000 m2 cada una con una separación entre ellas de 10 m, de un suelo Ferralítico Rojo compactado (16).
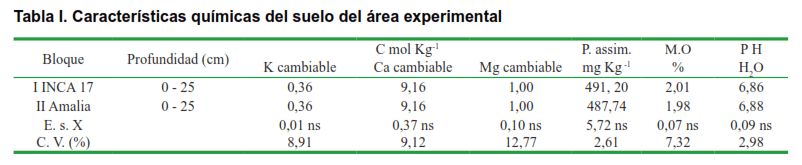
En cada bloque previamente identificado se realizó un muestreo agroquímico compuesto de cinco muestras en diagonal hasta 25 cm, de profundidad, con el objetivo de conocer las variaciones de fertilidad presentes en el área experimental. Los datos de los análisis de suelo se procesaron estadísticamente mediante un ANOVA de clasificación simple por cada uno de los elementos determinados y los resultados se presentan en la Tabla I, donde se evidenció que la fertilidad fue homogénea en ambos bloques, sin que se detectaran diferencias estadísticamente significativas en ninguna de las variables analizadas. De esta forma, se estableció un diseño muestral, que se detalla a continuación:
Las posturas de las dos variedades de tomate se plantaron en sus bloques correspondientes con un marco de plantación de 1,40 x 0,30 m. Las dos parcelas quedaron constituidas por 20 surcos de 40 m de largo cada una.
En los primeros 10 días posteriores al trasplante se realizaron tres riegos de 250 m3 há-1 mediante un sistema de aspersión y a los 56 días del trasplante (DDT) la parcela cultivada con la variedad INCA 17 recibió un riego adicional de 250 m3 há-1 que obedeció a un estudio específico de la floración de esta variedad. Todas las laborales culturales se realizaron por igual en ambas parcelas. A partir de los 36 DDT se realizaron diferentes evaluaciones en las plantas de las dos variedades.
En cada parcela se seleccionaron tres áreas de muestreo con el fin de conocer la dinámica de la humedad del suelo. Se realizaron perfiles de humedad a dos profundidades de 0 – 15 cm y de 15- 30 cm. Para la extracción y manejo de las muestras de suelo se utilizó una barrena de tirabuzón y cápsulas de humedad (pesafiltros) de aluminio debidamente taradas. Las muestras fueron procesadas mediante el método gravimétrico con un tiempo de secado en estufa de tiro forzado de 20 horas a 110 ºC. Los datos fueron expresados en porcentaje de humedad en base a suelo seco y de la capacidad de campo (C.c.) las mediciones se realizaron a los 36, 42, 49, 57, 63, 70 y 77 días de realizado el trasplante.
Los datos climáticos de temperatura mínima ºC (T. Min.), temperatura máxima ºC (T. Máx.), temperatura media ºC (T. Med.), radiación solar diaria en MJ m-2 día-1 (R. S. D.), lluvia en mm y evaporación en mm, se tomaron diariamente de una estación meteorológica ubicada a 1 500 m del área experimental y se expresan como promedios por decenas.
La conductancia estomática (gs) se midió a las 10:00, 11:00, 12:00, 13:00, 14:00 y 15:00 horas en
10 plantas por cada variedad en hojas del tercio superior bien expuestas al sol y mediante un porómetro de difusión (Delta–T DevicesType AP4). Las evaluaciones se realizaron a los 36, 49, 63 y 77 DDT.
En hojas similares se evaluó el potencial osmótico actual (YOs Act.) y el potencial osmótico a máxima saturación (YOs Sat.).
Para el YOs Act., las hojas se cubrieron con papel aluminio y se congelaron en nitrógeno líquido. Para la determinación de YOs Sat., las hojas seleccionadas se colocaron en cámaras de hidratación con agua destilada, a la oscuridad y entre 6 y 8 ºC durante 24 horas. Inmediatamente después se envolvieron con papel aluminio para su congelación en nitrógeno líquido y se almacenaron a – 20 ºC.
Posteriormente todas las muestras se descongelaron a temperatura ambiente y por centrifugación (1 minuto a 3000 rpm) se obtuvo el jugo celular de las hojas. A partir de alícuotas de 100 mL, se determinó el YOs Act.y el YOs Sat., de hojas con un osmómetro de presión de vapor VAPRO 5520. Para estas evaluaciones se realizaron cinco repeticiones por cada tratamiento.
Todas las evaluaciones se realizaron a los 36, 42, 49, 57, 63, 70 y 77 días de realizado el trasplante.
Para el procesamiento de los datos, la comparación de medias, y el cálculo de los Intervalos de Confianza de las medias se utilizó el programa estadístico SPSS 10.0 para Windows. La graficación de los resultados se realizó mediante el SIGMA PLOT 10.0. Además, con los valores medios de todas las variables y de la conductancia estomática en las distintas horas en que se midió se realizó una correlación de Pearson.
RESULTADOS Y DISCUSIÓN
En la Figura 1, se presentan los valores porcentuales de la humedad del suelo para las profundidades de 0–15 cm, de 15-30 cm, al igual que para el perfil de 0–30 cm. En la misma se apreciaron diferencias estadísticas en los dos primeros muestreos; a los 36 DDT la humedad fue mayor del 88 % de la Capacidad de campo (C.c.) en el bloque cultivado con la variedad Amalia y menor en el de la variedad INCA-17 (80 % de la C.c.). A los 42 DDT la humedad del suelo descendió alrededor del 70 % de la C. c. en ambos bloques y el porcentaje mayor de humedad correspondió al bloque cultivado con INCA-17.
Desde los 57 DDT y hasta los 70 DDT la humedad del suelo a esta profundidad fue superior en el bloque de la variedad INCA-17, mientras que a los 77 DDT los valores en ambos bloques fueron muy similares y muy próximos al 80 % de la C.c.
A la profundidad entre 15-30 cm (Figura 1B) solamente se apreciaron diferencias estadísticas en los porcentajes de humedad en el suelo a los 57, 63 y 70 DDT a favor del bloque de la variedad INCA-17 debido al riego adicional recibido. En el perfil promedio de 0-30 cm (Figura 1C) el comportamiento fue muy similar al mostrado en la figura 1B.
En general, se puede afirmar que los valores de humedad del suelo fueron casi siempre superiores o iguales en el bloque INCA-17 que en el correspondiente a la variedad Amalia.
Los datos meteorológicos en el período del experimento se muestran en las Figuras 2A y B, en 2A, se presentan los valores promedio decenales de la radiación solar diaria (RSD) y de evaporación (Ev), donde se aprecia que los valores de RSD estuvieron alrededor de los 21 Mj m-2 d-1 al inicio del experimento y alrededor de los 18 Mj m-2 d-1 al final, mientras que los valores de Ev al inicio fueron alrededor de 9 mm y al final cerca de los 7 mm. Por su parte, en la Figura 2B, las temperaturas en general variaron poco, las máximas estuvieron como promedio decenal entre 26,4 y 26,9 ºC.
La conductancia estomática (gs) de las dos variedades medida a las 10: 00, 11:00, 12:00, 13:00, 14:00 y 15:00 horas en los 36, 49, 63 y 77 DDT, se muestran en las Tablas II y III, respectivamente, en las que se encontró, que los valores más elevados de gs se presentaron a las 11:00 am y a los 36 DDT, con diferencias estadísticas a favor de las plantas de Inca-17 (Tabla II) y los valores más bajos de esta variable se presentaron a las 14:00 horas en los 49 DDT sin que se apreciaran diferencias estadísticas entre ambas variedades.
A nivel fisiológico, el cierre estomático constituye un mecanismo fundamental de tolerancia al estrés hídrico, por ser estos los responsables de la mayor pérdida de agua en las plantas (17). En este sentido, sería lo más lógico esperar que los valores más elevados de gs en Inca-17 se alcanzaran a los 63 DDT cuando la humedad en el suelo estuvo alrededor del 90 % de la C.c.; por el contrario, en Amalia se debían haber presentado los valores más bajos a los 63, o a los 77 DDT en ambas variedades, debido a los menores valores de humedad del suelo.
Al respecto otros autores (18, 19) trabajando con diferentes modelos de fotosíntesis y conductancia estomática vinculados con la humedad del suelo, han señalado que ningún método replica completamente la respuesta observada de los estomas al estrés hídrico del suelo y existen dudas acerca de la forma en que funciona el estrés de humedad del suelo cuando se trata de explicar el transporte físico y fisiológico del agua a través del continuo hidráulico suelo-planta-atmósfera (14, 20, 21).
Es de destacar que de forma general, los valores mayores de gs medidos a las 10:00 am, correspondieron a las plantas de la variedad Amalia, excepto a los 49 DDT que fueron ligeramente inferior a los de las plantas de Inca-17. Sin embargo, los valores de gs medidos a las 11:00 y 12:00 horas fueron casi siempre similares o superiores en Inca-17.
En el cultivo del caupí (Vigna unguiculata (L.) Walp.), se ha reportado que el cierre estomático como resultado de la disminución del contenido de humedad del suelo, constituye un indicador de estrés hídrico y este varía con el genotipo (22).
El potencial osmótico de las hojas es un componente importante de las relaciones hídricas de las plantas (23) el mismo hace una contribución negativa al potencial hídrico foliar debido a la concentración de solutos.
En la Figura 3A y 3B, se presentan las dinámicas de los YOs Act., y el YOs Sat., respectivamente, donde se encontró que los valores menos negativos de YOs Act. (Figura 3A) correspondientes a los 36, 49, 57, 70 y 77 DDT fueron propios de las plantas de la variedad Amalia con diferencias estadísticas respecto a las de la variedad Inca-17, lo que indica que en estas últimas la concentración de solutos fue mayor, debido fundamentalmente a una mayor deshidratación, incluso a los 49 DDT este indicador en las plantas de Inca-17 alcanzó valores cercanos a -1,1 MPa.
Por otra parte, en la Figura 3B, las variaciones en los valores del YOs Sat., principalmente en las plantas de la variedad Inca-17 fueron diferentes a lo esperado, ya que estas presentaron valores iguales o superiores de YOs Sat., a los de las plantas de la variedad Amalia a los 42, 49, 57, 63 y 70 DDT y solamente valores inferiores en los 36 y 77 DDT con diferencias estadísticas.
Este comportamiento, está asociado posiblemente a que las plantas de la variedad Amalia manifiesten un mayor control estomático de las pérdidas de agua por transpiración. Este control estomático, o regulación de la gs es un fenómeno de suma importancia para las plantas, debido a que permite evitar la deshidratación y asegurar la entrada del CO2.
En otras investigaciones señalan (24), que el cierre estomático en respuesta a situaciones estresantes de sequía y salinidad ocurre generalmente debido a la disminución de la turgencia foliar o al déficit de presión atmosférica unido a señales químicas generadas por las raíces. Por tanto, la disminución de la tasa fotosintética en condiciones estresantes (salinidad, sequía y temperaturas) es normalmente atribuida a la detención de la conductancia del mesófilo y al cierre estomático en situaciones de estrés moderado y severo.
Los efectos de la sequía en la fotosíntesis son adjudicados directamente a limitaciones estomáticas por difusión de gases, lo que finalmente altera al proceso fotosintético y el metabolismo del mesófilo.
En cuanto a la comparación de los YOs Act., y el YOs Act en Inca-17 (Figura 3C) los valores de YOs Act., a los 42, 49, 57 y 70 DDT, fueron más negativos que el YOs Sat., con diferencias estadísticas entre ambos, estos valores fueron iguales a los 36 y 77 DDT y solamente a los 63 DDT el YOs. Sat., fue menor.
En las plantas de la variedad Amalia (Figura 3D) sólo a los 42 DDT el YOs Act., fue inferior al YOs Act. Se destaca el hecho de que a los 63 DDT los valores de YOs Sat fueron más negativos que los de YOs Act., debido a una mayor concentración de solutos, sugiriendo la posible ocurrencia de un ligero proceso de ajuste osmótico en las hojas de ambas variedades. Los cambios en el suministro de agua se reflejan en variaciones pasivas y reversibles o activas e irreversibles, del YOs Act. del fluido vacuolar.
Estas variaciones en plantas bajo una radiación intensa oscilan de 0,2 a 0,6 MPa entre el valor máximo (medio día) y el valor mínimo (amanecer) y se deben a un desequilibrio transitorio entre la absorción y la pérdida de agua. Bajo un balance hídrico desfavorable con un desequilibrio hídrico interno, un mecanismo de defensa es el ‘ajuste osmótico’, al disminuir el YOs Act para mantener la turgencia.
El ajuste osmótico consiste en una disminución del potencial hídrico en los tejidos vegetales, lo que permite la entrada de agua e impide la disminución en el turgor o en la actividad fotosintética; se origina a través de la biosíntesis de osmolitos orgánicos de bajo peso molecular y por la acumulación de iones, especialmente K+ (25).
Este proceso de ajuste osmótico, constituye un mecanismo importante para el mantenimiento del consumo de agua y la turgencia celular en condiciones de estrés hídrico (26).
En las Tablas IV y V aparecen los resultados de las correlaciones de Pearson realizadas con los valores de gs medidos en diferentes horas del día frente a valores de la humedad del suelo, de potenciales osmóticos y variables climáticas, donde se encontró que la gs medida a las 10:00 am en las plantas de Inca-17 tuvo una correlación negativa con el YOs Act., mientras que las de Amalia mostraron correlaciones positivas con los valores de la humedad del suelo. Con las medidas correspondientes a las 11:00 am la gs en ambas variedades no tuvo correlación alguna con ninguna de las variables analizadas. Mientras que a las 12:00 m., las medidas de gs de las plantas de Inca-17 mostraron correlaciones positivas con los valores de la humedad del suelo y negativas con la radiación solar diaria (RDS) y la Evaporación diaria.
En el caso de la gs de las plantas de la variedad Amalia, solo presentaron correlaciones negativas con RDS y la evaporación diaria.
Al analizar las correlaciones en horas de la tarde (Tabla V), se encontró que a las 13:00 horas, la gs en la variedad Inca-17 mostró correlaciones positivas con la humedad del suelo, mientras que en las plantas de Amalia no presentaron correlación alguna. A las 14:00 horas Inca-17 mostró una correlación positiva de su gs con el YOs Act., y correlaciones negativas con los valores de las temperaturas, mientras que la gs en Amalia mostró correlaciones negativas con las temperaturas máximas y medias. A las 15 horas, solo las plantas de Amalia mostraron correlación negativa de su gs con los valores de temperaturas máximas.
CONCLUSIONES
A modo de conclusión, puede considerarse que las variables que más correlacionaron con la gs de las plantas de ambas variedades, fueron en horas de la mañana los valores de la humedad del suelo, de RSD y evaporación diaria, mientras que en horas de la tarde, fueron los valores de las temperaturas, fundamentalmente las máximas y las medias.
Estos resultados ponen de manifiesto, que los mecanismos que intervienen en la respuesta de los estomas a las variaciones ambientales, son múltiples y tienen efectos cuantitativamente diferentes, incluso a veces opuestos, en la conductancia estomática (15). Por ello, se hace necesario identificar los mecanismos que hagan una mayor contribución a la gs en un rango determinado de condiciones ambientales.
BIBLIOGRAFÍA
1. Li, C.; Ng, C. K.-Y. y Fan, L.-M. “MYB transcription factors, active players in abiotic stress signaling”. Environmental and Experimental Botany, vol. 114, 2015, (ser. Plant signalling mechanisms in response to the environment), pp. 80-91, ISSN 0098-8472, DOI 10.1016/j.envexpbot.2014.06.014.
2. Lauer, J. G.; Bijl, C. G.; Grusak, M. A.; Baenziger, P. S.; Boote, K.; Lingle, S.; Carter, T.; Kaeppler, S.; Boerma, R.; Eizenga, G.; Carter, P.; Goodman, M.; Nafziger, E.; Kidwell, K.; Mitchell, R.; Edgerton, M. D.; Quesenberry, K. y Willcox, M. C. “The Scientific Grand Challenges of the 21st Century for the Crop Science Society of America”. Crop Science, vol. 52, no. 3, 2012, pp. 1003-1010,
ISSN 0011-183X, DOI 10.2135/cropsci2011.12.0668.
3. Trenberth, K. E.; Dai, A.; van der Schrier, G.; Jones, P. D.; Barichivich, J.; Briffa, K. R. y Sheffield, J. “Global warming and changes in drought”. Nature Climate Change, vol. 4, no. 1, 2014, pp. 17-22, ISSN 1758-678X, DOI 10.1038/nclimate2067.
4. Peñuelas, J.; Poulter, B.; Sardans, J.; Ciais, P.; Velde, M. van der; Bopp, L.; Boucher, O.; Godderis, Y.; Hinsinger, P.; Llusia, J.; Nardin, E.; Vicca, S.; Obersteiner, M. y Janssens, I. A. “Human-induced nitrogen–phosphorus imbalances alter natural and managed ecosystems across the globe”. Nature Communications, vol. 4, 2013, p. 2934, ISSN 2041-1723, DOI 10.1038/ncomms3934.
5. Ukkola, A. M.; Pitman, A. J.; Decker, M.; De Kauwe, M. G.; Abramowitz, G.; Kala, J. y Wang, Y.-P. “Modelling evapotranspiration during precipitation deficits: identifying critical processes in a land surface model”. Hydrology and Earth System Sciences, vol. 20, no. 6, 2016, pp. 2403–2419, ISSN 1027-5606, DOI 10.5194/hess-20-2403-2016.
6. Tardieu, F.; Granier, C. y Muller, B. “Water deficit and growth. Co-ordinating processes without an orchestrator?”. Current Opinion in Plant Biology, vol. 14, no. 3, 2011, pp. 283-289, ISSN 1369-5266, DOI 10.1016/j.pbi.2011.02.002.
7. Cominelli, E.; Conti, L.; Tonelli, C. y Galbiati, M. “Challenges and perspectives to improve crop drought and salinity tolerance”. New Biotechnology, vol. 30, no. 4, 2013, (ser. Special Issue: 15th European Congress on Biotechnology (ECB15), Istanbul, 23-26th September 2012), pp. 355-361, ISSN 1871-6784, DOI 10.1016/j.nbt.2012.11.001.
8. Mencuccini, M. “Temporal scales for the coordination of tree carbon and water economies during droughts”. Tree Physiology, vol. 34, no. 5, 2014, pp. 439-442, ISSN 0829-318X, DOI 10.1093/treephys/tpu029.
9. Prasch, C. M. y Sonnewald, U. “Signaling events in plants: Stress factors in combination change the picture”. Environmental and Experimental Botany, vol. 114, 2015, (ser. Plant signalling mechanisms in response to the environment), pp. 4-14, ISSN 0098-8472, DOI 10.1016/j.envexpbot.2014.06.020.
10. Nahar, K.; Ullah, S. M. y Gretzmacher, R. “Influence of soil moisture stress on height, dry matter and yield of seven tomato cultivars”. Journal of Scientific & Industrial Research, vol. 2, no. 4, 2011, pp. 160–163, ISSN 0022-4456.
11. Wang, F.; Kang, S.; Du, T.; Li, F. y Qiu, R. “Determination of comprehensive quality index for tomato and its response to different irrigation treatments”. Agricultural Water Management, vol. 98, no. 8, 2011, pp. 1228-1238, ISSN 0378-3774, DOI 10.1016/j.agwat.2011.03.004.
12. Cisneros, Z. E.; López, S. T.; Leyva, L. A. y Placeres, M. Z. “Consideraciones sobre el servicio de asesoramiento al regante para las condiciones de Cuba”. Revista Ciencias Técnicas Agropecuarias, vol. 20, no. 3, 2011, pp. 41-45, ISSN 2071-0054.
13. Ashraf, M. y Harris, P. J. C. “Photosynthesis under stressful environments: An overview”. Photosynthetica, vol. 51, no. 2, 2013, pp. 163-190, ISSN 0300-3604, 1573-9058, DOI 10.1007/s11099-013-0021-6.
14. Manzoni, S.; Vico, G.; Palmroth, S.; Porporato, A. y Katul, G. “Optimization of stomatal conductance for maximum carbon gain under dynamic soil moisture”. Advances in Water Resources, vol. 62, Part A, 2013, pp. 90-105, ISSN 0309-1708, DOI 10.1016/j.advwatres.2013.09.020.
15. Tardieu, F. y Simonneau, T. “Variability among species of stomatal control under fluctuating soil water status and evaporative demand: modelling isohydric and anisohydric behaviours”. Journal of Experimental Botany, vol. 49, no. Special_Issue, 1998, pp. 419-432, ISSN 0022-0957, DOI 10.1093/jxb/49.Special_Issue.419.
16. Hernández, J. A.; Pérez, J. J. M.; Bosch, I. D. y Castro, S. N. Clasificación de los suelos de Cuba 2015. Ed. Ediciones INCA, 2015, Mayabeque, Cuba, 93 p., ISBN 978-959-7023-77-7.
17. Vidal, A. Y.; Pérez, A. y Fernández, L. “Óxido Nítrico y su papel en las respuestas de las plantas al estrés hídrico”. Cultivos Tropicales, vol. 36, no. supl. 1, 2015, pp. 51-58, ISSN 0258-5936.
18. De Kauwe, M. G.; Medlyn, B. E.; Zaehle, S.; Walker, A. P.; Dietze, M. C.; Hickler, T.; Jain, A. K.; Luo, Y.; Parton, W. J.; Prentice, I. C.; Smith, B.; Thornton, P. E.; Wang, S.; Wang, Y.-P.; Wårlind, D.; Weng, E.; Crous, K. Y.; Ellsworth, D. S.; Hanson, P. J.; Seok Kim, H.-; Warren, J. M.; Oren, R. y Norby, R. J. “Forest water use and water use efficiency at elevated CO2: a model-data intercomparison at two contrasting temperate forest FACE sites”. Global Change Biology, vol. 19, no. 6, 2013, pp. 1759-1779, ISSN 1365-2486, DOI 10.1111/gcb.12164.
19. Zhou, S.; Duursma, R. A.; Medlyn, B. E.; Kelly, J. W. G. y Prentice, I. C. “How should we model plant responses to drought? An analysis of stomatal and non-stomatal responses to water stress”. Agricultural and Forest Meteorology, vol. 182–183, 15 de diciembre de 2013, pp. 204-214,
ISSN 0168-1923, DOI 10.1016/j.agrformet.2013.05.009.
20. Bonan, G. B.; Williams, M.; Fisher, R. A. y Oleson, K. W. “Modeling stomatal conductance in the earth system: linking leaf water-use efficiency and water transport along the soil–plant–atmosphere continuum”. Geoscientific Model Devlopment, vol. 7, no. 5, 2014, pp. 2193-2222, ISSN 1991-9603, DOI 10.5194/gmd-7-2193-2014.
21. Verhoef, A. y Egea, G. “Modeling plant transpiration under limited soil water: Comparison of different plant and soil hydraulic parameterizations and preliminary implications for their use in land surface models”. Agricultural and Forest Meteorology, vol. 191, 2014, pp. 22-32,
ISSN 0168-1923, DOI 10.1016/j.agrformet.2014.02.009.
22. Singh, S. K. y Raja, R. K. “Regulation of photosynthesis, fluorescence, stomatal conductance and water-use efficiency of cowpea (Vigna unguiculata L. Walp.) under drought”. Journal of Photochemistry and Photobiology B: Biology, vol. 105, no. 1, 2011, pp. 40-50,
ISSN 1011-1344, DOI 10.1016/j.jphotobiol.2011.07.001.
23. Callister, A. N.; Arndt, S. K. y Adams, M. A. “Comparison of four methods for measuring osmotic potential of tree leaves”. Physiologia Plantarum, vol. 127, no. 3, 2006, pp. 383-392, ISSN 1399-3054, DOI 10.1111/j.1399-3054.2006.00652.x.
24. Chaves, M. M.; Flexas, J. y Pinheiro, C. “Photosynthesis under drought and salt stress: regulation mechanisms from whole plant to cell”. Annals of Botany, vol. 103, no. 4, 2009, pp. 551-560, ISSN 0305-7364, DOI 10.1093/aob/mcn125.
25. González-Rodríguez, H.; Cantú-Silva, I.; Ramírez-Lozano, R. G.; Gómez-Meza, M. V.; Pando-Moreno, M. y López-Hernández, J. M. “Potencial hídrico xilemático en cuatro especies arbustivas nativas del noreste de México”. Revista Chapingo: Serie Ciencias Forestales y del Ambiente, vol. 17, no. Especial, 2011, pp. 97-109, ISSN 0186-3231, DOI 10.5154/r.rchscfa.2010.09.080.
26. Florido, B. M. y Bao, F. L. “Tolerancia a estrés por déficit hídrico en tomate (Solanum lycopersicum L.)”. Cultivos Tropicales, vol. 35, no. 3, 2014, pp. 70-88, ISSN 0258-5936.
Recibido: 27/10/2016
Aceptado: 09/02/2017
Dr.C. José M. Dell’Amico-Rodríguez, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32 700. Email:amico@inca.edu.cu