ARTÍCULO ORIGINAL
Evaluación de la actividad antifúngica de Trichoderma asperellum Samuels ante patógenos fúngicos que afectan al cultivo de la soya (Glycine max L.)
Evaluation of antifungal activity of Trichoderma asperellum Samuels against fungal pathogens that affect soybean (Glycine max L.) crop
M.Cs. Ariel Cruz-Triana,I Dra.C. Deyanira Rivero-González,I Dr.C. Benedicto Martínez-Coca,II M.Cs. Anayza Echevarría-Hernández,I M.Cs. Aida Tania-RodríguezI
IUnidad Científico Tecnológica de Base “Los Palacios”, Km 1 ½ carretera La Francia, Los Palacios, Pinar del Río, Cuba.
IIGrupo de Fitopatología Protección de plantas. Centro Nacional de Sanidad Agropecuaria (CENSA), Carretera Jamaica Km 3,5 San Josť de las Lajas, Mayabeque, Cuba.
RESUMEN
Entre los factores que inciden negativamente en el rendimiento del cultivo de la soya (Glycine max L.) se destaca la incidencia de numerosas plagas y en específico las causadas por hongos. En el control fitosanitario de estos agentes se emplean numerosos fungicidas en dosis cada vez mayores, y en la mayoría de los casos no se logra el control deseado, situación que incrementa los costos de producción y reduce significativamente los beneficios de los productores. Sobre la base de estos antecedentes, el objetivo del trabajo fue evaluar las enfermedades fúngicas de mayor incidencia en el cultivo de la soya, así como la actividad antifúngica de Trichoderma asperellum Samuels. El experimento se desarrolló en la Unidad Científica Tecnológica de Base “Los Palacios”. Se evaluó el antagonismo in vitro de cepas de T. asperellum por el método de cultivo dual en placas de Petri. Además se evaluó la distribución e índice de ataque de enfermedades claves del cultivo de la soya en condiciones de campo al ser tratado con la cepa de T. asperellum Ta. 13. De manera general T. asperellum mostró un elevado potencial para el control biológico de las enfermedades evaluadas, disminuyendo significativamente su distribución y porcentaje de infección, e incidió en que el número de vainas por plantas fuera superior.
Palabras clave: control biológico, Cercospora kikuchii, Fusarium sp., Phakopsora pachyrhizi.
ABSTRACT
Among the factors that adversely affect crop yield of soybean (Glycine max L.) the incidence of pests and more specifically pests caused by fungi stand out. Numerous fungicides in increasing doses are used in the phytosanitary control of these agents, and in most cases the desired control is not achieved, a situation that increases production costs and significantly reduces farmer benefits. Based on these antecedents, the objective was to evaluate fungal diseases of highest incidence in soybean crop and antifungal activity of Trichoderma asperellum Samuels. The experiment was carried out at the Basic Scientific and Technological Unit “Los Palacios”. The in vitro antagonism of T. asperellum strains by the method of dual culture in Petri dishes was assessed. Besides, the distribution and the attack index of soybean crop key diseases under field conditions when the crop was treated with the Ta. 13 strain of T. asperellum were evaluated. Generally, T. asperellum showed a high potential for the biological control of evaluated diseases, significantly reducing its distribution and infection percentage and it provoked that the number of pods per plant were higher.
Key words: biological control, Cercospora kikuchii, Fusarium sp, Phakopsora pachyrhizi.
INTRODUCCIÓN
La soya (Glycine max L.) es una de las oleaginosas más importantes del mundo (1,2). La soja es el principal cultivo en Argentina debido a su adaptación a los suelos, la incorporación de tecnología con el empleo de la siembra directa y el precio del mercado internacional. Las propiedades físicas, químicas y biológicas de cada suelo se ven modificadas por el tipo de sistema de laboreo empleado. El entorno generado por la labranza altera el crecimiento y el equilibrio funcional de los cultivos herbáceos. En el año 2006, se instaló un ensayo en el Partido de Ezeiza (Pampa Ondulada, tanto por los volúmenes comercializados como semilla, como por los importantes subproductos que se obtienen, los que forman parte de una larga serie de cadenas agroindustriales. Es altamente nutritiva, sus granos contienen alrededor del 35 % de proteínas y posee casi todos los aminoácidos esenciales. La producción mundial de soya ha superado los 250 millones de toneladas, distribuidas principalmente entre Estados Unidos (45 %) y Brasil (26 %), seguidos por Argentina, China, India, Paraguay y Canadá (3).
En Cuba se importa desde Brasil, Argentina y países de Asia, lo que hace necesario destinar cuantiosos recursos para adquirir el grano, que resulta un componente importante en la producción intensiva de carne de aves y cerdos, producción de leche, yogur, aceite y otros alimentos (4). Sobre la base de esta premisa, en los últimos cinco años hubo un incremento notable de las áreas para la producción de soya y de la tecnificación del cultivo en el país.
Las condiciones edafoclimáticas en Cuba son favorables para el desarrollo del cultivo de la soya, alcanzándose rendimientos superiores a las 2 t ha-1. Sin embargo, las altas temperaturas y humedades relativas son propicias para la proliferación de numerosas plagas, y daños causados por hongos. Las enfermedades se manifiestan en cualquier estado de desarrollo de la planta o simplemente durante todo su ciclo; reduciendo la producción de soya, afectando la calidad física, fisiológica, nutricional y comercial del producto, tanto en grano comercial como en semilla, provocando pérdidas anuales alrededor del 10 % de la producción.
Las enfermedades fúngicas del suelo son de difícil control y el tratamiento de semillas no logra la protección de los cultivos durante largos períodos de tiempo (5). La aplicación reiterada de fungicidas químicos contra estos patógenos ha favorecido la aparición de cepas resistentes y desbalances en la microbiota del suelo, que disminuyen la actividad antagonista de microorganismos beneficiosos que están presentes en el suelo (5). Teniendo en cuenta estos aspectos las demandas de alternativas de control de las enfermedades cobran mayor importancia. En este sentido, la aplicación de Trichoderma spp. en diferentes interacciones planta-patógeno ha demostrado su factibilidad biológica a nivel global (6). Este hongo antagonista es un habitante natural del suelo que posee excelentes cualidades para el control biológico de patógenos fúngicos y posee diferentes mecanismos, a través de los cuales ejerce su acción, destaca entre ellos, la competencia microbiana actuando como colonizador de las raíces y no dejando nicho ecológico a otros hongos fitopatógenos (6). También producen metabolitos que favorecen la salud, la masa radicular, y consecuentemente los rendimientos.
Sobre la base de estas premisas se plantea que los productos a base de Trichoderma spp. constituyen una nueva alternativa ecológica al uso de los productos químicos en la agricultura.
Este trabajo tiene como objetivo evaluar la actividad antifúngica de Trichoderma asperellum ante patógenos que afectan al cultivo de la soya (Glycine max L.).
MATERIALES Y MÉTODOS
Determinar las plagas de origen fúngico de mayor incidencia en el cultivo de la soya
El experimento se desarrolló en la Unidad Científica Tecnológica de Base, Los Palacios, Pinar del Río, Cuba; perteneciente al Instituto Nacional de Ciencias Agrícolas (INCA), durante la época poco lluviosa del año 2014, en un sistema de terrazas planas y suelo arrocero clasificado como Hidromórfico Gley Nodular Petroférrico (7).
Se sembró un área de 250 m2 con el cultivar Vietnamita DT-20, siguiendo las normas descritas en la guía técnica para la producción de soya, con la variante de que no se aplicó ningún fungicida químico (8).
Se evaluaron las enfermedades fúngicas presentes y su distribución con una frecuencia
de 15 días; para ello se contaron 100 plantas en diagonal cruzada, y se determinó el porcentaje de plantas con síntomas de las enfermedades. La determinación de los agentes causales de las enfermedades se basó en la comparación entre la sintomatología presentada y la bibliografía (8). También se realizaron observaciones al estéreo (Modelo Novel con aumento de 100x) y un microscopio óptico (Modelo Novel N-800M, con aumento de 400x), con el apoyo de las claves morfológicas de identificación para los patógenos (9). La fórmula empleada en la evaluación de campo es la siguiente:
P= (a/N) 100
a.- No. de plantas u órganos enfermos
N.- Total de plantas de la muestra
Antagonismo in vitro de aislamientos de T. asperellum frente a la especie fúngica de mayor distribución en condiciones de campo
Se evaluó el efecto antagónico de las cepas Ta.3, Ta.13, Ta.17, y Ta.85 de T. asperellum frente al hongo de mayor distribución en condiciones de campo. Para ello se utilizó el método de cultivo dual, a partir de cultivos del hongo sembrado en medio Papa-Dextrosa-Agar (BIOCEN) a pH 5,5, incubado a 26 ºC
y oscuridad durante siete días. Los aislamientos de T. asperellum utilizados en este ensayo fueron aislados y caracterizados (10), y se conservan en el Laboratorio de Micología Vegetal del Centro Nacional de Sanidad Agropecuaria (CENSA).
Se sembraron discos de 0,6 cm de diámetro del antagonista y del patógeno, diametralmente opuestos sobre placas de Petri de 9 cm de diámetro con medio PDA. Se sometieron a similares condiciones de incubación durante 11 días de observación. Se utilizó un control del patógeno, incubado en condiciones similares. Se emplearon cinco réplicas por tratamiento.
Se evaluó la competencia por sustrato. Para ello se midió el radio de las colonias a las 16, 24, 40, 48, 64, 72, 64, 72, 88, 96, 184, 208 y 232 horas, mediante el uso de una regla graduada (mm) y se determinó el grado de antagonismo según Escala descrita por Bell y colaboradores (11):
1- Trichoderma sp. creció completamente sobre el medio de cultivo y sobre el organismo patógeno.
2- Trichoderma sp. creció completamente sobre el medio de cultivo y sobre el organismo patógeno.
3- Trichoderma sp. alcanza 2/3 de la superficie del medio de cultivo.
4- Trichoderma sp. y el patógeno han colonizado aproximadamente la mitad de la superficie del medio y ninguno de ellos domina sobre el otro.
5- El organismo patógeno coloniza al menos 2/3 de la superficie del medio.
6- El organismo patógeno crece por encima de Trichoderma sp. y ocupa la superficie del medio.
A las 64 horas, se determinó el porcentaje de inhibición del crecimiento radial del patógeno (PICR) según la fórmula:
donde:
r1: crecimiento radial de la colonia control.
r2: crecimiento radial del aislamiento enfrentado al antagonista.
Efectividad de T. asperellum contra los hongos de mayor incidencia en el cultivo de la soya en condiciones de campo
El experimento se desarrolló en la Unidad Científica Tecnológica de Base Los Palacios. La siembra se realizó sobre el camellón del surco, y se utilizó soya, cultivar vietnamita DT-20, a una densidad de siembra de 160 000 plantas por ha y la distancia entre camellón de 0,70 m, siguiendo las normas descritas en la guía técnica para el cultivo de la soya (8).
Se empleó la cepa T. asperellum Ta.13 y las aplicaciones se realizaron con mochila, en horas de la mañana. El tratamiento al suelo se aplicó cinco días previos a la siembra, en las plantas jóvenes se aplicó en la base de la planta y el último tratamiento se realizó a inicios de la floración, sobre el follaje de las plantas. En todas las variantes la dosis de T. asperellum fue de 1 kg ha-1a una concentración de 109 conidios.g-1.
Se realizaron parcelas de 30 m2 (5x6) en un diseño de bloques al azar, con tres repeticiones por cada tratamiento, con las siguientes variantes:
1- Tratamiento control de los patógenos con aplicación de fungicidas químicos (C+Q)
2- Tratamiento control sin aplicación química (C-Q)
3- Tratamiento de T. asperellum al suelo (Ta. 13+S)
4- Tratamiento de T. asperellum al suelo y al tallo de plantas jóvenes (Ta.13+S+T)
5- Tratamiento de T. asperellum al suelo, al tallo de plantas jóvenes y previo a la floración (Ta.13 +S+T+F)
En el tratamiento control de los patógenos se utilizaron los productos Celest Top a la dosis de
3,0 ml kg-1 de semilla y una aplicación previa a la floración con Amistar 250 SC a la dosis de 0,3 L ha-1.
Se evaluaron quincenalmente los síntomas presentes y se realizó un muestreo de 50 plantas siguiendo la metodología de bandera inglesa (12). Posteriormente se determinó la distribución de la enfermedad y su incidencia.
El cálculo del porcentaje de infección se realizó a través de las escalas de evaluación y la fórmula de Townsend y Heuberger (13).
I= [∑ (a.b)/NK] 100
I.- Porcentaje de infección.
[∑ (a.b).- Sumatoria de los productos del número de plantas (a) por su correspondiente grado (b).
N.- Número total de plantas observadas.
K.- Mayor grado de la escala.
Escala de evaluación de enfermedades del suelo (14):
Sin síntomas visibles de la enfermedad.
Decoloración ligera, sin lesiones necróticas o con 10 % de los tejidos del hipocótilo y de la raíz cubiertos con lesiones.
Aproximadamente el 25 % de los tejidos del hipocótilo y de la raíz están cubiertos con lesiones, con decoloración fuerte, aunque los tejidos estén firmes.
Aproximadamente el 50 % de los tejidos del hipocótilo y de la raíz están cubiertos con lesiones que se combinan con ablandamiento, pudrición y reducción considerable del sistema radical.
Aproximadamente el 75 % o más de los tejidos del hipocótilo y de la raíz están afectados por estados avanzados de pudrición, en combinación con una reducción severa del sistema radical.
En dependencia del área del órgano aéreo de la planta afectada, se elaboró la siguiente escala:
0- Hojas aparentemente sanas
1- Algunas manchas
2- Hasta 10 % de la superficie de un órgano con síntoma.
3- Atacada de 11 a 25 % de la superficie de un órgano con síntoma.
4- Atacada de 26 a 50 % de la superficie de un órgano con síntoma.
5- Más del 50 % de la superficie de un órgano con síntoma.
Se seleccionaron 30 plantas al azar por cada tratamiento y se determinó el número de vainas por plantas y la masa de 100 granos.
Con los datos de distribución, porcentaje de infección y del rendimiento, se realizó un análisis de varianza simple para cada enfermedad y variable de rendimiento evaluada. Se utilizó el paquete estadístico STATGRAPHYCS versión 5,1 (15). Las medias se docimaron mediante la prueba de rangos múltiples de Duncan con un nivel de significación de p≤ 0,05 (16).
RESULTADOS Y DISCUSIÓN
Evaluación de las plagas fúngicas de mayor incidencia en el cultivo de la soya
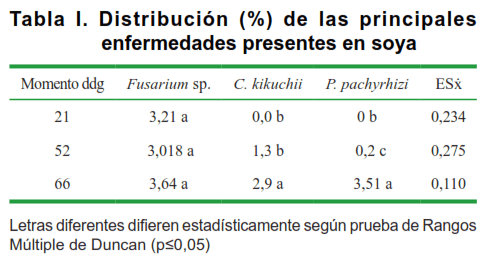
Los hongos que incidieron bajo las condiciones experimentales evaluadas fueron Fusarium sp., Cercospora kikuchii (Matsumoto & Tomoyasu) M. W. Gardner y Phakopsora pachyrhizi Sydow & P Sydow y más marcadamente sobresaliendo Fusarium sp., con una distribución superior al 3 % independientemente del momento de la evaluación (Tabla I). Se observó que la distribución de C. kikuchii y P. pachyrhizi aumentó con el tiempo lo que corrobora que son enfermedades de mayor incidencia en las fases finales de desarrollo del cultivo. A los 52 días hubo una distribución significativamente mayor de C. kikuchii con respecto P. pachyrhizi y a los 66 días se manifestó un comportamiento inverso. Los momentos de mayor incidencia de las enfermedades en estudio concuerdan con los descritos por otros autores bajo condiciones experimentales similares (17).
Antagonismo in vitro de aislamientos de T. asperellum frente al principal agente fungoso de la soya
Competencia por el sustrato
Los aislamientos Ta. 13 y Ta. 85 de T. asperellum se ubicaron en el grado 1 de la Escala de Bell, frente al patógeno evaluado, mientras que las cepas Ta. 3 y Ta. 17 mostraron el grado 2 de antagonismo (Tabla II).
Esto evidencia una alta capacidad antagónica de los mismos, aun cuando estos últimos no crecen completamente sobre el patógeno. Esto les confiere una importante ventaja competitiva por el espacio respecto a los hongos fitopatógenos, inclusive antes de mostrar su arsenal de micotoxinas y actividad micoparasítica (18).
Esto revierte mayor importancia ya que las cepas de Trichoderma colonizan rápidamente el suelo, debido a que son naturalmente resistentes a muchos compuestos químicos tóxicos, incluyendo herbicidas, fungicidas, plaguicidas y compuestos fenólicos, y más aún si se tiene presente que muchas de éstas son fuertes invasores oportunistas y productoras de antibióticos poderosos (19).
Los aislamientos Ta. 3, Ta. 13, Ta. 17 y Ta. 85 de T. asperellum manifiestan un efecto inhibitorio del crecimiento radial con respecto al control, a las 64 horas que varía de 11 a 26 % con respecto al control.
El aislamiento Ta.13 fue el que mayor PICR produjo frente al patógeno (26 %), observándose diferencias significativas con respecto a las demás cepas evaluadas, por lo que de este análisis se puede concluir que el mejor aislamiento en cuanto al PICR frente al patógeno fue Ta. 13 (Figura).
Los valores de PICR de la cepa Ta 13, fueron similares a los obtenidos por otros autores al evaluar la antibiosis de aislamientos de Trichoderma spp. frente a Botrytis cinérea en Mora y Rhizoctonia sp. (18,20).
El proceso micoparasítico es complejo y puede involucrar el crecimiento quimiotrófico de Trichoderma hacia el hospedante estimulado por moléculas procedentes del mismo, como aminoácidos y azúcares; el reconocimiento mediado por lectinas; la formación de garfios o estructuras parecidas a apresorios que contienen altas concentraciones de solutos osmóticamente activos como el glicerol y que facilitan la penetración; la secreción de enzimas hidrolíticas extracelulares; y finalmente la penetración y la muerte del hospedante. La capacidad antibiótica del género Trichoderma se debe principalmente a la producción de los antibióticos peptaibol, trichozianinas A1 y B1. Mediante la producción de estos metabolitos Trichoderma sp. logran inhibir la germinación de las esporas y la elongación de hifas de hongos fitopatógenos. Sobre la base de lo antes expuesto, resulta razonable pensar que la eficacia de la cepa Ta. 13 pudiera deberse a que produce altas concentraciones de estos metabolitos (18).
Efectividad de T. asperellum frente a los hongos fitopatógenos Fusarium sp., C. kikuchii y P. pachyrhizi en condiciones de campo
Independientemente de la enfermedad evaluada, la distribución de las enfermedades en los tratamientos con T. asperellum fue significativamente menor que en el tratamiento sin aplicación química, excepto el tratamiento tres con T. asperellum contra el hongo P. pachyrhizi, donde no se observaron diferencias. Esto pudiera deberse a que en el tratamiento tres solo se realizó la aplicación de T. asperellum al suelo y este patógeno afecta las partes aéreas y en las fases finales de desarrollo del cultivo (21), por lo que la acción de T. asperellum fue limitada (Tabla III).
La distribución de Fusarium sp. en todos los tratamientos con T. asperellum fue significativamente menor con respecto al control sin aplicación, por lo que no se justifica realizar las tres aplicaciones para el control de esta enfermedad.
Con respecto al tratamiento químico se observó menor distribución de las enfermedades C. kikuchii y P. pachyrhizi cuando se realizaron las tres aplicaciones con T. asperellum.
Al evaluar el porcentaje de infección se observó una tendencia similar a la distribución; sin embargo, para disminuir las afectaciones de los hongos C. kikuchii y P. pachyrhizi fueron necesarias realizar al menos dos aplicaciones con el biocontrolador (Tabla IV).
Hay que señalar que a partir de la primera aplicación de T. asperellum, tanto la distribución como el porcentaje de infección de Fusarium fue significativamente menor con respecto al control sin aplicación. Esto pudiera deberse a que ambos comparten el mismo habitad y se favorece la activación temprana de mecanismos de acción como la competencia por el substrato, la antibiosis y el micoparasitismo de Trichoderma sobre el patógeno (5).
Los tratamientos con el control biológico tuvieron un mayor número de vainas con respecto al tratamiento sin aplicación; sin embargo, no se observaron diferencias significativas entre los tratamientos con respecto al peso de los granos (Tabla V). Las diferencias en cuanto al número de vainas por plantas, pudiera deberse a que Trichoderma promueve el crecimiento vegetal. Según Viterbo (22) Trichoderma potencia la germinación seminal, el crecimiento y desarrollo radical, la toma y uso de nutrientes, la resistencia a estrés abiótico, floración más abundante y temprana, un aumento de altura y peso de las plantas, incluso un incremento en los rendimientos. Éstos procesos están mediados por la síntesis o estimulación de la producción de fitohormonas por la planta debido a la interacción con algunas cepas de Trichoderma, como las moléculas semejantes a citoquininas (zeatina) y giberelina GA3; así como por la acidificación del medio circundante debido a la excreción de ácidos orgánicos: glucónico, cítrico y fumárico, los que permiten la solubilización de fosfatos, micronutrientes y trazas minerales (hierro, manganeso y magnesio) (19,23).
CONCLUSIONES
La cepa Ta. 13 de la especie Trichoderma asperellum tiene potencial de biocontrol por la inhibición y antagonismo sobre Fusarium sp. in vitro y sobre Fusarium sp., C. kikuchii y P. pachyrhizi en condiciones de campo. Además estimula el crecimiento vegetal de la soya al incrementar el número de vainas por planta.
BIBLIOGRAFÍA
1. Barrios MB, Buján A, Debelis SP, Sokolowski AC, Blasón ÁD, Rodríguez HA, et al. Relación de raíz/biomasa total de Soja (Glycine max) en dos sistemas de labranza. Terra Latinoamericana. 2014;32(3):221–30.
2. dos Passos AMA, de Rezende PM, Carvalho ER, Aker AM. Residual Effects of the Organic Amendments Poultry Litter, Farmyard Manure and Biochar on Soybean Crop. Agricultural Sciences. 2014;05(14):1376–83. doi:10.4236/as.2014.514148
3. Menéndez C, Trujillo LE, Ramírez R, González-Peña D, Espinosa D, Enriquez GA, et al. Producción de un inoculante líquido de Bradyrhizobium japonicum con alto impacto en la siembra mecanizada de la soya en Cuba. Biotecnología Aplicada. 2014;31(2):116–20.
4. Romero A, Ruz R, González M. Evaluación de siete cultivares de soya (Glycine max) en las condiciones edafoclimáticas del municipio Majibacoa, Las Tunas. Pastos y Forrajes. 2013;36(4):459–63.
5. Narsimha RB, Venkata SK, Hindumathi A. In vitro screening for antagonistic potential of seven species of Trichoderma againts different plant pathogenic fungi. Research & Reviews: Research Journal of Biology. 2014;29–36.
6. Martínez B, Infante D, Reyes Y. Trichoderma spp. y su función en el control de plagas en los cultivos. Revista de Protección Vegetal. 2013;28(1):1–11.
7. Hernández JA, Pérez JJM, Bosch ID, Castro SN. Clasificación de los suelos de Cuba 2015. Mayabeque, Cuba: Ediciones INCA; 2015. 93 p.
8. Pérez M. El cultivo y utilización de la soya en Cuba. La Habana, Cuba: Manual Técnico; 1997.
9. Ellis MB. More Dematiaceous Hyphomycetes [Internet]. Kew, Surrey, England: Commonwealth Mycological Institute; 1976 [cited 2017 Sep 16]. 507 p. doi:10.1007/BF01989814
10. Infante D, Martínez B, Peteira B, Reyes Y, Herrera A. Identificación molecular y evaluación patogénica de trece aislamientos de Trichoderma spp. frente a Rhizoctonia solani Kühn. Biotecnología Aplicada. 2013;30(1):23–8.
11. Bell DK, Wells HD, Markham CR. In vitro antagonism of Trichoderma species against six fungal plant pathogens. Phytopathology. 1982;72(4):379–82.
12. Miranda I. Estadística Aplicada a la Sanidad Vegetal. Mayabeque, Cuba: Centro Nacional de Sanidad Agropecuaria (CENSA); 2011. 25 p.
13. Townsend GR, Heuberger JW. Methods for estimating losses caused by diseases in fungicide experiments. Plant Disease Report. 1943;27(17):340–343.
14. Navarrete-Maya R, Trejo-Albarrán E, Navarrete-Maya J, Prudencio-Sains JM, Acosta-Gallegos JA. Reacción de genotipos de frijol a Fusarium spp. y Rhizoctonia solani bajo condiciones de campo e invernadero. Agricultura Técnica en México. 2009;35(4):459–470.
15. Statistical Graphics Crop. STATGRAPHICS® Plus [Internet]. Version 5.1. 2000. (Profesional). Available from: http://www.statgraphics.com/statgraphics/statgraphics.nsf/pd/pdpricing
16. Duncan DB. Multiple Range and Multiple F Tests. Biometrics. 1955;11(1):1–42. doi:10.2307/3001478
17. CABI. Crop protection compendium [Internet]. Wallingford: CAB International; 2014 [cited 2017 Sep 16]. Available from: http://www.cabi.org/publishing-products/compendia/crop-protection-compendium/
18. Calvo-Araya JA, Rivera-Coto G, Orozco-Cayasso S, Orozco-Rodríguez R. Aislamiento y evaluación in vitro de la antagonistas de Botrytis cinerea en mora. Agronomía Mesoamericana. 2012;23(2):225–231.
19. Lorito M. La biología molecular de las interacciones entre Trichoderma, hongos fitopatógenos y plantas: oportunidades para desarrollar nuevos métodos de control de enfermedades. Fitosanidad. 2006;10(2):139–40.
20. Vargas-Hoyos HA, Rueda-Lorza EA, Gilchrist-Ramelli E. Actividad antagónica de Trichoderma asperellum (Fungi: Ascomycota) a diferentes temperaturas. Actualidades Biológicas. 2012;34(96):103–12.
21. Reis EM, Deuner E, Zanatta M. In vivo sensitivity of Phakopsora pachyrhizi to DMI and QoI fungicides. Summa Phytopathologica. 2015;41(1):21–4. doi:10.1590/0100-5405/1975
22. Viterbo A, Harman GE, Howell CR, Chet I, Lorito M. Trichoderma species–opportunistic, avirulent plant symbionts. Nature Reviews Microbiology. 2004;2(1):43–56.
23. González RM, Castellanos GL, Ramos FM, González GP. Efectividad de Trichoderma spp. para el control de hongos patógenos de la semilla y el suelo en el cultivo del frijol. Fitosanidad. 2005;9(1):37–41.
Recibido: 26/12/2016
Aceptado: 1/06/2017
M.Cs. Ariel Cruz-Triana, Unidad Científico Tecnológica de Base “Los Palacios”, Km 1 ½ carretera La Francia, Los Palacios, Pinar del Río, Cuba. Email: actriana@inca.edu.cu