ARTÍCULO ORIGINAL
Morfología y viabilidad de semillas de Bombacopsis quinata y Anacardium excelsum
Morphology and viability of seeds of Bombacopsis quinata y Anacardium excelsum
Dr.C. Miguel Espitia-Camacho, Dr.C. Carlos Cardona-Ayala, Dr.C. Hermes Araméndiz-Tatis
Facultad de Ciencias Agrícolas, Universidad de Córdoba, Montería–Colombia, carrera 6N°76-103, CP: 230002
RESUMEN
Gran parte de las especies forestales del trópico se propagan por semilla sexual, pero, en muchos casos, se desconoce su morfología y no se tiene estandarizada la medición rápida de su viabilidad con pruebas bioquímicas. El objetivo del estudio fue describir las características morfológicas y la viabilidad de las semillas de las especies Bombacopsis quinata y Anacardium excelsum. El estudio se realizó en la Universidad de Córdoba de Montería – Colombia, entre abril de 2012 y julio de 2014. En plantaciones comerciales de cinco localidades del Departamento de Córdoba, se seleccionaron al azar cinco árboles/especie y, de cada árbol, se tomaron al azar cinco muestras de 100 semillas. Para la descripción morfométrica de las partes de las semillas, se utilizaron 10 semillas/especie. La prueba bioquímica de tetrazolio se hizo bajo un diseño completamente al azar, con seis tratamientos: tres concentraciones de tetrazolio, 0,5; 1,0 y 1,5 % con dos tiempos de inmersión en la solución: dos y tres horas, y cuatro repeticiones de 25 semillas cada una. La viabilidad obtenida con la prueba de tetrazolio se comparó con la de una prueba de germinación convencional, en laboratorio. Las características externas de las semillas de especie B. quinata, presentaron menor variación que las de A. excelsum, especialmente aquellas relacionadas con el peso. Tres patrones topológicos fueron identificados en las semillas de cada especie. La concentración de 1,0 % de tetrazolio durante tres horas, resultó ser efectiva para determinar la viabilidad de las semillas de estas dos especies.
Palabras clave: árboles forestales, germinación de las semillas, prueba de tetrazolio, reproducción sexual.
ABSTRACT
Most of tropical forest species are propagated by sexual seed, but in many cases, their morphology is unknown and there is no standardized rapid measurement of viability with biochemical tests. The aim of the study was to describe the morphological characteristics and viability of the species seed Bombacopsis quinata and Anacardium excelsum. The study was conducted at the Córdoba University, Montería - Colombia, between April 2012 and July 2014. In forest plantations in five locations in Córdoba department, five trees by species were randomly selected, and each tree, five samples of 100 seeds were taken randomly. For morphometric description of the parts of seeds, 10 seeds by species were used. Biochemistry tetrazolium test was done under a completely randomized design, with six treatments: three tetrazolium concentration, 0,5; 1,0 and 1,5 % with two times of immersion in the solution: two and three hours, and four replications of 25 seeds each. The viability obtained with tetrazolium test was compared with a conventional test of germination in laboratory. External characteristics of the seeds of the species B. quinata, showed less variation than A. excelsum, especially those related with the weight of them. Three topological patterns were identified in the seeds of each species. The concentration of 1,0 % tetrazolium for three hours, proved to be effective to determine the seed viability of these two species.
Key words: forest trees, seed germination, tetrazolium test, sexual reproduction.
INTRODUCCIÓN
Estudios sobre características morfológicas, dimensiones, peso, determinación de viabilidad y conservación de las semillas de especies forestales nativas y exóticas, de varios autores, muestran la importancia de usar ese conocimiento en viverismo y silvicultura. Son relevantes los estudios, en semillas de Pinus brutia (1); Pinus tropicalis (2); Anadenanthera Colubrina (3); Tabebuia rosea (4); Stizolobium aterrimum (5), Bumelia obtusifolia (6); Plinia trunciflora (7); Gliricidia sepium (8); Jatropha curcas (9); Piptadenia moniliformis (10); Ceiba speciosa (11), Coffea arabica (12) y Alibertia patinoi (13).
En Colombia, son importantes los trabajos en semillas de las especies Alnus jorullensis, Cariniana piryformis, Cedrela odorata, Cordia alliodora, Tabebuia rosea, Anacardium excelsum, Cedrela montana, Enterolobium cyclocarpum, Erythrina edulis, Erythrina fusca, Jacaranda copaia, Juglans neotropica, Lafoensia speciosa, Samanea saman, Tabebuia chrysantha., Cariniana micrantha, Manilkara bidentata y Peltogyne paniculata, (14–16). Esto demuestra que el número de especies forestales nativas en estudio sigue en aumento a nivel nacional, a medida que en las diferentes zonas con bosques naturales se van investigando y conociendo sus características, bondades y potencial silvícola e industrial.
Las especies forestales Bombacopsis quinata (Jacq.) Dugand y Anacardium excelsum (Bertero & Balb. ex Kunth) Skeels) están priorizadas en el Caribe colombiano por todos los actores de la Cadena Forestal de Córdoba, por su adaptación y dispersión en el trópico, aportes a la conservación y regeneración de los bosques naturales, bondades en los procesos de producción de maderas, reforestación, servicios ecosistémicos, silvicultura, viveros, excelente calidad y nobleza de la madera, e importante demanda de este tipo de maderas en los mercados locales, nacionales e internacionales(14–16). A pesar de las utilidades anteriores, las características de las semillas de estas especies forestales en el Departamento de Córdoba son poco conocidas y estudiadas, en comparación las de las especies forestales exóticas comerciales y con la de cultivos agrícolas.
El conocimiento e interpretación de la calidad integral de la semilla y su manejo óptimo en vivero, es importante en la producción agrícola y forestal, dado que es el primer paso para lograr el éxito en el manejo silvicultural, crecimiento, rendimiento, calidad, productividad, competitividad y sostenibilidad de las plantaciones y producción de madera (17,18).
El objetivo de este trabajo fue describir las características morfológicas y la viabilidad de las semillas de Bombacopsis quinata (Jacq.) Dugand y Anacardium excelsum (Bertero & Balb. ex Kunth) Skeels), mediante caracterización biométrica y prueba de viabilidad con tetrazolio.
MATERIALES Y MÉTODOS
Localización y época de evaluación
La investigación se llevó en la Universidad de Córdoba, de Montería - Colombia, ubicada en la zona media del valle del Sinú, entre abril de 2012 y julio de 2014.
Material genético
Se utilizó semilla sexual de libre polinización de cinco árboles muestreados al azar en plantaciones de B. quinata en Planeta Rica (a.s.n.m.: 87 m; LN: 08º24’47,6’’ y LO: 075º36’16,9’’) y San Antero (a.s.n.m.: 48 m; LN: 09º19’39,95” y LO: 075º49’54,06”), y de A. excelsum en Montería (a.s.n.m.: 13 m; LN: 08º42’27,73” y LO: 075º40’06,47”), Ciénaga de Oro (a.s.n.m.: 13 m; LN: 08º51’16,75” y LO: 075º35’21,06”) y San Carlos (a.s.n.m.: 50 m; LN: 08º42’23,67” y LO: 075º40’13,19”), municipios ubicados en la zona ecológica bosque seco tropical con temperatura promedio de 27– 28 ºC, humedad relativa de 84– 86 % y precipitación anual de 1200-1400 mm, en el Departamento de Córdoba-Colombia (19). Por tanto, la semilla de cada árbol constituyó una familia de medios hermanos (20). Al momento de la colecta de la semilla, los árboles presentaron edades de 10 - 22 años, altura de planta de 8-18 m y diámetro a 1,3 m de altura, de 20 a 53 cm.
Procedimiento
El proceso de muestreo de árboles y colecta de semillas en cada una de las especies se realizó atendiendo los protocolos específicos propuestos (21), ajustados y validados (18).Para la caracterización morfométrica de las semillas de las dos especies, se tomaron al azar cinco árboles/especie y, de cada árbol, cinco muestras de 100 semillas, para un total de 500 semillas/especie. A continuación, se identificaron las partes esenciales de las semillas como embrión, endospermo y radícula, sobre diez semillas/especie, con base en la metodología propuesta para semillas de árboles y arbustos (22,23).
Las características biométricas ancho máximo (AS), largo máximo (LS), relación ancho/largo (RALA), se midieron en centímetros (cm); mientras que las asociadas con el peso de semilla (PES) y peso de 100 semillas (P100S) se midieron en gramos (g). El número de semillas/kg (NSKG), se estimó por conteo del número de semillas en cinco muestras de 100 semillas/especie, luego el promedio se llevó a kilogramo (kg), por proporcionalidad.
Para la identificación y descripción de los tejidos seminales, y la determinación de patrones topológicos en laboratorio se utilizaron diez semillas completas y sanas, tomadas al azar, por cada especie. En la descripción de la estructura del embrión, se realizó un pre-acondicionamiento, mediante inmersión en agua destilada a temperatura entre 25 y 30 ºC. La separación de la cubierta seminal permitió total exposición del embrión y de las partes consideradas “esenciales” y de importancia para la prueba de tetrazolio (24). Las observaciones se hicieron con un estereoscopio (Vista Visión®).
Para el estudio de la viabilidad de las semillas, se realizó una tinción con 2, 3, 5 trifenil cloruro de tetrazolio (tetrazolio) mediante inmersión de las semillas en solución al 1 %, con tiempo de tinción de dos horas, en ausencia de luz y a una temperatura de 40 ºC (24). Luego se lavaron las semillas tres veces con agua destilada para remover el exceso del colorante y se evaluó la viabilidad con la ayuda de un estereoscopio (Vista Visión®) para mejorar la visualización de la estructura del embrión.
La viabilidad se evaluó mediante la identificación de tres categorías de semillas, según las recomendaciones para la interpretación de patrones topológicos de tinción (25):
Categoría 1. Semillas viables: a) aquellas con el embrión y endospermo completamente teñidos; b) aquellas que presentan necrosis superficial en la mitad del endospermo, principalmente en las partes alejadas del embrión; c) aquellas con áreas no teñidas (muertas) en el endospermo, en zonas opuestas a la radícula.
Categoría 2. Semillas no viables. a) aquellas con el embrión y el endospermo sin teñir (muertas); b) aquellas que presenten el embrión sin teñir, aunque el endospermo esté teñido; c) aquellas que presenten necrosis aguda en el embrión; d) aquellas que presenten el embrión teñido y endospermo sin teñir; e) aquellas que presenten necrosis en la punta de la radícula; f) aquellas con daños graves en más de la mitad de las partes esenciales de la semilla.
Categoría 3. Semillas dudosas: semillas parcialmente teñidas que producirán plántulas normales o anormales, dependiendo de la intensidad y patrón de la tinción. En esta categoría están las semillas que presentan menos de la mitad teñida y con partes esenciales sanas.
Para la evaluación de la eficiencia de la tinción de los embriones, sobre la base de la intensidad y uniformidad del color (26), se estableció un experimento bajo un diseño completamente aleatorizado, con seis tratamientos y cuatro repeticiones de 25 semillas cada una. El pre-acondicionamiento, remoción de las cubiertas y exposición de los embriones, se realizó de igual forma como fue descrito en la determinación de los patrones topológicos. Los tratamientos se estructuraron sobre la base de la combinación de tres concentraciones de tetrazolio (0,5; 1,0 y 1,5 %) y dos tiempos de tinción (dos y tres horas) y se aleatorizaron como seis niveles de un factor. La viabilidad se evaluó mediante el uso de las categorías descritas para los patrones de tinción, definidos para cada especie (25).
Para medir la confiabilidad del test de tetrazolio, se realizó una prueba de germinación convencional en condiciones de laboratorio por cada especie. Se utilizó una cámara de germinación (Dies®) a una temperatura de 28 ºC, humedad relativa de 80 %, con período de luz de 10 horas por día. Se utilizaron cuatro repeticiones de 25 semillas cada una por especie, dispuestas sobre papel toalla en bandejas de aluminio, con suministro de riego uniforme durante 45 días. Se evaluó la viabilidad de las semillas con el registro del número de plántulas normales y sanas emergidas durante el ensayo. La comparación con la prueba de tetrazolio se hizo asumiendo como semillas viables las de la categoría ´Viables´, más la mitad de las semillas de la categoría ´Dudosas´, de acuerdo a lo utilizado por varios autores (11,12,14).
Análisis estadístico
Para las características morfológicas se realizaron estadísticas descriptivas y se estimaron intervalos de confianza de 95 % de probabilidad, y para la estimación de los efectos de los tratamientos y la confiabilidad del test de tetrazolio en estas dos especies, se realizó un análisis de varianza de un factor con seis niveles (tratamientos) y la prueba de rango múltiple de Duncan al 5 % de probabilidad (27). Se utilizó el programa computacional GENES versión Windows GENES V, 2013, 5.1 (28). La validación del test de tetrazolio, se hizo mediante la comparación múltiple de las medias de viabilidad de los seis tratamientos, más el promedio de viabilidad obtenido con la prueba convencional de germinación en cámara germinativa, como un tratamiento adicional.
RESULTADOS Y DISCUSIÓN
Caracterización biométrica de las semillas
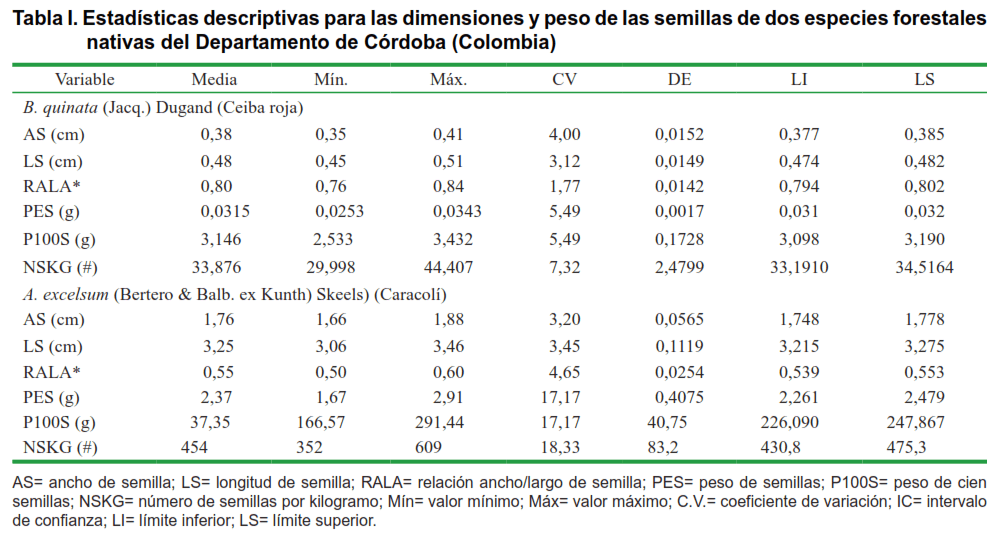
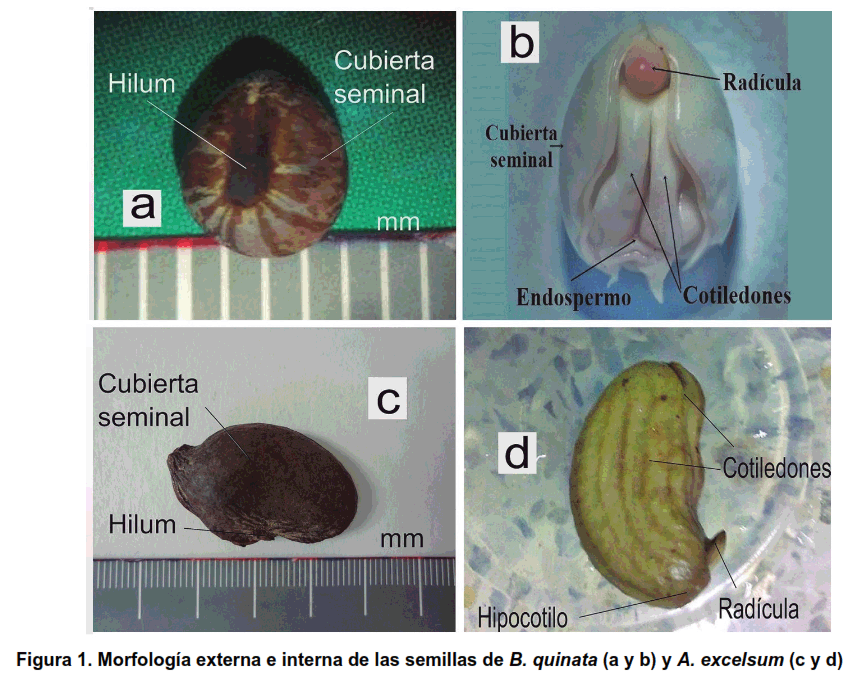
Las semillas de B. quinata, especie conocida en el Caribe colombiano como ceiba roja, presentaron promedios de 0,38 ± 0,015 cm de ancho (AS), 0,48 ± 0,015 cm de largo (LS), 0,80 ± 0,014 de relación AS/LS (RALA), 0,0315 ± 0,0017 g de peso de semilla (PES) y 3,15 ± 0,173 g peso de 100 semillas (P100S). De acuerdo con el peso de 100 semillas, el número de semillas/kg (NSKG), fue de 33,876 ± 2,480, aproximadamente (Tabla I). La semilla registró forma redondeada y lisa, con cubierta seminal de color marrón oscuro (Figura 1a y 1b). Según las observaciones, y teniendo en cuenta la clasificación realizada por Martín (22), el embrión se definió como axial, foliado, doblado, convoluto, encorvado y con cotiledones gruesos planoconvexos; de color blanco a crema, doblados sobre el hipocótilo (Figura 1b), concordando con las descripciones realizadas (29,30).
Las semillas de A. excelsum, conocida en Colombia como caracolí, presentaron promedios de 1,76 ± 0,057 cm de ancho (AS), 3,25 ± 0,112 cm largo (LS), 0,55 ± 0,025 relación AS/LS (RALA), 2,37 ± 0,408 g peso de semilla (PES) y, 237,35 ± 40,75 g para peso de 100 semillas (P100S). De acuerdo con el P100S, el número promedio de semillas/kg (NSKG) fue de 454 ± 83, aproximadamente (Tabla I). Estas características concuerdan con las encontradas en otras investigaciones (22,23). Según las observaciones y teniendo en cuenta la clasificación (22,23), el endospermo resultó muy delgado; el embrión masivo provisto de cotiledones gruesos de color crema y carnosos, ápice redondeado y unidos parcialmente en la base sobre la inserción de la radícula (acumbentes) (Figura 1c y 1d), similares a los reportados en otros estudios (28).
Patrones topológicos
Los patrones de tinción identificados en las semillas de B. quinata y A. excelsum, se muestran en las Figuras 2 y 3, con tres categorías definidas sobre la base del porcentaje de tejido teñido: viables, dudosas e inviables, de forma similar a lo reportado en otras especies arbóreas, como: T. roseoalba (4); Enterolobium contortisiliquum (31); Bumelia obtusifolia (6); Plinia trunciflora (7).
Las semillas acusaron variaciones en la intensidad de la tinción, debido a que la sal de tetrazolio permite determinar la presencia, localización y naturaleza de las alteraciones en los tejidos vivos de las semillas (24), al producirse en ellos trifenil formazán (rojo), que evidencia la actividad respiratoria de las mitocondrias, y con ello, la viabilidad celular. Por lo tanto, el color rojo en los embriones, es un indicador positivo de la viabilidad de las semillas (32), mientras que aquellas regiones débilmente coloreadas en algunas partes del embrión, indican que las células presentan una disminuida actividad respiratoria y, por consiguiente, menor actividad de enzimas deshidrogenasas (26,32).
Evaluación de la viabilidad de las semillas con la prueba del tetrazolio
Las comparaciones de medias de las categorías viables, dudosas e inviables, como respuestas a las concentraciones de tetrazolio y tiempo de tinción, están consignados en la Tabla II. Así mismo, la intensidad y uniformidad de la tinción se registra en las Figuras 4 y 5. En las dos especies, las medias de viabilidad en cada una de tres categorías difieren entre sí, lo que indica que los tejidos de las semillas son influenciados de forma diferencial por las concentraciones de tetrazolio junto con los tiempos de tinción. Estos resultados son similares a los obtenidos en Tabebuia roseoalba (4), Enterolobium contortisiliquum (29), Pinus tropicalis (2), Plinia trunciflora (7), Gliricidia sepium (8) y Piptadenia moniliformis (10).
En semillas de B. quinata, el mayor porcentaje de semillas de la categoría viables, se observó a la concentración de 0,5 % de tetrazolio y tiempo de tinción de tres horas, sin diferencias significativas con respecto a la concentración de 1,5 % e igual tiempo de tinción. Estos mismos tratamientos, resultaron estadísticamente similares a los porcentajes de las categorías dudosas e inviables. No obstante, en la categoría inviables, la concentración de 1 % de tetrazolio y tres horas de tinción, registró el valor más alto y diferente estadísticamente del resto de tratamientos, los cuales, a su vez, no presentaron diferencias entre sí. Por otro lado, el porcentaje de semillas de la categoría dudosas fue menor al 1 % de tetrazolio y tres horas, sin diferir de los tratamientos al 0,5 y 1,5 % de tetrazolio y tres horas de tinción. Por lo tanto para determinar la viabilidad de las semillas de B. quinata es necesario tres horas de contacto con la solución de tetrazolio a concentraciones entre 0,5 y 1,5 %.
En semillas de A. excelsum, el mayor porcentaje de semillas de la categoría viables, se observó en tres de los seis tratamientos: 0,5 % de tetrazolio y tres horas, 1 % de tetrazolio y dos horas, 1 % de tetrazolio y tres horas. Sin embargo, en la categoría inviables, estos mismos tratamientos registraron los valores más bajos y, en la categoría dudosas valores en el rango de 19 a 32 %. Por tanto, para A. excelsum, es necesario una inmersión en la solución de tetrazolio a concentración de 0,5 % por tres horas o 1,0 % de tetrazolio por dos horas, para determinar la viabilidad de sus semillas.
En general, las tinciones correspondientes a los tratamientos mencionados para cada especie, presentan una coloración óptima, cuya uniformidad e intensidad, están de acuerdo a las recomendaciones realizadas en otras investigaciones (11,12,14). Además, permiten valorar eficientemente la viabilidad de las semillas a través de esta prueba; lo cual es coherente con lo encontrado en semillas de mortiño (Acca sellowiana), en las que, con la concentración de tetrazolio al 1 %, se logró una tinción adecuada del embrión (33). Así mismo, otros autores afirman que esta concentración es la más recomendada para realizar la prueba de tetrazolio (12,14, 25).
De acuerdo con lo anterior, se puede notar que, en la medida que aumenta la concentración del tetrazolio, los embriones muestran mayor intensidad de color, desde una baja tonalidad en los tratamientos con 0,5 % de tetrazolio hasta una coloración muy intensa en los tratamientos con concentración de 1,5 %, debido a una mayor actividad del tetrazolio en los tejidos vivos. Así mismo, en la medida en que aumenta el tiempo de tinción, bajo una misma concentración, los colores se tornan más oscuros, lo que indica que el tiempo de exposición de los tejidos a la sal de tetrazolio influye en la imbibición y en las reacciones de óxido-reducción. Tendencias similares fueron reportados en las especies: Pinus tropicalis (2), Enterolobium contortisiliquum (32), Plinia trunciflora (7)y Piptadenia moniliformis (10),entre otras.
Al comparar las medias de los tratamientos con tetrazolio, entre sí y con la prueba de germinación convencional, se observó que el uso de una concentración de tetrazolio al 1 % durante tres horas, para las semillas de B. quinata, es lo indicado, toda vez que los porcentajes promedios, no difieren significativamente entre sí (Tabla III).
Para A. excelsum, el porcentaje de germinación obtenido con la prueba convencional no difiere estadísticamente, del porcentaje de semillas viables estimado con 0,5 y 1 % de tetrazolio con tiempos de tinción entre dos y tres horas, respectivamente. Por lo tanto, cualquiera de las dos concentraciones tiene validez en su aplicación y obtener resultados confiables en verificar la viabilidad de dichas semillas, en un análisis de su calidad.
Investigaciones con semillas de Ricinus comunis, Poincianella pyramidalis y Crambe abyssinica (34–36), indican que con concentraciones más bajas de la sal de tetrazolio, los resultados de la evaluación de la viabilidad parecen tener mayores correlaciones con la prueba de germinación convencional.
La coherencia en los resultados de la prueba de viabilidad con tetrazolio y la de germinación convencional en este estudio, en las dos especies estudiadas, indica que la primera estima la viabilidad de las semillas de forma segura, rápida y económica, ya que las diferencias en los resultados de ambas pruebas, estadísticamente se deben al azar y están dentro del rango admitido y reportado para otras especies forestales, arbóreas y agrícolas (2,4–12,31,35,37–39). A pesar de lo anterior, en las especies con problemas de dormancia en sus semillas, la prueba de tetrazolio y la de germinación pueden originar resultados muy diferentes, cuando no se aplican los tratamientos pre-germinativos adecuados (4,5,31,35).
Estos resultados constituyen un aporte importante al proceso de certificación y control de calidad fisiológica de las semillas de las dos especies estudiadas. Igualmente, su uso contribuye a agilizar decisiones de compra, venta, beneficio, conservación, almacenamiento o descarte de semillas en tales especies. Adicionalmente, es de resaltar, como lo han propuesto (2,5,35,37–39), que esta prueba puede utilizarse también para estimar el vigor de las semillas, dada la relación directa entre el vigor y la intensidad y distribución de la tinción en estructuras vitales de las mismas. No obstante, la selección de la concentración de tetrazolio y el tiempo de tinción de las semillas en esta prueba, debe realizarse siempre en concordancia con la facilidad y seguridad para diferenciar las semillas viables de las inviables.
CONCLUSIONES
Las características externas de las semillas de Bombacopsis quinata, presentan menor variación que las de Anacardium excelsum, especialmente aquellas relacionadas con el peso.
Los patrones de tinción identificados con la prueba de tetrazolio permiten evaluar eficientemente la viabilidad de las semillas en las dos especies forestales nativas estudiadas.
La viabilidad de las semillas para B. quinata y A. excelsum puede ser determinada a una concentración de 1,0 % de tetrazolio y un tiempo de tres horas.
Las pruebas de tetrazolio y de germinación convencional no presentaron diferencias significativas en las dos especies y garantiza la confiabilidad de la prueba bioquímica para medir la calidad fisiológica de las especies estudiadas.
BIBLIOGRAFÍA
1. Dilaver M, Seyedi N, Bilir N. Seedling Quality and Morphology in Seed Sources and Seedling Type of Brutian Pine (Pinus brutia Ten.). World Journal of Agricultural Research, World Journal of Agricultural Research. 2015;3(2):83–5. doi:10.12691/wjar-3-2-9
2. Bonilla VM. Variación del peso y viabilidad de las semillas de Pinus tropicalis para diferentes procedencias. Revista Cubana de Ciencias Forestales. 2014;2(1):89–96.
3. Barboza-Nogueira FC, Lobo-Pinheiro C, Medeiros-Filho S, da Silva-Matos DM. Seed Germination and Seedling Development of Anadenanthera Colubrina in Response to Weight and Temperature Conditions. Journal of Plant Sciences. 2014;2(1):37. doi:10.11648/j.jps.20140201.17
4. Caravita AL, Massanori T. Teste de tetrazólio para avaliação da qualidade de sementes de Tabebuia roseoalba (Ridl.) Sandwith-Bignoniaceae, submetidas ao armazenamento. Revista Árvore. 2014;38(2):233–40. doi:10.1590/S0100-67622014000200003
5. Deminicis BB, Rodrigues PDR, Faria BP, Vieira HD, Filho ADP, Freitas GS. Tetrazolium Test to Evaluate Stizolobium aterrimum Seeds Quality. American Journal of Plant Sciences. 2014;5(1):148–52. doi:10.4236/ajps.2014.51019
6. Nascimento IL. Determination of methodologies for seed germination and vigor of quixabeira (Bumel obtusifolia Roem et Schult. Var. excels (DC) Mig.). Revista Árvore. 2013;37(4):701–6. doi:10.1590/S0100-67622013000400013
7. Hössel C, de Oliveira JSMA, Fabiane KC, Wagner-Júnior A, Citadin I. Conservação e teste de tetrazólio em sementes de jabuticabeira. Revista Brasileira de Fruticultura. 2013;35(1):255–61. doi:10.1590/S0100-29452013000100029
8. Reis RCR, Pelacani CR, Antunes CGC, Dantas BF, de Castro RD. Physiological quality of Gliricidia sepium (Jacq.) Steud. (Leguminosae - Papilionoideae) seeds subjected to different storage conditions. Revista Árvore. 2012;36(2):229–35. doi:10.1590/S0100-67622012000200004
9. Brenha JAM, de Oliveira NC, Cándido ACS, Godoy AR, Alves CZ. Teste de tetrazólio em sementes de pinhão manso. Visão Acadêmica. 2012;13(4):63–79. doi:10.5380/acd.v13i4.30342
10. de Azerêdo GA, de Paula RC, Valeri SV. Viabilidade de sementes de Piptadenia moniliformis Benth. pelo teste de tetrazólio. Revista Brasileira de Sementes. 2011;33(1):61–8. doi:10.1590/S0101-31222011000100007
11. Lazarotto M, Piveta G, Muniz MFB, Reiniger LRS. Adequação do teste de tetrazólio para avaliação da qualidade de sementes de Ceiba speciosa. Semina: Ciências Agrárias. 2011;32(4):1243–50. doi:10.5433/1679-0359.2011v32n4p1243
12. Clemente AS, de Carvalho M, Guimarães R, Zeviani W. Preparo das sementes de Café para avaliação da viabilidade pelo teste de tetrazólio. Revista Brasileira de Sementes. 2011;33(1):38–44.
13. Escobar EDF, Torres GAM. Morphology, ecophysiology and germination of seeds of the Neotropical tree Alibertia patinoi (Rubiaceae). Revista de Biología Tropical. 2013;61(2):547–56.
14. Rodríguez RJ, Nieto RVM. Investigación en semillas forestales nativas. In Santafé de Bogotá, Colombia: Programa de Investigación en Semillas Forestales Nativas - Ministerio de Agricultura y Desarrollo Rural - Corporación Nacional de Investigación y Fomento Forestal; 1999 [cited 2017 Jul 7]. p. 89. (Serie técnica). Available from: http://www.sidalc.net/cgi-bin/wxis.exe/?IsisScript=UNC.xis&method=post&formato=2&cantidad=1&expresion=mfn=007013
15. Gómez M, Toro J. Manejo de las semillas y la propagación de diez especies forestales del bosque húmedo tropical. Boletín Técnico Biodiversidad. 2011;(6):57–74.
16. Rivera-Martin LE, Peñuela-Mora MC, Jiménez-Rojas EM, Vargas-Jaramillo M del P. Ecología y silvicultura de especies útiles amazónicas: Abarco (Cariniana micrantha Ducke), Quinilla (Manilkara bidentata (A. DC.) A. Chev.) y violeta (Peltogyne paniculata Benth) [Internet]. Bogotá, Colombia: Universidad Nacional de Colombia; 2013 [cited 2017 Jul 7]. 180 p. Available from: http://www.bdigital.unal.edu.co/36632/
17. Poorter L, Rose SA. Light-dependent changes in the relationship between seed mass and seedling traits: a meta-analysis for rain forest tree species. Oecologia. 2005;142(3):378–87. doi:10.1007/s00442-004-1732-y
18. Murillo O, Espitia M, Castillo C. Fuentes semilleras para la producción forestal. Bogotá, Colombia: Damar S.A.S; 2012. 176 p.
19. Palencia G, Mercado T, Combatt E. Estudio agroclimático del Departamento de Córdoba. Montería: Universidad de Córdoba; 2006. 126 p.
20. Trujillo E. Guía de reforestación. 3rd ed. Bogotá, Colombia: El Semillero S.A.S.; 2015. 76 p.
21. Gold K, León-Lobos P, Way YM. Manual de recolección de semillas de plantas silvestres para conservación a largo plazo y restauración ecológica [Internet]. La Serena, Chile: INIA - Centro Regional de Investigación Intihuasi; 2004 [cited 2017 Jul 7]. 62 p. (Boletín INIA). Available from: https://books.google.com.cu/books?id=Z1j2ZwEACAAJ
22. Martin AC. The Comparative Internal Morphology of Seeds. The American Midland Naturalist. 1946;36(3):513–660. doi:10.2307/2421457
23. Niembro A. Semillas de árboles y arbustos: ontogenia y estructura. México: Limusa; 1988. 285 p.
24. ISTA (International Seed Testing Association). International Rules for Seed Testing 2014. Bassersdorf, Suiza: ISTA; 2014. 272 p.
25. Rao NK, Hanson J, Dulloo ME, Ghosh K, Novell D, Larinde M. Manual para el manejo de semillas en bancos de germoplasma [Internet]. Roma, Italia: Biodiversity International; 2007 [cited 2017 Jul 7]. 182 p. (Manuales para bancos de germoplasma). Available from: http://www.fao.org/sustainable-forest-management/toolbox/tools/tools-details/es/c/233964/
26. Pinto TLF, Filho JM, Forti VA, de Carvalho C, Gomes-Junior FG. Avaliação da viabilidade de sementes de pinhão manso pelos testes de tetrazólio e de raios X. Revista Brasileira de Sementes. 2009;31(2):195–201. doi:10.1590/S0101-31222009000200023
27. Duncan DB. Multiple Range and Multiple F Tests. Biometrics. 1955;11(1):1–42. doi:10.2307/3001478
28. Cruz CD. Programa Genes - Aplicativo computacional em Genética e Estatística Experimental [Internet]. Version 5.1. Viçosa, MG. Brasil: Universidade Federal de Viçosa; 2013. Available from: http://www.ufv.br/dbg/genes/genes.htm
29. Salazar R. Manejo de semillas de 100 especies forestales de América Latina [Internet]. Turrialba, Costa Rica: CATIE; 2000 [cited 2017 Jul 7]. 218 p. (Técnica; vol. 1). Available from: https://books.google.com.cu/books?id=wS_3vuPi4ZgC
30. Flores E. Biología de las semillas. In: Vozzo JA, editor. Manual de Semillas de Árboles Tropicales [Internet]. Missouri: USDA Forest Service; 2010 [cited 2017 Jul 7]. p. 75. Available from: https://www.rngr.net/publications/manual-de-semillas-de-arboles-tropicales
31. Nogueira NW, Torres SB, de Freitas RMO. Tetrazolium test in timbaúba seeds. Semina: Ciências Agrárias. 2014;35(6):2967–76. doi:10.5433/1679-0359.2014v35n6p2967
32. Craviotto M, Arango M, Gallo C. Topographic tetrazolium test for soybean [Internet]. Argentina: Ediciones INTA; 2008 [cited 2017 Jul 7]. 100 p. Available from: http://www.cosechaypostcosecha.org/data/articulos/calidad/TopographicTetrazoliumTestForSoybean.asp
33. Sarmento MB, da Silva ACS, Villela FA, Santos KL dos, de Mattos LCP. Teste de tetrazólio para avaliação da qualidade fisiológica em sementes de Goiabeira-serrana (Acca sellowiana O. Berg Burret). Revista Brasileira de Fruticultura. 2013;35(1):270–6. doi:10.1590/S0100-29452013000100031
34. de Oliveira LM, Caldeira CM, de Souza ALA, Moreira de CML, da Silva CD. An alternative procedure for evaluating the quality of castor seeds by the tetrazolium test. African Journal of Agricultural Research. 2014;9(35):2664–8. doi:10.5897/AJAR2014.8962
35.Sousa DMM, Bruno R de LA, Silva K da RG, Torres SB, Andrade AP. Viability and vigour in seeds of Poincianella pyramidalis (Tul.) L. P. Queiroz by tetrazolium test. Revista Ciência Agronômica. 2017;48(2):381–8. doi:10.5935/1806-6690.20170044
36. Rezende RG, de Jesus LL, Nery MC, Rocha ADS, Cruz SM, Andrade PCDR. Teste de tetrazólio em sementes de crambe. Semina: Ciências Agrárias. 2015;36(4):2539. doi:10.5433/1679-0359.2015v36n4p2539
37. Gimenez JI, Ferreira G, Cavariani C. Teste de tetrazólio para a avaliação da viabilidade de sementes de atemoia (Annona cherimola Mill. x A. squamosa L.). Journal of Seed Science. 2014;36(3):357–61.
38. Paiva EP de, Torres SB, de Almeida JPN, Sá FV da S, Oliveira RRT. Tetrazolium test for the viability of gherkin seeds. Revista Ciência Agronômica. 2017;48(1):118–24. doi:10.5935/1806-6690.20170013
39. Vicente D, Oliveira LM de, Tonetti OAO, Silva AA, Liesch PP, Engel ML. Viabilidade de Sementes de Ocotea puberula (Rich.) Ness ao Longo do Armazenamento. Floresta e Ambiente. 2016;23(3):418–26. doi:10.1590/2179-8087.107414
40. Tukey JW. Bias and confidence in not quite large samples. The Annals of Mathematical Statistics. 1958;29(2):614–23. doi:10.1214/aoms/1177706647
Recibido: 20/10/2016
Aceptado: 20/03/2017
Dr.C. Miguel Espitia-Camacho, Facultad de Ciencias Agrícolas, Universidad de Córdoba, Montería – Colombia, carrera 6N°76-103, Código postal: 230002. Email: mmespitia@correo.unicorddoba.edu.co