ARTÍCULO ORIGINAL
Evaluación de películas biodegradables en el control de hongos postcosecha de la papaya
Evaluation of biodegradable films for postharvest control of fungi in papaya
Mónica Hernández-López,I Jessica Guillén-Sánchez,II Silvia Bautista-Baños,I Dagoberto Guillén-SánchezII
IDepartamento de Interacciones Planta-Insecto. Instituto Politécnico Nacional, Centro de Desarrollo de Productos Bióticos, Carr. Yautepec-Jojutla Km. 6, Col. San Isidro, CEPROBI 8, Morelos 62731, México.
IIEscuela de Estudios Superiores de Xalostoc, Universidad Autónoma del Estado de Morelos, Nicolas Bravo s/n, Parque Industrial Cuautla, Ayala, Morelos, México.
Resumen
Existen varios hongos postcosecha que causan enfermedades y que reducen en gran medida la vida de almacenamiento del fruto de papaya. El estudio tuvo como objetivo evaluar el efecto antimicótico de películas formuladas con quitosano y otros productos naturales. Las películas de quitosano combinadas con cera de abeja, ácido oleico y aceites esenciales de tomillo, canela y clavo, fueron evaluadas primeramente como inhibidores del crecimiento micelial in vitro de Rhizopus stolonifer, Colletotrichum gloeosporioides, Alternaria alternata, Fusarium oxysporum y Penicillium digitatum. Los formulados que mejor respondieron in vitro fueron evaluados por inmersión de los frutos de papaya, determinado su efecto en el control de antracnosis (C. gloeosporioides), comparado con Sportak (procloraz) a 3 mL L-1 como control comercial. Las películas a base de quitosano, cera de abeja/ácido oleico y aceites esenciales de canela y clavo al 1 % (Tratamientos 9, 3, 21 y 25), inhibieron completamente el crecimiento micelial de los cinco hongos. Los tratamientos aplicados por inmersión de frutos de papaya, no presentaron un efecto significativo sobre la incidencia y severidad de la antracnosis, solo el tratamiento con Sportak y Quitosano tuvieron efecto a los 17 días de almacenamiento a 14±2 ºC. En cuanto a calidad, las películas biodegradables no afectaron el contenido de sólidos solubles totales en los frutos y pérdida de peso.
Palabras clave: Antracnosis, Carica papaya, cera de abeja, quitosano.
ABSTRACT
There are several postharvest fungi that cause diseases and that greatly reduce the storage life of the papaya fruit. The objective of the study was to evaluate the antifungal effect of films formulated with chitosan, and other natural products. Chitosan films combined with beeswax, oleic acid and essential oils of thyme, cinnamon and clove were first evaluated as inhibitors of the in vitro mycelial growth of Rhizopus stolonifer, Colletotrichum gloeosporioides, Alternaria alternata, Fusarium oxysporum and Penicillium digitatum. The formulations that responded best in vitro were evaluated by immersion of the papaya fruits, determined their effect on the control of anthracnose (C. gloeosporioides) compared with Sportak (prochloraz) at 3 mL L-1 as commercial control. Films based on chitosan, beeswax/oleic acid and essential oils of cinnamon and clove 1 % (Treatments 9, 3, 21 and 25), completely inhibited the mycelial growth of the five fungi. The treatments applied by immersion of papaya fruits did not present a significant effect on the incidence and severity of the anthracnose, only the treatment with Sportak and Chitosan had effect after 17 days of storage at 14 ± 2 ºC. Regarding quality, the biodegradable films did not affect the content of total soluble solids in the fruits and weight loss.
Key words: antracnosis, Carica papaya, beeswax, chitosan.
INTRODUCCIÓN
Los frutos de papaya (Carica papaya L.) se caracterizan por su gran demanda en los diferentes mercados internacionales (1). México se ubicó como el primer exportador mundial de papaya en el 2014 con 131,391 toneladas. En Estados Unidos de dies papayas compradas, aproximadamente ocho provienen de México; sin embargo, como producto tropical tiene serias limitaciones en el almacenamiento por ser un fruto altamente climatérico, susceptible a daños mecánicos y ser hospedero de varios microorganismos durante su almacenamiento entre los que se cuentan hongos del género Rhizopus, Fusarium, Penicillium y otros (2). La enfermedad más común de la papaya es la antracnosis causada por el hongo Colletotrichum gloeosporioides, el cuál causa pérdidas que van de un 40 a un 100 %, dependiendo de la zona de producción (3). La fruta se infecta en la precosecha y luego se producen daños durante su almacenamiento (2,4,5)alternativas de control antifúngico, como el empleo del ozono (6), carragenano y glicerol (7) y películas de recubrimiento biodegradables (8) han tenido buenos resultados para proteger frutos y extender la vida de anaquel por la inhibición de los microorganismos (9). El quitosano, compuesto natural que se obtiene de la quitina que se encuentra en la capa exterior de crustáceos como cangrejos, camarones, se ha utilizado por sus efectos antifúngicos contra bacterias y hongos, y a su vez se ha demostrado también su eficacia para el control de hongos en el cultivo de la papaya tanto en ensayos in vitro e in situ (2). También este polímero, utilizado como recubrimiento adicionado con agentes antimicrobianos (aceites esenciales de clavo, canela, tomillo, limón, menta, romero, cedro, etc.), puede proporcionar al producto natural una mayor actividad antimicrobiana (10). En estudios previos, donde se usaron formulaciones a base de quitosano a 10 mg ml-1, mezclados con aceites esenciales de clavo, canela y tomillo a 300 µg ml-1, se redujo hasta un 50 % la pudrición causada por R. stolonifer en tomate (10). El objetivo del ensayo fue evaluar el efecto antimicrobiano de formulaciones a base de quitosano y otros productos combinados como cera de abeja, ácido oleico y aceites esenciales de tomillo (Thymus vulgaris L.), canela (Cinnamomum verum J.Presl) y clavo (Syzygium aromaticum (L.) Merr. & L.M.Perry), así como su efecto en la calidad postcosecha de la papaya.
MATERIALES Y MÉTODOS
Cultivo de hongos
Para los experimentos in vitro se utilizaron las cepas Rhizopus stolonifer, Colletotrichum gloeosporioides, Alternaria alternata, Fusarium oxysporum y Penicillium digitatum, lasque se obtuvieron del cepario del Laboratorio de Tecnología Postcosecha de Productos Agrícolas, del Centro de Desarrollo de Productos Bióticos-IPN. De las cepas de hongos se prepararon suspensiones de esporas a una concentración de 1x105 esporas mL-1. La inoculación se realizó en frutos de papaya a los cuales se le realizaron cuatro heridas de 0,5 mm con una aguja de disección esterilizada, en cada herida se colocaron 50 µL de la suspensión de esporas. Los frutos inoculados se colocaron en cámaras húmedas, que consistieron en platos de unicel sobre los cuales se colocó papel absorbente húmedo. posteriormente los frutos, se colocaron dentro de bolsas de polietileno transparente, selladas con una liga, para propiciar el desarrollo del micelio durante 48 horas a 28±2 °C. Luego de este tiempo se tomó una porción de micelio del hongo y se colocó en cajas de Petri con medio de cultivo Papa-Dextrosa-Agar (PDA, Bioxon®) que se incubaron durante cuatro días para R. stolonifer, 10 días para C. gloeosporioides y P. digitatum y 12 días para F. oxysporum y A. alternata, a una temperatura de 28±2 °C y fotoperíodo 12:12 h (luz: oscuridad). Estos aislados activados se conservaron resembrándolos en PDA. Para los estudios in situ, se seleccionó únicamente la cepa de C. gloeosporioides.
Preparación de la solución de quitosano
Se preparó una solución de quitosano (Sigma Aldrich®), de peso molecular medio al 1 % (p/v), con ácido acético al 1 % (v/v) y agua destilada. La solución se calentó a 70 °C y se agitó constantemente durante 24 h. El pH final se ajustó a 5,6 con NaOH 0,1N.
Formulaciones de las películas
Se utilizaron diferentes combinaciones de productos como películas en su efecto sobre el crecimiento de los cinco hongos. Se colocaron 12,5 mL de quitosano al 1 % (p/v), en un matraz erlenmeyer sobre una parrilla con agitación a una temperatura de 70 ºC durante 1 minuto. Una vez homogenizado la solución, se agregaron cera de abeja al 0,1 % y ácido oleico al 1 %, ambas en glicerol al 0,3 % v/v. Posteriormente se incorporó el aceite esencial de tomillo, canela o clavo (Aceites y Esencias Essencefleur de México®), a las concentraciones de 0,1 % (12,5 µl), 0,25 % (31,3 µl), 0,5 % (62,5 µl) y 1 % v/v (125 µl), para un total de 24 combinaciones.
Evaluaciones in vitro
Una porción de inóculo de cada cepa (5 mm de diámetro), se colocó en el centro de cajas de Petri con medio de cultivo PDA, se recubrieron entonces con 1,0 mL de cada formulación, según los diferentes tratamientos y se incubaron según se describió anteriormente. En el control no se aplicó ningún formulado.
El crecimiento radial de cada hongo se midió con una regla hasta que el hongo alcanzó su máximo crecimiento en la placa.
Evaluaciones in situ
Para el ensayo in situ, se utilizó la formulación que mejor inhibió el desarrollo de C. gloeosporioides in vitro. Los frutos de papaya cv. Maradol roja, se obtuvieron de la Central de Abasto de Cuautla Morelos, México, con un tamaño uniforme y un índice de madurez 2, correspondiente al cambio de color de la fruta (1/2 de madurez) a la aparición de tonos amarillos (3/4 de madurez), para todos los tratamientos. A cada fruto se le realizó una herida de 0,5 mm con una aguja de disección estéril y en ella se inoculó 50 µl de una suspensión de esporas de C. gloeosporioides a una concentración de 105 esporas mL-1. Después de 24 h los frutos se sumergieron en cada una de las dos formulaciones y se secaron a temperatura ambiente (28 ± 2 °C). Los tratamientos control consistieron en sumergir los frutos en agua corriente y otro en el fungicida sintético Sportak (procloraz) a concentración de 3 mL L-1. Unos frutos fueron almacenados en cámara de almacenamiento a 14 ± 2 °C y otros a temperatura ambiente (28 ± 2 °C). Para cada uno de los tratamientos se utilizaron tres repeticiones con 10 frutos. El por ciento de incidencia y severidad se evaluó a los 13 y 17 días, después en frutos almacenados a 14 ± 2 °C y a los 2 días en frutos almacenados a temperatura ambiente. El por ciento de incidencia se determinó dividiendo el número de frutos enfermos entre los frutos evaluados y multiplicandos por 100. La severidad se evaluó con una escala de 5 clases: 1:0 %, 2:1-25 %, 3:26-50 %, 4:51-75 %, y 5:76-100 % de la superficie del fruto con síntomas por C. gloeosporioides.
Al final del periodo de almacenamiento (17 días), se determinó la firmeza con un penetrómetro sobre ambas caras laterales de cada fruto y se expresó en Newtons; los sólidos solubles totales (SST %) se determinaron a partir de dos muestras de pulpa de los frutos (10 g), las cuales se colocaron en una gasa y se exprimieron, posteriormente se colocó una gota de cada muestra en un refractómetro y se tomó la lectura. La pérdida de peso (%) se calculó con la fórmula: Pérdida de peso = (peso inicial-peso final/ peso inicial) X 100; y el color se evaluó con un colorímetro Baking meter (Konica Minolta, modelo BC-10), las mediciones se hicieron en ambas caras de la fruta, considerando las coordenadas cromáticas L* (luminosidad), a* (tonalidades de verde a rojo) y b* (tonalidades de amarillo a azul).
Análisis estadístico
Para los estudios in vitro e in situ se utilizó un diseño completamente al azar. A los datos se les realizó un análisis de varianza y prueba de medias mediante Tukey (α=0,05), con el programa Sigma Stat 3.5. Previamente fue calculada la premisa de normalidad y homogeneidad de las muestras. Para el ensayo in vitro se utilizaron seis cajas de Petri para cada formulación. En el ensayo in situ los tratamientos tuvieron tres repeticiones con 15 frutos por repetición.
RESULTADOS
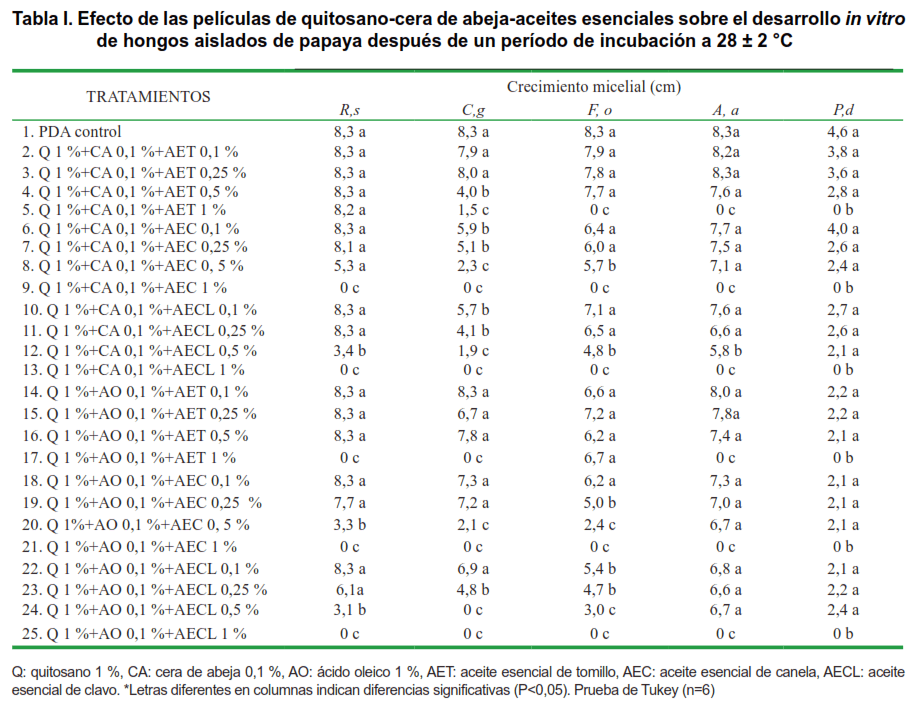
El efecto in vitro de las películas biodegradables sobre los cinco microorganismos evaluados se muestra en la Tabla I. Las formulaciones de quitosano con cera de abeja y ácido oleico con los aceites esenciales de canela y clavo a la concentración de 1 % inhibieron completamente el desarrollo del micelio de todos los hongos evaluados, mientras que la formulación a base de quitosano con cera de abeja y con aceite esencial de tomillo al 1,0 %, inhibió el desarrollo de Fusarium oxysporum, Alternaria alternata y Penicillium digitatum, la formulación con quitosano, ácido oleico y aceite esencial de tomillo al 1,0 % inhibieron el desarrollo de R. stolonifer,y C. gloeosporioides, Alternaria alternata y Penicillium digitatum. Igualmente, la formulación que incluyó ácido oleico y aceite esencial de clavo al 0,5 % inhibió el crecimiento de C. gloeosporioides al 100 %.
Las formulaciones que lograron una inhibición media (50 a 82 %) en R. stolonifer fueron las que se mezclaron con cera de abeja y aceite esencial de clavo al 0,5 %, así como las realizadas con ácido oleico y aceite esencial de canela y clavo al 0,5%. Así mismo en Colletotrichum gloeosporioides fueron las formulaciones con cera de abeja, aceite esencial de tomillo al 0,5 y 1,0 %, aceite esencial de canela
al 0,5 % y aceite esencial de clavo al 0,25 y 0,5 % y por último la formulación con ácido aleico y aceite esencial de canela al 0,5 %. En Fusarium oxysporum solo las formulaciones con ácido oleico y aceite esencial de canela y clavo al 0,5 % lograron una inhibición media. Finalmente para Penicillium digitatum fueron las formulaciones realizadas con cera de abeja y ácido oleico y aceite esencial de tomillo, canela y clavo al 0,1; 0,25 y 0,5 %.
Las formulaciones con inhibiciones menores al 50 % para Rhizopus stolonifer fueron aquellas con cera de abeja y aceite esencial de tomillo a 0,1; 0,25; 0,5 y 1,0 %, aceite esencial de canela y clavo a 0,1; 0,25 y 0,5 %; así mismo las formulaciones con aceite oleico y aceite esencial de tomillo a 0,1, 0,25 y 0,5 %, aceite esencial de canela y clavo a 0,1 y 0,25%.
En Colletotrichum gloeosporioides se registraron las formulaciones con cera de abeja, aceite esencial de tomillo a 0,1, 0,25 y 0,5 %, aceite esencial de canela a 0,1 y 0,25 % y aceite esencial de clavo a 0,1 %; de igual manera las formulaciones con ácido oleico y aceite esencial de tomillo a 0,1, 0,25 y 0,5 %, aceite esencial de canela y clavo a 0,1 y 0,25 %.
En Fusarium oxysporum se encontraron las formulaciones con cera de abeja y aceite esencial de tomillo, canela y clavo a 0,1, 0,25 y 0,5 %, así también las formulaciones con ácido oleico, aceite esencial de tomillo a 0,1, 0,25, 0,5 y 1,0 %, aceite esencial de canela y clavo a 0,1 y 0,25 %. En el mismo sentido, para Alternaria alternata, las inhibiciones menores al 50 % se lograron con formulaciones a base de quitosano, tanto con cera de abeja como ácido oleico con los tres aceites esenciales a 0,1, 0,25 y 0,5 % respectivamente.
Los hongos que más tolerancia presentaron a las formulaciones de quitosano, cera de abeja y ácido oleico y aceites esenciales de tomillo, canela y clavo fueron Alternaria alternata, Rhizopus stolonifer y Fusarium oxysporum y los más susceptibles fueron Penicillium digitatum y Colletotrichum gloesporioides.
En frutos almacenados a temperatura controlada a los 13 días después del tratamiento, la incidencia menor (10,0 %) de la antracnosis se logró con las formulaciones de quitosano, ácido oleico y cera de abeja y aceite esencial de canela y clavo al 1 %, aunque no se diferenciaron de los tratamientos donde se aplicó el fungicida Sportak (10,0 %) ni del control (16,7 %). La incidencia mayor (40,0 %) se registró en el tratamiento con la formulación de quitosano, cera de abeja y aceite esencial de tomillo, siguiendo los tratamientos con la formulación de quitosano, ácido oleico y aceite esencial de tomillo y el tratamiento con quitosano solo (Tabla II).
A los 17 días después del tratamiento la incidencia de la enfermedad en frutos almacenados a temperatura controlada, se incrementó considerablemente. La incidencia menor (13,3 %) se observó en el tratamiento con fungicida y con el quitosano 1 % (32,4 %) y la incidencia mayor (81,5 %) fue con el tratamiento quitosano 1 % + cera de abeja 0,1 % + aceite esencial de tomillo 1 %, siendo igual estadísticamente con las tratamientos a base de quitosano, ácido oleico y cera de abeja y los aceites esenciales de clavo, canela y tomillo y el control (Tabla II).
La incidencia de la antracnosis solo disminuyó ligeramente en los tratamientos con Sportak y Quitosano al 1 % a los 17 días de almacenamiento con 13,3 y 32,4 % respectivamente, comparado con el control que presentó 59,9 %.
El índice de severidad de antracnosis, en frutos almacenados a temperatura ambiente, no presentó diferencias significativas entre los tratamientos, varió de 1,3 a 2,0, siendo iguales que el control donde se registró un índice de 2,0 (Tabla III). En frutos almacenados a temperatura controlada, a los 13 días después del tratamiento, el índice de severidad fue de 1,1 a 1,5, pero sin diferencias estadísticas con el control, quien registró un índice de severidad de 1,3.
A los 17 días después del tratamiento, en frutos almacenados a temperatura controlada, el índice de severidad menor se logró en los tratamientos Sportak (1,1) y quitosano al 1% (1,2), mientras que los tratamientos a base de quitosano, cera de abeja y aceites esenciales de tomillo y canela, así como los tratamientos a base de quitosano, ácido oleico y aceites esenciales de tomillo, canela y clavo presentaron un índice que varió de 1,7 a 1,9, siendo iguales estadísticamente al control. El índice de severidad mayor (2,0) se alcanzó en el tratamiento con quitosano, cera de abeja y aceite esencial de clavo.
El comportamiento de los sólidos solubles totales fue muy parecido, con valores que oscilaron entre 8,9 ± 1,010 (T5) a 10,8 ± 0,898 (T6). Los frutos con firmeza menor (6,9 ± 1,0) se obtuvieron con el T6, muy similar a los valores iníciales (6,5 N) en comparación con el resto de los tratamientos. La pérdida de peso menor (4,6± 1,217) se presentó con el T8, similar al T2 (4,8 ± 1,476) y la pérdida de peso mayor (6,3 ± 0,719) correspondió al T4 (Tabla IV).
Los valores determinados de luminosidad (L), cromaticidad (C) y ángulo de matiz (hº) indican que los frutos de los diferentes tratamientos mantuvieron valores similares de luminosidad y aumentaron su cromaticidad, disminuyendo su ángulo matiz, en comparación con los frutos iníciales que no fueron tratados presentando una cromaticidad de C=34,8 y un ángulo matiz hº=87,5. La luminosidad menor (49,3 ± 2,3) se observó con el tratamiento T5 y la luminosidad mayor (55,2 ± 3,5) se alcanzó con el tratamiento T7. El valor mayor de a* (18,9 ± 4,0) se observó con el tratamiento T6 y el menor (7,6 ± 4,6) con el T2, en comparación con los demás tratamientos y con los frutos iníciales (1,53 ± 4,8). Los frutos iníciales presentaron valores para b* de 34,8 ± 8,2, el mayor valor de b* (42,4 ± 4,8) lo presentó el T7 y el menor (37,0 ± 3,7) que corresponde al T5. El color amarillo se mantuvo en la mayoría de los tratamientos incluyendo los frutos iniciales a excepción de los tratamientos T6, T8 y T9, que presentaron un color amarillo-naranja (Tabla V).
DISCUSIÓN
Los estudios in vitro en general mostraron que las mejores películas biodegradables a base de quitosano, cera de abeja ó ácido oleico, fueron las que se mezclaron con aceite de tomillo, canela y clavo a la concentración más alta (1,0 %), donde la inhibición micelial fue de 100 % en R. stolonifer, C. gloeosporioides, F. oxysporum, A. alternata y P. digitatum en comparación con el tratamiento control, en donde el desarrollo micelial fue de 8,3 cm. En R. stolonifer las películas a base de quitosano, cera de abeja y ácido oleico con el aceite esencial de canela y clavo a la concentración 0,5 % también inhibieron el desarrollo micelial de este hongo, obteniendo un crecimiento micelial de 3,1 a 5,3 cm.
Estudios in vitro con quitosano a 2,5 y 3,0 % reportaron un efecto fungicida sobre R. stolonifer, C. gloeosporioides, F. oxysporum y P. digitatum. Así mismo quitosano a 1,5 % inhibió el crecimiento micelial en más de 50 % de C. gloeosporioides, F. oxysporum, P. digitatum y R. stolonifer aislados de papaya (4). En este estudio, C. gloeosporioides presentó inhibición del crecimiento micelial cuando se utilizaron películas biodegradables a base de quitosano, cera de abeja y/o ácido oleico y aceites esenciales de tomillo, canela y clavo a la concentración de 0,5 y 1,0 %, su crecimiento micelial fue de 0; 1,5; 1,9; 2,1; 2,3 y 4,0 cm en comparación al control (PDA) que obtuvo un crecimiento micelial de 8,3 cm, a excepción de la película biodegradable de quitosano, ácido oleico y aceite de tomillo al 0,5 % en donde el crecimiento micelial fue igual que el tratamiento control. Quitosano a concentraciones de 2,5 y 3,0 % logró inhibición micelial total sobre C. gloeosporioides aislado de papaya, durante 7 días de incubación (2).
Las películas a base de quitosano y cera de abeja con aceites de tomillo, canela y clavo al 0,5 y 1,0 % fueron mejores en la reducción del crecimiento de F. oxysporum. Los aceites de canela, clavo y tomillo a concentraciones de 100-300 µg mL-1 presentaron los valores menores del crecimiento micelial (0-36 mm) en Fusarium sp. aislado de fruto de papaya (11). El crecimiento micelial de A. alternata y P. digitatum, en interacción con películas biodegradables a base de quitosano, cera de abeja, ácido oleico, y aceites esenciales de tomillo, canela y clavo presentó un comportamiento muy parecido; el efecto de las películas a base de quitosano, cera de abeja, ácido oleico con los aceites al 1 % presentaron un porcentaje de inhibición del crecimiento micelial del 100 %.
Los hongos que presentaron mayor inhibición micelial in vitro fueron P. digitatum y C. gloesosporioides ya que el efecto de inhibición de las cubiertas fue a partir de la concentración 0,5 y 1% en todos los tratamientos realizados. No se sabe si esto se debe a la morfología del hongo, su sensibilidad o a su comportamiento con el quitosano, cera de abeja, ácido oleico y los aceites esenciales.
Los tratamientos que mostraron tener un mejor efecto in vitro fueron la película biodegradable a base de quitosano, cera de abeja, ácido oleico, aceite esencial de tomillo, canela y clavo a la concentración del 1%.
La incidencia de antracnosis en frutos de papayo almacenados a temperatura ambiente, en la mayoría de los tratamientos fue mayor al 80 % e iguales estadísticamente al tratamiento control, solo los tratamientos con quitosano 1% (61,1 %), quitosano + ácido oleico + aceite esencial de tomillo (67,8 %) y Sportak (70,0 %) lograron incidencias menores, pero que comercialmente se consideran incidencias muy altas.
La incidencia de la antracnosis en frutos de papaya almacenados a temperatura controlada durante 13 días varió de 10,0 a 13,3 % para los tratamientos con quitosano, ácido oleico o cera de abeja y aceite esencial de clavo y canela, pero fueron iguales estadísticamente al tratamiento control (16,7 %) y Sportak (10 %), el resto de los tratamientos presentaron incidencias de 26,7 a 40 %. Sin embargo, a los 17 días de almacenamiento, la incidencia menor (13,3 y 32,4 %) solo se consiguió en los tratamientos con Sportak y quitosano 1 %, el resto de los tratamientos con películas registraron incidencias de 57,8 a 81,5 %, pero fueron iguales al tratamiento control que logró 59,9 %.
El índice de severidad de la antracnosis en frutos de papaya almacenados a temperatura ambiente, para todos los tratamientos fue de 1,3 a 2,0 sin diferencias estadísticas. Los frutos almacenados a temperatura controlada durante 13 días presentaron un comportamiento similar, pero con índices menores, los cuales variaron de 1,1 a 1,4, sin diferencias estadísticas con el control. Finalmente, los frutos almacenados a temperatura controlada durante 17 días presentaron índices ligeramente superiores, siendo los más bajos para los tratamientos Sportak (1,1) y quitosano 1 % (1,2), y el más alto (2,0) para el tratamiento con quitosano, cera de abeja y aceite esencial de clavo; el índice de severidad para el resto de los tratamientos varió de 1,7 a 1,9, pero estadísticamente se comportaron iguales al control.
Las películas pueden tener un efecto de protección probablemente por la presencia de quitosano, el cual prolonga la vida y mejora la calidad de las frutas por presentar permeabilidad selectiva a los gases, así mismo funciona como barrera protectora contra el deterioro de los frutos, retardando los procesos naturales de maduración y restringiendo el crecimiento de microorganismos (5). La incorporación de agentes antimicrobiales como el aceite esencial de tomillo presenta un compuesto fenólico el cual puede penetrar la membrana del citoplasma causando una desestabilización, actuando como intercambiador de protones reduciendo el gradiente de pH a lo largo de la membrana y este compuesto fenólico puede ser el responsable del efecto que tiene al aplicarlo en películas, cubiertas o empaques en donde inhibe el desarrollo de hongos y bacterias (12). En frutos de papaya maradol inoculados con C. gloeosporioides y posteriormente tratados con un recubrimiento comestible formulado con goma de mezquite y cera de candelilla y aceite esencial de tomillo, la concentración a 0,15 % redujo la incidencia en 0 % y la concentración de 0,12 % redujo en 50 % (13).
Los sólidos solubles totales, firmeza y pérdida de peso no mostraron diferencias significativas en los días de almacenamiento, conforme fueron pasando los días de almacenamiento la enfermedad fue aumentando sin afectar a las tres variables de estudio, observando que el contenido de sólidos solubles totales, firmeza y pérdida de peso no fueron afectados por la aplicación de los tratamientos. La pérdida de peso en frutos de papaya maradol se incrementó durante el almacenamiento y que esto se debe a la pérdida de agua de los frutos ya que depende tanto de la actividad fisiológica como de factores externos, particularmente la temperatura y la humedad relativa (5).
La reducción de la firmeza durante los días de almacenamiento se debe a la pérdida de sustancias pécticas y por los cambios hidrolíticos de la protopectina (5). La cera comestible aplicada a frutos de papaya maradol almacenados durante 12 días, no causó daño aparente a los frutos ni a sus características fisicoquímicas a los nueve días de almacenamiento, los parámetros de calidad presentaron una tendencia normal esperada con la maduración del fruto, sin embargo, a los 12 días los frutos fueron afectados por daño patológico (5).
Por otra parte, el color de los frutos no presentó diferencias estadísticas entre los tratamientos. Los frutos de los diferentes tratamientos mantuvieron valores similares de luminosidad y aumentaron su cromaticidad, disminuyendo su ángulo matiz, en comparación con los frutos iniciales que no fueron tratados, presentando una cromaticidad de C=34,8 y un ángulo matiz hº=87,5. De acuerdo al color exhibido con la gráfica CIELAB a los 17 días de almacenamiento, los frutos mantuvieron un color amarillo en la mayoría de los tratamientos incluyendo los frutos iniciales con un ángulo matiz (hº=71,7- 87,5), a excepción de los tratamientos quitosano 1 % + ácido oleico 1 % + aceite esencial de clavo 1 %, quitosano 1 % + ácido oleico 1 % + aceite esencial de canela 1 % y quitosano 1 % + cera de abeja 0,1 % + aceite esencial de clavo 1% que presentaron un color amarillo-naranja con un ángulo matiz (hº=70,5). La madurez de consumo de frutos de papaya Maradol se alcanzó entre los 13 y 15 días después de la cosecha en condiciones de almacenamiento a 23 ± 1 °C y 75 % de humedad relativa y el ángulo del tono de la cáscara estuvo entre 70 y 80°, el contenido de sólidos solubles totales varió de 10 a 11,5 °Brix y la firmeza de la pulpa de 4,7 a 6,9 N, permitiendo diferenciar dos estados de madurez de consumo (14,15). Estas características pueden ser propuestas como índices objetivos para describir la madurez de consumo de papaya maradol (14). En este estudio la vida de anaquel fue de 19 días.
CONCLUSIONES
Las películas biodegradables a base de quitosano, cera de abeja, ácido oleico y aceites esenciales de tomillo, clavo y canela a la concentración del 1 %, inhibieron el desarrollo de R. stolonifer, C. gloeosporioides, F. oxysporum, A. alternata y P. digitatum in vitro, y permitieron observar un mejor efecto en el control de la enfermedad causada por C. gloeosporioides cuando los frutos se conservaron a temperatura controlada (14±2 °C), sin afectar los parámetros fisiológicos de las frutas tratadas, lo que permitió extender hasta 19 días la vida útil y calidad de los frutos de papaya.
BIBLIOGRAFÍA
1. FAO. Stadistical Production and Marketing of Papaya [Internet]. FAOSTAT. 2010. Disponible en: http://www.fao.org/faostat/es/#home
2. Bautista-Baños S, Sivakumar D, Bello-Pérez A, Villanueva-Arce R, Hernández-López M. A review of the management alternatives for controlling fungi on papaya fruit during the postharvest supply chain. Crop Protection. 2013;49(12):8-20. doi:10.1016/j.cropro.2013.02.011
3. Rojo-BáEz I, GarcíA-Estrada RS, SañUdo-Barajas JA, LeóN-FéLix J, Allende-Molar R. Proceso de infección de antracnosis por colletotrichum truncatum en papaya maradol. Revista Brasileira de Fruticultura [Internet]. 2017 [citado 8 de febrero de 2018];39(spe). doi:10.1590/0100-29452017379
4. Dotto GL, Vieira MLG, Pinto LAA. Use of chitosan solutions for the microbiological shelf life extension of papaya fruits during storage at room temperature. LWT - Food Science and Technology. 2015;64(1):126-30. doi:10.1016/j.lwt.2015.05.042
5. Petit-Jiménez D, Terán Y, Rojas B, Salinas-Hernández R, García-Robles J, Báez-Sañudo R. Efecto de las ceras comestibles sobre la calidad en frutos de papaya. Revista Iberoamericana de Tecnología Postcosecha. 2010;11(1):37-42.
6. Ong MK, Ali A. Antifungal action of ozone against Colletotrichum gloeosporioides and control of papaya anthracnose. Postharvest Biology and Technology. 2015;100(2):113-9. doi:10.1016/j.postharvbio.2014.09.023
7. Hamzah HM, Osman A, Tan CP, Mohamad Ghazali F. Carrageenan as an alternative coating for papaya (Carica papaya L. cv. Eksotika). Postharvest Biology and Technology. 2013;75(1):142-6. doi:10.1016/j.postharvbio.2012.08.012
8. López-Mata MA, Ruiz-Cruz S, Navarro-Preciado C, Ornelas-Paz J de J, Estrada-Alvarado MI, Gassos-Ortega LE, et al. Efecto de recubrimientos comestibles de quitosano en la reducción microbiana y conservación de la calidad de fresas. Biotecnia. 2012;14(1):33-43. doi:10.18633/bt.v14i1.113
9. Jiménez A, Fabra MJ, Talens P, Chiralt A. Edible and Biodegradable Starch Films: A Review. Food and Bioprocess Technology. 2012;5(6):2058-76. doi:10.1007/s11947-012-0835-4
10. Ramos-García M, Bosquez-Molina E, Hernández-Romano J, Zavala-Padilla G, Terrés-Rojas E, Alia-Tejacal I, et al. Use of chitosan-based edible coatings in combination with other natural compounds, to control Rhizopus stolonifer and Escherichia coli DH5α in fresh tomatoes. Crop Protection. 2012;38(8):1-6. doi:10.1016/j.cropro.2012.02.016
11. Barrera-Necha LL, Bautista-Banos S, Flores-Moctezuma HE, Estudillo AR. Efficacy of essential oils on the conidial germination, growth of Colletotrichum gloeosporioides (Penz.) Penz. and Sacc and control of postharvest diseases in papaya (Carica papaya L.). Plant Pathology Journal. 2008;7(2):174-8. doi:10.3923/ppj.2008.174.178
12. Cagri A, Ustunol Z, Ryser ET. Antimicrobial edible films and coatings. Journal of Food Protection. 2004;67(4):833-48. doi:10.4315/0362-028X-67.4.833
13. Bosquez-Molina E, Jesús ER, Bautista-Baños S, Verde-Calvo JR, Morales-López J. Inhibitory effect of essential oils against Colletotrichum gloeosporioides and Rhizopus stolonifer in stored papaya fruit and their possible application in coatings. Postharvest Biology and Technology. 2010;57(2):132-7. doi:10.1016/j.postharvbio.2010.03.008
14. Santamaría Basulto F, Díaz Plaza R, Sauri Duch E, Espadas y Gil F, Fernández S, Manuel J, et al. Características de calidad de frutos de papaya maradol en la madurez de consumo. Agricultura técnica en México. 2009;35(3):347-53.
15. Acosta Ramos M, Nieto-Ángel D, Domínguez-Álvarez JL, Delgadillo-Sánchez F. Calidad y tolerancia en frutos de papaya (Carica papaya L.) a la inoculación del hongo Colletotrichum gloeosporioides Penz en postcosecha. Revista Chapingo Serie Horticultura 7(1): 119-130, 2001.
Recibido: 14/03/2017
Aceptado: 17/10/2017
Mónica Hernández-López, Departamento de Interacciones Planta-Insecto. Instituto Politécnico Nacional, Centro de Desarrollo de Productos Bióticos, Carr. Yautepec-Jojutla Km. 6, Col. San Isidro, CEPROBI 8, Morelos 62731, México. Email: dagoguillen@yahoo.com