ARTÍCULO ORIGINAL
Recuperación de la planta de arroz a la suspensión de la lámina de agua. Parte II
Recovery of the rice plant to the suspension of the water lamina. Part II
Michel Ruiz,I Yaumara Muños,II José M. Dell Ámico,I Juan A. Cabrera,I Ricardo Polón,I Ricardo Aroca,III Juan M. RuizIII
I Instituto Nacional de Ciencias Agrícolas (INCA), Carretera Tapaste, Km 3½, Gaveta Postal 1. San José de las Lajas, Mayabeque. Cuba. CP 32700.
II Universidad Hermanos Saiz Montes de Oca. Pinar del Río, Cuba.
III Estación Experimental del Zaidín. Granada, España.
RESUMEN
Lograr un uso eficiente de agua de riego en el cultivo del arroz, no responde únicamente al manejo del riego, también depende de la respuesta de la planta a nivel fisiológico y bioquímico de la misma, para adaptarse y recuperarse del déficit hídrico y llegar a completar su ciclo biológico. La investigación se realizó en la Estación Experimental del Zaidín, Granada, España, en condiciones semi-controladas en macetas plásticas, con plantas de arroz `INCA LP-5´, que se cultivaron en condiciones de anaerobiosis y fueron expuestas a déficit hídrico, mediante la suspensión de la lámina de agua en tres momentos de su desarrollo, a los 30, 40 y 50 días después del trasplante (DDT) por un período de 15 días y se evaluaron después del período de recuperación a los 122 DDT. En general, las plantas se recuperaron del estrés hídrico al que estuvieron expuestas durante su fase vegetativa, lo que se evidenció a través del aumento del potencial hídrico y la conductancia estomática, también se incrementó el contenido de peróxido de hidrógeno y el daño oxidativo a los lípidos. Además, se encontró una relación directa entre estas variables (potencial hídrico - conductancia estomática y peróxido de hidrógeno - daño oxidativo a lípidos). Estas variables indicaron que las plantas expuestas a estrés hídrico a los 30 DDT, mostraron un estado de recuperación mayor que las expuestas a los 40 y 50 DDT, respuesta que puede influir en el rendimiento agrícola del cultivo.
Palabras clave: estrés hídrico, Oryza sativa, peróxido de hidrógeno, peroxidación lipídica.
ABSTRACT
Achieving an efficient use of irrigation water in rice cultivation, not only responds to the management of irrigation, also depends on the response of the plant to physiological and biochemical level of it, to adapt and recover from the water deficit and to complete its biological cycle. The experiment was carried out at the Zaidín Experimental Station, Granada, Spain, under semi-controlled conditions in plastic pots, with ‘INCA LP-5’ rice plants, which were cultivated under anaerobic conditions and exposed to water deficit, the suspension of the water lamina at three stages of its development, at 30, 40 and 50 days after transplantation (DAT) for a period of 15 days and evaluated after the recovery period at 122 DAT. In general, plants recovered from the water stress to which they were exposed during their vegetative phase, which was evidenced through increased water potential and stomatal conductance, also increased the content of hydrogen peroxide and oxidative damage to lipids. In addition, a direct relationship was found between these variables (hydric potential - stomatal conductance and hydrogen peroxide - oxidative damage to lipids). These variables indicated that plants exposed to water stress at 30 DAT, showed a higher recovery state than those exposed to 40 and 50 DAT, response may influence crop yield.
Key word: water stress, Oryza sativa, hydrogen peroxide, lipid peroxidation.
INTRODUCCIÓN
La variabilidad a nivel mundial en el rendimiento del cultivo de arroz está influenciada por los cambios climáticos durante las últimas tres décadas, y se estimó que aproximadamente el 53 % de las regiones donde se cosecha arroz, experimentan la influencia de este fenómeno climatológico, con un 32 % de la variabilidad del rendimiento del arroz por año (1). La sequía limita la producción de arroz, debido a que afecta a nivel morfológico (reducción de la germinación, biomasa vegetal, número de tallos, diversos rasgos de raíces y hojas) y fisiológicos (fotosíntesis reducida, transpiración, conductancia estomática, contenido de clorofila, actividad del fotosistema II y el contenido relativo de agua). También a nivel bioquímico modifica la acumulación de osmoprotectores como, la prolina, azúcares, poliaminas y compuestos antioxidantes, así como la producción hormonal (auxinas, citoquininas, giberilinas, etileno y ácido abscísico).
El arroz (Oryza sativa L.) para cultivarse requiere una gran cantidad de agua a lo largo de su ciclo biológico en comparación con otros cultivos, aun cuando no es una planta acuática. Por lo tanto, el estrés por sequía causa una grave amenaza a la producción de arroz (2). La sequía es reconocida como un desastre ambiental que perjudica la producción de arroz. La mejora de la tolerancia a la sequía en el arroz es una tarea difícil debido a su naturaleza compleja e impredecible (2).
El déficit hídrico modifica la fisiología de la planta de arroz de innumerables maneras, como la fotosíntesis neta (3), la tasa de transpiración (4), la conductancia estomática (5), la eficiencia del uso del agua (6), el contenido relativo de agua (7) y el índice de estabilidad de la membrana (8); y a nivel bioquímico los contenidos de especies reactivas de oxígeno (3). Todos estos parámetros son indicadores de estrés hídrico en el arroz (6,8)
Para facilitar el desarrollo de variedades tolerantes que puedan sobrevivir y dar mayores rendimientos en condiciones de sequía, es necesario un conocimiento profundo de los diversos caracteres morfológicos, fisiológicos y bioquímicos que rigen el rendimiento de arroz en condiciones de estrés hídrico. El objetivo de este trabajo es evaluar la recuperación de las plantas de arroz a nivel fisiológico y bioquímico cultivado en condiciones de anaerobiosis y expuestos a suspensión de la lámina de agua por un periodo de 15 días en la fase vegetativa.
MATERIALES Y MÉTODOS
La investigación se realizó en la Estación Experimental del Zaidín, Granada, España (EEZ) en el año 2010 en condiciones de invernadero, con plantas de arroz cv. INCA LP-5. Inicialmente se estableció un semillero de arroz en bandejas plásticas de 0,40x0,80x0,08 m con arena estéril. Para lograr la germinación del arroz, se regaron las bandejas hasta lograr una lámina de agua de 5 cm por encima de la superficie de la arena por un periodo de 24 horas. Momento a partir del cual se desaguó la bandeja, manteniendo la arena a máxima capacidad de retención de agua, hasta que brotaron dos hojas por planta. Con posterioridad, se restableció la lámina de agua de 3 cm hasta los 30 días después de la emergencia (DDE).
A los 30 DDE se trasplantó una planta en cada maceta de 1 kg de capacidad (0,18 m de alto y 0,13 m de diámetro), que contenía un sustrato compuesto por arena (granulometría <1 mm) y suelo (granulometría <5 mm) en proporción 1:1 (v:v), que previamente se esterilizó; la arena a 120 ºC durante 20 min, en una autoclave Selecta, modelo PRESOCLAVE-II 75 L, y el suelo a 95-100 ºC, pero durante 60 min diarios por tres días consecutivos. El suelo que se utilizó, se clasificó como Fluvisol Háplico Calcáreo (9), el que presentó un pH de 8,1 (medido por potenciometría), 1,81 % de materia orgánica (método de Walkley y Black), fósforo asimilable 6,2 mg kg-1 (P-Olsen) y potasio intercambiable 0,34 cmol kg-1 (extracción con NH4OAc 1 mol L-1 a pH 7).
Las macetas se colocaron en el invernadero donde se estableció el semillero, con temperaturas de 26 y 22 ºC (día/noche, respectivamente); humedad relativa entre 50-70; fotoperiodo de 16 horas de luz y 8 horas de oscuridad y radiación fotosintéticamente activa de 850 µmol m-2 s-1, medida con un LICOR portátil (Lincoln, NE, EE.UU., modelo LI-188B), siguiendo un diseño experimental Completamente Aleatorizado, con arreglo bifactorial y cinco repeticiones, para lo cual se emplearon 15 macetas por tratamiento, que permitieron realizar las evaluaciones después de cada periodo sin lámina de agua.
El suministro de agua consistió, en mantener una lámina de agua a 5 cm sobre la superficie del sustrato en todos los tratamientos (Sin E), hasta el momento en que se suspendió la lámina de agua, a los 30, 40 y 50 días después del trasplante (Con E), por un periodo de 15 días, momento en el cual se repuso la lámina de agua que permaneció hasta los 15 días antes de efectuar la cosecha; el grupo de macetas a las que no se les suspendió la lámina de agua quedaron como tratamientos testigos.
La aplicación total de nutrientes, correspondiente a 0,123 g de N; 0,050 g de P2O5 y 0,059 g de K2O por maceta, se realizó a los 20, 35 y 60 días después del trasplante (DDT), aplicando en cada momento el 30, 40 y 30 %, respectivamente, utilizando como portadores, urea (46 % de N), superfosfato triple (46 % de P2O5) y cloruro de potasio (60 % de K2O), respectivamente.
Muestreo y evaluaciones realizadas
Se tomaron cinco plantas por tratamiento a los 122 DDT (25 días antes de la cosecha del grano), para evaluar la altura de las plantas (ALT), la masa fresca aérea (MFA) y de las raíces (MFR), el rendimiento agrícola y sus componentes, el potencial hídrico foliar (Ψh), la conductancia estomática (CE), los contenidos foliares de peróxido de hidrógeno (H2O2) y el daño oxidativo a lípidos (DOL).
La ALT, MFA, MFR, Ψh, CE, H2O2 y el DOL, se evaluaron siguiendo los mismos procedimientos y protocolo que se describen en la primera parte de este artículo (10).
Las medias de los tratamientos se compararon a partir de los intervalos de confianza para α=0,05. Se realizaron también análisis de regresión entre el potencial hídrico y la conductancia estomática, y entre el contenido de peróxido de hidrógeno (H2O2) y el daño oxidativo a lípidos y él.
RESULTADOS Y DISCUSIÓN
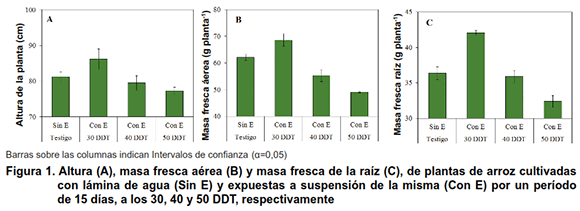
El estrés hídrico impuesto a los 30 DDT provocó mayor ALT, MFA y MFR después del periodo de recuperación (122 DDT), por el contrario, dicha condición a los 40 DDT no mostró diferencias con el testigo, siempre el crecimiento y desarrollo del arroz se limitó con la imposición del déficit hídrico a los 50 DDT (Figura 1A, B y C).
La condición de estrés hídrico a los 30 DDT, limitó el crecimiento y desarrollo de la planta (11); sin embargo, a los 122 DDT se incrementó el mismo, lo que pudiera estar relacionado, con el tiempo que medió desde que las plantas concluyeron este periodo de estrés y el momento de evolución a los 122 DDT (periodo de recuperación). El cual fue menor en aquellas plantas que se expusieron más tardíamente a esta condición y, por otra parte, con el estado fenológico de la planta en el momento de imponer la reducción del suministro hídrico. Esta respuesta indicó el potencial que tiene la planta de arroz para recuperase tras un periodo de estrés hídrico, ya que se incrementó el crecimiento de las plantas a un ritmo superior, comportamiento que se correspondió con lo informado para este cultivo, pero cultivado por siembra directa (12,13). La recuperación de la planta de arroz es posible siempre y cuando el periodo de estrés hídrico no categorice como estrés severo (14).
A los 122 DDT (Figura 2A), las plantas que se expusieron a estrés hídrico el Ψh y la CE presentó mayores valores, con respecto a las evaluaciones realizadas a los 45, 55 y 65 DDT, o sea después de terminado cada periodo de estrés hídrico (10). El Ψh y la CE fueron siempre menor en las plantas de los tratamientos Con E a los 40 y 50 DDT.
Es importante destacar que después del periodo de recuperación se observó a través del Ψh la capacidad de recuperación que presentaron las plantas, expuestas a estrés hídrico. Al respecto se informó que el arroz tiene la capacidad de recuperarse, aun cuando el estrés hídrico impuesto se puede considerar moderado por su duración e intensidad (12).
Por otra parte, la CE también denotó una recuperación de las plantas, aun cuando no hayan superado los valores de CE que alcanzó el tratamiento testigo, este resultado sugiere que, el daño ocasionado por el estrés hídrico en las hojas debió provocar variaciones en el número y funcionalidad de las estomas. Además, se hizo más evidente en aquellos tratamientos expuestos a estrés hídrico a los 40 y 50 DDT, respuesta que tuvo efecto en la ALT y la acumulación MFA, puesto que esto no superaron al tratamiento de los 30 DDT y al testigo.
El análisis de regresión entre el Ψh y CE mostró un coeficiente de determinación de R2 = 0,8368 y el de correlación es de 0,914, indicando una relación lineal directa entre las variables, estadísticamente significativas para un nivel de confianza del 95 %, se apreció que al incrementarse el potencial hídrico también se aumentó la conductancia estomática (Figura 3).
La relación que se encontró entre el Ψh y CE corrobora las consideraciones hechas anteriormente al analizar la Figura 2 (A y B), aun cuando es determinante el momento en que se aplicó el estrés hídrico durante la fase vegetativa del cultivo. La recuperación de las plantas a través de estas dos variables (Ψh y CE), puede deberse a la rehidratación de todos los tejidos, así como a la activación progresiva de los procesos de fotosíntesis y respiración, además de mejorar el transporte activo de agua y nutrientes en la planta, el cual disminuyó como mecanismo de defensa ante el estrés hídrico (15,16). La respuesta que se encontró en cuanto a la ALT, MFA, MFR, Ψh y CE demostró que la planta de arroz activa mecanismos de evasión ante una condición de estrés (17,18) y son capaces de recuperarse, siempre que la intensidad del estrés hídrico no provoque totalmente la muerte celular.
La exposición a estrés hídrico durante la fase vegetativa a los 30, 40 y 50 DDT, aumentó el contenido de H2O2 y de DOL, con respecto a los testigos, contenidos que a los 122 DDT continuó siendo superior en estas plantas, con la excepción en el DOL de aquellas que fueron expuestas a los 30 DDT, que no mostraron diferencias con el testigo (Figura 4A y B).
Desde el punto de vista bioquímico las plantas que fueron expuestas a estrés hídrico durante el periodo vegetativo, mostraron un comportamiento diferencial, que está muy asociado con el momento en que se realizó la evaluación, o sea después de un periodo de recuperación (a los 122 DDT).
Por otra parte, resulta importante que el momento de evaluación (122 DDT, 25 días antes de la cosecha), las plantas se encontraban en un proceso caracterizado por una demanda mayor de agua para la translocación de metabolitos y llenado de los granos (14), así como por el incremento de los procesos de senescencia, aspecto este último que disminuye la fotosíntesis (19) y provoca cambios bioquímicos en la planta con la finalidad de completar su ciclo biológico durante la fase de maduración.
El análisis de regresión entre el H2O2 y DOL mostró un coeficiente de determinación de R2 = 0,8123 y el de correlación es de 0,901, indicando una relación lineal directa entre las variables, estadísticamente significativas para un nivel de confianza del 95 %, se apreció que al incrementarse el contenido de peróxido de hidrógeno foliar, también aumentó el daño oxidativo a lípidos (Figura 5).
La relación que se encontró entre el H2O2 y DOL corrobora lo informado por otros autores, en cuanto al incremento de la peroxidación lipídica, o sea el daño a lípidos ante una condición de estrés abiótico (20), aun cuando esta afectación puede ser provocada por otras especies reactivas de oxígeno (ROS, siglas en inglés), entre las que se encuentra el radical hidroxilo (OH-), el superóxido (O2-) y el oxígeno singlete (1O2). En el caso de las ROS son consideradas moléculas indicadoras de estrés abiótico, y en el caso del H2O2, este realiza varias funciones, como indicador y como molécula señal (20). El H2O2, no sólo es la ROS más estable con capacidad de difundirse fácilmente de un compartimento celular a otro, también puede ser fácilmente asimilable por un sistema antioxidante celular eficiente, debido a que se produce a tasas elevadas en condiciones de sequía (21).
En este trabajo en la fase de maduración del cultivo del arroz, es posible que el contenido de H2O2 encontrado (20,07 nmol g-1 MS), no esté ejerciendo la función de señalización de estrés, si tenemos en cuenta los valores que se encontraron al finalizar cada periodo de estrés hídrico (promedio 17,88 nmol g-1 MS), que indicaron un déficit de agua en la planta (10).
Es posible que en este momento estén expresando concentraciones relacionadas con el proceso de senescencia y envejecimiento de las hojas. En sentido general no queda un panorama claro de cuando estamos en presencia de un proceso de señalización o de fitotoxicidad a partir de los contenidos de H2O2 y el daño oxidativo ocasionado. Es posible que los valores que se encontraron de H2O2 y de DOL estén asociados a la propia biología de la planta en la fase de maduración.
CONCLUSIONES
Las plantas se recuperaron del estrés hídrico al que fueron expuestas durante su fase vegetativa, que se evidenció a través del incremento del potencial hídrico y la conductancia estomática, también se incrementó el contenido de peróxido de hidrógeno y el daño oxidativo a lípidos. Además, se encontró una relación directa entre las variables potencial hídrico - conductancia estomática y peróxido de hidrógeno - daño oxidativo a lípidos. Estas variables indicaron que las plantas expuestas a estrés hídrico a los 30 DDT, mostraron un estado de recuperación mayor que las expuestas a los 40 y 50 DDT, respuesta que puede influir en el rendimiento agrícola del cultivo.
BIBLIOGRAFÍA
1. Ray DK, Gerber JS, MacDonald GK, West PC. Climate variation explains a third of global crop yield variability. Nature Communications. 2015;6(6989). doi:10.1038/ncomms6989
2. Pandey V, Shukla A. Acclimation and tolerance strategies of rice under drought stress. Rice Science. 2015;22(4):147–61. doi:10.1016/j.rsci.2015.04.001
3. Yang PM, Huang QC, Qin GY, Zhao SP, Zhou JG. Different drought-stress responses in photosynthesis and reactive oxygen metabolism between autotetraploid and diploid rice. Photosynthetica. 2014;52:193–202. doi:10.1007/s11099-014-0020-2
4. Lauteri M, Haworth M, Serraj R, Monteverdi MC, Centritto M. Photosynthetic diffusional constraints affect yield in drought stressed rice cultivars during flowering. Araujo WL, editor. PLoS ONE. 2014;9(10):e109054. doi:10.1371/journal.pone.0109054
5. Singh A, Sengar K, Sengar RS. Gene regulation and biotechnology of drought tolerance in rice. International Journal of Biotechnol ogy and Bioengineering Research. 4(6):547–52.
6. Akram HM, Ali A, Sattar A, Rehman HSU, Bibi A. Impact of water deficit stress on various physiological and agronomic traits of three Basmati rice (Oryza sativa L.) cultivars. JAPS, Journal of Animal and Plant Sciences. 2013;23(5):1415–23.
7. Cha-Um S, Yooyongwech S, Supaibulwatana K. Water deficit stress in the reproductive stage of four indica rice (Oryza sativa L.) genotypes. Pakistan Journal of Botany. 2010;42(5):3387–98.
8. Ding L, Li YR, Li Y, Shen QR, Guo SW. Effects of drought stress on photosynthesis and water status of rice leaves. Chin J Rice Sci. 2014;28(1):65–70. doi:10.3969/j.issn.1001-7216.2014.01.009
9. IUSS Working Group WRB. World Reference Base for Soil Resources 2014. International soil classification system for naming soils and creating legends for soil maps. World Soil Resources Reports [Internet]. FAO, Rome; 2014 [cited 2018 Apr 9] p. 192. Report No.: 106. Available from: http://www.fao.org/3/i3794en/I3794en.pdf
10. Ruiz-Sánchez M, Muños-Hernández Y, Dell’Ámico-Rodríguez JM, Cabrera-Rodríguez JA, Aroca R, Ruiz-Lozano JM. Respuesta de la planta de arroz (Oryza sativa L.) a la suspensión de la lámina de agua en tres momentos de su desarrollo. Parte I. Cultivos Tropicales. 2017;38(2):61–9.
11. IRRI (International Rice Research Institute). Standard Evaluation System for Rice. 5ta Ed. [Internet]. Manila, Philippines; 2013 [cited 2018 Apr 9]. Available from: http://www.clrri.org/ver2/uploads/SES_5th_edition.pdf
12. Polón R. Impacto nacional en el incremento del rendimiento agrícola, economizar agua de riego y energía en el cultivo del arroz (Oryza sativa L.) como consecuencia del estrés hídrico. In: XVI Fórum deficiencia y técnica [Internet]. 2006 [cited 2018 Apr 19]. Available from: http://www. forumcyt. cu/UserFiles/forum/Textos/0109604. pdf
13. Bunnag S, Pongthai P. Selection of rice (Oryza sativa L.) cultivars tolerant to drought stress at the vegetative stage under field conditions. American Journal of Plant Sciences. 2013;04(09):1701–8. doi:10.4236/ajps.2013.49207
14. García A, Dorado M, Pérez I, Montilla E. Efecto del déficit hídrico sobre la distribución de fotoasimilados en plantas de arroz (Orysa sativa L.). Interciencia. 2010;35(1):47–54.
15. Taiz L, Zeiger E. Plant Physiology. 4th edition. Publishers, Sunderland, Massachusetts: Sinauer Associates, Inc.; 2006. 700 p.
16. Jarma O. A, Beltramo D, M V, Montoya RA. Índices fisiotécnicos, fases de crecimiento y etapas de desarrollo de la planta de arroz. Capítulo 5. In: Degiovanni Beltramo, Víctor M.; Martínez Racines, César P.; Motta O., Francisco, editors [Internet]. Producción eco-eficiente del arroz en América Latina. Tomo I. Centro Internacional de Agricultura Tropical (CIAT), Cali, Colombia; 2010 [cited 2018 Apr 9]. p. 60–82. Available from: https://cgspace.cgiar.org/handle/10568/82473
17. Osakabe Y, Osakabe K, Shinozaki K, Tran L-SP. Response of plants to water stress. Frontiers in Plant Science. 2014;5(86):1–8. doi:10.3389/fpls.2014.00086
18. Song X-J, Matsuoka M. Bar the windows: an optimized strategy to survive drought and salt adversities. Genes & Development. 2009;23(15):1709–13. doi:10.1101/gad.1834509
19. Lim PO, Kim HJ, Gil Nam H. Leaf Senescence. Annual Review of Plant Biology. 2007;58(1):115–36. doi:10.1146/annurev.arplant.57.032905.105316
20. Noctor G, Mhamdi A, Foyer CH. The Roles of Reactive Oxygen Metabolism in Drought: Not So Cut and Dried. Plant Physiology. 2014;164(4):1636–48. doi:10.1104/pp.113.233478
21. Noctor G, Mhamdi A, Chaouch S, Han Y, Neukermans J, Marquez-Garcia B, et al. Glutathione in plants: an integrated overview: Glutathione status and functions. Plant, Cell & Environment. 2012;35(2):454–84. doi:10.1111/j.1365-3040.2011.02400.x
Recibido: 16/06/2017
Aceptado: 19/02/2018
Michel Ruiz, Instituto Nacional de Ciencias Agrícolas (INCA), Carretera Tapaste, Km 3½, Gaveta Postal 1. San José de las Lajas, Mayabeque. Cuba. CP 32700. Email: mich@inca.edu.cu