ARTÍCULO ORIGINAL
Inducción de señales en la interacción Mesorhizobium cicerii - Cicer arietinum L.
Induction of signals in Mesorhizobium cicerii - Cicer arietinum L. interaction
Dra.C. María C. Nápoles,I Dr.C. Juan C. Cabrera,II Dr.C. Guilleaume Wegria,II Dr.C. Rob Onderwater,II Dr.C. Ruddy Wattiez,III M.Cs. Ionel Hernández,I M.Cs. Daimy Costales,I Alejandro Rossi,IV Luisina Andriolo,IV Gustavo GonzálezIV
I Instituto Nacional de Ciencias Agrícolas (INCA), Carretera Tapaste, Km 3½, Gaveta Postal 1. San José de las Lajas, Mayabeque. Cuba. CP 32700.
II Unité Biotechnologie-Materia Nova A.S.B.L., Rue des Foudriers, 1, 7822 Ghislenghien, Belgium.
III Institute Biosciences, University of Mons, Belgium.
IV Empresa Rizobacter S.A., Ruta Nº 32, Km. 1,5 Parque Industrial de la ciudad de Pergamino, Buenos Aires, Argentina.
RESUMEN
El garbanzo es una leguminosa de grano con un valor nutritivo excepcionalmente alto que permite producir gran variedad de alimentos. Se cultiva principalmente en condiciones de secano en las zonas áridas y semiáridas de todo el mundo, donde llega a considerarse la tercera leguminosa de grano más cultivada. Como la mayor parte de las leguminosas, se asocia en simbiosis con bacterias de la familia de los rizobios, que le garantizan parte del nitrógeno que necesita para su crecimiento y desarrollo. En las primeras etapas de la simbiosis, se genera un complejo diálogo molecular que involucra a los factores Nod sintetizados por la bacteria y los flavonoides liberados por la semilla, de modo que ambos simbiontes pueden reconocerse mutuamente e iniciar todo el proceso de la nodulación. Este trabajo tuvo como objetivo evaluar la producción de moléculas señales inducidas en la cepa Mesorhizobium cicerii y su impacto sobre la nodulación y el rendimiento del garbanzo. La fracción lipídica en los inóculos fue extraída con n-butanol y analizada por cromatografía líquida de alta resolución y cromatografía gaseosa acoplada a un espectrómetro de masas. En los inóculos inducidos con daidzeína se detectó una cantidad superior de lipoquitooligosacáridos (factores de nodulación) y de ácidos grasos de alto peso molecular. De manera similar, los inóculos inducidos con este flavonoide mostraron un efecto positivo en la nodulación y el rendimiento de garbanzo en condiciones semicontroladas y de campo, respectivamente.
Palabras clave: comunicación, factores Nod, legumbres, simbiosis.
ABSTRACT
Chickpea is a grain legume of exceptionally high nutritive value and most versatile food used. It is mostly grown under rainfed conditions in arid and semi-arid areas around the world. Chickpea is the third most cultivated grain legume in the world. Like most legumes, it is associated in symbiosis with bacteria from the rhizobia family, which guarantee much of the nitrogen it needs for its growth and development. In early stages of the symbiosis, a complex molecular dialogue takes place, involving Nod factors synthesized by the bacterium and flavonoids released by legume roots, so that both partners can recognize each other and initiate nodulation. This work aimed to evaluate the production of the induced signals in Mesorhizobium cicerii strain and the impact of that induction on chickpea nodulation and yield. The lipid fraction in the inocula was extracted with n-butanol and analyzed by high performance liquid chromatography and gas chromatography coupled to a mass spectrometer. A higher amount of lipochitooligosaccharides (nodulation factors) and high molecular weight fatty acids were detected in daidzein-induced inocula. Similarly, the inoculums induced with this flavonoid showed a positive effect on nodulation and yield of chickpea in semicontrolled and field conditions, respectively.
Key words: communication, Nod factors, legumes, symbiosis.
INTRODUCCIÓN
El garbanzo (Cicer arietinum L.) es una leguminosa de gran importancia en la dieta humana, especialmente en el Oriente Medio, el Mediterráneo y la India donde es la segunda leguminosa más ampliamente cultivada. La producción mundial de garbanzo ha ido en aumento y datos que ofrece la FAO muestran 13,7 Mt producidas en el 2014. La India constituye uno de los mayores productores con aproximadamente el 70 % de la producción mundial (1).
Esta leguminosa fija nitrógeno atmosférico (N) mediante simbiosis con cepas efectivas de Mesorhizobium. Se plantea que puede llegar a fijar hasta 141 kg N año-1 (2), con lo cual mejora la fertilidad del suelo, así como la productividad de los cultivos posteriores, en los que reduce la dependencia de N (3).
La inoculación de semillas con rizobios apropiados en el momento de la siembra es una práctica agronómica recomendada en la tecnología de producción de leguminosas. La inoculación exitosa depende de varios factores, entre ellos la capacidad de la cepa introducida para competir con la población nativa existente y lograr una mayor infección, nodulación y aporte de N (4).
En las primeras etapas de la simbiosis, se produce un intercambio molecular que permite la comunicación de ambos simbiontes. (5). Los flavonoides liberados por la semilla entre los que se encuentran la daidzeína, inducen la expresión de los genes nod en la bacteria, que sintetizan los factores Nod, moléculas esenciales en el éxito de la interacción (6). Estos compuestos han sido relacionados además, con la quimioatracción que ejercen las leguminosas sobre los rizobios y con la expresión de otros genes en dichas bacterias que regulan la síntesis de exopolisacáridos y el sistema de secreción tipo III, relacionados con las respuestas defensivas en el hospedero y con la exportación de proteínas en la nodulación, respectivamente (7). Otros compuestos derivados del microorganismo determinan la simbiosis: lipopolisacáridos (LPS), polisacáridos capsulares (CPS), exopolisacáridos (EPS) y glucanos cíclicos, así como proteínas de secreción (8).
El uso de inoculantes inducidos en la síntesis de estas señales que rigen la comunicación, ha permitido obtener no sólo una mejor nodulación y rendimiento de las plantas, sino una tolerancia a condiciones estresantes en el medio (9).
La importancia agronómica y ambiental de la simbiosis rizobios-leguminosas ha exigido el perfeccionamiento de las tecnologías de producción y aplicación de inoculantes, donde se tiene en cuenta desde la selección de cepas hasta el uso de protectores y de condiciones que mejoren cada vez más el proceso de infección y formación de nódulos activos, que luego se traduzcan en mayor fijación del N (10).
En este sentido el presente trabajo intentó modificar la composición de señales químicas en un inoculante a base de M. cicerii y evaluar el efecto de estos biopreparados sobre la nodulación y el rendimiento del garbanzo.
MATERIALES Y MÉTODOS
CULTIVO BACTERIANO. INDUCCIÓN CON DAIDZEÍNA
Se utilizó una cepa de M. cicerii, procedente del cepario del laboratorio de Rizobacterias, del INCA, conocida por su simbiosis con el garbanzo (11). A partir de ella se produjo un preinóculo en 50 mL de medio Extracto de Levadura Manitol, a pH 6,8; con el cual se inocularon 600 mL del mismo medio y otros 600 mL de este medio, al cual se le adicionó daidzeína (Sigma) a una concentración final de 5 µM (micromolar). Los inóculos se obtuvieron después de mantener los frascos a 150 rpm durante 56 h en un agitador orbital, a 28 ± 2 ºC de temperatura.
Para cada caso se repitió tres veces el procedimiento, con lo cual se contó con tres muestras de cada tratamiento (sin inducir e inducido con daidzeína).
EXTRACCIÓN DE FRACCIÓN LIPÍDICA
Teniendo en cuenta que la mayoría de las señales reconocidas por su actividad biológica en la interacción Rhizobium-leguminosas son de naturaleza lipídica, se realizó una extracción selectiva de estas moléculas del inóculo tratado con la daidzeína (Inducido) o no (Control), utilizando un solvente de alta especificidad para este tipo de componentes. Para ello se utilizaron 180 mL de n-butanol en cada muestra. Se agitaron en zaranda orbital a 150 rpm durante 15 min y se mantuvieron toda la noche en reposo y oscuridad a temperatura ambiente de 25 ± 2 ºC. Se extrajo la fase orgánica en cada muestra, se centrifugó a 12000 g, 10 ºC, 10 min. Todas las muestras se concentraron por rotoevaporación a 50-80 ºC hasta obtener 2 mL de cada una de ellas, éstas se utilizaron para la detección de señales producidas por la bacteria.
DETECCIÓN DE SEÑALES. CARACTERIZACIÓN ESTRUCTURAL DE COMPONENTES MAYORITARIOS EN LA FRACCIÓN LIPÍDICA
Análisis por cromatografía líquida de alta resolución, fase inversa (HPLC-C18, del inglés High Performance Liquid Chromatography)
Con el objetivo de evaluar la presencia de factores de nodulación entre los metabolitos, 10 µL de todos los extractos lipídicos fueron analizadas por HPLC, utilizando una columna de fase inversa Waters Symmetry C-18 (46 x 250 mm) de 5 µ de tamaño de partículas, instalada en un sistema HPLC Waters Alliance. La velocidad del flujo fue de 1 mL min-1 y como solventes se utilizaron agua (A) y acetonitrilo (B) con un gradiente: 0-10 min 18 % B, 10-30 min 60 % B, 30-35 min 95 % B, 35-45 min 18 % B. Se utilizó un detector espectrofotométrico UV-Waters a una longitud de onda de 214 nm.
Análisis por cromatografía gaseosa acoplada a un espectrómetro de masas (GC-MS, del inglés Gas Chromatography - Mass Spectrometry)
Los derivados volátiles de los ácidos grasos fueron preparados por sililación, utilizando como reactivo el BSTFA (N, O-Bis (trimetilsilil) trifluoroacetamida) en combinación con trimetil clorosilano (TMCS) (Kit BSTFA+TMCS, Supelco). Para el análisis por GC-MS se utilizó un cromatógrafo de gases acoplado a un espectrómetro de masas marca Shimadzu GC-MS QP-2010; sistema equipado con autoinyector AOC-20i, automuestreador AOC-20s y un sistema de inserción directa controlado por el software ´ GC-MS solution´. Se empleó una columna Optima 5 MS (30 m × 0,25 mm DI, 0,25 µm espesor de película). Las condiciones de los análisis cromatográficos fueron: temperatura del inyector 310 °C, temperatura del horno 100 °C durante seis minutos. Posteriormente, se incrementó a 320 °C a razón de 20 °C min-1 y manteniéndose durante 5 minutos. El volumen de inyección fue de 1 µL y el flujo en la columna de 0,75 mL min-1, utilizando helio como gas de arrastre.
EFECTO SOBRE LA NODULACIÓN DE PLANTAS DE GARBANZO, EN CONDICIONES CONTROLADAS
A partir de los biopreparados obtenidos se inocularon 4 mL por cada 1000 g de semillas. Las plantas fueron cultivadas en cámara de crecimiento con un fotoperíodo de 16/8 horas de luz/oscuridad a 28 °C y con 60 % de humedad relativa, durante 35 días. El riego fue realizado por capilaridad con agua desionizada, manteniendo el régimen hídrico en aproximadamente el 90 % de la capacidad de campo. Se utilizaron nueve plantas por tratamiento para evaluar número y masa seca de nódulos (mg) por planta.
EFECTO SOBRE EL RENDIMIENTO DE LAS PLANTAS, EN CONDICIONES DE CAMPO
El ensayo se realizó en la localidad de Ferré, Argentina, durante la campaña del 2015, empleando la variedad de garbanzo Chañarito. Las semillas se inocularon a razón de 4 mL por cada 1000 g de semillas y se usó el sistema de siembra directa. En el momento de la cosecha se determinó el rendimiento (kg ha-1).
DISEÑO Y PROCESAMIENTO ESTADÍSTICO
El experimento en cámara de crecimiento fue repetido tres veces, los datos del número de nódulos totales fueron transformados según √x. Se utilizó un Diseño Completamente Aleatorizado y los datos se sometieron a la prueba de normalidad y homogeneidad de varianza. El ensayo en campo siguió un diseño de bloques al azar, con una densidad de siembra de 25 semillas m-1. En ambos casos los datos fueron analizados según Tukey para p≤0,05.
RESULTADOS Y DISCUSIÓN
Detección de señales. Caracterización estructural de componentes mayoritarios en la fracción lipídica
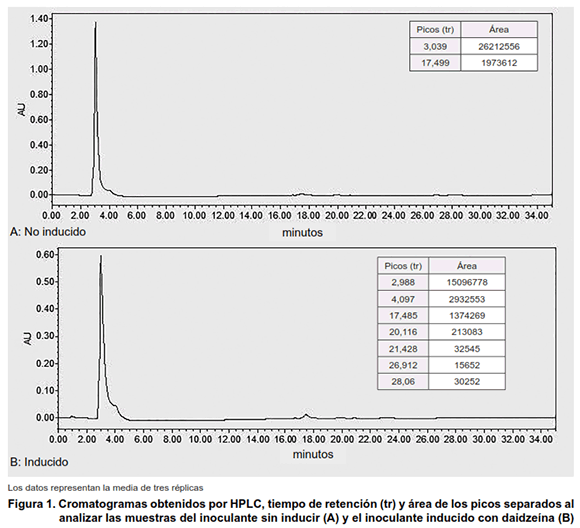
El análisis de la composición de los extractos en n-butanol, correspondiente a tres réplicas biológicas independientes para cada tratamiento, realizado por HPLC y GC-MS se muestra en las Figuras 1 y 2, respectivamente.
El perfil cromatográfico característico de la media de los tratamientos control y la media de los extractos inducidos con daidzeína, así como el área promedio para cada pico se representa en la Figura 1 (A y B).
Se evidencia una diferencia entre los tratamientos sin inducir e inducido en el número y área (concentración) de los picos, siendo superior cuando se induce el biopreparado con la daidzeína.
Teniendo en cuenta que no se dispone de estándares comerciales de factores de nodulación, es difícil afirmar con seguridad que estos picos se corresponden a dichas estructuras. No obstante, este análisis constituye una evidencia incuestionable sobre la diferencia marcada en el perfil de metabolitos producidos por la bacteria en presencia de la daidzeína.
Al analizar las muestras mediante cromatografía gaseosa acoplada a un espectrómetro de masas (Figura 2), se identificaron cuatro picos diferentes correspondientes a ácidos grasos de alto peso molecular (ácido palmítico, ácido eicosenoico, Cis-ácido eicosenoico y ácido oleico). El ácido oleico sólo se presentó en la muestra inducida.
Los resultados muestran en todos los casos un incremento en el área de estos picos con el tratamiento inducido (Figura 2C). Esto significa que la daidzeína promueve en la bacteria no solamente la producción de factores de nodulación, sino además de otros componentes de naturaleza lipídica como los ácidos grasos.
Los ácidos grasos de alto peso molecular son componentes estructurales de los lipoquitooligosacáridos asociados a la nodulación. Los factores Nod consisten en un esqueleto de 3-5 moléculas de N-acetil-glucosamina, que en el grupo amino del extremo no reducido se encuentra acilado con un ácido graso de 16-20 átomos de C de largo (C16-C20) (12). Otros autores han encontrado igualmente un incremento de estos ácidos grasos en factores Nod producidos por cepas simbiontes de frijol ante la presencia de inductores de los genes nod y en condiciones de estrés abiótico (13).
La función biológica de los factores de nodulación está bien documentada. Sin embargo, se desconoce una posible función de los ácidos grasos en el proceso de nodulación. No obstante, se ha descrito que los ácidos grasos de alto peso molecular exhiben actividad antimicrobiana en ensayos ´in vitro´, por lo que pudieran actuar como moléculas defensivas, ante la presencia de patógenos en el suelo (14). Estas estructuras de ácidos grasos son además componentes de las membranas celulares de las plantas y se ha demostrado su acumulación en las raíces de plantas de soya colonizadas por Bradyrhizobium japonicum (15). Algunos ácidos grasos de alto peso molecular son precursores de la síntesis del ácido jasmónico, el cual es fundamental en las respuestas de la planta ante los estreses bióticos y abióticos (16). Curiosamente, la incubación de B. japonicum con jasmonato o su derivado metilado, induce la expresión de genes nod, y consiguientemente aumenta la nodulación y la fijación del nitrógeno (17).
Mediante los métodos utilizados para caracterizar los compuestos lipídicos y detectar la presencia de factores Nod en las muestras de inoculantes, se identificaron estas estructuras en mayor cuantía en el inoculante inducido con daidzeína. Este isoflavonoide induce la transcripción de los genes nod en varias especies de rizobios, lo que se traduce en la producción de factores de nodulación desde la bacteria, que a su vez inducen la formación de los nódulos en la leguminosa (18).
EFECTO SOBRE LA NODULACIÓN EN CONDICIONES CONTROLADAS
Las plantas no inoculadas no formaron nódulos (Figura 3), lo que indica que en el suelo utilizado no existían poblaciones de rizobios o no fueron compatibles con el garbanzo.
Al analizar el efecto de los tratamientos Inducido y no inducido sobre la nodulación, se pudo observar un efecto superior del tratamiento inoculado con el biopreparado inducido sobre el número de nódulos formados y su masa. Estos resultados sugieren que la presencia de mayor cantidad y diversidad de señales en el inoculante inducido (Figuras 1 y 2) estimuló la formación de nódulos sobre las plantas. Se plantea que la percepción de factores Nod activa las vías biosintéticas requeridas para la nodulación (19).
EFECTO SOBRE EL RENDIMIENTO DEL GARBANZO, EN CONDICIONES DE CAMPO
Los resultados en condiciones de campo mostraron un rendimiento superior cuando se utilizó el inoculante inducido, con 833 kg ha-1 de semillas de garbanzo por encima del tratamiento inoculado sin inducir.
El mayor número de nódulos y mayor masa de dichas estructuras (Figura 4) sugiere un mayor número de bacteroides en su interior y por tanto una mayor actividad en la fijación del Nitrógeno, lo que se traduciría en mayores rendimientos del cultivo.
Resultados similares a los obtenidos en esta investigación fueron encontrados en cepas simbiontes de soya y frijol, al ser inducidas en la síntesis y excreción de factores Nod. El análisis de perfiles cromatográficos obtenidos mostraron diferencias positivas en el número de picos y el área de los mismos; resultados que se correspondieron con el número de nódulos y el rendimiento de ambos cultivos (20,21).
La importancia de los Factores Nod en la interacción con las leguminosas, no sólo está relacionada con la nodulación y la eficiencia en la fijación biológica del N en condiciones normales y de estrés abiótico. La similitud de su estructura con los quitooligosacáridos, derivados de la pared celular fúngica y activadores de defensa (22), así como evidencias directas sobre la reducción de enfermedades (23) e indirectas sobre la activación de enzimas de defensa (24), suponen una participación de estas moléculas en determinadas respuestas de inmunidad a la invasión por patógenos.
Los sistemas de producción actuales se basan en el empleo de grandes cantidades de fertilizantes inorgánicos (25,26), lo que representa una amenaza para el medio ambiente. Lograr elevados rendimientos con el uso de menor cantidad de estos productos químicos significa un reto para la agricultura sostenible. La fijación simbiótica del N constituye una alternativa prometedora en este sentido (27). Los intentos por mejorar los valores de fijación en el garbanzo como en otras leguminosas incluyen desde el empleo de cepas más competitivas y eficientes, la búsqueda de variedades hasta el desarrollo de inoculantes y formulaciones más complejas (28,29). En este estudio se ha optado por inducir en el inoculante la síntesis y excreción de metabolitos de especial interés y función en esta interacción.
CONCLUSIONES
El empleo de un inductor exógeno como la daidzeína en la elaboración de inóculos a base de M. cicceri, genera una mayor producción de señales por la bacteria. El uso de este inoculante inducido sobre plantas de garbanzo provoca mayor nodulación y rendimiento del cultivo.
BIBLIOGRAFÍA
1. FAO. FAOSTAT [Internet]. [cited 2018 Apr 2]. Available from: http://www.fao.org/faostat/en/#data/QC
2. Hossain Z, Wang X, Hamel C, Knight JD, Morrison MJ, Gan Y. Biological nitrogen fixation by pulse crops on semiarid Canadian prairies. Canadian journal of plant science. 2016;97(1):119–31.
3. Fatima Z, Aslam M, Bano A. Chickpea nitrogen fixation increases production of subsequent wheat in rainfed system. Pak. J. Bot. 2008;40(1):369–76.
4. Navprabhjot Kaur, Poonam Sharma, Sunita Sharma. Co-inoculation of Mesorhizobium sp. and plant growth promoting rhizobacteria Pseudomonas sp. as bio-enhancer and bio-fertilizer in chickpea (Cicer arietinum L.). Legume Research: An International Journal. 2015;38(3):367–74. doi:10.5958/0976-0571.2015.00099.5
5. Oldroyd GED. Speak, friend and enter: signalling systems that promote beneficial symbiotic associations in plants. Nature Reviews Microbiology. 2013;11(4):252–63. doi:10.1038/nrmicro2990
6. Gourion B, Berrabah F, Ratet P, Stacey G. Rhizobium–legume symbioses: the crucial role of plant immunity. Trends in plant science. 2015;20(3):186–94. doi:10.1016/j.tplants.2014.11.008
7. Hassan S, Mathesius U. The role of flavonoids in root–rhizosphere signalling: opportunities and challenges for improving plant–microbe interactions. Journal of experimental botany. 2012;63(9):3429–44. doi:10.1093/jxb/err430
8. Fauvart M, Michiels J. Rhizobial secreted proteins as determinants of host specificity in the rhizobium–legume symbiosis. FEMS Microbiology Letters. 2008;285(1):1–9. doi:10.1111/j.1574-6968.2008.01254.x
9. Nápoles MC, Guevara E, Montero F, Rossi A, Ferreira A. Role of Bradyrhizobium japonicum induced by genistein on soybean stressed by water deficit. Spanish Journal of Agricultural Research. 2009;7(3):665–71. doi:10.5424/sjar/2009073-451
10. Lodeiro AR. Interrogantes en la tecnología de la inoculación de semillas de soja con Bradyrhizobium spp. Revista Argentina de Microbiología. 2015;47(3):261–73. doi:10.1016/j.ram.2015.06.006
11. Ávila Miramontes JA, Padilla Zaldo G, Martínez Heredia D, Rivas Santoyo FJ, Coronado Espericueta MÁ, Ortega Murrieta P. Respuesta de algunos componentes del rendimiento del cultivo de garbanzo (cicer arietinum l.) a la inoculación de mesorhizobium ciceri, trichoderma harzianum y bacillus subtilis en la región agrícola de la costa de hermosillo. BIOtecnia. 2015;17(3):3. doi:10.18633/bt.v17i3.212
12. Poinsot V, Crook MB, Erdn S, Maillet F, Bascaules A, Ané J-M. New insights into Nod factor biosynthesis: Analyses of chitooligomers and lipo-chitooligomers of Rhizobium sp. IRBG74 mutants. Carbohydrate Research. 2016;434:83–93. doi:10.1016/j.carres.2016.08.001
13. Estévez J, Soria-Díaz ME, Fernández de Córdoba F, Morón B, Manyani H, Gil A, et al. Different and new Nod factors produced by Rhizobium tropici CIAT899 following Na + stress. FEMS Microbiology Letters. 2009;293(2):220–31. doi:10.1111/j.1574-6968.2009.01540.x
14. Kachroo A, Kachroo P. Fatty Acid–Derived Signals in Plant Defense. Annual Review of Phytopathology. 2009;47(1):153–76. doi:10.1146/annurev-phyto-080508-081820
15. Brechenmacher L, Lei Z, Libault M, Findley S, Sugawara M, Sadowsky MJ, et al. Soybean metabolites regulated in root hairs in response to the symbiotic bacterium Bradyrhizobium japonicum. Plant Physiology. 2010;153(4):1808–22. doi:10.1104/pp.110.157800
16. Wasternack C. Jasmonates: An Update on Biosynthesis, Signal Transduction and Action in Plant Stress Response, Growth and Development. Annals of Botany. 2007;100(4):681–97. doi:10.1093/aob/mcm079
17. Mabood F, Smith DL. Pre-incubation of Bradyrhizobium japonicum with jasmonates accelerates nodulation and nitrogen fixation in soybean (Glycine max) at optimal and suboptimal root zone temperatures. Physiologia Plantarum. 2005;125(3):311–23. doi:10.1111/j.1399-3054.2005.00559.x
18. Subramanian S, Smith DA. Proteomics Approach to Study Soybean and Its Symbiont Bradyrhizobium japonicum. A Review. In: Board J, Rinaldi L, editors. A Comprehensive Survey of International Soybean Research - Genetics, Physiology, Agronomy and Nitrogen Relationships [Internet]. InTech; 2013 [cited 2018 Apr 2]. doi:10.5772/45867
19. Morieri G, Martinez EA, Jarynowski A, Driguez H, Morris R, Oldroyd GED, et al. Host-specific Nod-factors associated with Medicago truncatula nodule infection differentially induce calcium influx and calcium spiking in root hairs. New Phytologist. 2013;200(3):656–62. doi:10.1111/nph.12475
20. Nápoles MC, Cabrera JC, Luyten E, Dombrecht B, Vanderleyden J, Hormaza J, et al. Nod factor detection in B. elkanii ICA 8001. Culture medium influence. Cultivos Tropicales. 2014;35(1):92–9.
21. Nápoles MC, Cabrera JC, Onderwater R, Wattiez R, Hernández I,, Martínez L. Señales producidas por Rhizobium leguminosarum en la interacción con frijol común (Phaseolus vulgaris L.). Cultivos Tropicales. 2016;37(2):37–44.
22. Ganesan S, Vadivel K, Jayaraman J, editors. Sustainable crop disease management using natural products. Boston, MA Oxfordshire: CAB International; 2015. 413 p.
23. Duzan HM, Mabood F, Zhou X, Souleimanov A, Smith DL. Nod factor induces soybean resistance to powdery mildew. Plant Physiology and Biochemistry. 2005;43(10):1022–30. doi:10.1016/j.plaphy.2005.08.004
24. Nakagawa T, Kaku H, Shimoda Y, Sugiyama A, Shimamura M, Takanashi K, et al. From defense to symbiosis: limited alterations in the kinase domain of LysM receptor-like kinases are crucial for evolution of legume-Rhizobium symbiosis: Evolution of Nod factor receptors. The Plant Journal. 2011;65(2):169–80. doi:10.1111/j.1365-313X.2010.04411.x
25. Malhi SS, Johnson EN, Hall LM, May WE, Phelps S, Nybo B. Effect of nitrogen fertilizer application on seed yield, N uptake, and seed quality of Camelina sativa. Canadian Journal of Soil Science. 2014;94(1):35–47. doi:10.4141/cjss2012-086
26. Wile A, Burton DL, Sharifi M, Lynch D, Main M, Papadopoulos YA. Effect of nitrogen fertilizer application rate on yield, methane and nitrous oxide emissions from switchgrass (Panicum virgatum L.) and reed canarygrass (Phalaris arundinacea L.). Canadian Journal of Soil Science. 2014;94(2):129–37. doi:10.4141/cjss2013-058
27. Geurts R, Lillo A, Bisseling T. Exploiting an ancient signalling machinery to enjoy a nitrogen fixing symbiosis. Current Opinion in Plant Biology. 2012;15(4):438–43. doi:10.1016/j.pbi.2012.04.004
28. Devi MJ, Sinclair TR, Beebe SE, Rao IM. Comparison of common bean (Phaseolus vulgaris L.) genotypes for nitrogen fixation tolerance to soil drying. Plant and Soil. 2013;364(1–2):29–37. doi:10.1007/s11104-012-1330-4
29. Abd-Alla MH. Nodulation and nitrogen fixation in interspecies grafts of soybean and common bean is controlled by isoflavonoid signal molecules translocated from shoot. Plant Soil Environ. 2011;57:453–8.
Recibido: 04/12/2017
Aceptado: 23/03/2018
María C. Nápoles, Instituto Nacional de Ciencias Agrícolas (INCA), Carretera Tapaste, Km 3½, Gaveta Postal 1. San José de las Lajas, Mayabeque. Cuba. CP 32700. Email: tere@inca.edu.cu