REVISIÓN BIBLIOGRÁFICA
Los oligogalacturónidos en el crecimiento y desarrollo de las plantas
Oligogalacturonides in the growth and development of plants
Danurys Lara Acosta, M.Cs. Daimy Costales Menéndez, Dr.C. Alejandro Falcón Rodríguez
Instituto Nacional de Ciencias Agrícolas (INCA), Carretera Tapaste, Km 3½, Gaveta Postal 1. San José de las Lajas, Mayabeque. Cuba. CP 32700.
RESUMEN
Los oligogalacturónidos consisten en una cadena lineal de moléculas de ácido galacturónico unida por enlaces α-1-4. Estas macromoléculas se localizan en la porción péctica que constituye la pared celular de las plantas y en condiciones naturales se liberan de la pectina mediante la acción de enzimas pécticas de la propia planta o proveniente de los microorganismos que invaden los tejidos vegetales. Ellos pueden regular la síntesis y acción de algunas hormonas, y distintos procesos de organogénesis y crecimiento en las plantas. A partir de una mezcla de estas moléculas se obtuvo un producto denominado comercialmente Pectimorf® que favorece el crecimiento y la formación de raíces, la diferenciación de las células del periciclo, ejerce un efecto inductor sobre los procesos de diferenciación de embriones somáticos e incrementa el rendimiento de varios cultivos. También se ha demostrado que los oligogalacturónidos pueden reducir los efectos provocados por metales pesados y contrarrestar algunos de los efectos negativos del estrés hídrico. Por sus funciones biológicas estas macromoléculas pueden considerarse idóneas para crear nuevos bioestimulantes en beneficio de la agricultura.
Palabras clave: ácido galacturónico, bioestimulantes, estrés, hormonas, organogénesis.
ABSTRACT
Oligogalacturonides consist of a linear chain of galacturonic acid molecules linked by α-1-4. bonds. These macromolecules are located in the pectic portion that constitutes the cell wall of plants and under natural conditions are released from pectin through the action of pectic enzymes from the plant itself or from microorganisms that invade plant tissues.They can regulate the synthesis and action of some hormones, and different processes of organogenesis and growth in plants. From a mixture of these molecules a product commercially called Pectimorf® has been obtained that favors the growth and formation of roots, the differentiation of the cells of the pericycle and it has exerts an inducing effect on the processes of differentiation of somatic embryos, also that it increases the yield of several crops. Oligogalacturonides are proved to reduce heavy metal toxicity and counteract some of the negative effects of water stress. Due to their biological functions, these macromolecules can be considered suitable to create new biostimulants for the benefit of agriculture.
Key words: galacturonic acid, biostimulants, stress, organogenesis, hormones.
INTRODUCCIÓN
La agricultura cumple un papel fundamental en el desarrollo de la economía y en la alimentación de la sociedad. En los últimos años está actividad se ha afectado por las condiciones ambientales desencadenadas como consecuencia de los cambios climáticos. Se prevé que si no se afronta esta problemática de manera adecuada podría dar lugar a consecuencias económicas y sociales desfavorables.
Estas variaciones en el clima pueden conllevar a acelerar la descomposición de la materia orgánica del suelo, afectar la fertilidad de los suelos, propiciar su salinización por aumento del nivel del mar y la proliferación de enfermedades en las plantas. En zonas semiáridas se espera una mayor frecuencia y severidad de sequías y calor excesivo, condiciones que pueden limitar significativamente el crecimiento y rendimiento de los cultivos (1).
Esta situación ha causado preocupación entre los científicos y ha motivado a que muchas de sus investigaciones estén dirigidas a mitigar sus efectos mediante el descubrimiento de nuevos productos para mejorar el desarrollo vegetal y potenciar la agricultura. Dentro de estos productos se encuentran las oligosacarinas.
Estas moléculas se generan por hidrólisis enzimática de la pared celular de plantas y hongos que en concentraciones bajas tiene actividad biológica; y están involucradas en varios procesos de desarrollo en las plantas (2).
Son consideradas bioestimulantes por ser moléculas bioactivas cuya función es mejorar las propiedades físico-químicas de las plantas, los rendimientos y la calidad de los cultivos. Al no ser tóxicas para el hombre ni el medio ambiente se proponen como una alternativa al uso de agroquímicos (3).
Las oligosacarinas se clasifican de tipo endógeno o exógeno, de acuerdo a si son obtenidas o liberadas de las paredes celulares de la planta o del patógeno. Entre las endógenas las más conocidas son los oligogalacturónidos y los xiloglucanos. Entre las exógenas se conocen los oligoglucanos, oligoquitinas, poli y oligoquitosanas y lipo-oligosacáridos de quitina (4,5).
Los oligogalacturónidos (OGAs, de sus siglas en inglés) son una de las oligosacarinas más estudiadas. Estos oligosacáridos son liberados de los polisacáridos pécticos que componen la pared celular durante la degradación de estas estructuras por las enzimas pécticas de la propia planta o proveniente de los microorganismos que invaden los tejidos vegetales (5).
En el presente trabajo se exponen las características químicas de los oligogalacturónidos, que los hacen funcionales desde el punto de vista biológico, su papel en el crecimiento y desarrollo de las plantas, y sus potencialidades para atenuar el estrés. Propiedades que permiten considerarlos candidatos idóneos para formar parte de nuevos bioestimulantes agrícolas.
Características estructurales de los oligogalacturónidos
Los OGAs son oligosacáridos lineales de unidades de ácido D-galacturónico unidos por enlaces del tipo α (1–4) (6,7). El anillo piranósido del ácido D-galacturónico aparece en la conformación de silla 4C1 correspondiente a su forma más estable (6,8,9). Los enlaces glicosídicos en los C-1 y C-4 están además en la posición axial-axial y el número de residuos de D-galacturonatos que contiene el oligosacárido define su grado de polimerización (10).
Estas moléculas pueden presentarse en los tejidos vegetales en forma insaturada con un doble enlace entre los C-4 y C-5 del residuo terminal o en forma de OGAs C-1 oxidados, en los que el residuo del extremo reductor es un ácido galactárico. Es frecuente que los residuos de ácido galacturónico se encuentren metilados determinando un mayor o menor grado de esterificación en la pectina. Las características más importantes a considerar en la macromolécula son el grado de esterificación, grado de polimerización, la masa molecular, el contenido y lugar de unión de los azúcares neutros y la distribución de los sustituyentes no urónicos (6,9).
El grado de polimerización de estas moléculas es el factor estructural de mayor significación en la definición de su función biológica (2,6). Los fragmentos pécticos con grado de polimerización mayor de 16 presentan actividad biológica, pero tienen poca movilidad en el apoplasto, esto le confiere menor importancia como moléculas señalizadoras debido a que es posible que la misma pared celular actúe como una barrera para la interacción de estos macrofragmentos con la membrana citoplasmática (11). Se conoce, además, que la actividad de los OGAs disminuye cuando los grupos carboxilos (–COOH) están esterificados o reducidos y cuando el extremo reductor del oligosacárido se reduce a alditol (9).
Los OGAs pueden obtenerse por hidrólisis ácida o enzimática de la pared celular vegetal o del ácido poligalacturónico. El ácido poligalacturónico se obtiene por desmetoxilaciónbásica o enzimática de la pectina (12,13). Las materias primas más abundantes para la producción de pectinas son los residuos de la producción de jugos de manzana y la extracción de jugos de cítricos (14).
Actividad auxínica/antiauxínica de los OGAs
Los OGAs son considerados actualmente como biorreguladores endógenos en el desarrollo de las plantas, pues pueden regular la síntesis y acción de las hormonas y distintos procesos de organogénesis y crecimiento; de manera directa regulan muchos de los procesos fisiológicos que intervienen en la formación de órganos en las plantas (15,16). Están involucrados en el crecimiento y la formación de raíces laterales, la formación de raíces adventicias y la diferenciación de las células del periciclo (17), además de que ejercen un efecto inductor sobre los procesos de diferenciación de embriones somáticos (18). Sin embargo, varios autores plantean que se comportan como antagonistas de la actividad auxínica (15,19,20). La primera evidencia de este antagonismo entre auxina y OGAs se mostró en segmentos de tallos de guisantes en los que el crecimiento inducido por auxina era competitivamente inhibido por elicitores de OGAs (21).
En estudios realizados en plantas de tabaco (Nicotiana tabacum) y Arabidopsis (Arabidopsis thaliana) los OGAs inhibieron la inducción de la formación de las raíces por auxina y la formación de flores de explantes que normalmente no forman órganos. Además de que impidieron la estimulación por auxina de la actividad mitótica que conduce a la formación de estomas (15). Los resultados en tabaco indicaron que los OGAs inhiben la inducción de genes sensibles a auxina (Nt114, rolB y rolD) e interfieren en la activación de promotores regulados por auxina (17). En Arabidopsis inhiben la inducción por auxina de la transcripción de varios genes (IAA-5, SAUR-16) (15,21) y la activación del promotor síntetico de respuesta a auxina (15).
Se plantea que el antagonismo entre estas moléculas no implica el silenciamiento de los genes que codifican para los receptores de auxina (TIR1 / AFB, T1R1, AFBs), ni requiere la actividad de un microRNA, ni el silenciamiento postrancripcional de genes (15), sino que ocurre cuando los genes reguladores de auxina son inducidos por la traducción del inhibidor Cicloheximida, sugiriendo que los OGAs podrían actuar en sitios posteriores a los represores Aux/IAA, posiblemente a nivel de las regiones promotoras de genes que responden a auxina (19). Además, se conoce que la inhibición de las respuestas a auxina por OGAs no requiere etileno, ácido jasmónico, ni ácido salicílico y es independiente de la producción de especies reactivas del oxígeno (15).
Contrariamente, existen varios estudios que demuestran que la mezcla de oligogalacturónidos denominada comercialmente como Pectimorf® desarrollada por el grupo de productos bioactivos del Instituto Nacional de Ciencias Agrícolas tiene un efecto auxínico en plantas (22–26). Este producto está constituido por una mezcla de OGAs con diferentes grados de polimerización de moléculas de ácido galacturónico, que se produce por la degradación enzimática de la pectina presente en la pared celular de la corteza de los cítricos. Es un estimulante del enraizamiento, crecimiento y diferenciación celular de diferentes especies vegetales; puede activar mecanismos de defensa y disminuir o atenuar el estrés ambiental en las plantas (2,5,9,27–29). Este producto es muy efectivo en todas las fases del cultivo desde semillero hasta la producción y en diferentes modelos vegetales (30) como veremos a continuación.
OGAs en el cultivo in vitro
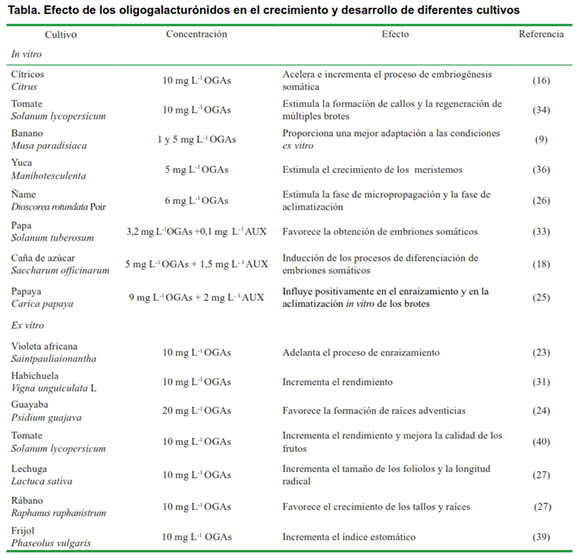
En el cultivo in vitro, el Pectimorf® ha sido ampliamente estudiado, demostrándose su capacidad como sustituto de hormonas tradicionales, auxinas y citoquininas (26,31), en diferentes estadios y en diversos cultivos como la caña de azúcar (Saccharum officinarum) (18), el café (Coffea) (32), los cítricos (Citrus) (16), la papa (Solanum tuberosum) (33), el tomate (Solanum lycopersicum) (34), el tabaco (35), el banano (Musa paradisiaca) (9), la yuca (Manihotesculenta) (36),entre otros (Tabla).
Se plantea que en el cultivo in vitro los OGAs pueden ejercer un efecto auxínico o citoquinínico en dependencia del balance hormonal en el medio de cultivo, además de que estimulan la síntesis de proteínas en células y actúan en la desagregación celular durante la obtención de suspensiones celulares aumentando la eficiencia del proceso (30,37).
En el cultivo de ápices de plantas in vitro de yuca (Manihotesculenta Crantz), clones `CMC-40´ y `Señorita´ en el que emplearon diferentes concentraciones de Pectimorf® como sustituto y complemento de los reguladores del crecimiento ANA (ácido naftalenacético) y 6-BAP (6- bencilaminopurina). El clon `CMC- 40´con 5 mg L-1 de Pectimorf® en sustitución de ANA, mostró el mayor valor de altura (2,88 cm), sin diferencias significativas con el control (ANA y BAP), y los tratamientos donde añadieron el Pectimorf® a 5 y 10 mg L-1 respectivamente, en presencia de ANA y en sustitución del BAP. Los resultados indicaron que el bioproducto logró compensar el efecto de la auxina (ANA) en ausencia de esta en el medio; sin embargo, no se produjo un efecto antagónico marcado cuando estuvo presente (36).
Este efecto auxínico-citoquinínico también se comprobó en el cultivo in vitro del ñame (Dioscorea rotundata Poir) clon ‘Blanco de guinea’ donde evaluaron diferentes concentraciones de Pectimorf® . A partir de evaluaciones morfoagrónomicas (longitud del vástago, longitud de la raíz de mayor tamaño, número de hojas, número de nudos de novo y número de raíces) determinaron que las concentraciones de 6, 9 y 12 mg L-1 provocan un incremento significativo sobre el desarrollo vegetativo de las plantas evidenciándose el efecto auxínico del producto. Sin embargo, en concentraciones menores y mayores que estas el producto tuvo un efecto citoquinínico (26).
En el desarrollo in vitro de la embriogénesis somática de Citrus macrophylla Wester donde el medio se suplementó con Pectimorf® los primeros embriones se formaron a las cinco semanas, mientras que en los medios que no contenían la mezcla de OGAs estas estructuras se observaron entre las seis y siete semanas de cultivo. Se conoce que para favorecer la formación de embriones somáticos se requiere la aplicación exógena de auxinas al medio de cultivo, sin embargo, los porcentajes obtenidos en esta investigación estuvieron por encima del 50 % en cuanto a la formación de embriones, sin añadir auxina (16).
El Pectimorf® también influye positivamente en el enraizamiento y aclimatización de plantas de papaya (Carica papaya). La concentración de 9 mg L-1 de Pectimorf®combinado con 2 mg L-1 de auxina (AIB) garantizó una mayor área foliar, masa fresca, mayor valor en el número de raíces, una elevada tasa fotosintética y conductancia estomática, un alto porcentaje de enraizamiento (84,2 %) y un menor porcentaje de estomas abiertos con respecto al control sin Pectimorf® (25).
Según estudios con OGAs en Arabidopsis thaliana y en la línea celular BY-2 de tabaco la elongación de la raíz ocurre a través de un incremento de la división celular en los meristemos de las raíces apicales junto con un efecto positivo en la elongación celular. Hay autores que plantean que los OGAs inducen el acortamiento del ciclo celular en la raíz primaria como consecuencia del acortamiento o eliminación de la fase G1, mientras las otras fases permanecen relativamente constantes, aunque no pueden asegurar que la fase G1 se elimine totalmente de la célula (38).
Estos resultados le confieren una gran importancia a esta mezcla de OGAs en el desarrollo del cultivo in vitro, a pesar de que los mecanismos que explican la estimulación de los OGAs en la división celular en las plantas superiores aún son desconocidos.
OGAs en el cultivo ex vitro
En los últimos años las investigaciones con este producto en el cultivo ex vitro han estado encaminadas a determinar la mejor concentración y forma de aplicación a la cual las plantas muestran una mayor respuesta fisiológica y bioquímica dirigida a mejorar el desarrollo, además de aumentar el rendimiento y la calidad del cultivo (Tabla).
Se ha demostrado que el Pectimorf® tiene un efecto positivo en la activación del crecimiento tanto de plantas ornamentales como la areca (Areca catechu), el anturium (Anthurium) y las orquídeas (Orchidaceae), como de plantas comestibles, principalmente las leguminosas y las solanáceas.Según estudios, el crecimiento de las plantas ornamentales se favorece mediante la aspersión foliar en diferentes concentraciones y momentos de aplicación (5).
En leguminosas esta mezcla de OGAs también incrementa el desarrollo foliar y el rendimiento principalmente en el cultivo del frijol (Phaseolus vulgaris) y en la soya (Glycine max) (31). A este desarrollo foliar contribuye la formación de raíces desde estadios tempranos del cultivo con la posibilidad de garantizar un suministro eficiente de agua y sales minerales y, por tanto, un mayor éxito en el desarrollo de la planta.
El efecto enraizador de los OGAs también se pone de manifiesto en pecíolos de violeta africana (Saintpauliaionantha), donde se utilizaron dos concentraciones (10 y 20 mg L-1), siendo capaz este producto de estimular la emisión de raíces, su longitud, así como logró adelantar en una semana la aparición de ellas (23). También provocó este mismo efecto en plántulas de pepino (Cucumis sativus) en combinación con auxinas (17); en esquejes de guayaba (Psidium guajava) var. Enana Roja Cubana a concentraciones de 20 mg L-1 (24) y en plantas ornamentales (25).
Investigaciones en plantas de frijol asperjadas con 10 mg L-1 de Pectimorf® al iniciarse la segunda etapa de la fase vegetativa de cultivo, revelaron que esta mezcla de OGAs provoca un incremento en el índice estomático sin alterar la estructura de las células epidérmicas en ambas superficies foliares; ni modificar el tamaño de las células estomáticas. En la superficie abaxial las células oclusivas se mostraron más estrechas y cortas, lo que evidenció que las hojas de mayor índice estomático presentaron estomas más pequeños. Estas modificaciones en los patrones de distribución y morfogénesis estomática pudiera favorecer el crecimiento adecuado de las plantas de frijol en ambientes desfavorables (39).
Los OGAs también están involucrados en el proceso de maduración de los frutos (19) además, pueden mejorar su calidad. En plantas de tomate tratadas con esta mezcla de OGAs se obtuvieron resultados en los que se incrementó el rendimiento del fruto por planta en un 40 %, mejoró en un 0,04 % la ácidez titulable, los sólidos totales en un 13 %; así como la firmeza del fruto en un 27 % con respecto al control (40).También en estudios realizados en plantas de fresa silvestre tratadas con OGAs se obtuvieron frutos maduros con un incremento de tamaño (17).
En uva de mesa, variedades Flame Seedless y Red Globe, la aplicación de OGAs de 3-20 GP provocó un aumento en su coloración, lo que constituye un indicador de calidad. Una posible explicaciónes que los OGAs aumentan el nivel de etileno en frutosy a su vez sobrerregulan genes relacionados con la síntesis de antocianinas como chalcona sintasa, flavonona 3-hidroxilasa y UDP glucosa flavonoide-3-glucosiltransferasa (41,42), leucoantocianidina dioxigenasa, así como lignina (42). La aplicación de OGAs incrementaron la capacidad antioxidante de las uvas por la acumulación de compuestos fenólicos (41). La mejora de color y el incremento en el contenido de antocianinas puede ser resultado de la acción inductora que ejercen los OGAs sobre la síntesis del ARNm de la Fenilalanina amonio liasa (PAL) (42).
En hortalizas como la lechuga (Lactuca sativa) y el rábano (Raphanus raphanistrum subsp. sativus) los OGAs provocan cambios morfológicos. En el caso de la lechuga incrementan el tamaño de los foliolos y en plantas de rábano favorece el crecimiento de los tallos, las raíces y de los rábanos (27). En la habichuela (Vigna unguiculata L.) var. Lina logró incrementar su rendimiento a 4,7 kg m2 a partir de la combinación de dos formas de aplicación, imbibición de semillas+aplicación foliar a una concentración de 10 mg L-1 al inicio de la floración (31).
Hay autores que plantean que una posible vía por la cual los OGAs incrementan el crecimiento de las plantas es porque estas moléculas pueden estimular la actividad fotosintética; lo que provoca una mayor ganancia de esqueletos carbonados que pueden ser utilizados para la síntesis de nuevos compuestos, como son las proteínas (43).
A partir del análisis de los resultados obtenidos en hortalizas, frutales y plantas ornamentales se puede plantear que esta mezcla de OGAs promueve el proceso de crecimiento y desarrollo de distintos órganos en las plantas y los procesos fisiológicos a concentraciones entre 5 y 20 mg L-1 en el tratamiento de semillas, esquejes y mediante aspersión foliar y la combinación de estas formas de aplicación; aunque varios autores le atribuyen como efecto principal su poder enraizador (23,24,27,44).
Oligogalacturónidos como atenuantes del estrés abiótico
El estrés provocado en las plantas por déficit hídrico inhibe la fotosíntesis, causa cambios en el contenido de clorofila y daña el aparato fotosintético. En estas condiciones el peso seco y fresco de las plantas disminuyen y el contenido de prolina, carbohidratos y proteínas aumentan como mecanismos de supervivencia adoptado por la propia planta (45).
La propiedad de los OGAs de estimular el crecimiento del sistema radical, le permite a la planta una mejor exploración y actividad radical, traducida en una mayor capacidad de absorción de agua y nutrientes, por lo que representa una opción adecuada para enfrentar problemas de estrés hídrico (30).
Se conoce además que el efecto gelificante de los OGAs permite la absorción del agua del medio, aunque esta sea escasa, facilitando que tengan lugar los procesos involucrados en la germinación y emergencia de las semillas. Estas moléculas son capaces de desencadenar en las células vegetales una serie de estímulos que propician acelerar el metabolismo y mayor actividad enzimática, dependiendo de la especie vegetal, las concentraciones empleadas y el grado de polimerización (30).
En un estudio realizado en plantas de albahaca (Ocimum basilicum) en fase de germinación, emergencia y crecimiento inicial sometidas a estrés hídrico, a las que se les aplicó Pectimorf® a una concentración de 10 mg L-1, se obtuvo un incremento tanto en la tasa como en el porcentaje de germinación. Las plantas estresadas tratadas con la mezcla de OGAs presentaron una mayor concentración de carbohidratos reductores foliares, contenido de proteínas y prolina en hojas y raíz, que las plantas sometidas a estrés que no fueron tratadas (30).
Este resultado se relaciona con el aumento de la fotosíntesis y con la estimulación directa que tienen los OGAs en el metabolismo celular, producto de su participación en la síntesis de moléculas precursoras de agentes antioxidantes, capaces de contrarrestar algunos de los efectos negativos del estrés hídrico (30).
Los OGAs también han sido estudiados con el objetivo de reducir los efectos negativos provocados por metales pesados (13). Como consecuencia de la presencia de estos iones en el suelo las raíces de las plantas se acortan y engrosan, debido a que los iones metálicos actúan directamente sobre el metabolismo, interfiriendo en la transferencia de iones a través de las membranas celulares, lo cual afecta la absorción de agua y nutrientes del suelo por la planta (46). A partir de estudios, se comprobó que al aplicar una dosis de 60 kg ha-1 de Pectimorf® a un suelo con altos niveles de Cu2+ cultivado con plantas de tomate del cultivar Amalia, se estimula el alargamiento de la raíz principal y se logran niveles de extracción de iones Cu2+ de 25, 47 mg kg-1 (47).
Ellos poseen buenas propiedades como absorbentes de iones cobre en solución acuosa debido a que forman complejos estables en un intervalo de pH de 3-7, aunque los complejos metálicos obtenidos son menos estables térmicamente que la mezcla de OGAs de partida (13). Esta característica le confiere gran importancia en los procesos de fitoextracción.
CONCLUSIONES
Los OGAs constituyen una alternativa ecológica y económicamente viable para incrementar el rendimiento de los cultivos. Su capacidad como atenuantes del estrés abiótico permite potenciar la agricultura en condiciones desfavorables. A pesar de que en los últimos años han aumentado las investigaciones con Pectimorf®y que se han obtenido muy buenos resultados morfoagrómicos, no se conocen los mecanismos bioquímicos y moleculares por los cuales este producto ejerce su acción. Por lo que sería válido realizar estudios dirigidos a determinar que indicadores del metabolismo del carbono y el nitrógeno se estimulan con su aplicación. Por otro lado, la capacidad que tienen los OGAs de tener actividad biológica a bajas concentraciones y sustituir algunas hormonas tradicionales son elementos a considerar para crear nuevos bioestimulantes en beneficio de la agricultura.
BIBLIOGRAFÍA
1. Vergara W, Rios AR, Trapido P, Malarín H. Agricultura y Clima Futuro en América Latina y el Caribe: Impactos sistémicos y posibles respuestas. División de Cambio Climático y Sostenibilidad. 2014.
2. Cabrera JC, González G, Nápoles MC, Falcón AB, Costales D, Rogers HJ. Practical Use of Oligosaccharins in Agriculture. Acta Horticulturae. 2013;1009:195–212.
3. Calvo P, Nelson L, Kloepper JW. Agricultural uses of plant biostimulants. Plant and Soil. 2014;383(1–2):3–41. doi:10.1007/s11104-014-2131-8
4. Nápoles MC, Gómez G, Costales D. Factores de nodulación. experiencia en cuba. Cultivos Tropicales. 2007;28(4):71–80.
5. Falcón AB, Costales D, González-Peña D, Nápoles MC. Nuevos productos naturales para la agricultura: las oligosacarinas. Cultivos Tropicales. 2015;36:111–29.
6. Ridley BL, O’Neill MA, Mohnen D. Pectins: structure, biosynthesis, and oligogalacturonide-related signaling. Phytochemistry. 2001;57(6):929–67. doi:10.1016/S0031-9422(01)00113-3
7. Castañeda BI. Inducción de antocianinas y capacidad antioxidante por oligogalacturónidos en uvas de mesa cv. ‘FlameSeedless [Tesis de Maestría]. 2010. 38–40 p.
8. Cabrera JC. Obtención de una mezcla de (1-4) α-D oligogalacturónidos bioactivos a partir de un grupo de subproductos de la industria citrícola [Tesis de Doctorado]. [La Habana ,Cuba]: Instituto Nacional de Ciencias Agrícola; 2000. 99 p.
9. Izquierdo OH. Los oligogalacturónidos de origen péctico y su acción en las plantas. Temas de Ciencia y Tecnología de México. 2009;13(39):31–40.
10. Mederos Torres Y, Reynaldo IM, Hormaza J. Características metrológicas en la determinación de azúcares reductores para el control de la calidad en mezclas de oligogalacturónidos. Cultivos Tropicales. 2014;35(2):86–9.
11. Frirdich E, Bouwman C, Vinogradov E, Whitfield C. The Role of Galacturonic Acid in Outer Membrane Stability in Klebsiella pneumoniae. Journal of Biological Chemistry. 2005;280(30):27604–12. doi:10.1074/jbc.M504987200
12. Mederos-Torres Y, Hormaza-Montenegro J, Reynaldo-Escobar I, Montesino-Sequi R. Caracterización de mezclas de oligogalacturónidos bioactivos. Revista CENIC. Ciencias Químicas. 2011;42(2–3):1–5.
13. Cartaya O, Moreno AM, Guridi F, Cabrera A. Estudio de los complejos oligogalacturónidos–Cu (II) en solución y fase sólida. Revista Iberoamericana de polímeros. 2017;18(1):38–46.
14. Singthong J, Ningsanond S, Cui SW, Douglas Goff H. Extraction and physicochemical characterization of Krueo Ma Noy pectin. Food Hydrocolloids. 2005;19(5):793–801. doi:10.1016/j.foodhyd.2004.09.007
15. Savatin DV, Ferrari S, Sicilia F, De Lorenzo G. Oligogalacturonide-auxin antagonism does not require posttranscriptional gene silencing or stabilization of auxin response repressors in Arabidopsis. Plant physiology. 2011;157(3):1163–74. doi:10.1104/pp.111.184663
16. Bao L, Hernández RM, Diosdado E, Román MI, González C, Rojas A, et al. Embriogénesis somática de Citrus macrophylla Wester con el empleo del Pectimorf® y análogos de brasinoesteroides. Revista Colombiana de Biotecnología. 2013;15(1):189–94.
17. Vallarino JG, Osorio S. Signaling role of oligogalacturonides derived during cell wall degradation. Plant Signaling & Behavior. 2012;7(11):1447–9. doi:10.4161/psb.21779
18. Nieves N, Poblete A, Cid M, Lezcano Y, González-Olmedo JL, Cabrera JC. Evaluacion del Pectimorf como complemento del 2, 4-D en el proceso de la embriogenesis somatica de caña de azúcar (Saccharum spp). Cultivos Tropicales. 2006;27(1):25–30.
19. Ferrari S, Savatin DV, Sicilia F, Gramegna G, Cervone F, De Lorenzo D. Oligogalacturonides: plant damage-associated molecular patterns and regulators of growth and development. Plant Physiology [Internet]. 2013 [cited 2018 Apr 3];49(4). doi:10.3389/fpls.2013.00049
20. Mattei B, Spinelli F, Pontiggia D, De Lorenzo G. Comprehensive Analysis of the Membrane Phosphoproteome Regulated by Oligogalacturonides in Arabidopsis thaliana. Frontiers in Plant Science. 2016;7:1107. doi:10.3389/fpls.2016.01107
21. Branca C, Lorenzo G, Cervone F. Competitive inhibition of the auxin-induced elongation by α -D-oligogalacturonides in pea stem segments. Physiologia Plantarum. 1988;72(3):499–504. doi:10.1111/j.1399-3054.1988.tb09157.x
22. Suárez L. Efectos del Pectimorf® en la propagación in vitro de la yuca (Manihot esculenta C.), clones CMC-40 y Señorita [Tesis de Doctorado]. [Mayabeque , Cuba]: Instituto Nacional de Ciencias Agrícolas; 2016. 50–54 p.
23. Falcón AB, Cabrera JC. Actividad enraizadora de una mezcla de oligogalacturónidos en pecíolos de violeta africana (Saintpaulia ionantha). Cultivos Tropicales. 2007;28(2):87–90.
24. Ramos Hernández L, Arozarena Daza NJ, Lescaille Acosta J, García Cisneros F, Tamayo Aguilar Y, Castañeda Hidalgo E, et al. Dosis de Pectimorf® para enraizamiento de esquejes de guayaba var. Enana Roja Cubana. Revista Mexicana de Ciencias Agrícolas [Internet]. 2013 [cited 2018 Apr 3];(6). Available from: http://www.redalyc.org/resumen.oa?id=263128353002
25. Posada-Pérez L, Padrón-Montesinos Y, González-Olmedo J, Rodríguez-Sánchez R, Barbón-Rodriguez R, Norman-Montenegro O, et al. Efecto del Pectimorf® en el enraizamiento y la aclimatización in vitro de brotes de papaya (Carica papaya L.) cultivar Maradol Roja. Cultivos Tropicales. 2016;37(3):50–9. doi:10.13140/RG.2.1.1642.2642
26. Borges-García M, González-Paneque O, Reyes-Avalos DM, Rodríguez-González M, Villavicencio-Ramírez A, Abeal EE-. Respuesta de plantas in vitro de ñame clon Blanco de guinea al uso del Pectimorf®. Cultivos Tropicales. 2017;38(2):129–36.
27. Alvarez Bello I, Reynaldo Escobar I, Cartaya Rubio O, Teheran Z. Efectos de una mezcla de oligogalacturónidos en la morfología de hortalizas de importancia económica. Cultivos Tropicales. 2011;32(3):69–74.
28. Terry Alfonso E, Ruiz Padrón J, Tejeda Peraza T, Reynaldo Escobar I. Efectividad agrobiológica del producto bioactivo Pectimorf® en el cultivo del Rábano (Raphanus sativus L.). Cultivos Tropicales. 2014;35(2):105–11.
29. Terry-Alfonso E, Ruiz-Padrón J, Tejeda-Peraza T, Reynaldo-Escobar I, Carrillo-Sosa Y, Morales-Morales HA. Interacción de bioproductos como alternativas para la producción horticultura cubana. Tecnociencia Chihuahua. 2014;8(3):163–74.
30. Ojeda CM. Efecto de un producto bioactivo compuesto por oligogalacturónidos como mitigador del estrés hídrico en variedades de albahaca (Ocimum basilicum L) [Tesis de Doctorado]. [California]: Centro de Investigaciones Biológicas del Noroeste; 2015. 47–123 p.
31. Nápoles-Vinent S, Garza-Borges T, Reynaldo-Escobar IM. Respuesta del cultivo de habichuela (Vigna unguiculata L.) var. Lina a diferentes formas de aplicación del Pectimorf®. Cultivos Tropicales. 2016;37(3):172–7. doi:10.13140/RG.2.1.3698.4566
32. Cabrera JC, Ceballos M, Montes S. Utilización del Pectimorf en la embiogénesis somática del cafeto (Coffea canephora) var. Robusta. In Seminario Científico de Instituto Nacional de Ciencias Agrícolas, La Habana ,Cuba; 2000. p. 204.
33. Hidrobo AR, Ardisana EH, Cabrera JC, Jomarrón I. Utilización del PECTIMORF y BIOBRAS-16 en la embriogénesis somática de la papa. Biotecnología Vegetal. 2002;2(1):9–14.
34. Plana D, Álvarez M, Florido M, Lara RM, Cabrera JC. Actividad biológica del Pectimorf en la morfogénesis in vitro del tomate (Lycopersicon esculentum, Mill) var. Amalia. Cultivos Tropicales. 2003;24(1):29–33.
35. González S, Cabrera JC, Nato A. Efecto del Pectimorf sobre la morfogénesis in vitro en tabaco (Nicotiana tabacum). Revista del Jardín Botánico Nacional. 2004;25/26:187–91.
36. Suárez Guerra L, Hernández MM. Efecto del Pectimorf® en el cultivo de ápices de plantas in vitro de yuca (Manihot esculentaCrantz), clones `CMC-40´ y `Señorita´. Cultivos Tropicales. 2015;36(4):55–62.
37. Cabrera JC, Iglesias R, González S, Diosdado E, Gómez R, Izquierdo H, et al. Aportes al conocimiento de la función de los fragmentos pécticos en la regulación del crecimiento y desarrollo vegetal. Evaluación de sus posibilidades biotecnológicas. In Simposio Internacional de Biotecnología de las Plantas (6: 2000: La Habana), CNIC; 2000. p. 17.
38. González-Pérez L, Vázquez-Glaría A, Perrotta L, Acosta A, Scriven SA, Herbert R, et al. Oligosaccharins and Pectimorf®stimulate root elongation and shorten the cell cycle in higher plants. Plant Growth Regulation. 2012;68(2):211–21. doi:10.1007/s10725-012-9709-z
39. Álvarez Bello I, Reynaldo IM. Efecto del Pectimorf® en el índice estomático de plantas de frijol (Phaseolus vulgaris L.). Cultivos Tropicales. 2015;36(3):82–7.
40. García ML, Martínez Juárez V, Avendaño AN, Padilla MC, Izquierdo Oviedo H. Acción de oligosacáridos en el rendimiento y calidad de tomate. Revista fitotecnia mexicana. 2009;32(4):295–301.
41. Enríquez-Guevara EA, Aispuro-Hernández E, Vargas-Arispuro I, Martínez-Téllez MÁ. Oligosacarinas Derivadas de Pared Celular: Actividad Biológica y Participación en la Respuesta de Defensa de Plantas. Revista mexicana de fitopatología. 2010;28(2):144–55.
42. Ochoa-Villarreal M, Vargas-Arispuro I, Islas-Osuna MA, González-Aguilar G, Martínez-Téllez MÁ. Pectin-derived oligosaccharides increase color and anthocyanin content in Flame Seedless grapes. Journal of the Science of Food and Agriculture. 2011;91(10):1928–30. doi:10.1002/jsfa.4412
43. El-Sharkawy MA. Utility of basic research in plant/crop physiology in relation to crop improvement: a review and a personal account. Plant Physiology. 2006;18(4):419–46. doi:10.1590/S1677-04202006000400001
44. Pérez R, Aranguren M, Luzbet R, Reynaldo IM, Rodríguez J. Aportes a la producción intensiva de plantas de guayabo (Psidium guajava L.) a partir de esquejes en los viveros comerciales. CitriFrut. 2013;30(2):11–6.
45. Malekpoor F, Pirbalouti AG, Salimi A. Effect of foliar application of chitosan on morphological and physiological characteristics of basil under reduced irrigation. Research on Crops. 2016;17(2):354–9. doi:10.5958/2348-7542.2016.00060.7
46. Cartaya OE, Reynaldo I, Peniche C, Garrido M. Empleo de polímeros naturales como alternativa para la remediación de suelos contaminados por metales pesados. Revista internacional de Contaminación Ambiental. 2011;27(1):41–6.
47. Cartaya-Rubio OE, Moreno-Zamora AM, Hernández-Baranda Y, Cabrera-Rodríguez JA, Guridi-Izquierdo F. Efectos de la aplicación de una mezcla de oligogalacturónidos sobre un suelo contaminado cultivado con plántulas de tomate. Cultivos Tropicales. 2016;37(4):160–7. doi:10.13140/RG.2.2.20663.52642
Recibido: 04/12/2017
Aceptado: 27/03/2018
Danurys Lara Acosta, Instituto Nacional de Ciencias Agrícolas (INCA), Carretera Tapaste, Km 3½, Gaveta Postal 1. San José de las Lajas, Mayabeque. Cuba. CP 32700. danurys@inca.edu.cu